红曲抗菌肽hqP2及其应用的制作方法
本发明涉及分子生物学领域,具体涉及一种来源于红曲的抗菌肽及其应用。
背景技术:
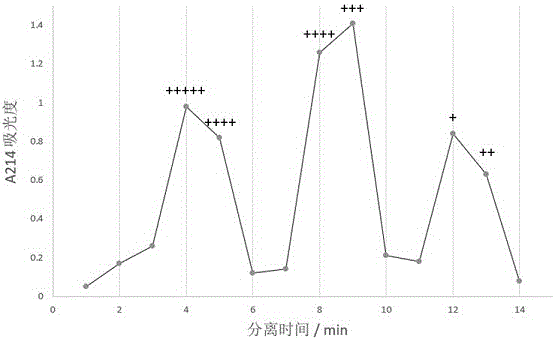
:中国黄酒是世界三大古酒之一,是我国的民族特产。它是以谷物为原料,用曲酿造而成。由于它营养丰富、酒精度低且具有独特的风味口感和功效而深受广大人民群众的喜爱。福建红曲黄酒是中国黄酒中十分具有特色的一种,它是以糯米、大米为主要原料,红曲和白曲混合使用酿造而成,以色红、味醇、香浓而著称。红曲黄酒不仅具有丰富的营养成分,还因添加了红曲进行发酵而具有与众不同的生理功效。黄酒酿造可以分为制曲和酿造两大阶段,传统酿造过程是一个群微共酵的过程,需要多种微生物的参与,而酒曲能提供酿造过程中所需的微生物,因此其对于酿造是不可或缺的。长久以来,传统酒曲包括红曲的制作完全采用天然接种微生物的方式,微生物的来源主要包括母曲、酿造原料、用水、器具及制曲场所等。这些微生物源当中既含有酿造相关微生物,也含有大量其它微生物,因此在酒曲的形成过程中必定存在相应的生态学机制,使得酿造相关微生物取得竞争优势成为主要菌群并在此后维持这一体系的稳定。目前已知红曲霉是红曲当中的主要微生物,生长比较缓慢,然而却具有独特的代谢特性。研究表明,红曲霉能产生丰富的次级代谢产物,主要包括红曲色素、莫纳可林k、r-氨基丁酸、多种抗氧化成分如dimerumicacid、乙酰胆碱、麦角固醇和桔霉素等,这些代谢产物是红曲黄酒独特品质和生理功效的重要组成部分,红曲也因红曲霉产生的红曲色素而得名。除了肉眼可见的色素外,做为红曲当中的主要微生物,红曲霉还能产生多种抗菌物质。我国古代历来就有利用红曲保存食物的传统,例如在《天工开物》中就有关于炎暑利用红曲保存肉色10日不腐的记载,说明红曲具有抑菌和杀菌作用。现代研究表明,红曲中的红曲霉会产生桔霉素等抗菌物质,此外其产生的红曲色素和橙色素等色素同时也有一定的抗菌功能。由此可见红曲中必然蕴含着丰富的抗菌物质,抵抗有害微生物和其它杂菌的滋生,以产生并维持其独特的微生物生态稳定性。鉴于红曲做为可能蕴含有害微生物的潜在抗菌物质的来源,本发明申请人经过筛选从中得到了具有良好特定杀菌性能的多肽。抗菌肽作为一种新型的抗生素,微生物不易对其产生耐药,具有广阔的应用前景,需要不断挖掘出新的抗菌多肽,以用于临床治疗药物、食品防腐保鲜和动物饲料等领域。技术实现要素:本发明首次提供了一种来源于红曲的抗菌多肽hqp2,揭示了其基因编码序列,探究了其抗菌谱并测定了相应的最小杀菌浓度,此外还探究了目标菌对多肽hqp2的耐药性以及多肽hqp2对耐药目标菌的杀灭作用。本发明解决其技术问题所采用的技术方案如下:本发明提供了一种来源于红曲的新型抗菌多肽hqp2,其氨基酸序列如seqidno:2所示,其基因编码序列如seqidno:6所示;多肽hqp2对于金黄色葡萄球菌和肺炎链球菌均具有良好的杀菌作用,最小杀菌浓度均低至0.08μg/ml,并且不产生耐药菌;此外多肽hqp2对于耐甲氧西林的金黄色葡萄球菌耐药菌以及同时耐耐红霉素、四环素和克林霉素的肺炎链球菌多重耐药菌均具有杀灭作用。本发明提供的来源于红曲的新型抗菌多肽hqp2对于金黄色葡萄球菌和肺炎链球菌均具有强烈的杀菌作用,且不产生耐药菌,并且可杀灭金黄色葡萄球菌和肺炎链球菌的主要耐药菌,有望做为抗生素替代品,具有广阔的应用前景。附图说明图1是sm红曲蛋白分离液吸光度和抗菌效能关系图谱。图2是多肽hqp1的空气接触抗菌效能实验结果图。图3是多肽hqp2的空气接触抗菌效能实验结果图。图4是多肽hqp3的空气接触抗菌效能实验结果图。图5是多肽hqp4的空气接触抗菌效能实验结果图。图6是空白对照组的空气接触抗菌效能实验结果图。具体实施方式以下结合具体实施例,进一步阐述本发明。实施例1红曲蛋白提取液具有抗菌效能收集来源于福建地区的4种典型红曲(包括福州、三明、龙岩和永春四地,其红曲分别用fz、sm、ly和yc表示),均购买于当地市场。取粉碎好的每种酒曲各5g,装入盛有100ml无菌水并带有玻璃珠的锥形瓶中,剧烈振荡约30min制成悬液,用纱布过滤收集悬液,悬液加入60%质量体积分数的硫酸铵搅拌15min,之后5000rpm离心15min悬液并去除清液得到沉淀物。采用novipure土壤蛋白提取试剂盒(德国qiagen公司),按照说明书中方法提取沉淀物中的总蛋白(包括多肽)。提取的总蛋白经qubit荧光仪(美国thermofisher公司)测定浓度,结果分别为4.81mg/ml(fz红曲)、6.23mg/ml(sm红曲)、7.07mg/ml(ly红曲)和3.61mg/ml(yc红曲)。为了探究红曲蛋白提取液中是否具有抗菌效能,可将蛋白提取液加入营养琼脂培养基中,置于环境中观察其上自然微生物的生长情况。首先制备含有红曲蛋白提取液的营养琼脂平板。称取10g蛋白胨、3g牛肉膏、5g氯化钠,混合后溶解于蒸馏水内,加入15%质量体积分数的氢氧化钠溶液约2ml,校正ph至7.2-7.4,加入16g琼脂,加热煮沸使琼脂熔化,蒸馏水补足至总体积1000ml,煮开后分装到三角瓶中,包扎好后于121°c下高压灭菌20min。使用时将已灭菌营养琼脂培养基放置于微波炉中微波加热重新熔解,待其温度降至50-60°c时,在超净台中加入红曲蛋白提取液(每100ml培养基中加入1mg红曲蛋白提取液),充分混匀后再将其倒入灭菌玻璃平板(直径9cm)中,得到含有红曲蛋白提取液的营养琼脂平板(简称红曲营养琼脂平板)。营养琼脂培养液若不加红曲蛋白提取液,则制备得到的是常规的营养琼脂平板,做为阴性空白对照。将各红曲营养琼脂平板开盖倾斜迎风置于医院污浊空气流通处1h进行空气接触处理(每种红曲使用3个平板做为平行),空白对照组为常规营养琼脂平板,然后置于37°c生化培养箱中倒置培养48h,再观察平板菌落情况。估算肉眼可见每个平板的总菌落数,大于1000的用“+++++”表示,1000-500之间的用“++++”表示,500-250之间的用“+++”表示,250-100之间的用“++”表示,100以下的用“+”表示,未检出用“-”表示,结果如表1所示。对于表1中各平板菌落整体生长情况,每种红曲以及空白对照组的自身三个平板结果基本一致,因此取平均信息。从表1中可知,相比于常规营养琼脂平板中大于1000的菌落数,各红曲营养琼脂平板菌落数均有显著减少,其中最为显著的是sm红曲营养琼脂平板,其上的菌落数均在100以下。初步表明红曲蛋白提取液中含有抗菌物质,以sm红曲蛋白提取液的抗菌效果最为显著,因此选择sm红曲蛋白提取液为对象,探究其含有的抗菌物质信息。表1平板菌落生长情况平板类型菌落整体生长情况常规营养琼脂平板+++++fz红曲营养琼脂平板+++sm红曲营养琼脂平板+ly红曲营养琼脂平板++yc红曲营养琼脂平板+++实施例2红曲蛋白提取液抗菌组分初步分析对于sm红曲蛋白提取液,首先进一步采用zenix-csec柱(美国sigma-aldrich公司,150å)进行抗菌成分分离。zenix-csec柱是一种体积排阻色谱(又称凝胶过滤色谱)柱,这是分离不同分子量生物大分子的一种有效方法,可用于蛋白以及多肽的快速分离。流动相采用150mm磷酸钠缓冲液(ph=7),流速为1.0ml/min,室温下分离,检测器为uv214nm(肽键的最大吸收波长),上样量为2ml,每1.0ml蛋白分离液收集1管,其余参数和步骤按照说明书中内容进行。虽然上样量只有2ml,因有流动相分离缓冲液,因此总共收集到了14管蛋白分离液,其吸光度数据详见图1。采用zenix-csec柱初步分离sm红曲蛋白提取液,从图1可知总共出现了3个蛋白(或多肽)峰,分别是出峰时段为4-5min、8-9min和12-13min的蛋白(或多肽)分离液。对于这3个时间段的蛋白分离液,参照实施例1中方法进行抗菌效能实验,然而加入营养琼脂培养基中的物质由红曲蛋白提取液换成sm红曲蛋白分离液,加入量为每50ml培养基中加入0.1ml蛋白分离液,菌落生长情况评估参照实施例1标准标注在图1中。从图1可知12-13min的蛋白分离液对应的平板菌落数最少,因此抑菌物质主要分布在12-13min的蛋白(或多肽)分离液中。在sec色谱中分子量大的先出峰,分子量小的后出峰,并且参照肌球蛋白轻链(144aa,分子量为16.9kda,相同条件下出峰时间约为11min)和维生素b12(分子量为1355da,相同条件下出峰时间约为14min),可知12-13min出峰的物质主要是多肽。因此表明sm红曲中含有抗菌多肽,接着进一步解析多肽序列。实施例3筛选抗菌多肽候选基因编码序列红曲中的抗菌多肽来源于其上的微生物体系,在外源菌存在的情况下抗菌多肽的表达量必定显著增加,据此设计实验对抗菌多肽的候选编码基因进行筛选。取粉碎好的sm酒曲5g,装入盛有100ml无菌水并带有玻璃珠的锥形瓶中,剧烈振荡约30min制成悬液,用8层纱布过滤3次收集悬液,1000rpm离心2min悬液并去除清液得到沉淀物(主要目的在于收集曲中微生物),用1ml无菌水重悬,在操作台中取0.3ml重悬菌液涂布于已做空气接触处理的有菌常规营养琼脂平板(该常规营养琼脂平板事先参照实施例1中空白对照组做空气接触处理并倒置培养12h,则其上已有空气微生物滋生,再取出用于红曲菌悬液涂布)中,对照组为涂有红曲菌悬液但事先不做空气接触处理的常规营养琼脂平板,然后置于37°c生化培养箱中倒置培养36h。培养36h后,用无菌刀片将平板上的菌落轻轻刮下,置于10ml无菌水中,充分振荡并吸出菌悬液,之后3000rpm下离心5min,后去除上清取沉淀。采用trnzoluniversal总rna提取试剂(北京天根生化科技有限公司)提取沉淀菌体的总rna,之后采用mag-bindmrna捕获试剂盒(美国omega公司)从总rna中富集mrna。富集的mrna反转录成cdna后送基因测序公司(上海数谱生物科技有限公司)进行测序、拼接和分析。主要流程包括将cdna打碎成短片段,进行末端修复和接头连接,再纯化和扩增,之后采用truseqrnasampleprepkit构建cdna文库,最后在illuminagaiix测序仪上机测序(2×100bp),利用软件和数据库进行拼接和分析。实验组和对照组所有数据过滤后最终得到1423mbp的cleanreads,q20=93.1%,拼接后得到21281条转录本,平均长度为554.22bp。对比有空气接触处理的实验组和无空气接触处理的对照组的mrna测序数据筛选抗菌多肽的基因编码序列,需要满足:(1)可以转录成完整mrna且mrna长度短于300bp(编码多肽),(2)在ncbi数据库中比对不属于已明确的具有非抑菌功能的序列,(3)标准化后对应的特定基因序列含量(即cdna的reads数)实验组的要超过对照组10倍以上。经过分析,符合条件的多肽候选基因编码序列共有18条。实施例4抗菌多肽的抗菌谱探究根据实施例3筛选到的18条mrna候选基因编码序列,委托北京赛百盛基因技术有限公司进行编码多肽的合成,纯度>75%。参照实施例1中方法进行抗菌效能实验,然而加入营养琼脂培养基中的物质由红曲蛋白提取液换成18种多肽溶液,加入量为每100ml培养基中加入10μg的足量多肽,不加多肽溶液的常规营养琼脂培养基为空白对照组。每种多肽单独测定其抗菌效能,结果发现有4种多肽具有显著的抗菌效能,其中2种结果为“+”,2种结果为“++”。4种多肽的氨基酸序列分别如seqidno:1(32aa)、seqidno:2(27aa)、seqidno:3(25aa)和seqidno:4(30aa)所示,分别用hqp1、hqp2、hqp3和hqp4表示,其对应的基因编码序列分别如seqidno:5、seqidno:6、seqidno:7和seqidno:8所示,对应的空气接触抗菌效能实验图片分别如图2-5所示,空白对照组的实验图片如图6所示。进一步的,利用标准菌株或典型菌株(来源于美国菌种保藏管理中心即atcc)初步探究筛选到的4种多肽对于临床上8种常见的致病菌(包括大肠杆菌、肺炎链球菌、福氏志贺菌、金黄色葡萄球菌、铜绿假单胞菌、幽门螺杆菌、白色念珠菌和新型隐球菌)的抗菌谱,相关实验需要在生物安全柜中进行。各菌株均采用其常规液体培养基和条件(表2)进行增菌培养,取1ml对数生长期的菌液调整其浓度至2×104-105cfu/ml,取100μl该稀释菌液加入1ng当量的多肽(取1μl的1μg/ml的多肽溶液加入),充分混匀后再采用预加菌液倾注平板法制备测试平板,空白对照组为不加多肽处理的菌液测试平板,在各菌最适的条件(表2)下培养24-48h,观察菌落生长情况,设置三个平行取平均信息。估算肉眼可见每个平板的菌落数,大于1000的用“+++++”表示,1000-500之间的用“++++”表示,500-100之间的用“+++”表示,100-10之间的用“++”表示,10以下的用“+”表示,未检出用“-”表示,结果详见表2。表2红曲多肽抗菌平板菌落生长实验数据测试菌固/液体培养基培养条件对照组hqp1hqp2hqp3hqp4大肠杆菌atcc25923lb琼脂/肉汤培养基37℃,有氧++++++++-++++肺炎链球菌atcc49619脑心注射琼脂/肉汤培养基37℃,5%二氧化碳+++++++++-+++++++福氏志贺菌atcc12022营养琼脂/营养肉汤培养基37℃,有氧+++++++++++++++++++++++++金黄色葡萄球菌atcc25923乳酪消化大豆胨琼脂/肉汤培养基37℃,有氧+++++++++-+++++++++铜绿假单胞菌atcc9027mh培养基/tsb培养基37℃,有氧++++++++++++-+++++幽门螺杆菌atcc43504胰酪胨大豆琼脂/肉汤培养基37℃,3-5%氧气+10%二氧化碳+++++-++++++++++++白色念珠菌atcc66027ym琼脂/ym肉汤培养基25℃,有氧++++++++++++++++++++-新型隐球菌atcc32609ym琼脂/ym肉汤培养基30℃,有氧+++++++++++++++++++++表2显示对照组平板菌落均在1000个以上,而对于对于多肽hqp2实验组,只在肺炎链球菌、金黄色葡萄球菌、大肠杆菌和幽门螺杆菌这4种菌的测试平板中菌落数显著降低,其中大肠杆菌和幽门螺杆菌测试平板中菌落数小于100,而肺炎链球菌和金黄色葡萄球菌测试平板未见菌落生长,由此表明多肽hqp2对于肺炎链球菌和金黄色葡萄球菌具有强烈的杀灭作用。实施例5抗菌多肽hqp2的最小杀菌浓度对于具有肺炎链球菌和金黄色葡萄球菌抗菌效能的多肽hqp2(如前所述,其氨基酸序列如seqidno:2所示,其基因编码序列如seqidno:6所示),进一步测定其最小杀菌浓度。再次委托北京赛百盛基因技术有限公司进行多肽hqp2的合成,纯度>98%。分别将肺炎链球菌和金黄色葡萄球菌振荡培养至对数生长期,事先计数后用灭菌生理盐水将对数生长期的菌株稀释至约1×106cfu/ml。在96孔板内将多肽hqp2用灭菌水按1:2逐级稀释使浓度为2.56μg/ml-0.01μg/ml,每孔添加10μl多肽hqp2溶液和90μl菌液(浓度约为1×106cfu/ml),空白对照孔内为不加多肽的菌液(用10μl的灭菌水),设置三个复孔平行,静置培养1h。将同一多肽浓度的3个孔内的液体混匀后取出100μl涂平板(参照表2中培养条件),倒置培养观察菌斑数,完全没有菌斑的平板对应的最小多肽浓度为最小杀菌浓度。结果显示,多肽hqp2对肺炎链球菌和金黄色葡萄球菌的最小杀菌浓度分别低至0.08μg/ml和0.08μg/ml,表明多肽hqp2对肺炎链球菌和金黄色葡萄球菌均具有良好的杀菌活性。实施例6目标菌对抗菌多肽hqp2的耐药性测试耐药菌的产生是导致抗生素失效的主要原因,是衡量抗菌药物的重要指标。针对新获得的抗菌多肽hqp2,有必要开展目标菌株(据实施例5选择杀菌作用最显著的两种菌即肺炎链球菌和金黄色葡萄球菌)对其的耐药性测试。主要是利用在目标菌培养体系中加入抗菌药物,如果存在或产生耐药菌,则经过多轮筛选后耐药菌必然成为优势菌群。具体做法如下:(1)分别将肺炎链球菌atcc49619和金黄色葡萄球菌atcc25923标准菌株(表2)振荡培养至对数生长期,事先计数后用灭菌生理盐水将对数生长期的菌株稀释至约1×104cfu/ml,接种1ml菌液到100ml液体培养基中振荡培养12h。(2)对于肺炎链球菌,实验组是在(1)中的12h培养菌液中加入终浓度为1μg/ml的多肽hqp2;对照组有两个,分别是在12h培养菌液中单独加入终浓度为1μg/ml的适量红霉素和四环素。对于金黄色葡萄球菌,实验组是在(1)中的12h培养菌液中加入终浓度为1μg/ml的多肽hqp2,对照组则是在12h培养菌液中加入终浓度为1μg/ml的甲氧西林。加入抗生素和多肽后,继续振荡培养12h。(3)取(2)中最终菌液1ml接种到含有1μg/ml的各自对应的相同抗生素或多肽的100ml新培养基中振荡培养12h,同时取(2)中最终菌液100μl涂布于平板培养基中培养24-48h后计算菌落数。(4)不断重复步骤(3)直至平板菌落数增加至1000cfu/平板以上。结果如表3所示,对于金黄色葡萄球菌,甲氧西林对照组的平板中始终有菌,从最开始平板中菌落数有3个,到后面一直增加,最终于第4轮平板时菌落数超过1000个,表明其产生了甲氧西林的耐药菌。对于肺炎链球菌,红霉素和四环素对照组的平板中始终有菌,从最开始平板中菌落数分别有1个和32个,到后面一直增加,最终分别于第4轮和第3轮平板时菌落数超过1000个,表明其产生了红霉素和四环素的耐药菌。而无论是肺炎链球菌还是金黄色葡萄球菌,使用多肽hqp2时各轮平板均无肉眼可见菌落形成,表明多肽hqp2可以有效杀灭肺炎链球菌和金黄色葡萄球菌且并无耐药菌的产生。表3耐药菌产生实验数据进一步的,选择临床分离的金黄色葡萄球菌耐药菌株sar03(耐甲氧西林)以及肺炎链球菌耐药菌株spr14(多重耐药,同时耐红霉素、四环素和克林霉素)。参照实施例5进行最小杀菌浓度实验,显示多肽hqp2对耐甲氧西林金黄色葡萄球菌sar03和肺炎链球菌多重耐药菌spr14的最小杀菌浓度分别是0.16μg/ml和0.64μg/ml,表明多肽hqp2对金黄色葡萄球菌和肺炎链球菌耐药菌均具有良好的杀灭能力。综上可知,本发明首次发现了一种来源于红曲的新型抗菌多肽hqp2,对于金黄色葡萄球菌和肺炎链球菌均具有良好的杀菌作用,最小杀菌浓度均低至0.08μg/ml,并且不产生耐药菌;此外红曲多肽hqp2对于耐甲氧西林的金黄色葡萄球菌耐药菌以及同时耐耐红霉素、四环素和克林霉素的肺炎链球菌多重耐药菌均具有杀灭作用。序列表<110>福州四纪达生物医学科技有限公司<120>红曲抗菌肽hqp2及其应用<160>8<170>siposequencelisting1.0<210>1<211>32<212>prt<213>人工序列(artificialsequence)<400>1metthrthrhisalaphecysmetleutyraspglnthrcysargser151015gluglugluhisglnglyproargvaltyrlyshisalailetyrlys202530<210>2<211>27<212>prt<213>人工序列(artificialsequence)<400>2metcysphehisargvaltrptyrmetlysaspaspalagluprocys151015aspphetrpglygluasnpheleuasntrpasn2025<210>3<211>25<212>prt<213>人工序列(artificialsequence)<400>3metglnhisleucysilethralaprohisasptrpgluphethrser151015glucysalaalaleutrpilephetrp2025<210>4<211>30<212>prt<213>人工序列(artificialsequence)<400>4metaspalacyspheseralaalaphethrvalasnileasnglngln151015valphetrppheasntrpcysasplyshisleutrpprotyr202530<210>5<211>96<212>dna<213>未知(unknown)<400>5atgactactcatgctttttgtatgttgtatgatcaaacttgtagatctgaagaagaacat60caaggtccaagagtttataaacatgctatttataaa96<210>6<211>81<212>dna<213>未知(unknown)<400>6atgtgttttcatagagtttggtatatgaaagatgatgctgaaccatgtgatttttggggt60gaaaattttttgaattggaat81<210>7<211>75<212>dna<213>未知(unknown)<400>7atgcaacatttgtgtattactgctccacatgattgggaatttacttctgaatgtgctgct60ttgtggattttttgg75<210>8<211>90<212>dna<213>未知(unknown)<400>8atggatgcttgtttttctgctgcttttactgttaatattaatcaacaagttttttggttt60aattggtgtgataaacatttgtggccatat90当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1