甘蓝型油菜高矮性状紧密连锁的SNP标记及其应用的制作方法
本发明属于植物基因工程和生物技术领域。具体而言,本发明涉及甘蓝型油菜高矮性状紧密连锁的snp标记及其应用。
背景技术:
油菜是我国重要油料作物,菜籽油占国产植物油总量的55%以上,对保障我国食用油供给安全具有重要作用。倒伏可导致油菜减产10%-30%,并显著降低含油量。降低株高可显著增强油菜抗倒性,从而提高产量和品质,并有利于油菜机械化生产。小麦、水稻的“绿色革命”是作物育种最伟大的成果之一,培育的半矮杆品种在世界范围内广泛种植,使产量增加了近一倍,这场革命成功的基础是矮杆资源的充分利用。甘蓝型油菜引入我国时间不长,遗传基础相对较为狭窄。由于矮杆资源比较缺乏,我国油菜的矮化育种尚未取得显著进展。
目前针对油菜矮杆种质的研究已有一些报道,浦惠明等(1995)获得了甘蓝型油菜“矮源1号”,株高为24cm;王茂林等(2005)用快中子照射及des对甘蓝型油菜种子进行联合处理,获得了株高为70cm的矮秆突变体ndf-1;蒲晓斌等(2006)利用太空诱变,获得了株高为110cm的矮秆突变体“9804”;梅德圣等(2006)通过连续自交获得了一个矮杆自然突变体99cdam,株高约为85cm;傅寿仲等(2006)选育了株高为130cm的新种质;石淑稳等(1997)利用ems处理小孢子胚状体获得了突变体ds-1和ds-2,株高分别是106cm和95cm;zengetal.(2011)利用ems诱变,获得了株高为94cm的矮杆突变体bnac.dwf;wangetal.(2016)利用ems诱变,获得了两个稳定遗传的矮秆突变体bndwf1和bndwf1/dcl1,株高分别为80cm和50cm。但是,到目前为止,油菜矮杆种质成功用于矮化育种的报道还很少,主要原因是矮杆种质常携带不利性状,如长势弱、产量低、结实率低、抗病性差等。
有关甘蓝型油菜矮化机理的研究相对滞后,多数研究还停留在初步的qtl定位阶段,利用连锁分析或关联分析的方法,在油菜中已定位到200多个株高qtl,这些qtl分布于19条染色体,且贡献率普遍较低,仅在a2、a3、c2和c6染色体上发现少数效应较大的qtl。对油菜株高qtl进行精细定位的研究还比较少,仅有极少数基因被克隆与验证。liuetal.(2010)克隆了a06染色体上控制矮杆性状的基因bnaa06.rga,该基因编码ga信号转导抑制因子della蛋白,基因突变导致编码della蛋白的vhynp基序中脯氨酸被亮氨酸替换,从而导致矮杆表型。随后,该基因在c07染色体上的同源基因bnac07.rga也被克隆,功能与bnaa06.rga类似。此外,lietal.(2018)克隆了a03染色体上编码iaa信号转导途径抑制因子aux/iaa蛋白的基因bnaa3.iaa7,该基因突变导致aux/iaa蛋白的gwppv基序中第84位甘氨酸被谷氨酸替换,导致矮杆表型。总之,除个别矮杆基因被克隆外,在油菜株高形态建成中起决定作用的功能基因及其调控机制尚不明确,相关研究有待进一步深入,这些基因在油菜矮化育种中的利用价值有待进一步挖掘。
技术实现要素:
发明目的:本发明在前期研究利用ems诱变技术,在常规油菜品种宁油18号(ny18,株高190cm)诱变后代中,获得了稳定遗传的矮杆突变体df09(株高65cm)。遗传分析表明,突变体的矮杆性状受1对半显性基因控制,f1代株高为120±10cm,符合油菜“理想株型”要求的株高标准。因此,df09是油菜矮化育种的优异种质资源。本发明在获得矮杆种质df09的基础上,将矮杆性状控制位点bndwf.c9精细定位在c09染色体的132kb区间,并获得了与矮杆性状紧密连锁的snp标记,在油菜矮化育种中具有重要的应用前景。
本发明所要解决的技术问题是提供了一种控制甘蓝型油菜高矮性状的snp标记。
本发明还要解决的技术问题是提供了一组用于检测所述的一组snp标记的引物对。
本发明还要解决的技术问题是提供了一种用于检测所述的snp标记的试剂盒。
本发明还要解决的技术问题是提供了snp标记、所述的一组引物对或所述的试剂盒在甘蓝型油菜选育中的用途。
本发明还要解决的技术问题是提供了所述的snp标记、所述的一组引物对或所述的试剂盒在甘蓝型油菜矮化中的用途。
本发明还要解决的技术问题是提供了一种检测甘蓝型油菜高矮性状的方法。
本发明还要解决的技术问题是提供了一种甘蓝型油菜的高矮性状相关的snp标记位点精细定位筛选方法。
为解决上述技术问题,本发明采用的技术方案如下:一种控制甘蓝型油菜高矮性状的snp标记,包含:
第一snp标记,所述第一snp标记为甘蓝型油菜参考基因组darmor-bzh的c09染色体的第17420876bp位置的碱基为c或t,所述第一snp标记命名为bnac09-42标记;和/或;
第二snp标记,所述第二snp标记为甘蓝型油菜参考基因组darmor-bzh的c09染色体的第17463666bp位置的碱基为c或t,所述第二snp标记命名为bnac09-46标记;和/或;
第三snp标记,所述第三snp标记为甘蓝型油菜参考基因组darmor-bzh的c09染色体的第17541746bp位置的碱基为c或t,所述第三snp标记命名为bnac09-54标记。
其中,所述碱基是c的油菜为高杆,所述碱基是t的油菜为矮杆。
本发明内容还包括用于检测所述的snp标记的引物对(parms引物对),包含:第一引物对,所述第一引物对包括:bnac09-42位点扩增引物bnac09-42-f、等位基因引物1:bnac09-42-rg和等位基因引物2:bnac09-42-ra;
其中,bnac09-42位点扩增引物bnac09-42-f为:
5′-agtctatgaagaaaaacaacccaac-3′,
等位基因引物1:bnac09-42-rg为:
5′-gaaggtgaccaagttcatgctgttatcttgtatatatgtgggtttcttatg-3′,
等位基因引物2:bnac09-42-ra为:
5′-gaaggtcggagtcaacggattgttatcttgtatatatgtgggtttcttata-3′;
和/或;
第二引物对:所述第二引物对包括:bnac09-46位点扩增引物bnac09-46-r、等位基因
引物1:bnac09-46-fc和等位基因引物2:bnac09-46-ft;
其中,所述bnac09-46位点扩增引物bnac09-46-r为:
5′-catctgatactgtgcgtgaccc-3′,
等位基因引物1:bnac09-46-fc为:
5′-gaaggtgaccaagttcatgctgatatgaatatgtggaaaatgcgc-3′,
等位基因引物2:bnac09-46-ft为:
5′-gaaggtcggagtcaacggattgatatgaatatgtggaaaatgcgt-3′;
和/或;
第三引物对:所述第三引物对包括:bnac09-54位点扩增引物bnac09-54-r、等位基因引物1:bnac09-54-fc和等位基因引物2:bnac09-54-ft;
其中,bnac09-54位点扩增引物bnac09-54-r为5′-caaagagattgcttgccaccc-3′;
等位基因引物1:bnac09-54-fc为:
5′-gaaggtgaccaagttcatgctgatcttggccaactaatatcttttc-3′,
等位基因引物2:bnac09-54-ft为:
5′-gaaggtcggagtcaacggattgatcttggccaactaatatcttttt′-3′。
本发明内容还包括用于检测所述的snp标记的常规pcr扩增引物对,所述引物对用于扩增第二snp标记(bnac09-46标记),所述引物对包括:bnac09-46pcr位点扩增正向引物:bnac09-46pcr-f、bnac09-46pcr位点扩增反向引物:bnac09-46pcr-r、等位基因引物1:bnac09-46pcr-fc和等位基因引物2:bnac09-46pcr-rt;
其中,bnac09-46pcr位点扩增正向引物:bnac09-46pcr-f为:
5′-gagaaatactccgcaacctacg-3′,
bnac09-46pcr位点扩增反向引物:bnac09-46pcr-r为:
5′-atgttccgaaaccaaccagag-3′,
等位基因引物1:bnac09-46pcr-fc为5′-tatgaatatgtggaaaatgagc-3′,
等位基因引物2:bnac09-46pcr-rt为5′-gcgtgtagtatacctgcttgga-3′。
本发明内容还包括一种用于检测所述的snp标记的试剂盒,包含所述任意一组引物对或几组引物对。
本发明内容还包括所述的snp标记、所述的任意一组引物对或几组引物对或所述的试剂盒在甘蓝型油菜选育中的用途。
本发明内容还包括所述的snp标记、所述的任意一组引物对或几组引物对或所述的试剂盒在甘蓝型油菜矮化中的用途。
一种利用bnac09-42、bnac09-46和bnac09-54的任意一组引物对或几组引物对(parmspcr引物)检测油菜矮杆性状的方法,其步骤如下:
(1)提取待检测的油菜基因组dna;
(2)以基因组为模板,利用上述的parmspcr引物在荧光定量pcr仪中进行pcr扩增反应;
(3)利用snpdecoder软件(www.snpway.com),根据荧光信号,进行基因型分型,其中,绿色信号与野生型基因型(cc)一致,为高杆基因型;蓝色信号与突变体基因型(tt)一致,为矮杆基因型;红色信号与f1基因型(ct)一致,为杂合基因型;灰色信号与空白对照一致,为不确定基因型;
即当所述snp标记基因型为cc时,甘蓝型油菜表现为高杆,当所述snp标记基因型为tt时,甘蓝型油菜表现为矮杆;当所述snp标记基因型为ct时,甘蓝型油菜表现为中杆。
其中,该bnac09-42标记的检测准确率为99.81%;bnac09-46标记的检测准确率为100%;bnac09-54标记的检测准确率为99.91%。
本发明内容还包括一种检测甘蓝型油菜高矮性状的方法,通过对待测甘蓝型油菜进行所述的一组snp标记的检测,预测待测甘蓝型油菜的高矮性状,具体包括以下步骤:
(1)提取待检测的油菜基因组dna;
(2)以基因组dna为模板,利用所述的snp标记的常规pcr扩增引物对进行pcr扩增反应;
(3)扩增产物在2.5%的琼脂糖凝胶电泳后,分析扩增条带,增产物如果只有351bp的扩增片段,预测为纯合高杆油菜,只有179bp的扩增片段,预测为纯合矮杆油菜,如果同时有351bp和179bp两个扩增片段,预测为杂合中间型材料。
本发明内容还包括一种甘蓝型油菜的高矮性状相关的snp标记位点精细定位筛选方法,所述筛选方法包括以下步骤:
1)油菜矮杆突变体df09的获得;所述矮杆突变体df09保藏于中国微生物菌种保藏管理委员会普通微生物中心,所述矮杆突变体df09的保藏编号为cgmcc.no.:18532;所述矮杆突变体df09的c09染色体的第17420876bp位置的碱基由c突变为t,第17463666bp位置的碱基由c突变为t和第17541746bp位置的碱基由c突变为t。
2)矮杆性状控制位点的初定位:将ny18与矮杆突变体df09杂交并自交、回交获得六个基本世代,初步确定df09的矮杆性状受1对主基因控制;ny18×df09的f2群体中分别选择高杆极端单株和矮杆极端单株,提取dna进行等量混合,构建两个dna混合池,与两个亲本一起进行基因组重测序,通过两亲本的重测序结果,筛选多态性的snp标记,通过分析多态性snp在两个dna混合池中的频率差异,来计算snp-index及δ(snp-index),分析其与株高性状的连锁关系,选择95%置信水平下,大于阈值的窗口作为候选区间,在全基因组范围内挑选两个子代在snp-index差异显著的snp位点,利用bsa性状定位方法,初步将df09的矮杆位点定位在c09染色体的10mb区间,命名为bndwf.c9;
3)矮杆性状控制位点的精细定位:将加拿大材料holly与df09进行杂交,获得f2群体,将f2群体按照常规栽培方法进行种植,苗期选取幼嫩的叶片,利用ctab法提取基因组dna,利用ny18与df09的重测序结果,在矮杆性状位点bndwf.c9的区间内筛选snp,提取候选snp上下游各200bp的序列,设计parmspcr引物,典型的parmspcr反应体系包括了5种引物:allele1fam荧光通用引物,allele2hex荧光通用引物,allele1特异扩增引物,allele2特异扩增引物和locus特异扩增引物,利用设计的parmspcr引物,对验证群体进行基因分型,筛选出能够很好区分不同基因型的多态性的引物;利用多态性引物,对holly×df09的f2群体进行检测,筛选交换单株,结合株高表型,将bndwf.c9精细定位在snp标记bnc0923和bnc0999之间。利用snp标记的序列信息,将其与甘蓝型油菜参考基因组darmor-bzh进行序列比对,bnc0923和bnc0999分别对应c9染色体的17233664bp和18004384bp位置,对应的物理距离为771kb;
4)进一步的精细定位:将中双11号与df09进行杂交,获得了一个f2群体,苗期选取幼嫩的叶片,利用ctab法提取基因组dna,终花期统计所有单株的株高表型,利用snp标记bnc0923和bnc0999,采用pcr方法对中双11号×df09的f2群体进行检测,在bndwf.c9的771kb区间内,继续筛选多态性的parmspcr标记,并对筛选出的交换单株进行基因分型,结合株高表型,最终将bndwf.c9精细定位在bnac09-42和bnac09-54之间,对应的物理距离为132.1kb;
5)利用snp标记的序列信息,将其与甘蓝型油菜参考基因组darmor-bzh进行序列比对,最终获得如所述的与高矮性状相关的的snp标记。
有益效果:与现有技术相比,本发明基于ems诱变技术,获得了新的油菜矮杆突变体df09,并利用图位克隆的方法,将矮杆性状位点bndwf.c9精细定位在c09染色体的17420876-17541746bp区间内。在精细定位区间,获得了与矮杆性状紧密连锁的snp标记,在甘蓝型油菜矮化育种中具有重要的应用价值。
1.首次在甘蓝型油菜c09染色体上精细定位了控制矮杆性状位点bndwf.c9,并获得了三个与矮杆性状极显著相关的snp标记:bnac09-42位点、bnac09-46位点和bnac09-54位点以及与三个snp标记对应的四组snp标记引物bnac09-42、bnac09-46、bnac09-54和bnac09-46pcr。
2.上述四组snp标记引物均为共线性标记,可以准确的区分不同基因型。其中parmspcr引物bnac09-42、bnac09-46和bnac09-54可以实现高通量筛选,实验要求荧光定量pcr仪;而常规pcr引物bnac09-46pcr具有常规pcr仪即可。不同的引物可满足不同实验要求。
3.利用本发明的方法可以在油菜不同生长发育阶段进行分子标记筛选株高性状,极大提高了油菜矮化育种的效率。
4.本发明为图位克隆油菜矮杆基因,解析矮杆性状形成的分子机理奠定了基础。
附图说明
图1甘蓝型油菜矮杆突变体的表型;
ny18为野生型,株高190em;df09为突变体,株高65cm;f1株高为120cm;
图2两个子代delta_all-index在19染色体上的分布;
横轴:染色体长度(mb);纵轴:δ(all-index)
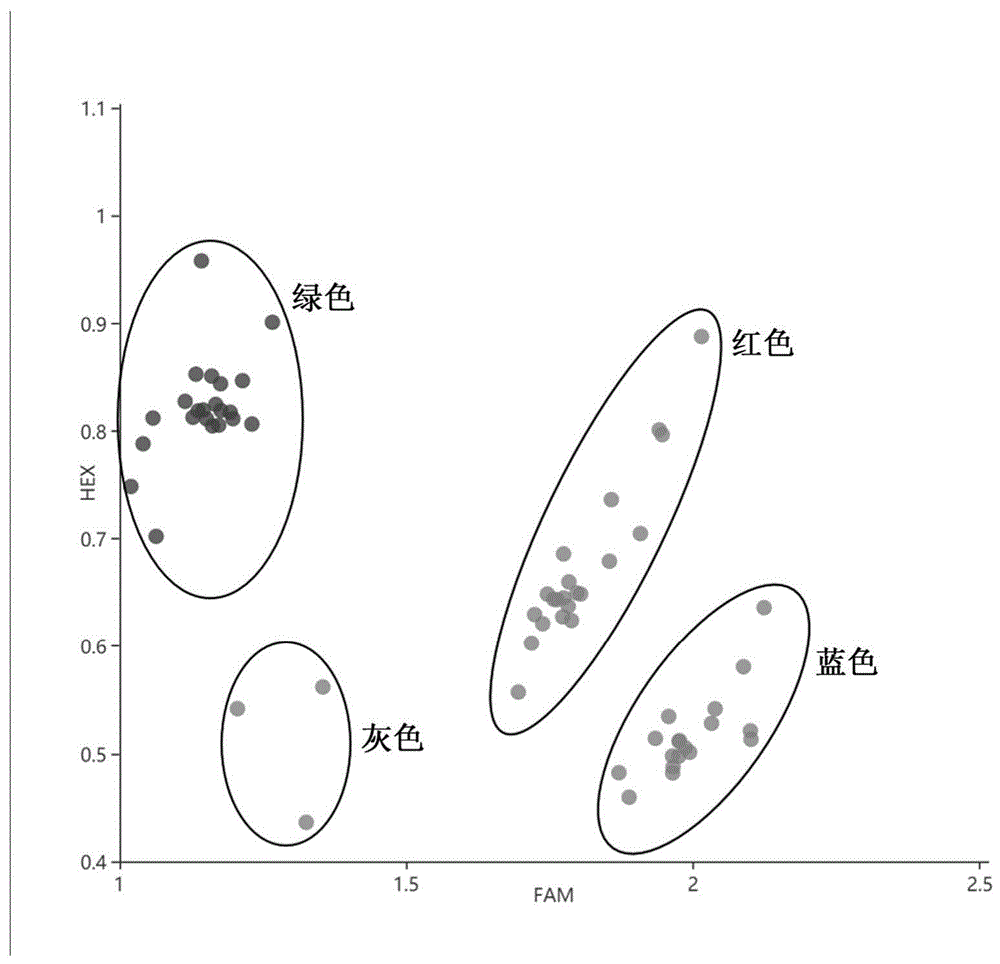
图3snp标记bnac09-42对(中双11号×df09)的f2部分单株的parmspcr检测结果;
绿色信号,高杆基因型;蓝色信号,矮杆基因型;红色信号,杂合基因型;灰色信号,不确定基因型;
图4snp标记bnac09-46对(中双11号×df09)的f2部分单株的parmspcr检测结果;
绿色信号,高杆基因型;蓝色信号,矮杆基因型;红色信号,杂合基因型;灰色信号,不确定基因型;
图5snp标记bnac09-52对(中双11号×df09)的f2部分单株的parmspcr检测结果;
绿色信号,高杆基因型;蓝色信号,矮杆基因型;红色信号,杂合基因型;灰色信号,不确定基因型;
图6snp的常规pcr引物bnac09-46pcr对(中双11号×df09)的f2部分单株的琼脂糖凝胶电泳pcr检测结果;
a,bnac09-46pcr在f2群体矮杆单株的扩增带型;b,bnac09-46pcr在f2群体高杆单株的扩增带型;c,bnac09-46pcr在f2群体中杆单株的扩增带型;z:高杆亲本中双11号扩增带型;d,矮杆亲本df09扩增带型;f1,(中双11号×df09)的f1扩增带型;bnac09-46pcr能够快速准确的区分f2群体中的高杆、中杆和矮杆单株。
具体实施方式
下述实施例中所用方法如无特别说明均为常规方法,实施例中的各种试剂均可通过商业渠道购买,所用引物由武汉擎科生物科技有限公司合成,测序由武汉擎科生物科技有限公司完成,parmspcrmix和常规pcrmix均购自武汉市景肽生物科技有限公司,parmspcr标记的检测由武汉市景肽生物科技有限公司提供技术支持,bsa测序由北京诺禾致源科技股份有限公司完成。实验中所用的甘蓝型油菜品种宁油18号(ny18)和加拿大材料holly为江苏省农业科学院经济作物研究所提供,中双11号为中国农业科学院油料作物研究所提供。
实施例1油菜矮杆突变体df09的获得
试验材料选择ny18,该品种具有抗倒、抗病、抗寒、抗裂角、粒大、产量高、配合力高等优点。筛选ny18粒大饱满的种子,在磷酸缓冲液(0.1m,ph=7.0)稀释的1.0%ems溶液浸种12小时,处理后用自来水冲洗1小时,晾干种子表面水分后,将种子(m1)均匀撒播于苗床,苗龄35天时移栽到大田。花期对所有单株套袋自交,成熟期收获m2种子。将收获的m2单株种子种成m2家系,每个家系1行。油菜发育各个时期,对m2家系进行观察,选择矮杆突变表型的单株套袋自交,成熟期收获m3种子。将m3种子种成m3家系,每个家系1行,确认矮杆性状是否分离,最终获得矮杆突变体df09。
该矮杆突变体df09于2019年9月18日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno.:18532,保藏地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮政编码:100101,分类命名为:欧洲油菜(brassicanapus)。
后续通过基因组重测序,该矮杆突变体df09的c09染色体的第17420876bp位置的碱基由c突变为t,第17463666bp位置的碱基由c突变为t和第17541746bp位置的碱基c突变为t。
实施例2矮杆性状控制位点的初定位
将ny18与df09杂交并自交、回交,获得p1、p2、f1、f2、b1和b2等六个基本世代,在成熟期对株高性状进行考察,利用植物主基因+多基因混合遗传模型(sea-g6)进行分析,根据aic值最小原则,1mg-a为该性状的最适遗传模型,初步确定df09的矮杆性状受1对主基因控制。
ny18×df09的f2群体共有170个单株,从中分别选择高杆极端单株和矮杆极端单株各24株,提取dna进行等量混合,构建两个dna混合池,与两个亲本一起进行基因组重测序。通过两亲本的重测序结果,筛选多态性的snp标记,通过分析多态性snp在两个dna混合池中的频率差异,来计算snp-index及δ(snp-index),分析其与株高性状的连锁关系。选择95%置信水平下,大于阈值的窗口作为候选区间,在全基因组范围内挑选两个子代在snp-index差异显著的snp位点。利用bsa性状定位方法,初步将df09的矮杆位点定位在c09染色体的10mb区间,命名为bndwf.c9。
实施例3矮杆性状控制位点的精细定位
将加拿大材料holly与df09进行杂交,获得了一个包含2536个单株的f2群体,将群体按照常规栽培方法进行种植,苗期选取幼嫩的叶片,利用ctab法提取基因组dna。终花期统计所有单株的株高表型。
利用ny18与df09的重测序结果,在矮杆性状位点bndwf.c9的区间内筛选snp。提取候选snp上下游各200bp的序列,设计parmspcr引物。典型的parmspcr反应体系包括了5种引物:allele1fam荧光通用引物,allele2hex荧光通用引物,allele1特异扩增引物(等位基因引物1),allele2特异扩增引物(等位基因引物2)和locus特异扩增引物(位点扩增引物)。其中,allele1fam荧光通用引物和allele2hex荧光通用引物,预置在购买的2×parmspcrmix里。从f2群体中分别随机选择了15个高杆单株、15个矮杆单株和15个中杆单株,与df09、holly及其f1构成48个单株的验证群体。利用设计的parmspcr引物,对验证群体进行基因分型,筛选出能够很好区分不同基因型的多态性的引物。利用多态性引物,对holly×df09的f2群体进行检测,筛选交换单株,结合株高表型,将bndwf.c9精细定位在snp标记bnc0923和bnc0999之间,对应的染色体位置为17233664-18004384bp,对应的物理距离约为771kb。该技术具有通量高,操作简便,综合成本较低等优点(接近现有ssr系统)。
parmspcr引物序列如下:
第一组引物对包括:bnac09-42位点扩增引物bnac09-42-f、等位基因引物1:bnac09-42-rg和等位基因引物2:bnac09-42-ra;
bnac09-42位点扩增引物bnac09-42-f为:5′-agtctatgaagaaaaacaacccaac-3′,等位基因引物1:bnac09-42-rg为:
5′-gaaggtgaccaagttcatgctgttatcttgtatatatgtgggtttcttatg-3′,
等位基因引物2:bnac09-42-ra为:
5′-gaaggtcggagtcaacggattgttatcttgtatatatgtgggtttcttata-3′;
第二组引物对包括:bnac09-46位点扩增引物bnac09-46-r、等位基因引物1:
bnac09-46-fc和等位基因引物2:bnac09-46-ft;
其中,所述bnac09-46位点扩增引物bnac09-46-r为:
5′-catctgatactgtgcgtgaccc-3′,
等位基因引物1:bnac09-46-fc为:
5′-gaaggtgaccaagttcatgctgatatgaatatgtggaaaatgcgc-3′,
等位基因引物2:bnac09-46-ft为:
5′-gaaggtcggagtcaacggattgatatgaatatgtggaaaatgcgt-3′;
第三引物对包括:bnac09-54位点扩增引物bnac09-54-r、等位基因引物1:bnac09-54-fc和等位基因引物2:bnac09-54-ft;
其中,bnac09-54位点扩增引物bnac09-54-r为5′-caaagagattgcttgccaccc-3′;等位基因引物1:bnac09-54-fc为:
5′-gaaggtgaccaagttcatgctgatcttggccaactaatatcttttc-3′,
等位基因引物2:bnac09-54-ft为:
5′-gaaggtcggagtcaacggattgatcttggccaactaatatcttttt′-3′。
pcr体系为5μl:2×parmsmix:2.5μl;等位基因引物1:0.1μl;等位基因引物2:0.1μl;位点扩增引物:0.3μl;基因组dna:1μl(50ng/μl);ddh2o:1μl。
pcr程序为:94℃预变性15min;94℃变性20s,65℃退火延伸1min(每循环降0.8℃),10个循环;94℃变性20s,57℃退火延伸1min,30个循环;72℃延伸7min,4℃保存。在q6(abi)中进行pcr扩增反应;利用snpdecoder软件根据荧光信号,进行基因型分型。
扩增结果参见图3~5。其中,绿色信号为高杆基因型;蓝色信号为矮杆基因型;红色信号为杂合基因型;灰色信号为不确定基因型。
为了对bndwf.c9进一步的精细定位,将中双11号与df09进行杂交,获得了一个f2群体,包含2210个单株,苗期选取幼嫩的叶片,利用ctab法提取基因组dna。终花期统计所有单株的株高表型。利用snp标记bnc0923和bnc0999,依据上述pcr体系和pcr程序,对中双11号×df09的f2群体进行检测,共筛选到34个交换单株。在bndwf.c9的771kb区间内,继续筛选多态性的parmspcr标记,并对筛选出的34个交换单株进行基因分型。参见表1,bndwf.c9区间内多态性的parmspcr标记对34个交换单株的检测结果;其中,a为高杆基因型(cc);b为矮杆基因型(tt);h为杂合基因型(ct);n为不确定基因型。
表1
结合株高表型,最终将bndwf.c9精细定位在bnac09-42和bnac09-54之间,对应的染色体位置为17233664-18004384bp,对应的物理距离为132.1kb。
利用多态性snp标记的序列信息,将其与甘蓝型油菜参考基因组darmor-bzh进行序列比对,得到如下snp标记:
snp标记的基因型为cc时,甘蓝型油菜表现为高杆,snp标记的基因型为tt时,甘蓝型油菜表现为矮杆;snp标记的基因型为ct时,甘蓝型油菜表现为中杆。
其中,bnac09-42筛选到4个交换单株,对应的筛选效率为(2210-4)/2210=99.81%;bnac09-54筛选到2个交换单株,对应的筛选效率为(2210-2)/2210=99.91%;bnac09-46与株高表型共分离,没有筛选到交换单株,筛选效率为100%。
实施例4:针对目标性状共分离的snp位点开发常规pcr标记
为了扩大df09矮杆种质的利用范围,让不具备荧光定量pcr仪,仅具有普通pcr仪的实验室也能很好的利用分子标记筛选矮杆材料,我们将与目标性状共分离的位于c09染色体17463666bp位置的snp,设计成了常规pcr引物bnac09-46pcr。该引物包含四条引物序列:位点扩增正向引物f:bnac09-46pcr-f为5′-gagaaatactccgcaacctacg-3′,位点扩增反向引物r:bnac09-46pcr-r为5′-atgttccgaaaccaaccagag-3′,等位基因引物1:bnac09-46pcr-fc为5′-tatgaatatgtggaaaatgagc-3′,等位基因引物2:bnac09-46pcr-rt为5′-gcgtgtagtatacctgcttgga-3′。利用该引物,在普通pcr仪上(bio-radc1000)进行扩增。pcr体系为20μl:2×pcrmix:10μl;bnac09-46pcr-f:0.8μl;bnac09-46pcr-r:0.8μl;bnac09-46pcr-fc:0.8μl;bnac09-46pcr-rt:0.8μl;dna:1μl(50ng/μl);ddh2o:5.8μl。pcr程序如实施例3所述。扩增产物进行2.5%琼脂糖凝胶电泳,即可准确鉴定高杆(cc)、矮杆(tt)及中间型材料(ct)的基因型。参见图6,只有351bp扩增片段的是纯合高杆油菜,只有179bp扩增片段的是纯合矮杆油菜,同时具有351bp和179bp两个扩增片段的是杂合中间型油菜。在中双11号×em59的f2群体中随机选择了21个高杆单株,21个矮杆单株和22个中间型株高的单株,利用bnac09-46pcr进行基因型检测,结果完全与表型一致(正确率100%),表明该标记可以快速准确的对油菜株高进行基因分型,在将来的矮杆油菜分子标记辅助选择育种及矮杆种质的筛选,具有较大的应用前景。
序列表
<110>江苏省农业科学院、中国农业科学院油料作物研究所
<120>甘蓝型油菜高矮性状紧密连锁的snp标记及其应用
<160>13
<170>siposequencelisting1.0
<210>1
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>1
agtctatgaagaaaaacaacccaac25
<210>2
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>2
gaaggtgaccaagttcatgctgttatcttgtatatatgtgggtttcttatg51
<210>3
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>3
gaaggtcggagtcaacggattgttatcttgtatatatgtgggtttcttata51
<210>4
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>4
catctgatactgtgcgtgaccc22
<210>5
<211>45
<212>dna
<213>人工序列(artificialsequence)
<400>5
gaaggtgaccaagttcatgctgatatgaatatgtggaaaatgcgc45
<210>6
<211>45
<212>dna
<213>人工序列(artificialsequence)
<400>6
gaaggtcggagtcaacggattgatatgaatatgtggaaaatgcgt45
<210>7
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>7
caaagagattgcttgccaccc21
<210>8
<211>46
<212>dna
<213>人工序列(artificialsequence)
<400>8
gaaggtgaccaagttcatgctgatcttggccaactaatatcttttc46
<210>9
<211>46
<212>dna
<213>人工序列(artificialsequence)
<400>9
gaaggtcggagtcaacggattgatcttggccaactaatatcttttt46
<210>10
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>10
gagaaatactccgcaacctacg22
<210>11
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>11
atgttccgaaaccaaccagag21
<210>12
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>12
tatgaatatgtggaaaatgagc22
<210>13
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>13
gcgtgtagtatacctgcttgga22
- 还没有人留言评论。精彩留言会获得点赞!