微流控芯片快速检测甘薯羽状斑驳病毒的方法及所用引物与流程
本发明涉及一种微流控芯片快速检测甘薯羽状斑驳病毒的方法。
背景技术:
甘薯(ipomoeabatatas.lam),又名红薯、地瓜等,为旋花科甘薯属植物。甘薯种植广泛,是重要的粮食安全和新型能源用作物,也是轻工业、饲料的重要原料。甘薯富含可溶性糖、维生素c和食用纤维等各种营养物质,据《本草纲目》记载,有生津止渴,补脾益气,宽肠通便等功效。因此,被世界卫生组织列为13种最佳蔬菜之首。目前我国甘薯的年产量达一亿吨,种植面积338万公顷,而且种植面积还在不断增加。
由于甘薯采用扦插、分株等方式进行无性繁殖,一旦感染到病毒,将会代代相传,逐年累积,造成病毒病害逐年加重。据安徽、山东、北京、江苏等省市的调查研究发现,病毒病导致的甘薯产量损失严重时高达50%以上,经济损失约达40亿元。到目前为止,全世界已报道的甘薯病毒有30多种。甘薯羽状斑驳病毒(sweetpotatofeatherymottlevirus,spfmv)已被发现广泛存在于世界各地的甘薯中,是甘薯上最常见的病毒。传统的生物学鉴定只能为植物病毒病提供一些初步的信息和诊断。分子生物学检测技术以其灵敏高效的特点已成为实验室常用的方法,但检测时间较长。血清学检测技术应用最为广泛,但检测结果可能会存在假阳性,同时对于复合侵染的病毒病,elisa检测方法灵敏度会受到一定影响。电子显微镜可以观察植物病毒内部的细胞学变化,但需要与血清学或者分子生物学检测技术结合才能更好地对病毒进行准确的鉴定,同时植物病毒电镜检测直观简便,但仪器昂贵,对操作人员技术要求较高。现有的检测植物病毒的传统方法一般是rt-pcr,该方法的缺点是耗时时间长,一般需要2小时左右。
微流控芯片技术是近年来迅速发展的新的植物病毒检测技术,可以在30分钟内快速准确的检测植物病毒,具有较高的特异性和灵敏度,仅需sc-ma2000微流控芯片检测仪和恒温加热台设备即可完成检测,不需要其他昂贵的设备。
技术实现要素:
本发明要解决的技术问题是提供一种微流控芯片快速检测甘薯羽状斑驳病毒的方法,本发明根据实时荧光信号的出现时间、强度和位置,可在30分钟内快速、高效检测spfmv,为甘薯病毒病害的监测防控提供技术支持。
为了解决上述技术问题,本发明提供一种微流控芯片快速检测甘薯羽状斑驳病毒所用引物组合(spfmv-3):包括引物f3-3、b3-3、fip-3、bip-3;
引物f3-3:ggaagggccattataaatttcc,
引物b3-3:ggatgtgccattttcaatgc;
引物fip-3:cttgagtcgaccgggtgtttagcacttgtcgacatatgaac;
引物bip-3:agttccaagcatggtatgaaggagccattagtccattcaataagatcc。
作为本发明的微流控芯片快速检测甘薯羽状斑驳病毒所用引物组合的改进,还包括环引物lb3-1;
环引物lb3-1:ttaaaggggattatggtgttgacg。
说明:利用lamp引物设计软件primerexplorerv5设计微流控芯片法扩增环引物lb序列有较多种,因每个序列只有个别碱基差别,对检出时间几乎无影响,任选其一即可,例如可选用上述引物。
本发明还同时提供了利用上述引物组合(spfmv-3)进行的微流控芯片快速检测甘薯羽状斑驳病毒的方法,包括如下步骤:
1)、包埋扩增引物(包埋spfmv-3的微流控芯片的扩增引物):
引物f3-3(100μmol·l-1)和引物b3-3(100μmol·l-1)各1μl,fip-3(100μmol·l-1)和引物bip-3(100μmol·l-1)各8μl,环引物lb3-1(100μmol·l-1)4μl,0.5%(0.5g/100ml)海藻糖(海藻糖溶液)26μl,ddh2o补足总体积至150μl形成引物混合液,每个微流控芯片检测孔加入1.5μl所述引物混合液,置于恒温加热台65℃加热10min;
2)、加样:
50μl的样品混合液由荧光等温扩增预混液18μl、待测样品cdna5μl(浓度最低可为963.68×10-3ng/μl)、ddh2o补足总体积至50μl组成;
吸取50μl的样品混合液加入至一个微流控芯片加样孔,设置ddh2o作为阴性对照;
3)、恒温扩增:
将微流控芯片进行恒温扩增,然后根据ct值进行判断。
作为本发明的微流控芯片快速检测甘薯羽状斑驳病毒的方法的改进,步骤3)为:
将微流控芯片置于sc-ma2000微流控芯片检测仪中进行恒温扩增,温度为63.5℃,反应时间为60min;
当ct<30,且有明显扩增曲线时,同时阴性对照未检出(即,无明显扩增曲线),判定待测样品中含有甘薯羽状斑驳病毒;
当ct≥30或显示未检出时,判定待测样品中不含有甘薯羽状斑驳病毒。
作为本发明的微流控芯片快速检测甘薯羽状斑驳病毒的方法的进一步改进:每个微流控芯片加样孔对应4个微流控芯片检测孔。
经验证,本发明建立的微流控芯片法快速检测法可在30min之内即可快速检出含spfmv的甘薯叶片,dna浓度最低为963.68×10-3ng/μl,相比rt-pcr极大缩短了检测时间。
本发明开展基于lamp引物设计软件primerexplorerv5设计的5组spfmv的微流控芯片法扩增引物进行筛选,利用微流控芯片和恒温扩增技术相结合,将提取的dna逆转录为cdna之后加入微流控芯片中,放入实时荧光检测的微流控荧光读数仪中,进行恒温扩增。检测结果根据实时荧光信号的出现时间、强度和位置,可在30分钟内快速、高效检测spfmv,为甘薯病毒病害的监测防控提供技术支持。
本发明引物组合的设计中,最关键的是选取spfmv外壳蛋白(coatprotein,cp)基因的核苷酸序列必须确保为该病毒的保守区域;若选取的病毒核酸序列不合适,则无法筛选出合适的引物组合。本发明根据genbank中spfmv的cp基因序列(登录号:fj155666),设计微流控芯片法扩增引物组合spfmv-3,分别命名为bip-3、b3-3、fip-3、bip-3和环引物lb3-1(可利用lamp引物设计软件primerexplorerv5设计)。
在本发明检测方法中:
步骤1)中,0.5%(0.5g/100ml)海藻糖的制备方法为:5g海藻糖溶于100ml无菌水中,充分混匀溶解,之后用无菌水稀释10倍成为0.5%海藻糖溶液。
步骤2),样品混合液中使用的荧光等温扩增预混液购自宁波爱基因科技有限公司。
步骤3)中,阈值线可根据实际情况进行调整,阈值线的设置规则(设定原则)为:阈值线刚好超过非典型s型扩增曲线的最高点,且ct值显示为未检出;阈值线例如可设置为700。
在本发明中,rna的提取步骤参考上海速创诊断产品有限公司的核酸提取试剂盒说明书提取叶片总rna,具体操作步骤稍作修改,具体提取方法如下:
①取0.1g待测叶片/经rt-pcr检测含有spfmv的植物叶片,将其快速放入已经液氮预冷的研钵中,迅速使用研杵研磨,并不断加入液氮,直到样品为粉末状。将粉末状样品快速转移至用液氮提前预冷的1.5ml离心管中,加入400μl裂解液和20μl蛋白酶混合液,璇涡振荡10s,56℃孵育10min,120000g离心2min。
②吸取250μl上清于新的1.5ml离心管,然后加入300μl核酸共沉剂和2μl磁珠,璇涡振荡,使管内磁珠分布均匀。静置离心管10分钟.期间每隔两分钟上下颠倒离心管5次,使管内磁珠分布均匀。离心管置于离心机上,8000g离心lmin,用移液器吸去管内液体。
③加入500μl洗液一,用移液器枪头轻柔打散管壁磁珠,璇涡振荡10s,直至其分布均匀。将离心管置于离心机上,8000g离心lmin,用移液器吸去管内液体。
④加入500μl洗液二,用移液器枪头轻柔打散管壁磁珠,璇涡振荡10s,直至其分布均匀。将离心管置于离心机上,8000g离心lmin,用移液器吸去管内液体。
⑤加入500μl洗液三,用移液器枪头轻柔打散管壁磁珠,璇涡振荡10s,直至其分布均匀。将离心管置于离心机上,8000g离心lmin,用移液器吸去管内液体。
⑥将离心管置于离心机上,8000g离心30s,用移液器吸去管内残余液体。打开管盖,室温干燥2min。
⑦加入60μl洗脱液,用移液器枪头打散管壁磁珠,直至其分布均匀,56℃孵育3min。
⑧将离心管置于离心机上,10000g离心lmin.将收集到的60μl上清液吸取至一个无核酸酶干净的离心管中,即为纯化后的核酸溶液。保存于-80℃备用。
提取感染spfmv的甘薯叶片总rna后,逆转录为cdna;反转录合成cdna具体步骤如下:
按下列顺序依次加入试剂:oligodtprimer(50μm)1μl,dntpmixture(10mmeach)1μl,templaterna2μl,rnasefreedh2o6μl,配置成反应混合液。65℃保温5min后,冰上迅速冷却。依次加入5×primescriptiibuffer4μl,rnaseinhibitor(40u/μl)0.5μl,primescriptiirtase(200u/μl)1μl,rnasefreedh2o4.5μl。缓慢混匀。按下列条件进行反转录反应:42℃45min,95℃5min,于-20℃冰箱中保存。
本发明具有如下技术优势:
1、本发明利用微流控法建立甘薯羽状斑驳病毒快速检测体系,可在30分钟内快速、高效检测spfmv。与普通rt-pcr检测方法相比,大大缩短了目标病毒的检测时间,为甘薯病毒病害的监测防控提供技术支持。
2、本发明利用微流控法微流控法进行甘薯羽状斑驳病毒微流控芯片法特异性引物的快速筛选,仅需sc-ma2000微流控芯片检测仪和恒温加热台设备即可完成检测,不需要其他昂贵的设备。
综上所述,本发明的一种基于spfmv的微流控芯片快速检测法,是依据实时荧光信号的出现时间、强度和位置,可在30分钟内快速、高效检测spfmv,为甘薯病毒病害的监测防控提供技术支持,具有灵敏度高、特异性好的优势。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
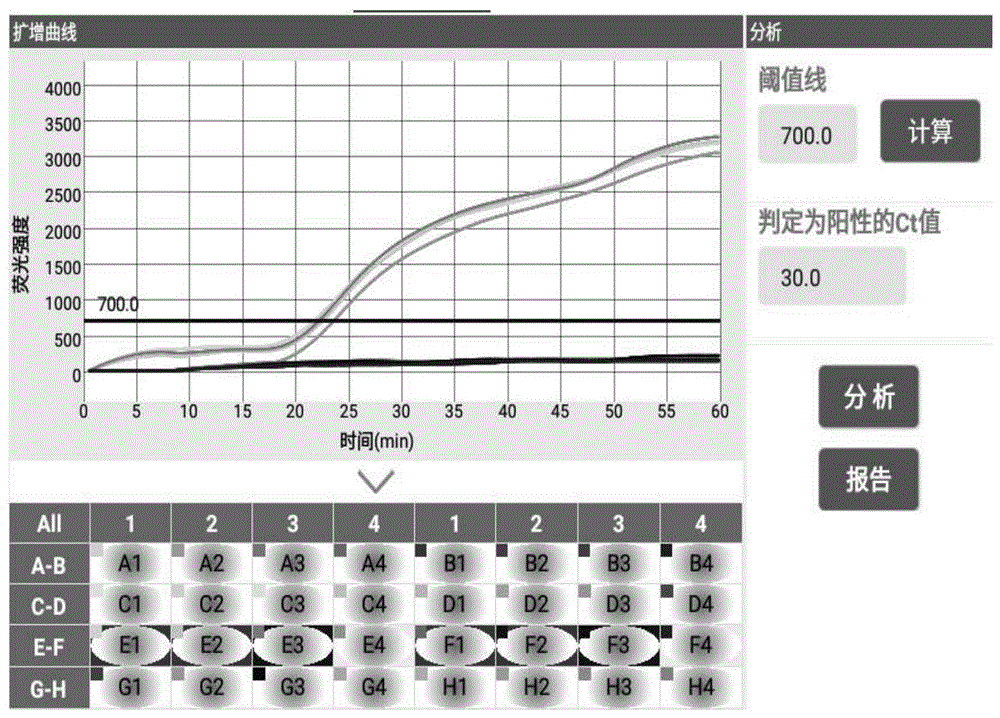
图1为实施例1所述的引物组合spfmv-3扩增曲线图;
图2为rt-pcr检测待测样品;
m:dl2000dnamarker;1:1042品系;2:zz1-458品系;3:zz1-292品系;4:阴性对照;
图3为对比例1所述的引物组合spfmv-1扩增曲线图;
图4为对比例2所述的引物组合spfmv-2扩增曲线图;
图5为对比例3所述的引物组合spfmv-4扩增曲线图;
图6为对比例4所述的引物组合spfmv-5扩增曲线图;
图1中:e1-e4为感病样品,f1-f4为阴性对照;
图3中:a1-a4为感病样品,b1-b4为阴性对照;
图4中:c1-c4为感病样品,d1-d4为阴性对照;
图5中:g1-g4为感病样品,h1-h4为阴性对照;
图6中:g1-g4为感病样品,h1-h4为阴性对照。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:一种基于spfmv的微流控芯片快速检测法,依次进行以下步骤:
1)、根据genbank中spfmv的cp基因序列(登录号:fj155666),利用lamp引物设计软件primerexplorerv5设计微流控芯片法扩增引物组合spfmv-3,分别命名为f3-3、b3-3、fip-3、bip-3和环引物lb3-1。
引物f3-3、b3-3序列分别为ggaagggccattataaatttcc和ggatgtgccattttcaatgc;
引物fip-3、bip-3序列分别为cttgagtcgaccgggtgtttagcacttgtcgacatatgaac和agttccaagcatggtatgaaggagccattagtccattcaataagatcc;
环引物lb3-1序列为ttaaaggggattatggtgttgacg。
2)、用移液枪分别吸取引物f3-3(100μmol·l-1)和引物b3-3(100μmol·l-1)各1μl,fip-3(100μmol·l-1)和引物bip-3(100μmol·l-1)各8μl,环引物lb3-1(100μmol·l-1)4μl,0.5%海藻糖26μl,ddh2o补足总体积至150μl形成引物混合液,每个微流控芯片检测孔加入1.5μl上述引物混合液,置于恒温加热台65℃10min,再用膜封住检测孔;
3)、每个加样孔对应4个检测孔;
50μl的样品混合液由荧光等温扩增预混液18μl、样品cdna5μl(浓度为963.68ng/μl)、ddh2o补足总体积至50μl组成;
吸取50μl的样品混合液加入至一个微流控芯片加样孔中,用膜封住上样孔。设置ddh2o作为阴性对照。
所述样品cdna为含有甘薯羽状斑驳病毒的甘薯cdna。
4)、将微流控芯片置于sc-ma2000微流控芯片检测仪中进行恒温扩增,温度设置为63.5℃,反应时间设置为1h,阈值线设置为700(可根据实际情况进行调整,设定原则以阈值线刚好超过非典型s型扩增曲线的最高点,且ct值显示为未检出),运行程序。
当阈值线设置为700,判断阴阳性的ct值设置为30时,结果发现,引物组合spfmv-3的检出时间为22-24min,且有明显扩增曲线,同时阴性对照未检出(即,阴性对照无扩增曲线),说明该引物组合为检测感染spfmv甘薯样品的特异性引物。
上述方法,建立的微流控芯片快速检测方法灵敏度高、特异性好,可在30分钟内快速、高效检测spfmv。
实验1、将3种不同来源的甘薯叶片先提取总rna,再反转录合成cdna;然后按照实施例1所述方法进行检测,cdna浓度分别为907.11ng/μl、927ng/μl和932.02ng/μl;所得检测结果如下表1:
表1、微流控芯片法检测不同来源的感染spfmv的甘薯叶片
验证实验、实验1中3份不同来源的甘薯叶片样品中利用rt-pcr方法均扩增出356bp的目的条带(图2),即,目的条带在250bp和500bp之间。证明这些待测样品中含有spfmv,与微流控芯片快速检测甘薯羽状斑驳病毒结果一致。
对比例1、相对于实施例1而言,仅仅更改步骤1)的引物组合,具体如下:根据genbank中spfmv的cp基因序列(登录号:fj155666),利用lamp引物设计软件primerexplorerv5设计微流控芯片法扩增引物组合spfmv-1,分别命名为f3-1、b3-1、fip-1、bip-1和环引物lb1-1。
引物f3-1、b3-1序列分别为ggtgcattgaaaatggca和cctttgtacggtttcgca;
引物fip-1、bip-1序列分别为ttgggtatgtcacttgctcatcatccccaaatataaatggtgtgt和ttaaaccattactggaccatgcagtctctatgtaagcttcagca;
环引物lb1-1序列为gcctacttttaggcagattatgacg。
结果发现,如图3所示,引物组合spfmv-1的检出时间为13-17min,有明显扩增曲线,但阴性对照在33-41min检出,也有明显扩增曲线,该引物组合检测感染spfmv甘薯样品时出现假阳性,说明该引物组合不为检测感染spfmv甘薯样品的特异性引物。
对比例2、相对于实施例1而言,仅仅更改步骤1)的引物组合,具体如下:根据genbank中spfmv的cp基因序列(登录号:fj155666),利用lamp引物设计软件primerexplorerv5设计微流控芯片法扩增引物组合spfmv-2,分别命名为f3-2、b3-2、fip-2、bip-2和环引物lb2-1。引物f3-2、b3-2序列分别为gcgtatacgagagttctcaa和gattctgggatgactgcg;引物fip-2、bip-2序列分别为gctcctgcatctttaaattcagtacgtatgatgacagtatgctcca和ctaagcctaagaacattcctccacctttcaaagctgcctgct;环引物lb2-1序列为cacccacaataactgaaatcactga。
结果发现,如图4所示,引物组合spfmv-2未检出,阴性对照也未检出,说明该引物组合不为检测感染spfmv甘薯样品的特异性引物。
对比例3、相对于实施例1而言,仅仅更改步骤1)的引物组合,具体如下:对比例根据genbank中spfmv的cp基因序列(登录号:fj155666),利用lamp引物设计软件primerexplorerv5设计微流控芯片法扩增引物组合spfmv-4,分别命名为f3-4、b3-4、fip-4、bip-4和环引物lf-1、lb-1。引物f3-4、b3-4序列分别为caagaacagttccaagcat和cctaaaagtaggcactgca;引物fip-4、bip-4序列分别为gcaccaaaccattagtccattcaatttaaaggggattatggtgttg和tgaaaatggcacatccccaaataattgggtatgtcacttgct;环引物lf-1、lb-1序列分别为ccccattcccgtgtcgt和ataaatggtgtgtggacaatgatgg。
说明:引物混合液中,环引物lf-1(100μmol·l-1)、lb-1(100μmol·l-1)各为4μl。
结果发现,如图5所示,引物组合spfmv-4的检出时间为7-9min,有明显扩增曲线,但阴性对照在10-11min检出,也有明显扩增曲线,该引物组合检测感染spfmv甘薯样品时出现假阳性,说明该引物组合不为检测感染spfmv甘薯样品的特异性引物。
对比例4、相对于实施例1而言,仅仅更改步骤1)的引物组合,具体如下:根据genbank中spfmv的cp基因序列(登录号:fj155666),利用lamp引物设计软件primerexplorerv5设计微流控芯片法扩增引物组合spfmv-5,分别命名为f3-5、b3-5、fip-5、bip-5和环引物lb5-1。引物f3-5、b3-5序列分别为aggcaaccaatggtcaat和ccattagtccattcaataagatcc;引物fip-5、bip-5序列分别为caacctcaaactgctcaggttggaagggccattataaatttcc和cacccggtcgactcaagaaccattcccgtgtcgtcaac;环引物lb5-1序列为agttccaagcatggtatgaagg。
结果发现,如图6所示,引物组合spfmv-5的检出时间为28-32min,有明显扩增曲线,但阴性对照在47-57min检出,也有扩增曲线,该引物组合检测感染spfmv甘薯样品时出现假阳性,说明该引物组合不为检测感染spfmv甘薯样品的特异性引物。
所得结果对比如下表2所述。
表2、微流控芯片法对spfmv检测特异性引物的筛选
由表2可知,本发明设计的利用微流控芯片法扩增引物组合spfmv-3,引物组合spfmv-3的检出时间为22-24min,且有明显扩增曲线,同时阴性对照未检出,说明该引物组合为检测感染spfmv甘薯样品的特异性引物,可在30分钟内快速、高效检测spfmv。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
序列表
<110>浙江大学
<120>微流控芯片快速检测甘薯羽状斑驳病毒的方法及所用引物
<160>5
<170>siposequencelisting1.0
<210>1
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>1
ggaagggccattataaatttcc22
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggatgtgccattttcaatgc20
<210>3
<211>41
<212>dna
<213>人工序列(artificialsequence)
<400>3
cttgagtcgaccgggtgtttagcacttgtcgacatatgaac41
<210>4
<211>48
<212>dna
<213>人工序列(artificialsequence)
<400>4
agttccaagcatggtatgaaggagccattagtccattcaataagatcc48
<210>5
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>5
ttaaaggggattatggtgttgacg24
- 还没有人留言评论。精彩留言会获得点赞!