检测生殖道致病微生物的LAMP引物组、微流控芯片和试剂盒的制作方法
本发明属于生殖道感染检测技术领域,尤其涉及检测生殖道致病微生物的lamp引物组、微流控芯片和试剂盒。
背景技术:
生殖道感染(reproductivetractinfection,rti)是指发生在生殖系统的一组感染性疾病。女性rti是全球性的社会及公共卫生问题,是女性生殖系统受到细菌、病毒、假丝酵母菌、滴虫、衣原体、支原体等致病微生物感染的总称,具有发病率高、复发率高、流行范围广的特点。
感染是多种疾病的源头,如果生殖道感染得不到及时诊断和正确治疗,可使艾滋病(aids)和宫颈癌的发生风险增加,以及引起不孕症、异位妊娠、流产、死胎、死产、早产、先天感染及新生儿感染、慢性腹痛等并发症,影响两代人的健康。世界卫生组织(who)发布的数据表明,中国女性中有40%患有不同程度的生殖道感染,(廖秦平,张岱.中国女性生殖道感染诊治现状及研究进展[j].国际妇产科学杂志,2011,38(6):469-471+474.)据此估算,中国每年至少有2亿女性患生殖道感染及相关疾病。另据统计表明,妇产科门诊患者中,生殖道感染占55%以上,由此产生的医疗费用每年高达200多亿元。
围生期妇女细胞免疫功能下降,体内会产生过量的雌激素,阴道微生态环境易被破坏,进而引起下生殖道感染,最终导致早产、胎膜早破、产褥感染、低出生体重儿、新生儿感染等。早产是指在怀孕28周至37周之间的分娩。早产儿死亡率国内为12.7%~20.8%,(黄善珠.早产儿护理研究进展[j].现代保健·医学创新研究,2008,5(3):26-28.)胎龄越小、体重越低,死亡率越高。早产儿即使存活,亦多有神经智力发育缺陷。心肺功能缺陷、肝脏发育不全、体温中枢发育不全和抗感染能力较低等都是早产儿多发的病症。
按照最新的国内每年出生1200万新生儿的数据统计,早产发生率为7%,即每年出生120万的早产儿。在2003~2008年,我国33.6%~40.9%的新生儿死亡与早产直接或间接相关。而感染是导致早产儿的最大的危险因素,感染所致的早产总体来说约占早产的40%。越早发生的早产感染因素所占的比例越大,30周前的早产感染因素占到80%。(崔浩,何春花,缪蕾,etal.1996-2013年中国早产或低出生体重儿死亡率变化趋势分析[j].中华预防医学杂志,2015,49(2):161-165.;时春艳,董悦.感染与早产[j].实用妇产科杂志,2005,21(11):648-650.)
临床常规的生化指标分析无法对患者所感染的病原菌种属做出准确鉴定,大多数临床治疗仍处于经验抗菌素应用阶段,在使用高级抗生素方面存在较大的盲目性。目前临床上对病原菌鉴定的方法主要是培养法。其主要步骤为取样、培养、鉴定。培养法本身存在较多缺陷,不能满足临床需要。首先培养法检测耗时长,培养时间与所感染的细菌种类有关,至少用时2-3天,当临床出现急性病症时,培养法无法适用;其次培养法准确性低,尤其是批量鉴定时,样品之间很容易互相感染;并且难以检出需要特殊培养条件的细菌等;再次受国内实验室安全防护条件的限制,实验室工作人员在分离培养病原菌时存在着高风险被感染的可能;最后培养法对实验条件要求较高,需要的培养基种类较多,乡镇医院、社区医疗单位和户外等均无法使用细菌培养的检测方法,很容易对病人造成贻误。
对于普通pcr(polymerasechainreaction,聚合酶链式反应)技术鉴定病原微生物的方法,因其对实验室要求高,需要特殊仪器,容易出现假阳性和交叉污染等缺点,也不利于其应用的开展。
在当前医疗卫生重心转移的大背景下,在临床上尤其是基层医疗机构对快速准确、操作简单、实验环境要求低的诊断产品具有迫切需求。
技术实现要素:
有鉴于此,本发明的目的在于提供检测生殖道致病微生物的lamp引物组、微流控芯片和试剂盒;本发明所述的lamp引物组、微流控芯片和试剂盒能够快速灵敏、准确、重复性强的检测无乳链球菌、粪肠球菌、阴道加德纳菌、白色念珠菌和沙眼衣原体。本发明提供的lamp引物组中的5组引物组能特异检测上述5种致病微生物,且不会和其他病原微生物发生交叉反应。
为了实现上述发明目的,本发明提供了以下技术方案:
一种检测生殖道致病微生物的lamp引物组,包括检测无乳链球菌引物组、粪肠球菌引物组、阴道加德纳菌引物组、白色念珠菌引物组和沙眼衣原体引物组;
其中所述无乳链球菌引物组包括正向外引物1-f3、反向外引物1-b3、正向内引物1-fip和反向内引物1-bip;所述1-f3、1-b3、1-fip、1-bip的的核苷酸序列依次如seqidno.1~seqidno.4所示;
所述粪肠球菌引物组包括正向外引物2-f3、反向外引物2-b3、正向内引物2-fip和反向内引物2-bip;所述2-f3、2-b3、2-fip、2-bip的的核苷酸序列依次如seqidno.5~seqidno.8所示;
所述阴道加德纳菌引物组包括正向外引物3-f3、反向外引物3-b3、正向内引物3-fip、反向内引物3-bip、正向环引物3-lf和反向环引物3-lb;所述3-f3、3-b3、3-fip、3-bip、3-lf和3-lb的核苷酸序列依次如seqidno.9~seqidno.14所示;
所述白色念珠菌引物组包括正向外引物4-f3、反向外引物4-b3、正向内引物4-fip、反向内引物4-bip和反向环引物4-lb;所述4-f3、4-b3、4-fip、4-bip、4-lb的核苷酸序列依次如seqidno.15~seqidno.19所示;
所述沙眼衣原体引物组包括正向外引物5-f3、反向外引物5-b3、正向内引物5-fip、反向内引物5-bip和反向环引物5-lb;所述5-f3、5-b3、5-fip、5-bip、5-lb的核苷酸序列依次如seqidno.20~seqidno.24所示。
本发明提供了一种检测生殖道致病微生物的微流控芯片,所述微流控芯片上固定有所述的引物组。
优选的,所述微流控芯片包括若干个反应池,每一个反应池内固定一种微生物的引物组。
优选的,所述引物1-f3、1-b3、2-f3、2-b3、3-f3、3-b3、4-f3、4-b3、5-f3和5-b3的固定量分别为10~20pmol;所述1-fip、1-bip、2-fip、2-bip、4-fip、4-bip、5-fip和5-bip的固定量分别为110~115pmol;所述3-fip和3-bip的固定量分别为50~60pmol;所述3-lf、3-lb、4-lb和5-lb的固定量分别为50~60pmol。
优选的,所述引物1-f3、1-b3、2-f3、2-b3、3-f3、3-b3、4-f3、4-b3、5-f3和5-b3的固定量分别为14pmol;所述1-fip、1-bip、2-fip、2-bip、4-fip、4-bip、5-fip和5-bip的固定量分别为112pmol;所述3-fip和3-bip的固定量分别为56pmol;所述3-lf、3-lb、4-lb和5-lb的固定量分别为56pmol。
优选的,所述微流控芯片还包括进样孔和出气孔;所述进样孔通过微通道分别与每一个反应池相连通。
优选的,所述反应池通过微通道并联连接。
本发明提供了一种检测生殖道致病微生物的试剂盒,包括所述的微流控芯片和恒温扩增mix。
优选的,所述恒温扩增mix包括isothermalamplificationbuffer、betaine、bsa溶液、mgso4、20×evagreen、datp、dttp、dctp、dgtp、bst2.0warmstartdna聚合酶、ung酶和dutp。
优选的,所述试剂盒的检测对象包括生殖道分泌物的dna。
本发明的有益效果:本发明提供的检测生殖道致病微生物的引物组,能特异检测无乳链球菌、粪肠球菌、阴道加德纳菌、白色念珠菌和沙眼衣原体,且不会和其他病原微生物发生交叉反应,特异性好,灵敏度高;本发明提供的试剂盒,可快速准确的检测生殖道致病微生物,操作简单,检测时间短,容易普及且适用于现场操作。根据实施例记载,利用本发明提供的试剂盒共检测了103份临床样本,与医院培养方法相对比,lamp芯片检测的阴性符合率为92%、阳性符合率为100%,整体符合率为92.23%;在医院检测为阴性的样本中(6份阴道加德纳菌和2份白色念珠菌样本),经lamp芯片和pcr检测均为阳性,说明本发明提供的试剂盒检测灵敏度高于传统的培养法。
附图说明
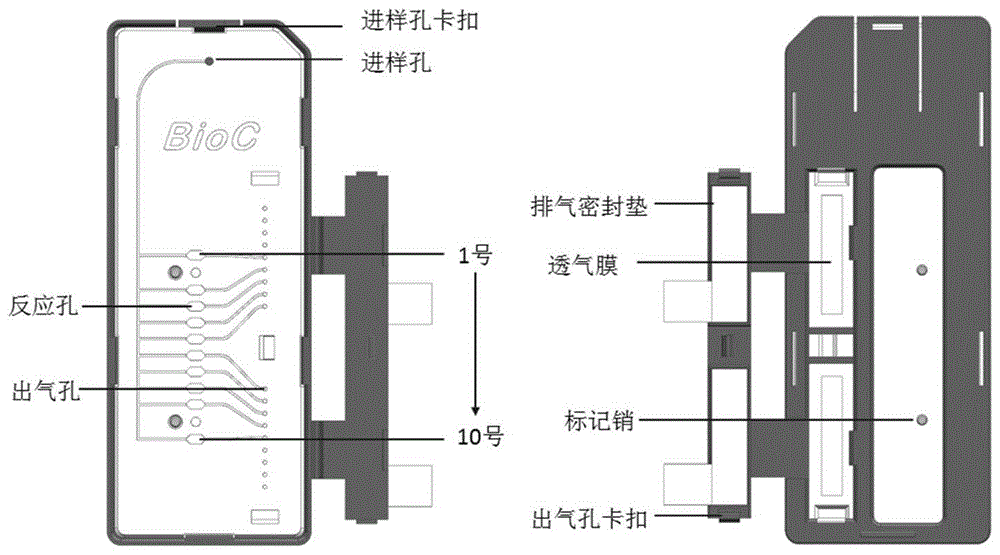
图1为实施例中应用的微流控芯片结构示意图;所述微流控芯片设有若干个反应池,每一个反应池进行编号,每一个反应池内分别包被一种微生物的检测引物组,用于扩增相应病原菌或质控。
图2为lamp微流控芯片反应的特异性实验结果。
具体实施方式
本发明提供了一种检测生殖道致病微生物的lamp引物组,包括检测无乳链球菌引物组、粪肠球菌引物组、阴道加德纳菌引物组、白色念珠菌引物组和沙眼衣原体引物组;
其中所述无乳链球菌引物组包括正向外引物1-f3、反向外引物1-b3、正向内引物1-fip和反向内引物1-bip;所述1-f3、1-b3、1-fip、1-bip的的核苷酸序列依次如seqidno.1~seqidno.4所示;
所述粪肠球菌引物组包括正向外引物2-f3、反向外引物2-b3、正向内引物2-fip和反向内引物2-bip;所述2-f3、2-b3、2-fip、2-bip的的核苷酸序列依次如seqidno.5~seqidno.8所示;
所述阴道加德纳菌引物组包括正向外引物3-f3、反向外引物3-b3、正向内引物3-fip、反向内引物3-bip、正向环引物3-lf和反向环引物3-lb;所述3-f3、3-b3、3-fip、3-bip、3-lf和3-lb的核苷酸序列依次如seqidno.9~seqidno.14所示;
所述白色念珠菌引物组包括正向外引物4-f3、反向外引物4-b3、正向内引物4-fip、反向内引物4-bip和反向环引物4-lb;所述4-f3、4-b3、4-fip、4-bip、4-lb的核苷酸序列依次如seqidno.15~seqidno.19所示;
所述沙眼衣原体引物组包括正向外引物5-f3、反向外引物5-b3、正向内引物5-fip、反向内引物5-bip和反向环引物5-lb;所述5-f3、5-b3、5-fip、5-bip、5-lb的核苷酸序列依次如seqidno.20~seqidno.24所示。
在本发明中,所述引物的具体序列如表1所示。
表1五个检测指标微生物的lamp引物组
本发明提供了一种检测生殖道致病微生物的微流控芯片,所述微流控芯片上固定有所述的引物组。
在本发明中,所述微流控芯片优选的包括若干个反应池,每一个反应池内固定一种微生物的引物组。在本发明中,所述引物1-f3、1-b3、2-f3、2-b3、3-f3、3-b3、4-f3、4-b3、5-f3和5-b3的固定量分别优选为10~20pmol,更优选为14pmol;所述1-fip、1-bip、2-fip、2-bip、4-fip、4-bip、5-fip和5-bip的固定量分别优选为110~115pmol,更优选为114pmol;所述3-fip和3-bip的固定量分别优选为50~60pmol,更优选为56pmol;所述3-lf、3-lb、4-lb和5-lb的固定量分别优选为50~60pmol,更优选为56pmol。
在本发明中,所述微流控芯片优选的还包括进样孔和出气孔;所述进样孔通过微通道分别与每一个反应池相连通。在本发明中,所述反应池通过微通道并联连接。在本发明中,所述微流控芯片优选的还包括进样孔卡口和出气孔卡扣;本发明对所述微流控芯片的具体结构和制备方法没有特殊限定,采用本领域常规的微流控芯片的结构和制备方法即可。在本发明中,所述微流控芯片优选的独立包装,并在2-8℃保存;所述微流控芯片在使用前优选的置于室温(20~30℃)平衡。在本发明中,所述微流控芯片优选的委托百康芯(天津)生物科技有限公司生产。
本发明提供了一种检测生殖道致病微生物的试剂盒,包括所述的微流控芯片和恒温扩增mix。在本发明中,所述恒温扩增mix包括isothermalamplificationbuffer、betaine、bsa溶液、mgso4、20×evagreen、datp、dttp、dctp、dgtp、bst2.0warmstartdna聚合酶、ung酶和dutp。在本发明中,所述恒温扩增mix优选的购自百康芯(天津)生物科技有限公司。在本发明中,所述试剂盒的检测对象优选的包括生殖道分泌物的dna;本发明对所述生殖道分泌物的dna的提取方法没有特殊限定,采用本领域常规的dna提取方法即可。
在本发明中,利用所述试剂盒进行生殖道致病微生物检测的方法,优选的包括以下步骤:1)提取待测样本的核酸;2)将所述待测样本的核酸与等温扩增mix混合加入到所述微流控芯片的加样孔中进行环介导等温扩增,检测扩增信号,确定待测样本是否含有引物组对应的生殖道致病微生物。在本发明中,步骤2)中所述待测样本的核酸与等温扩增mix混合的体积比优选为1:1。在本发明中,所述环介导等温扩增的程序优选的如下:37℃,3min;65℃,55min。在本发明中,所述检测扩增信号优选的通过ichip-400四通道芯片恒温扩增核酸分析仪进行。本发明对所述检测扩增信号的具体步骤没有他特殊限定,采用本领域常规的步骤即可。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
用于检测生殖道致病微生物lamp引物组的设计和制备
管家基因(hkg)是一类在不同组织中表达稳定,且受环境干扰较小的基因的总称。管家基因检测已被广泛应用于物种进化分析,鉴定以及复杂生物样品的安全监测领域。葡萄糖激酶基因(glucokinase,glk)是无乳链球菌的管家基因之一,有研究测定了152个无乳链球菌菌株glk基因的可变核苷酸位点,其百分比为1.5%,在无乳链球菌中普遍存在且保守,可以作为特异基因用于细菌鉴定。细菌基因gyra编码dna促旋酶(dnagyrase)a亚基,dna促旋酶在dna复制、转录和修复中起重要作用。gyra基因以单拷贝的形式存在于大多数细菌基因组中,是相对保守的管家基因,该基因的序列分析与dna-dna杂交的同源性分析具有较好的一致性,gyra的表达稳定性仅次于16srrna,因此还可用于细菌分型鉴定,是目前细菌分类鉴定中系统发育标记的代表。gyra基因已在芽孢杆菌的系统发育分析及菌株鉴定中广泛运用。
分别根据无乳链球菌的glk基因、粪肠球菌的gyra基因和沙眼衣原体的gyra基因序列设计引物组,基因序列从ncbi上gene数据库下载得到,上传至在线引物合成工具获得lamp引物组,每组引物包括一对特异内引物和一对特异外引物,沙眼衣原体的引物组还包括了一条特异环引物lb,根据反应效率和特异性对不同引物组的反应效果进行监测筛选,确定反应快、特异性高的引物组。
阴道加德纳菌和白色念珠菌的引物组分别来自文献中。
*higashides,choo,matsuday,etal.loop-mediatedisothermalamplificationfortherapiddetectionofgardnerellavaginalis:lampforrapiddetectionofg.vaginalis[j].microbiologyandimmunology,2018,62(9).
**kasaharak,ishikawah,satos,etal.developmentofmultiplexloop-mediatedisothermalamplificationassaystodetectmedicallyimportantyeastsindairyproducts[j].femsmicrobiologyletters,2014,357(2):208-216.
5种微生物具体的引物组序列见表1。
实施例2
用于检测生殖道致病微生物的试剂盒的制备及使用
试剂盒包括微流控芯片和恒温扩增mix。
2.1用于检测生殖道致病微生物试剂的制备
本发明所提供的用于检测生殖道致病微生物的试剂组成如下:
35μl恒温扩增mix,35μl模板,共计70μl。其中恒温扩增mix由百康芯公司提供,其中包括isothermalamplificationbuffer、betaine、bsa溶液、mgso4、20×evagreen、datp、dttp、dctp、dgtp、bst2.0warmstartdna聚合酶、ung酶、dutp。反应体系中各引物组的浓度见表2.
表2lamp反应体系中引物终浓度
2.2装载引物组的微流控反应芯片
微流控反应芯片由百康芯(天津)生物科技有限公司生产,示意图如图1所示。微流控芯片设有10个反应池,依次编号1~10号。1~10号反应池每个反应池内分别包被一套引物,用于扩增相应病原菌或质控。
2.3用于检测生殖道致病微生物的微流控芯片的使用方法
2.3.1提取dna
用dna快速提取试剂盒(玻璃珠法)提取无乳链球菌、粪肠球菌、阴道加德纳菌、白色念珠菌和沙眼衣原体的dna,操作步骤如下:
1)在1.5ml无菌ep管中加入1ml无菌生理盐水,将拭子置于生理盐水中洗脱拭子上的微生物。12000rpm,离心2min,弃上清。
2)向离心管中加入200μl核酸提取液,涡旋振荡混匀,使沉淀完全悬浮。
3)将悬浮液全部转移至核酸提取管中,旋紧管盖,剧烈振荡5min。
4)随后100℃加热5min,12000rpm,离心2min后,将上清液转移至洁净离心管中,用于lamp扩增检测。
2.3.2反应体系配制
分别吸取35μldna样本和35μl恒温扩增试剂到无菌的1.5ml离心管中,盖好管盖后,涡旋振荡混匀后瞬时离心。每份样品使用1个离心管,每份核酸扩增反应总体积为70μl。
2.3.3lamp扩增检测
从冰箱中取出芯片平衡至室温,在洁净工作台内打开包装并将芯片进出样口向上,用移液器吸取70μl上述配制好的核酸扩增反应体系,从进样孔加入到芯片主通道中,待其充满整张并能感觉明显加样阻力时停止加样,分别压紧进样孔与出气的卡扣。
扩增程序为第一阶段:37℃,3min;第二阶段:65℃,55min。
2.3.4微流控芯片结果判读
1)打开ichip-400四通道芯片恒温扩增核酸分析仪电源,然后打开《ichip-400呼吸道病原菌核酸检测应用软件》,点击主界面的“检测”按钮进入检测界面,等待右上角显示“就绪”。
2)打开仪器上盖,将芯片分别插入检测通道中(芯片进样口朝上,进行口面正对操作者)。
3)点击“检测设置”按钮,勾选芯片插入的通道,并在对应通道录入待检样本的信息。然后盖上仪器上盖,点击操作区域的“启动”按钮开始样本检测,进行样本检测,在“实时荧光曲线”区域显示实时荧光曲线,在“检测状态信息”区域显示剩余时间。检测完成后,根据“实时荧光曲线”有无扩增判读检测结果(曲线有扩增即为阳性,曲线无扩增即为阴性)。
实施例3
检测环介导等温扩增微流控芯片的特异性
特异性实验中用到的10种生殖道感染相关菌分别为:大肠杆菌、屎肠球菌、表皮葡萄球菌、停乳链球菌、肺炎克雷伯菌、脆弱拟杆菌、奇异变形杆菌、阴沟肠杆菌、金黄色葡萄球菌、副溶血链球菌,均来自于成都市第三人民医院临床分离株,用百康芯核酸快速提取试剂盒提取dna用于扩增检测提取方法同实施例2中的2.3.1。取上述十种菌的dna各2μl和35μl扩增mix,用depc水补足体系至70μl,混匀后按照2.3.3中的操作注入芯片置于配套仪器内检测。
检测结果显示十种生殖道感染相关病原菌均未发生非特异扩增,仅芯片内置阳性质控正常扩增(图2),说明lamp芯片能特异性的检测无乳链球菌、粪肠球菌、阴道加德纳菌、白色念珠菌和沙眼衣原体,而与其他病原微生物无交叉反应,检测特异性良好。
实施例4
检测环介导等温扩增微流控芯片的灵敏度
分别将无乳链球菌、粪肠球菌、阴道加德纳菌和白色念珠菌接入bhi液体培养基培养过夜,用pbs缓冲液进行十倍梯度稀释,选择合适稀释度涂布平板计数;取1ml原菌液用百康芯快速提取试剂盒提取dna,并测定含量,再用depc水将所得dna十倍梯度稀释作为lamp扩增模板测试反应的检测下限。沙眼衣原体灵敏度实验是利用pcr将gyra基因目的片段大量扩增:上游引物:gcactttcttgtatggacgaag(seqidno.25),下游引物:2490cccagattgaacacttgctg(seqidno.26),退火温度56℃,回收纯化后测定所得片段浓度,再根据片段长度计算拷贝数,十倍梯度稀释后作为lamp反应模板用于灵敏度测试,lamp芯片反应步骤与2.3.3中相同。五个指标微生物lamp芯片检测灵敏度见表3.
表3芯片上检测灵敏度
实施例5
利用环介导等温扩增微流控芯片检测人的生殖道分泌物拭子
按照实施例2中2.3的方法提取生殖道分泌物拭子的dna,洁净工作台中分别吸取35μldna样本和35μl恒温扩增试剂到无菌的1.5ml离心管中,盖好管盖后,涡旋振荡混匀后瞬时离心。每份样品使用1个离心管,每份核酸扩增反应总体积为70μl,混匀后按照2.3.3中的操作进样至微流控芯片中进行环介导等温扩增反应。
共检测了103份临床样本,与医院培养方法相对比,lamp芯片检测的阴性符合率为92%、阳性符合率为100%,整体符合率为92.23%。
此外,还对与医院检测结果不符的临床样本进行了pcr验证,在医院检测为阴性的样本中(6份阴道加德纳菌和2份白色念珠菌样本),经lamp芯片和pcr检测均为阳性,说明分子检测方法的灵敏度高于培养法。
表4生殖道拭子的lamp微流控芯片检测结果
*“+”表示lamp(chip)检测为阳性,”-“表示lamp(chip)检测为阴性。不符合表示该结果与医院培养法检测所得结果相反。
表5lamp微流控芯片检测的临床符合率
由上述实施例可知,本发明提供的生殖道致病微生物检测试剂盒可快速准确的检测无乳链球菌、粪肠球菌、阴道加德纳菌、白色念珠菌和沙眼衣原体,能够实现多个病原菌的同时检测,操作简便,在科学研究和生产实践中易于普及,更加适用于现场操作。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>天津红日药业股份有限公司
<120>检测生殖道致病微生物的lamp引物组、微流控芯片和试剂盒
<160>26
<170>siposequencelisting1.0
<210>1
<211>19
<212>dna
<213>artificialsequence
<400>1
aacatcgtttgagcctcta19
<210>2
<211>18
<212>dna
<213>artificialsequence
<400>2
attattggcaccagcacc18
<210>3
<211>46
<212>dna
<213>artificialsequence
<400>3
agttctatcaacagctcctggagattaacaaaagatgactttctcg46
<210>4
<211>45
<212>dna
<213>artificialsequence
<400>4
ggctgatactcaagaagtaggttcctgcaacattagcatcgttat45
<210>5
<211>22
<212>dna
<213>artificialsequence
<400>5
gcaatcagaagatgattatcgg22
<210>6
<211>22
<212>dna
<213>artificialsequence
<400>6
gcttaccataaccattttcagt22
<210>7
<211>40
<212>dna
<213>artificialsequence
<400>7
gatgctgtccggcccatatccacatgcaggatactctgtc40
<210>8
<211>45
<212>dna
<213>artificialsequence
<400>8
ggaatccgtctccgcgaaaaactaggacttctttattttcatcca45
<210>9
<211>18
<212>dna
<213>artificialsequence
<400>9
ttactccgcatccacgaa18
<210>10
<211>18
<212>dna
<213>artificialsequence
<400>10
aacacccttcttggtagc18
<210>11
<211>40
<212>dna
<213>artificialsequence
<400>11
acgttctccttcaggaagctggatcttcaccaacttcggt40
<210>12
<211>40
<212>dna
<213>artificialsequence
<400>12
tcctggaaggaatccgtcccggtattctccttgctcgaac40
<210>13
<211>22
<212>dna
<213>artificialsequence
<400>13
gagaacaagttgctgcggtgct22
<210>14
<211>20
<212>dna
<213>artificialsequence
<400>14
cgggttgatattcccgtacc20
<210>15
<211>19
<212>dna
<213>artificialsequence
<400>15
acatcccccggatttacct19
<210>16
<211>44
<212>dna
<213>artificialsequence
<400>16
aaccccgaaaggtaatcaaccagggtgttacaccgttcgaactg44
<210>17
<211>41
<212>dna
<213>artificialsequence
<400>17
tcggtagtaggttagcgtgggaggacagcccacacgcttag41
<210>18
<211>23
<212>dna
<213>artificialsequence
<400>18
acgaaggttagtactctcagatt23
<210>19
<211>19
<212>dna
<213>artificialsequence
<400>19
cggctgcggaggtggtttt19
<210>20
<211>18
<212>dna
<213>artificialsequence
<400>20
tctggtattccggagggc18
<210>21
<211>20
<212>dna
<213>artificialsequence
<400>21
agtcctacctgatttgaggt20
<210>22
<211>41
<212>dna
<213>artificialsequence
<400>22
ctaccgtctttcaagcaaacccatgagcgtcgtttctccct41
<210>23
<211>48
<212>dna
<213>artificialsequence
<400>23
ttgacaatggcttaggtctaaccaaaagatatacgtggtggacgttac48
<210>24
<211>20
<212>dna
<213>artificialsequence
<400>24
ctcaacaccaaacccagcgg20
<210>25
<211>22
<212>dna
<213>artificialsequence
<400>25
gcactttcttgtatggacgaag22
<210>26
<211>20
<212>dna
<213>artificialsequence
<400>26
cccagattgaacacttgctg20
- 还没有人留言评论。精彩留言会获得点赞!