一种微尺度血管网络体外组织及其制备方法与流程
本发明涉及生物医学领域,特别是涉及一种微尺度血管网络体外组织及其制备方法。
背景技术:
针对临床常见的组织缺损问题,采用生物制造技术在体外构建生物支架作为体外组织,进行培养后移植进入缺损部位实现组织的修复已成为临床医学领域广泛采用的方法之一。在体外组织内制备血管网络是实现体外组织功能的重要因素,因此,体外组织血管网络的制备是组织工程领域最为重要的课题之一。为制备体外组织血管网络,目前广泛采用的工艺包括传统模具工艺、增材制造工艺、牺牲工艺以及复合工艺。传统模具工艺制备过程较为复杂,涉及的装置及步骤较多,且制备的血管网络结构较为单一,主要集中在二维结构上;增材制造工艺主要包含了3d打印与喷墨打印,虽然可以打印结构较为复杂的血管网络,但所制备的血管网络尺寸较大,制备方法扩展能力较弱;牺牲工艺灵活性较高,无论是在血管网络结构复杂程度上,还是血管网络尺寸范围上,与其他制备工艺相比都具有较高的优势。牺牲工艺一般是与其他工艺进行配合,在体外组织中制备血管网络,也就是复合工艺。
工艺的多样性保证了不同尺度的血管网络的制备。从目前的研究现状来看,在体外组织内制备血管网络广泛采用的方法是复合工艺,此方法在制备管径>300μm的血管网络时成熟度较高;对于管径<100μm的血管网络,可采用静电纺丝作为水溶性模块去除后获得,但此方法获得的血管网络尺寸较为单一,且结构不可控。另外,通过内皮细胞自身的生长,结合外界刺激也可以获得管径较小的血管网络。但目前的工艺在制备管径为100-300μm的血管网络上还存在技术壁垒。随着增材制造技术的发展,光固化技术在制备特征尺寸较小的结构上,相对其他工艺具有无可比拟的优势,尤其是在制备微尺度血管网络结构上,数字光处理(dlp,digitallightprocessing)技术被广泛用来制备微尺度血管网络体外组织或器官。
dlp技术由于其技术特点,在制备精细结构上具有较高的优势,但目前针对dlp技术来制备微尺度血管网络还存在以下两点问题:(1)dlp技术对于材料要求较高,需要光固化材料配合使用才能使制备的结构成型,使得所制备的结构缺乏生物相容性,也限制了此项技术在制备体外组织时材料的选择范围;(2)dlp技术对于研究人员的专业知识和综合技能要求较高,需要多学科研究人员进行配合才能使用,使得临床研究人员在制备体外组织时受阻,限制了部分临床研究应用。
技术实现要素:
本发明的目的是提供一种新型的微尺度血管网络体外组织及其制备方法。
为实现上述目的及其他相关目的,本发明第一方面提供一种微尺度血管网络体外组织的制备方法,包括:
1)提供3d打印的牺牲模块;
2)将温敏性智能水凝胶和交联水凝胶混合后在温度小于25℃下包覆所述牺牲模块,成型后去除牺牲模块,制备获得宏观尺寸血管网络体外组织;
3)将步骤2)所述的宏观尺寸血管网络体外组织在温度36℃~42℃下进行培养,所述温敏性智能水凝胶收缩以及交联水凝胶交联成型后制备获得微尺寸血管网络体外组织。
在本发明的一些实施方式中,所述步骤1)中牺牲模块选自水溶性模块。
在本发明的一些实施方式中,所述步骤1)中所述水溶性模块的材质选自聚乙烯醇;去除水溶性模块的溶剂选自水。
在本发明的一些实施方式中,步骤1)中,所述3d打印牺牲模块时,将丝材在支撑材料上进行牺牲模块的打印;步骤2)中进一步去除所述支撑材料;所述支撑材料选自聚乳酸。
在本发明的一些实施方式中,所述步骤2)中,所述温敏性智能水凝胶和交联水凝胶的质量比为1:10~20。
在本发明的一些实施方式中,所述步骤2)中,所述牺牲模块与温敏性智能水凝胶的质量比为3~10:1。
在本发明的一些实施方式中,所述步骤2)中,所述温敏性智能水凝胶选自聚(n-异丙基丙烯酰胺)水凝胶。
在本发明的一些实施方式中,所述步骤2)中,所述交联水凝胶包括水凝胶、交联剂和/或光引发剂。
在本发明的一些实施方式中,所述水凝胶选自明胶、甲基丙烯酸化水凝胶、纤维蛋白原、或胶原中的一种或多种的组合;所述交联剂选自谷氨酰胺转氨酶、凝血酶、京尼平中的一种或多种的组合;所述光引发剂选自2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮。
在本发明的一些实施方式中,步骤2)中所述交联水凝胶包括明胶和谷氨酰胺转氨酶;
在本发明的一些实施方式中,步骤2)中所述交联水凝胶包括甲基丙烯酸化水凝胶和2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮。
在本发明的一些实施方式中,步骤2)中所述交联水凝胶包括纤维蛋白原和凝血酶;
在本发明的一些实施方式中,步骤2)中所述交联水凝胶包括胶原和京尼平。
在本发明的一些实施方式中,步骤3)中所述宏观尺寸血管网络体外组织是在5%co2的细胞培养箱中进行培养。
本发明另一方面提供一种微尺度血管网络体外组织,采用本发明所述微尺度血管网络体外组织的制备方法制备获得。
在本发明的一些实施方式中,所述微尺度血管网络体外组织的管内径小于300μm;优选为50~300μm。
本发明另一方面提供本发明所述的微尺度血管网络体外组织在生物制造技术和临床医学的用途。
附图说明
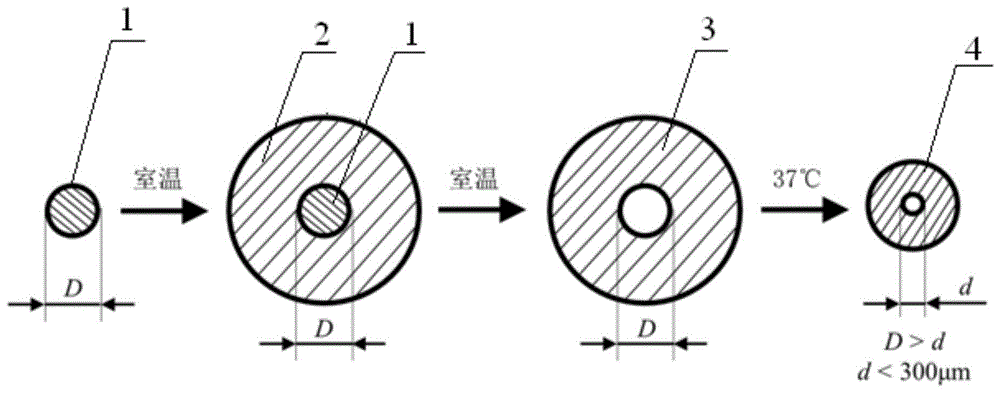
图1是本发明实施例1~4精准制备微尺度血管网络体外组织的流程图。
图中元件标号
1水溶性模块
2含温敏性智能水凝胶和交联水凝胶的混合水凝胶
3宏观尺寸血管网络体外组织
4微尺寸血管网络体外组织
具体实施方式
智能水凝胶是典型的刺激响应材料。智能水凝胶包含了交联聚合网络,使其结构保持稳定,智能水凝胶内部丰富的水分使其在常温下处于膨胀状态,在温度变化、ph变化和光照等外界条件的刺激下,膨胀的智能水凝胶发生相应的结构变化,在外界条件刺激下发生结构收缩。本发明的申请人经过大量探索实验,将3d打印工艺、牺牲工艺和体积收缩工艺进行复合,采用温敏性智能水凝胶材料及交联水凝胶制备含微尺度血管网络的体外组织,不需要借助外界的额外刺激来获得理想结构,通过细胞培养温度和人体生理温度即可实现微尺度血管网络的精准制备。
本发明第一方面提供一种微尺度血管网络体外组织的制备方法,包括:
1)提供3d打印的牺牲模块;
2)将温敏性智能水凝胶和交联水凝胶在温度小于25℃下包覆所述牺牲模块,成型后去除牺牲模块,制备获得宏观尺寸血管网络体外组织;
3)将步骤2)所述的宏观尺寸血管网络体外组织在温度36℃~42℃下进行培养,所述自由基聚合的温敏性智能水凝胶排水收缩以及交联水凝胶交联成型后制备获得微尺寸血管网络体外组织。
本发明所提供的微尺度血管网络体外组织的制备方法中,所述步骤1)是提供3d打印的牺牲模块。牺牲模块是在室温下打印,温度例如可以是小于25℃。步骤1)中所述牺牲模块选自水溶性模块,在一具体实施例中,所述水溶性模块的材质选自聚乙烯醇(pva)。例如可以采用商用的聚乙烯醇(pva)丝材进行牺牲模块的打印。牺牲模块为圆柱形。
通常情况下,如果打印结构较为简单的牺牲模块时,不需要借助支撑材料即可完成牺牲模块的打印。如果在打印结构较为复杂的牺牲模块时,需借助支撑材料方可完成牺牲模块的打印。在一具体实施例中,所述支撑材料为聚乳酸(pla)。
本发明所提供的微尺度血管网络体外组织的制备方法中,所述步骤2)是将温敏性智能水凝胶和交联水凝胶在温度小于25℃(室温)下包覆所述牺牲模块,成型后去除牺牲模块,制备获得宏观尺寸血管网络体外组织。由于血管是管状结构,此处包覆是指围绕圆柱形的牺牲模块的轴向方向包覆,牺牲模块的圆柱体的上表面和下表面并未被温敏性智能水凝胶和交联水凝胶包覆。在一具体实施例中,将3d打印的牺牲模块放置在细胞培养皿中,并进行相应固定,倒入配制好的温敏性智能水凝胶和交联水凝胶,放置在室温下固定成型后,将成型后的结构放置在水中,并借助注射器,快速冲洗牺牲模块,获得宏观尺度血管网络体外组织。宏观尺度血管网络体外组织为管状结构。所述宏观尺度血管网络体外组织的截面为环绕牺牲模块形成的同心圆结构。
本发明所提供的微尺度血管网络体外组织的制备方法中,步骤2)中,去除水溶性模块的溶剂选自水。
进一步的,温敏性智能水凝胶和交联水凝胶组成的混合水凝胶中,温敏性智能水凝胶和交联水凝胶的质量比为1:10~20。在一些实施例中,温敏性智能水凝胶和交联水凝胶的质量比例如可以为1:10~12,1:12~14,1:14~16,1:16~18;1:18~20;或1:12~18。
进一步的,牺牲模块和温敏性智能水凝胶的质量比为3~10:1。在一些实施例中,牺牲模块和温敏性智能水凝胶的质量比例如可以为3~10:1,3~5:1,5~7:1,7~10:1,4~9:1,或5~8:1。
步骤2)中所述温敏性智能水凝胶选自聚(n-异丙基丙烯酰胺)水凝胶,聚(n-异丙基丙烯酰胺)水凝胶由n-异丙基丙烯酰胺单体通过自由基聚合而成,聚(n-异丙基丙烯酰胺)大分子侧链上包含亲水性的酰胺基和疏水性的异丙基,亲水基在常温下与水分子之间作用溶于水。当达到32℃时,疏水基作用力增强,使聚(n-异丙基丙烯酰胺)水凝胶排水收缩。
步骤2)中所述交联水凝胶包括水凝胶、交联剂和/或光引发剂。在一些实施例中,所述水凝胶选自明胶、甲基丙烯酸化水凝胶、纤维蛋白原、或胶原中的一种或多种的组合。所述交联剂选自谷氨酰胺转氨酶、凝血酶、京尼平中的一种或多种的组合。所述光引发剂选自2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮。
其中明胶来源于猪皮肤、水中溶解度50mg/ml。谷氨酰胺转氨酶中酶活跃度约为100u/g。甲基丙烯酸化水凝胶中甲基丙烯酸化程度30%。2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮(例如可以是irgacure2959,2-hydroxy-4′-(2-hydroxyethoxy)-2-methylpropiophenone,98%)、纤维蛋白原来源于人类血浆、包含50-70%蛋白。凝血酶来源于牛血浆、包含40-300nihunits/mg蛋白。胶原为i型,来源于鼠尾,纯度>95%。京尼平的高效液相色谱法测量含量≥98%。
具体的,步骤2)中所述交联水凝胶选自明胶和交联剂谷氨酰胺转氨酶;
和/或交联水凝胶选自甲基丙烯酸化水凝胶和光引发剂2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮;
和/或交联水凝胶选自纤维蛋白原和交联剂凝血酶;
和/或交联水凝胶选自胶原和交联剂京尼平。
更具体的,在一具体实施例中,温敏性智能水凝胶选自聚(n-异丙基丙烯酰胺)水凝胶(pnipam);交联水凝胶选自明胶和谷氨酰胺转氨酶(tg酶)。
在另一具体实施例中,温敏性智能水凝胶选自聚(n-异丙基丙烯酰胺)水凝胶(pnipam);交联水凝胶选自甲基丙烯酸化水凝胶(gelma)和2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮。
在另一具体实施例中,温敏性智能水凝胶选自聚(n-异丙基丙烯酰胺)水凝胶(pnipam);交联水凝胶选自纤维蛋白原和凝血酶。
在另一具体实施例中,温敏性智能水凝胶选自聚(n-异丙基丙烯酰胺)水凝胶(pnipam);交联水凝胶选自胶原和京尼平。
如果步骤1)中采用了支撑材料,在步骤2)中成型后也需采用溶剂去除支撑材料,去除牺牲模块和支撑材料后制备获得宏观尺寸血管网络体外组织。在一具体实施例中,所述溶剂为三氯甲烷。
本发明所提供的微尺度血管网络体外组织的制备方法中,步骤2)所述的宏观尺寸血管网络体外组织在温度36℃~42℃下进行培养,所述温敏性智能水凝胶收缩以及交联水凝胶交联成型后制备获得微尺寸血管网络体外组织。36℃~42℃为人体生理温度。在一优选实施例中,在温度为37℃下进行培养。具体的,步骤3)中所述宏观尺寸血管网络体外组织是在5%co2的细胞培养箱中进行培养。
在一具体实施例中,对获得的宏观尺度血管网络体外组织在采用磷酸盐缓冲液进行冲洗后,将其放置在新的细胞培养皿中,并转移到37℃的细胞培养箱中进行培养,温敏性智能水凝胶在外界温度升高后产生结构收缩现象,宏观尺度血管网络向微尺度血管网络转变,完成微尺度血管网络的精准制备;交联水凝胶在37℃的细胞培养箱中需进一步培养,使交联水凝胶完全交联成型,获得结构较为稳定的微尺度血管网络体外组织。微尺度血管网络体外组织为管状结构。
本发明第二方面提供一种微尺度血管网络体外组织,采用本发明第一方面所述微尺度血管网络体外组织的制备方法制备获得。
本发明所提供的微尺度血管网络体外组织中,所述微尺度血管网络体外组织为管状结构。所述微尺度血管网络体外组织的管内径小于300μm。所述微尺度血管网络体外组织的管内径优选为50~300μm。在一些实施例中,所述微尺度血管网络体外组织的管内径例如可以是50~100μm,100~150μm,150~200μm,200~250μm,250~300μm,100~300μm,150~300μm,200~300μm,150~250μm,或100~250μm。
本发明第三方面提供本发明第二方面所述的微尺度血管网络体外组织在生物制造技术和临床医学的用途。
本发明所提供的用途中,通常情况下,将微尺度血管网络体外组织进行培养后移植进入缺损部位实现组织的修复。
本发明的有益效果如下:
1.本发明制备过程中不涉及到极限温度或酸碱性溶液,只需在人体生理温度下利用体积收缩,即可实现宏观尺度血管网络向微观尺度血管网络的转变,制备过程和所用材料具有生物相容性;
2.本发明牺牲模块的制备采用3d打印,可制备结构较为复杂的血管网络,灵活性较高;
3.本发明牺牲模块的打印采用桌面级3d打印机,操作简单,体外组织制备过程所涉及材料简单易得,且成本较低,简便快捷,适用于临床研究人员;
4.本发明不仅可制备微尺度血管网络体外组织,还可以制备体外模型,进行病理学相关研究,用途广泛。
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在下述实施例中,所使用到的试剂、材料以及仪器如没有特殊的说明,均可商购获得。
聚(n-异丙基丙烯酰胺)水凝胶为西格玛奥德里奇(上海)贸易有限公司生产的535311。明胶为西格玛奥德里奇(上海)贸易有限公司生产的v900863。谷氨酰胺转氨酶为深圳恒生生物科技有限公司生产的食品级酶。甲基丙烯酸化水凝胶为上海阿拉丁生化科技股份有限公司公司生产的m299511。光引发剂irgacure2959为西格玛奥德里奇(上海)贸易有限公司生产的410896。纤维蛋白原为西格玛奥德里奇(上海)贸易有限公司生产的f3879。凝血酶为西格玛奥德里奇(上海)贸易有限公司生产的t4648。胶原为美国bdbiosciences公司生产的354236。京尼平为西格玛奥德里奇(上海)贸易有限公司生产的g4796。
实施例
参见图1,一种基于温敏性智能水凝胶的微尺度血管网络体外组织精准制备方法:以3d打印的水溶性模块作为牺牲模块,采用温敏性智能水凝胶和交联水凝胶作为体外组织的主体材料,并在室温下对牺牲模块进行包裹,待交联水凝胶在一定条件下成型后,去除牺牲模块,获得宏观尺度血管网络体外组织,将获得的结构放置在37℃、5%co2的细胞培养箱中进行培养,在此过程中,温敏性智能水凝胶在外界温度升高的条件下收缩,实现血管网络由宏观尺度向微观尺度的转变,同时,交联水凝胶进一步交联,获得结构稳定的微尺度血管网络体外组织,从而完成基于温敏性智能水凝胶的微尺度血管网络体外组织精准制备。
实施例1:
在本实施例中,参见图1,水溶性模块的制备采用桌面级3d打印机进行水溶性模块的打印,体外组织材料为温敏性智能水凝胶和交联水凝胶的混合水凝胶,水溶去除宏观尺度血管网络,将体外组织从室温转移到37℃的细胞培养箱中培养后,温敏性智能水凝胶结构收缩,实现微尺度血管网络的制备,从而为微尺度血管网络体外组织的精准制备提供简便快捷、成本较低的方法。
在本实施例中,参见图1,一种基于温敏性智能水凝胶的微尺度血管网络体外组织精准制备方法,包括如下步骤:
a.采用商用聚乙烯醇(pva)丝材进行水溶性模块的打印,在打印结构较为简单的水溶性模块时,不需要借助支撑材料即可完成水溶性模块的打印;在打印结构较为复杂的水溶性模块时,需借助支撑材料方可完成水溶性模块的打印,在去除支撑材料后获得直径为600μm的水溶性模块即可用于宏观尺度血管网络体外组织的制备,此时,支撑材料为聚乳酸(pla),其去除采用三氯甲烷;
b.将打印的水溶性模块放置在细胞培养皿中,并进行相应固定,称取1g的温敏性智能水凝胶聚(n-异丙基丙烯酰胺)水凝胶和10g的交联水凝胶,其中包括9.1g的明胶和0.9g的谷氨酰胺转氨酶,放置在室温下2min固定成型后,将成型后的结构放置在水中,并借助注射器,快速冲洗水溶性模块,获得宏观尺度血管网络体外组织;
c.对获得的宏观尺度血管网络体外组织在采用磷酸盐缓冲液进行冲洗后,将其放置在新的细胞培养皿中,并转移到37℃的细胞培养箱中进行培养4h,温敏性智能水凝胶pnipam在外界温度升高后产生结构收缩现象,宏观尺度血管网络向微尺度血管网络转变,完成微尺度血管网络的精准制备;
d.交联水凝胶明胶和谷氨酰胺转氨酶在37℃的细胞培养箱中需进一步培养2h,使交联水凝胶完全交联成型,获得管内径为100μm的结构较为稳定的微尺度血管网络体外组织。
实施例2:
本实施例与实施例1基本相同,特别之处在于:
在本实施例中,一种基于温敏性智能水凝胶的微尺度血管网络体外组织精准制备方法,交联水凝胶采用甲基丙烯酸化水凝胶和光引发剂irgacure2959,包括如下步骤:
a.本步骤与实施例1相同;
b.将打印的水溶性模块放置在细胞培养皿中,并进行相应固定,倒入配制好的温敏性智能水凝胶聚(n-异丙基丙烯酰胺)水凝胶1g和10g交联水凝胶,交联水凝胶选自甲基丙烯酸化水凝胶和光引发剂irgacure2959,其中甲基丙烯酸化水凝胶和光引发剂irgacure2959的质量分别为9.1g和0.9g。放置在室温及紫外灯照射下10min固定成型后,将成型后的结构放置在水中,并借助注射器,快速冲洗水溶性模块,获得宏观尺度血管网络体外组织;
c.本步骤与实施例1相同;
d.交联水凝胶甲基丙烯酸化水凝胶在37℃的细胞培养箱中需进一步采用紫外灯照射培养10min,使交联水凝胶完全交联成型,获得管内径为150μm的结构较为稳定的微尺度血管网络体外组织。
实施例3:
本实施例与前述实施例基本相同,特别之处在于:
在本实施例中,一种基于温敏性智能水凝胶的微尺度血管网络体外组织精准制备方法,交联水凝胶采用纤维蛋白原和凝血酶,包括如下步骤:
a.本步骤与实施例1相同;
b.将打印的水溶性模块放置在细胞培养皿中,并进行相应固定,倒入配制好的温敏性智能水凝胶聚(n-异丙基丙烯酰胺)水凝胶1g和10g交联水凝胶,交联水凝胶选自纤维蛋白原和凝血酶,其中纤维蛋白原为9.52g,凝血酶为0.48g。放置在室温下5min固定成型后,将成型后的结构放置在水中,并借助注射器,快速冲洗水溶性模块,获得宏观尺度血管网络体外组织;
c.本步骤与实施例1相同;
d.交联水凝胶纤维蛋白原和凝血酶在37℃的细胞培养箱中需进一步培养2h,使交联水凝胶完全交联成型,获得管内径为200μm的结构较为稳定的微尺度血管网络体外组织。
实施例4:
本实施例与前述实施例基本相同,特别之处在于:
在本实施例中,一种基于温敏性智能水凝胶的微尺度血管网络体外组织精准制备方法,交联水凝胶采用胶原和京尼平,包括如下步骤:
a.本步骤与实施例1相同;
b.将打印的水溶性模块放置在细胞培养皿中,并进行相应固定,倒入配制好的温敏性智能水凝胶聚(n-异丙基丙烯酰胺)水凝胶1g和10g交联水凝胶,交联水凝胶选自胶原和京尼平,其中胶原为9.7g,京尼平为0.3g。放置在室温下10min固定成型后,将成型后的结构放置在水中,并借助注射器,快速冲洗水溶性模块,获得宏观尺度血管网络体外组织;
c.本步骤与实施例1相同;
d.交联水凝胶胶原和京尼平在37℃的细胞培养箱中需进一步培养2h,使交联水凝胶完全交联成型,获得管内径为300μm的结构较为稳定的微尺度血管网络体外组织。
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!