人工构建几丁质小体多酶复合体scaford-chiC-chiA-sg的方法及应用与流程
本发明属于生物技术领域,涉及一种酶制剂,一种人工构建几丁质小体多酶复合体scaford-chic-chia-sg的方法及应用。
背景技术:
据中国渔业协会统计,2018年全国小龙虾养殖总产量为141.5万吨,大闸蟹为80万吨,且仍呈现快速增长趋势。江苏省作为小龙虾和大闸蟹消费发源地之一,仅南京市每天至少就要消费45吨小龙虾。虾蟹加工中产生的头、壳等下脚料约占体重量的30%~40%。目前,虾蟹壳干粉的售价仅为每吨500-1000元,与农业木质纤维素生物质废料的价格相当。虾蟹壳的价值化可带来生态效益和经济效益。然而,至今还没有令人满意的解决方案。绝大多数虾蟹壳被直接丢弃或填埋,这不仅导致了资源浪费,更造成严重的环境问题。
虾蟹壳中含有诸多高附加值物质,如几丁质、蛋白质、脂质及虾青素等。其中,几丁质是由n-乙酰氨基葡萄糖聚合而成的多糖,在自然界中以α、β、γ三种构型存在,α-几丁质为其最主要的构型。几丁质在许多领域发挥着重要作用。比如,它可作为医疗材料如人造皮肤、分子筛、手术缝合线、抑菌织物、止血材料等;在食品行业可作为保鲜剂、防腐剂、保健剂;在化妆品行业可作为保湿剂、增粘剂……除此之外,几丁质也可以作为功能糖n-乙酰氨基葡萄糖(glcnac)的制备原料。
glcnac具有诸多生物活性,可以作为保健品添加剂,还可用于合成神经酰胺、乙醇胺及呋喃胺衍生物等重要的含氮化合物。因此,高效降解几丁质为单糖glcnac是其利用的关键。以几丁质为底物制备glcnac的传统方法为化学法,其产物的生物活性差并伴随着副产物的生成,同时涉及的强酸强碱的使用。因此随着环保压力的增加,寻找绿色高效的glcnac的制备方法迫在眉睫。
生物酶法降解几丁质制备glcnac具有过程绿色、专一性强、产品生物活性高的特点,被视为替代传统化学法的理想途径。自然界中许多野生型菌均能分泌几丁质降解酶系,可用于几丁质的降解。例如donzelli等利用菌株bacilluslicheniformissk-1几丁质酶系降解结晶型几丁质,6天产生78%的glcnac和10%的几丁二糖。(donzelliog,harmange.enhancedenzymatichydrolysisoflangostinoshellchitinwithmixturesofenzymesfrombacterialandfungalsources.carbohydrateresearch,2003,338(18):1823-1833)8];kudan等利用trichodermasp.g和bacillussp.w几丁质酶系降解200mg结晶型几丁质,8天产生36mgglcnac和28mg几丁二糖。(kudans,eksittikult,pichyangkurar,parkrd.preparationofn-acetyl-d-glucosamineandn,n'-diacetylchitobiosebyenzymatichydrolysisofchitinwithcrudechitinases.journalofbiotechnology,2010,150:89-89.)。这些研究表明大多数野生菌所产几丁质酶系在降解结晶型几丁质时,存在降解效率低和几丁二糖积累等问题。而专利文件ep2013355中,作者借助纤维小体的作用,形成降解纤维素的三元酶复合体,大大提高木质纤维素的糖化效率。
综合文献和专利报道可得出,在传统的游离多酶催化体系中,酶与酶之间的距离不固定,中间产物无法及时被下一步的酶所捕获,从而对其他酶产生抑制作用,这是多酶催化体系中的一个普遍性问题。在几丁质酶的体系中,同样存在着二糖积累负反馈抑制整体酶活的现象。因此,本领域需要一种,在不抑制各类酶的前提下,拉近酶与酶之间的空间距离,充分发挥物理空间上酶与酶之间的协同作用,解除中间产物几丁二糖的抑制的方法,以此来提高降解几丁质制备glcnac的速率。
技术实现要素:
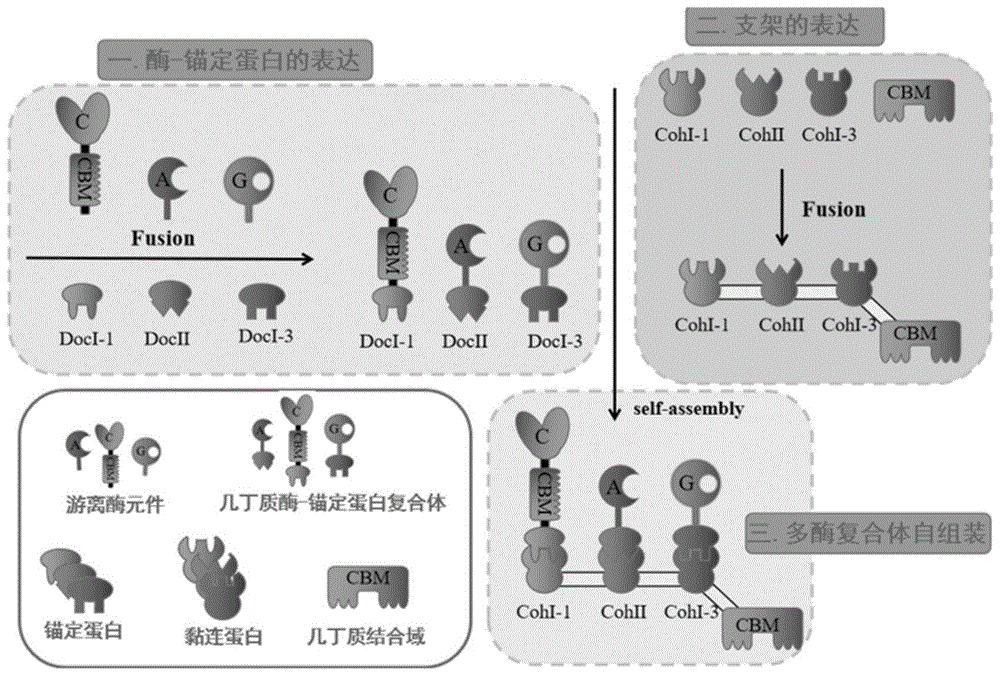
针对现有技术的不足,本发明提供一种人工构建几丁质小体多酶复合体scaford-chic-chia-sg的方法及应用。该方法在先前研究的几丁质酶系的基础上,模拟自然界中纤维素酶降解菌中的纤维小体多酶分子机器,利用纤维小体中的相互作用蛋白以构建蛋白支架,拉近几丁质酶与酶之间的空间距离,充分发挥酶与酶之间的协同作用,进而解除中间产物几丁二糖的抑制作用,大大提高几丁质酶系降解几丁质合成glcnac的效率。
为解决现有技术问题,本发明采取的技术方案为:
一种人工构建几丁质小体多酶复合体scaford-chic-chia-sg的方法,包括以下步骤:
步骤1,蛋白支架scaford-chbd的构建
将纤维小体中的三个不同的粘连蛋白cohesini-1,cohesinii,cohesini-3以及一个几丁质结合域chbd,融合表达构建蛋白支架scaford-chbd;
步骤2,几丁质酶-dockerins的构建
分别在几丁质降解中起关键作用的三种酶:几丁质内切酶chic、几丁质外切酶chia、n-乙酰氨基葡萄糖苷酶sg的c端融合锚定蛋白dockerin1、dockerin2、dockerin3,分别形成chic-doc1,chia-doc2,sg-doc3;
步骤3,几丁质小体scaford-chic-chia-sg的胞外自组装
将纯化得到的蛋白支架scaford-chbd和三种带dockerins的几丁质酶在体外自组装形成多酶复合体scaford-chic-chia-sg。
作为改进的是,步骤1中所述蛋白支架scaford-chbd中的粘连蛋白cohesini-1,cohesinii,cohesini-3分别来自于菌株clostridiumcellulovorans,clostridiumcellulolyticum,和clostridiumthermocellum,几丁质结合域基因chbd来自菌株chitinolyticbactermeiyuanensisybc-h1。
作为改进的是,步骤2中所述的锚定蛋白dockerin-i-1、dockerin-ii、dockerin-i-3,分别来自于菌株clostridiumcellulovorans,clostridiumcellulolyticum,和clostridiumthermocellum;几丁质酶chia与几丁质酶chic来自于菌株serratiamarcescens,几丁质酶sg来源于菌株chitinolyticbactermeiyuanensisybc-h1。
作为改进的是,步骤3中所述的几丁质小体scaford-chic-chia-sg胞外自组装的条件为,蛋白支架scaford-chbd:chic-doc1:chia-doc2:sg-doc3的蛋白摩尔比为1:1:1:1,于4℃,200rpm,ph7.0条件下孵育2h。
进一步改进的是,所添加的蛋白支架scaford-chbd、chic-doc1、chia-doc2、sg-doc3的蛋白浓度均为0.2μm或0.4μm。
作为改进的是,所述几丁质为粉粒几丁质或胶体几丁质或高压均质处理过的几丁质中的一种或多种。
上述多酶复合体scaford-chic-chia-sg在降解几丁质制备n-乙酰氨基葡萄糖上的应用。
作为改进的是,将几丁质小体与游离几丁质酶加入50ml离心管中至终浓度为0.2μm,用ph为7.0tbs补充至20ml的反应体系,其中几丁质的浓度为10g/l;反应体系于37℃,200rpm条件下进行;每隔0.5h、1h、2h、4h、8h、12h、20h取出20μl转化液,稀释后利用高效液相色谱测量其中glcnac浓度。
进一步改进的是,步骤4中所述的底物几丁质的浓度为10-30g/l。
有益效果:
现有技术中大多采用单酶降解或野生菌产酶降解降解几丁质。与现有技术相比,本发明一种人工构建几丁质小体多酶复合体scaford-chic-chia-sg的方法及其应用,人工构建“几丁小体”降解几丁质,具有绿色环保、降解效率高、单糖产率高、可重复利用等优势,简化下游分离工艺,降低了生产成本,对酶法降解几丁质制备glcnac具有一定的推动作用。具有如下优势:
(1)本发明构建所得的“几丁质小体”,固定了几丁质酶之间的空间距离,充分发挥酶与酶之间的邻近、协同效应,实现了几丁质的高效降解。
(2)本发明构建所得的“几丁小体”,能在一批几丁质完全降解结束后加入第二批几丁质继续进行反应,通过几丁质与“几丁小体”上chbd的亲和吸附,离心收集吸附有多酶复合体的几丁质,加入适量缓冲后可进行重复降解实验;上清则收集用作glcnac的后续纯化工作,实现“降解——吸附——再降解”的耦合过程。
附图说明
图1为本发明多酶组装路线图;
图2为支架蛋白及各几丁质酶sds-page;
图3为几丁质小体水解几丁质的产物液相分析,a为几丁质酶解液;b为混合糖标品;1-glcnac;2-几丁二糖;3-几丁三糖;
图4为几丁质小体降解几丁质进程曲线。
具体实施方案
实施例1
下面的实施例可使本专业技术人员更全面地理解本发明,但不以任何方式限制本发明。
实施例1蛋白支架scaford-chbd的构建
粘连蛋白cohesini-1,cohesinii,cohesini-3分别来源于菌株clostridiumcellulovorans(atcc35296t),clostridiumcellulolyticum,(atcc35319t)和clostridiumthermocellum(atcc27405t)的基因组。几丁质结合域基因chbd来自实验室保藏菌株chitinolyticbactermeiyuanensissybc-h1(atccbaa-2140t)的基因组。基因cohesini-1,cohesinii,cohesini-3由通用生物系统(安徽)有限公司全基因合成获取。
蛋白支架scaford-chbd的质粒构建采取一步克隆的方法,在基因cohesini-1,cohesinii,cohesini-3和chbd的上下引物中设计同源臂,与线性化载体petduet在同源重组酶(vazymece113)的作用下构建质粒。具体实施步骤如下:1.以含有cohesini-1基因的质粒为模板,用引物f-cohesini-1与r-cohesini-1扩增得到两端带有同源臂的cohesini-1基因片段,利用dna纯化试剂盒(tiangen)纯化cohesini-1基因片段备用;以同样的方法分别用引物f-cohesinii/r-cohesinii与引物f-cohesini-3/r-cohesini-3扩增得到cohesinii与cohesini-3的基因片段,纯化后备用。以chitinolyticbactermeiyuanensisybc-h1的总dna为模板,用引物f-chbd与r-chbd进行pcr扩增得到目的基因chbd,纯化后备用。2.用限制性内切酶bamhi/xhoi双酶切petduet空载,胶回收试剂盒(tiangen)回收目的基因后备用。3.将纯化后得到的cohesini-1、cohesinii、cohesini-3、chbd基因片段及线性化的petduet空载,按照同源重组酶(vazymece113)的说明书比例添加至重组体系中,37℃金属浴30min后得到petduet-cohesini-1-cohesinii-cohesini-3-chbd。经过转化测序得到阳性转座子后,导入大肠杆菌bl21(de3)中,完成蛋白支架scaford-chbd的构建。
实施例2几丁质酶-dockerins的构建
锚定蛋白dockerin-i-1,dockerin-ii,dockerin-i-3分别来源于菌株clostridiumcellulovorans(atcc35296t),clostridiumcellulolyticum,(atcc35319t)和clostridiumthermocellum(atcc27405t)。基因dockerin-i-1,dockerin-ii,dockerin-i-3由通用生物系统(安徽)有限公司全基因合成获取。几丁质内切酶chic,几丁质外切酶chia来源于实验室保藏菌株serratiamarcescens(atcc13880t),n-乙酰氨基葡萄糖苷酶sg来自实验室保藏菌株chitinolyticbactermeiyuanensissybc-h1(atccbaa-2140t)的基因组。
chic-doc1的质粒构建采取一步克隆的方法,在基因chic与dockerin-i-1的上下引物中设计加入同源臂,与线性化载体pet22b在同源重组酶(vazymece113)的作用下构建质粒pet22b-chic-doc1。具体实施步骤如下:1.以含有基因dockerin-i-1的空质粒为模板,利用引物f-dockerini-1/r-dockerini-1对其pcr扩增得到两端带有同源臂的目的基因dockerin-i-1,利用dna纯化试剂盒(tiangen)纯化cohesini-1基因片段备用;以serratiamarcescens的基因组为模板,利用引物f-chic/r-chic扩增得到目的基因chic,纯化后备用。2.以ecori/xhoi双酶切pet22b空质粒,胶回收后备用。3.将纯化后的目的基因cohesini-1、chic以及线性化载体pet22b按照同源重组酶(vazymece113)的说明书比例添加至重组体系中,37℃金属浴30min后得到重组质粒pet22b-chic-doc1。经过转化测序得到阳性转座子后,导入大肠杆菌bl21(de3)中,完成几丁质酶内切酶元件pet22b-chic-doc1的构建。以同样的方法完成几丁质外切酶元件pet28a-chia-doc2和n-乙酰氨基葡萄糖苷酶元件pet28a-sg-doc3的构建。
表1为实施例1与实施例2中构建所用引物
实施例3几丁质小体中各酶元件的sds-page分析
制备构建得到的蛋白支架scaford-chbd、外切酶chic-doc1、内切酶chia-doc2、n-乙酰氨基葡萄糖苷酶sg-doc3以及未接dockerins的几丁质酶(chic、chia、sg)的种子液,培养基为lb培养基,在37℃、200rpm下培养6-7h,将种子液以体积分数2%接种于装有100mllb的发酵培养基中,在37℃、200rpm下培养至od为0.6,以1‰的添加量添加诱导剂iptg,在18℃、200rpm下诱导20h后结束发酵收集发酵液。对发酵液进行8000g离心后收集菌体,用蒸馏水洗涤两次后,重悬于25mltbs(50mmph7.0)中,超声破碎后进行8000g离心,收集上清即为各酶元件的粗酶液,4℃贮存备用。因各酶元件上带有his标签,利用镍柱在akta蛋白纯化仪器上纯化各酶元件得到蛋白支架scaford-chbd、外切酶chic-doc1、内切酶chia-doc2、n-乙酰氨基葡萄糖苷酶sg-doc3及未接dockerins的几丁质酶(chic、chia、sg)的纯酶。分别取各纯酶15μl,用4xproteinsdsloadingbuffer(takara)完成热变性后,进行sds-page凝胶电泳分析,具体分析结果如图2所示。
实施例4几丁质小体scaford-chic-chia-sg的胞外自组装
用考马斯亮蓝法测出各个酶元件的蛋白浓度后,将蛋白支架:chic-doc1:chia-doc2:sg-doc3的蛋白摩尔比为1:1:1:1的量加入至50mmtbs(ph7.0)缓冲溶液中至各酶元件终浓度为0.2μm,于4℃、200rpm条件下孵育2h完成几丁小体scaford-chic-chia-sg的胞外自组装。
实施例5几丁质小体scaford-chic-chia-sg的组装验证
利用装配有ge凝胶排阻层析柱的akta蛋白纯化仪对几丁质小体scaford-chic-chia-sg进行组装验证。分别上样未组装的游离蛋白(蛋白支架scaford-chbd、外切酶chic-doc1、内切酶chia-doc2、n-乙酰氨基葡萄糖苷酶sg-doc3)和组装后的几丁质小体,由于几丁质小体分子量远大于单个有利蛋白的分子量,能相较对照组游离蛋白的出峰后期,多出一个较大的组装体出峰,则可验证几丁质小体在体外完成了自组装,形成相对紧密的多酶分子机器。
实施例6多酶复合体降解几丁质制备n-乙酰氨基葡萄糖
几丁质降解体系在50ml离心管中进行,分别将实施例4中所得几丁质小体与游离几丁质酶加入50ml离心管中至终浓度为0.2μm,用tbs(ph7.0)补充至20ml的反应体系,其中几丁质的浓度为10g/l。反应体系于37℃,200rpm条件下进行。每隔0.5h、1h、2h、4h、8h、12h、20h取出20μl转化液,稀释后利用高效液相色谱测量其中glcnac浓度。
glcnac的检测条件为液相分析在agilent1290infinityuhplc上进行,色谱柱为alltimahphilic柱(4.6×250mm),流动相为体积分数85%乙腈;流速为0.8ml/min,紫外检测器检测波长210nm,进样量10μl,柱温40℃。
检测结果如图3-4所示,从图3中可以看出几丁质小体降解几丁质产物为单一的单糖,产物转化率达93%。图4清晰地反映组装后的几丁质小体与游离几丁质酶相比降解活性得到明显的提升,在20h的降解过程中分别得到1.39g/l与3.05g/l产物,产量提升了1.19倍,这充分体现了人工几丁质小体的邻近效应及底物通道效应。
序列表
<110>南京工业大学
<120>人工构建几丁质小体多酶复合体scaford-chic-chia-sg的方法及应用
<160>20
<170>siposequencelisting1.0
<210>1
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>1
cacagccaggatccgccggtggaagccgttacc33
<210>2
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>2
cgagctcgaattcggaataatggtcacggtacc33
<210>3
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>3
ccgaattcgagctcgatggaagcaaccccgagt33
<210>4
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>4
tgcggccgcaagcttggccgcatctttcagcgg33
<210>5
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>5
aagcttgcggccgcagaactgggcgtggtggtg33
<210>6
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>6
gagatctgccatatgacccacattcacaccacc33
<210>7
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>7
catatggcagatctcatgtacccggtatggcag33
<210>8
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>8
tttaccagactcgaggtggtgatgatggtgatggccgactacgcgccatac51
<210>9
<211>49
<212>dna
<213>人工序列(artificialsequence)
<400>9
cagccggcgatggccatggatatgagcacaaataacattattaatgccg49
<210>10
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>10
gtggtggtggtggtgctcgagggcgatgagctgccacagg40
<210>11
<211>36
<212>dna
<213>人工序列(artificialsequence)
<400>11
tggcagctcatcgcccgtgttgatctgaaaggcgat36
<210>12
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>12
gtggtggtgctcgagtgccagcagtgctttttt33
<210>13
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>13
tgccgcgcggcagccatgcgcaaatttaataaaccgctg39
<210>14
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>14
cggtttattctgcagttgaacgccggcgctgtt33
<210>15
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>15
agcgccggcgttcaactgcagaataaaccggtg33
<210>16
<211>36
<212>dna
<213>人工序列(artificialsequence)
<400>16
gagtgcggccgcaagcttctgtgcatcataatcgct36
<210>17
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>17
gtgccgcgcggcagccatatgagccgtcccgccggatcg39
<210>18
<211>37
<212>dna
<213>人工序列(artificialsequence)
<400>18
ccgggaagtccacacgggcgcccacctgcaccgcgcg37
<210>19
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>19
gtgcaggtgggcgcccgtgtggacttcccggat33
<210>20
<211>43
<212>dna
<213>人工序列(artificialsequence)
<400>20
gtggtggtggtggtggtgctcgagtatttttatacggcagggt43
- 还没有人留言评论。精彩留言会获得点赞!