利用非变性胶从少量复杂蛋白样本中初步分离未知蛋白酶的方法与流程
本发明属于蛋白的提取及分离纯化,特别是指一种利用非变性胶从少量复杂蛋白样本中初步分离未知蛋白酶的方法。
背景技术:
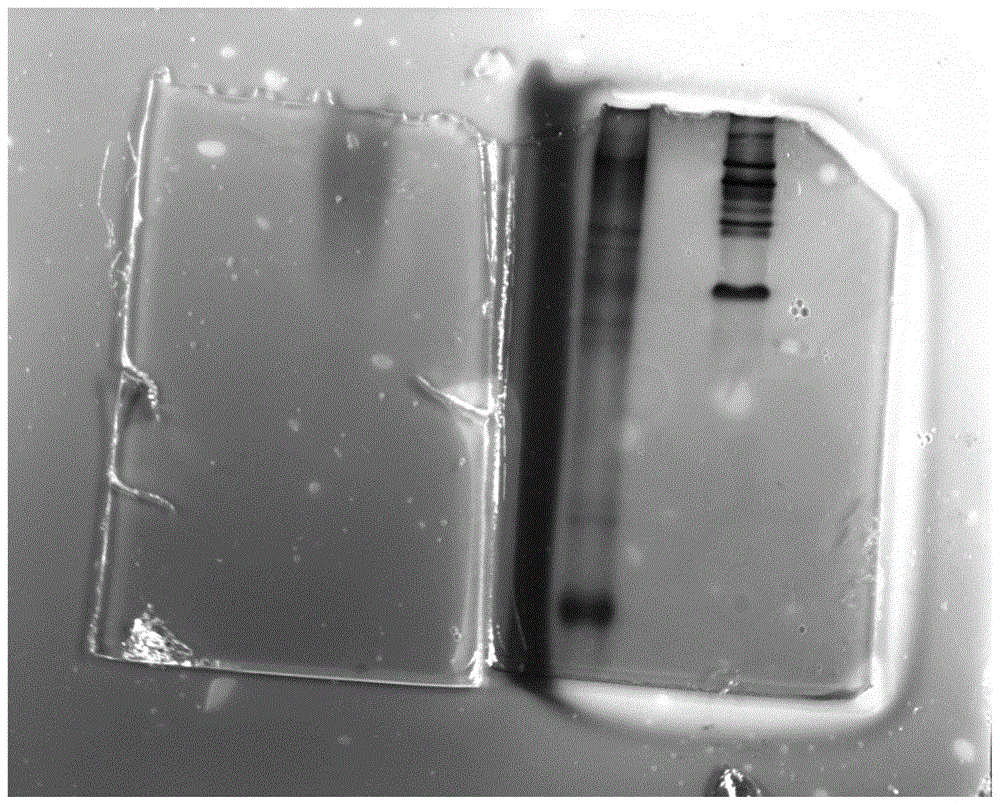
:蛋白的提取及分离纯化是蛋白质工程的主要内容之一,是研究蛋白的结构与功能的重要环节。蛋白的提取与纯化是指将蛋白从细胞或其他含蛋白的原料中提取出来,再与杂质分开而获得符合研究要求的蛋白制品的过程。主要内容包括细胞破碎,蛋白的提取,分离纯化(离心分离、过滤与膜分离、沉淀分离、层析分离、电泳分离、萃取分离)浓缩及干燥等。蛋白质和多肽产物的提取和分离纯化基本原则是从复杂的多组分物质中将目标组分分离,尽可能多的获得具有生物学活性的蛋白和多肽产物,并增加目标产物的纯度和比活性。蒋世强在《重组蛋白纯化研究进展》总结了根据目标蛋白的物理或化学性质的不同,可以有针对性地采取如下表中的分离纯化方法。表1依据蛋白特性采用的分离纯化方法蛋白质特性分离纯化方法电荷离子交换层析分子大小凝胶过滤层析、超滤离心疏水性疏水层析、反相色谱亲和性亲和层析、金属螯合亲和层析溶解度盐沉淀、有机物沉淀、双液相萃等电点等电点沉淀比如,梁欣在《复杂蛋白质样品中目标组分柱层析分离纯化策略研究》中用柱层析的方法为复杂蛋白质混合样品中目标蛋白的分离纯化提供试验方案。赵玉娟在《凝胶色谱法测定乳清中主要蛋白的相对分子量及其分布》中用凝胶色谱实验对球蛋白进行分离纯化及定量。叶子坚在《电泳法测定基因工程蛋白分子量和纯度及方法比较》用sds-page技术用于基因工程蛋白纯度及分子量的试验。陈璐在《tricine-sds-page分析极低分子量蛋白的条件优化》对3-20kda的低分子量蛋白质进行了很好的分离。蛋白质的提取纯化过程要有特定的条件,王启迪在《蛋白质纯化制备工艺研究》中提到,蛋白质的分子量往往达到10kda以上,结构复杂且在分离纯化的过程中还需要保持其生物学活性。所以需要根据不同蛋白质之间的物理化学性质及生物学特性(如根据蛋白质的形状、大小、疏水性、等电点、生物学活性等)将其分离纯化。同时吴少辉在《蛋白质分离纯化方法研究进展》中提出只有了解蛋白质的分子量、溶解性、等电点以及稳定性等基本性质,才能达到有效分离。而对于从混合蛋白中分离的未知目的蛋白尤其是从自然界获取的小量蛋白样本,其无法通过前期批次试验摸索未知目的蛋白的各种性质。上述分离纯化蛋白的方法便存在一定的局限性。酶是由活细胞产生的蛋白质性质的生物催化剂,酶的应用范围遍及化工、医药、轻工、食品、能源及环境保护等领域,是现代生物技术中相对成熟而又发展潜力巨大的核心产业。随着全球范围日益突出的资源环境压力和绿色合成产业的需求,新酶的挖掘和开发显得尤为重要和迫切。微生物细胞以及动植物组织是工业生物催化剂的重要来源。越来越多的研究表明肠道内的营养的消化吸收是依靠各类消化酶来完成的,huang在《thescarabgut:apotentialbioreactorforbio-fuelproduction》提出昆虫的肠道提供了一个巨大的酶资源的宝库。从肠道内挖掘酶资源用于生物催化剂产业的潜力巨大。李庆臻在1999年由科学出版社出版的《科学技术方法大辞典》指出重金属易使酶失效,有机溶剂能使酶变性,微生物污染以及蛋白水解酶的存在能使酶分解破坏等。可见酶蛋白的分离纯化过程首要考虑的是工艺对酶分子活性的影响,在保证酶活性的前提下选取适宜的分离纯化手段。非变性蛋白电泳是对保持活性的蛋白质进行聚丙烯酰胺凝胶电泳,常用于同工酶的鉴定和提纯。本发明针对含有蛋白酶活性的小量的、复杂的混合蛋白样本,利用非变性蛋白胶和脱脂牛奶培养基组合的方法将蛋白酶组分从混合蛋白样本中鉴别并初步分离出来。本发明中的蛋白酶是具有蛋白酶活性的已知或未知蛋白,可以是从动物、植物或微生物中来源的各类蛋白酶。技术实现要素:本发明的目的在于提供利用非变性胶从少量复杂蛋白样本中初步分离未知蛋白酶的方法,非变性蛋白胶和脱脂牛奶培养基组合的方法将蛋白酶组分从混合蛋白样本中鉴别并初步分离出来。本发明的整体技术构思是:利用非变性胶从少量复杂蛋白样本中初步分离未知蛋白酶的方法,包括如下工艺步骤:a、取体积质量份为2~5份的复杂蛋白样本和1倍的非变性蛋白胶上样缓冲液混匀;b、分别上样到体积百分比浓度为8%~12%的非变性蛋白胶两侧,同时在其中一侧的样本旁点样5~10μl的非变性蛋白标记;c、在0℃~4℃的温度、120v~150v的电压下电泳50-120分钟;d、将步骤c中电泳完毕的蛋白胶从中间切开,一半置于考马斯亮蓝染液中染色1~4小时,另一半置于厚度为0.2mm~0.5mm的脱脂牛奶培养基内,于30℃~37℃的条件静置1~4小时。本发明所取得的实质性特点和显著的技术进步在于:1、本发明建立了一种简单、便捷的从少量复杂蛋白样本中初步分离蛋白酶的方法。2、采用本发明中的方法不必获得蛋白酶的相关信息即可初步分离未知蛋白酶,仅需混合体系中含有蛋白酶活性即可快速鉴别蛋白酶,将其切胶回收初步分离后用于后续研究,对于发现未知蛋白酶具有重要意义。附图说明图1是含有混合蛋白的非变性胶置于脱脂牛奶培养基示意图。由图1可见,右半部分蛋白胶经染色后可以观察到混合蛋白的电泳条带,左半部分蛋白胶在点样孔上半部分有水解牛奶培养基变成透明的现象,同时右侧蛋白胶经过染色后蛋白变性在牛奶培养基未有水解的情况发生。而用脱脂牛奶筛选鉴别蛋白酶活性是较为通用的技术手段。图1中点样后的蛋白胶的泳道中含有蛋白酶活性,所以在蛋白酶条带的地方出现的水解牛奶培养基变成透明的现象,而其他不是蛋白酶的蛋白条带则不能水解牛奶培养基。因此,从图1中可以断定在蛋白胶的下方牛奶培养基上出现透明水解现象的位置即为蛋白酶的电泳条带。可以对照染色胶图将相应的蛋白条带位置切下,用于后续蛋白酶的研究。具体实施方式以下结合实施例对本发明作进一步描述,但不作为对本发明的限定。本发明的保护范围以权利要求记载的内容为准,任何依据说明书作出的等效技术手段替换,均不脱离本发明的保护范畴。实施例1a、取体积质量份为5份的复杂蛋白样本和1倍的非变性蛋白胶上样缓冲液混匀;b、分别上样到体积百分比浓度为12%的非变性蛋白胶两侧,同时在其中一侧的样本旁点样10μl的非变性蛋白标记;c、在4℃的温度、150v的电压下电泳50-120分钟;d、将步骤c中电泳完毕的蛋白胶从中间切开,一半置于考马斯亮蓝染液中染色4小时,另一半置于厚度为0.5mm的脱脂牛奶培养基内,于37℃的条件静置4小时。实施例2本实施例与实施例1的区别在于:a、取体积质量份为2份的复杂蛋白样本和1倍的非变性蛋白胶上样缓冲液混匀;b、分别上样到体积百分比浓度为8%的非变性蛋白胶两侧,同时在其中一侧的样本旁点样5μl的非变性蛋白标记;c、在0℃的温度下、120v的电压下,电泳50分钟;d、将步骤c中电泳完毕的蛋白胶从中间切开,一半置于考马斯亮蓝染液中染色1小时,另一半置于厚度为0.2mm的脱脂牛奶培养基内,于30℃的条件静置1小时。其余内容与实施例1相同。实施例3本实施例与实施例1的区别在于:a、取体积质量份为3份的复杂蛋白样本和1倍的非变性蛋白胶上样缓冲液混匀;b、分别上样到体积百分比浓度为10%的非变性蛋白胶两侧,同时在其中一侧的样本旁点样8μl的非变性蛋白标记;c、在2℃的温度、135v的电压下电泳85分钟;d、将步骤c中电泳完毕的蛋白胶从中间切开,一半置于考马斯亮蓝染液中染色2.5小时,另一半置于厚度为0.35mm的脱脂牛奶培养基内,于33℃的条件静置2.5小时。其余内容与实施例1相同。实施例4本实施例与实施例1的区别在于:a、取体积质量份为3份的复杂蛋白样本和1倍的非变性蛋白胶上样缓冲液混匀;b、分别上样到体积百分比浓度为8%-12%的非变性蛋白胶两侧,同时在其中一侧的样本旁点样6μl的非变性蛋白标记;c、在1℃的温度、130v的电压下电泳60分钟;d、将步骤c中电泳完毕的蛋白胶从中间切开,一半置于考马斯亮蓝染液中染色1.5小时,另一半置于厚度为0.3mm的脱脂牛奶培养基内,于32℃的条件静置1.5小时。其余内容与实施例1相同。实施例5本实施例与实施例1的区别在于:a、取体积质量份为4份的复杂蛋白样本和1倍的非变性蛋白胶上样缓冲液混匀;b、分别上样到体积百分比浓度为11%的非变性蛋白胶两侧,同时在其中一侧的样本旁点样9μl的非变性蛋白标记;c、在3℃的温度、140v的电压下电泳110分钟;d、将步骤c中电泳完毕的蛋白胶从中间切开,一半置于考马斯亮蓝染液中染色3小时,另一半置于厚度为0.4mm的脱脂牛奶培养基内,于36℃的条件静置3小时。其余内容与实施例1相同。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1