一种单层自组装多肽溶液培养细胞的方法
本发明涉及细胞培养领域,具体涉及一种单层自组装多肽溶液培养细胞的方法。
背景技术:
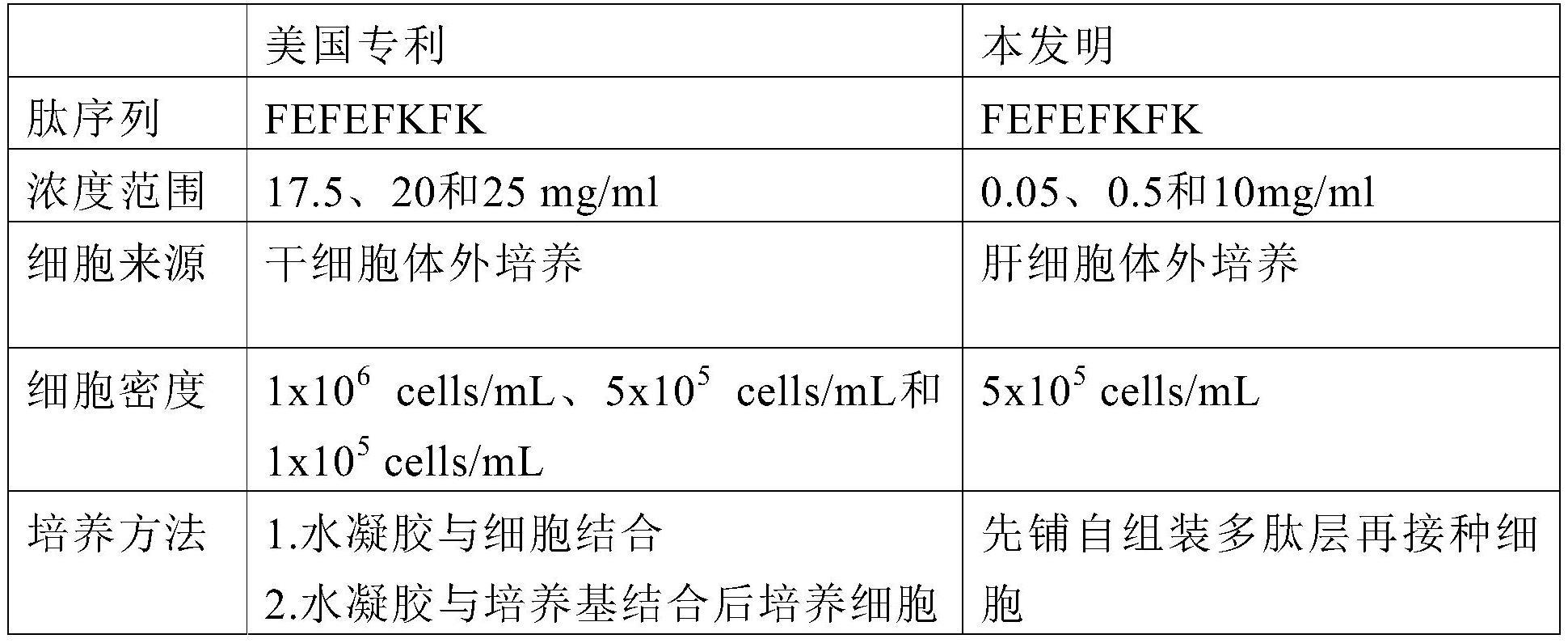
1、细胞被广泛应用于评价药物研发中的药物分布、代谢、药物相互作用以及药物诱导的生物毒性等。然而,在早期体外培养过程中,部分种类细胞容易出现形态扩散,功能丢失,难以重现在体的实际生理功能等。后来研究表明,可以通过三明治夹层培养(如以胶原蛋白collagen作下胶,matrigel基质胶作为上层胶)技术改善细胞功能。基于细胞外基质的三明治夹心培养(sc)是一种培养细胞的体外模型,具有重新建立和稳定细胞的功能。可用于细胞生理研究、药物代谢以及生物毒性测试。
2、然而,基于细胞外基质的材料成分具有复杂性、不确定性、可变性以及缺乏可重复性等特点,使matrigel和collagen在细胞生物学、细胞治疗和药物研发等方面的适用性受到限制。而且matrigel和collagen不利于物理或生化处理,因此难以有效控制这类基质以促进预期的细胞行为并实现特定的生物学结果。此外,不可控制的细胞外基质双涂层以及由凝胶化的matrigel顶部基质胶引起的传质障碍也是限制应用的一个因素。
3、因此,对于找到基于细胞外基质的三明治夹心培养的替代品研究有很大的实际需求。
技术实现思路
1、本发明的目的在于提供一种通过单层自组装多肽溶液替代三明治夹层培养细胞的方法。
2、针对基于细胞外基质sc的不足,本发明提供一种fek-sol培养细胞的新方法。该fek-sol在生理条件下可自发地自组装成反平行β-折叠,形成了纳米纤维结构,当浓度达到一定程度以上时进一步形成纤维结构,紧密交联模拟了三维的细胞外基质环境,可以有效维持细胞活性和功能。
3、在本发明的第一方面,提供了一种体外培养细胞的方法,包括步骤:
4、(a)提供一细胞培养体系,所述细胞培养体系包括:固相载体、铺于所述固相载体表面上的自组装多肽层,和第一培养基;其中,所述的自组装多肽层包含纤维网格结构,并且所述纤维网格结构由结构单元通过自组装形成,所述结构单元为fefefkfk的多肽;
5、(b)将待培养的细胞接种于(a)中所述的自组装多肽层;
6、(c)加入第二培养基,并培养(b)中所述的接种于自组装多肽层的细胞,获得自组装多肽-细胞复合物,其中,在所述复合物中,经培养的细胞被自组装多肽层的纤维网格结构所包裹或包埋。
7、在另一优选例中,所述的固相载体表面为培养介质表面或培养容器表面。
8、在另一优选例中,所述的固相载体包括培养皿、培养板、或培养板的培养孔。
9、在另一优选例中,所述的自组装多肽层负载于培养介质表面,优选为24孔板、96孔板或培养皿。
10、在另一优选例中,所述的第一培养基为液态培养基,并覆盖所述的自组装多肽层。
11、在另一优选例中,所述的第二培养基为液态培养基。
12、在另一优选例中,所述的第二培养基与第一培养基是相同的或不同的。
13、在另一优选例中,步骤(b)中,所述细胞的接种密度为1×104个/ml-9×106个/ml;较佳地,1×105个/ml-9×105个/ml。
14、在另一优选例中,步骤(c)中,所述第二培养基为william e培养基或dmem/f12培养基。
15、在另一优选例中,所述william e培养基还包含3-5%(v/v)fbs,0.5-2%(v/v)l-谷氨酰胺,0.5-2%(v/v)青链霉素,0.05-0.1%(v/v)胰岛素转铁蛋白硒培养添加物和0.005-0.05%(v/v)地塞米松。
16、在另一优选例中,步骤(c)中,还包括:
17、(c1)培养4-5时后,更换培养基,除去未粘附自组装多肽层的细胞;
18、(c2)培养20-48时后,使用第三培养基替换(c1)中的培养基;所述第三培养基为不含fbs的第二培养基。
19、在另一优选例中,步骤(c2)中,优选培养24时。
20、在另一优选例中,所述细胞来自肝脏、心肌或神经。
21、在另一优选例中,所述细胞选自肝细胞、成纤维细胞、神经细胞、成骨细胞或软骨细胞。
22、在另一优选例中,所述方法还包括:
23、(d)分离所述的经培养的细胞。
24、在另一优选例中,所述的分离包括分离所述的复合物,或进一步将经培养的细胞与纤维网格结构进行分开。
25、在另一优选例中,所述方法为非三明治培养细胞的方法。
26、在本发明的第二方面,提供了一种自组装的体外细胞培养体系,所述的培养体系包含:
27、(1)自组装多肽层,其包含纤维网格结构,所述纤维网格结构由结构单元通过自组装形成;其中所述结构单元为fefefkfk的多肽,所述多肽的浓度为0.001%wt-5.0%wt;
28、(2)第一培养基;
29、其中,所述培养体系中的ph为6.8-8.2,较佳地ph<8.0。
30、在另一优选例中,所述的自组装多肽层是将fefefkfk多肽溶液铺于培养板并经平衡处理而形成的。
31、在另一优选例中,所述的平衡处理是在ph6.9-7.5,较佳地ph7.0-7.4,更佳地ph7.2条件下进行。
32、在另一优选例中,所述的平衡处理是用第一培养基进行处理。
33、在另一优选例中,所述的平衡处理的时间t1为0.5-1小时。
34、在另一优选例中,所述的平衡处理在30-38゜c下进行,较佳地37゜c下进行。
35、在另一优选例中,所述多肽的浓度为0.002%wt-2.5%wt,较佳地0.05%wt-1.5%wt,更佳地0.1%wt-1.3%wt,最佳地0.5%wt-1.5%wt。
36、在另一优选例中,所述纤维网格结构为细胞生长提供三维环境。
37、在另一优选例中,所述纤维网格结构包含β-折叠的二级结构。
38、在另一优选例中,所述培养体系还含有被培养的细胞。
39、在另一优选例中,所述的细胞为非干细胞型的细胞。
40、在另一优选例中,所述的细胞未经干细胞富集处理并且不是干细胞。
41、在本发明中,所述的被培养的细胞指未经干细胞富集处理的体细胞。应理解,本发明的所述的被培养的细胞可含有天然存在的极微量(如≤1%,≤0.1%,≤0.01%,≤0.001%)的干细胞,即可含有天然存在的丰度的干细胞。
42、在另一优选例中,所述细胞包括哺乳动物细胞或非哺乳动物细胞。
43、在另一优选例中,所述哺乳动物包括人、小鼠或食蟹猴,优选为人。
44、在另一优选例中,所述细胞来自肝脏、心肌或神经。
45、在另一优选例中,所述细胞选自肝细胞、成纤维细胞、神经细胞、成骨细胞或软骨细胞。
46、在另一优选例中,所述细胞为肝细胞,较佳地为原代肝细胞。
47、在另一优选例中,所述细胞不包括干细胞。
48、在另一优选例中,所述第一培养基包括:dmem高糖培养基。
49、在另一优选例中,所述fefefkfk多肽通过dmem高糖培养基调节ph至生理条件形成自组装多肽网格结构。
50、在本发明的第三方面,提供了一种通过如本发明第一方面所述的方法培养获得的细胞,其特征在于,所述细胞具有选自下组的一种或多种特点:
51、(1)对药物的敏感性提高;
52、(2)代谢酶功能提高。
53、在另一优选例中,所述细胞来自肝脏、心肌或神经。
54、在另一优选例中,所述细胞选自肝细胞、成纤维细胞、神经细胞、成骨细胞、软骨细胞。在另一优选例中,所述细胞为肝脏细胞。
55、在另一优选例中,所述肝细胞为原代肝细胞。
56、在另一优选例中,所述代谢酶为cyp酶。
57、在另一优选例中,所述肝细胞具有选自下组的一种或多种特点:
58、(1)对药物的敏感性提高;
59、(2)代谢酶功能提高;
60、(3)核受体基因表达显著上调;所述核受体基因选自cyp3a4、cyp1a2、cyp2b6、fxr、car或pxr;
61、(4)mrp2极化表达和胆小管形成量提高;
62、(5)白蛋白和尿素分泌功能提高。
63、在另一优选例中,所述药物选自下组:瑞舒伐他汀(rifampin)、酮康唑(ketoconazole)、格列本脲(glibenclamide)、曲格列酮(troglitazone)、奥美拉唑(omeprazole)。
64、在本发明的第四方面,提供了一种体外提高细胞对药物的敏感性的方法,将所述细胞通过如本发明第一方面所述的方法培养。
65、在另一优选例中,所述的细胞为非干细胞型的细胞。
66、在另一优选例中,所述的细胞未经干细胞富集处理并且不是干细胞。
67、在另一优选例中,所述细胞来自肝脏、心肌或神经。
68、在另一优选例中,所述细胞为肝细胞。
69、应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
- 还没有人留言评论。精彩留言会获得点赞!