上皮钙黏素特异性抗体的制作方法
是t或i;
9.或包含通过1、2或3个保守取代而不同于所述ikskidg x1t x2序列的氨基酸序列的重链可变区cdr2;
10.c.包含氨基酸序列tpgvgx1nx2pyyfdr的重链可变区cdr3,其中x1是a或t,并且其中x2是d或n;
11.或包含通过1、2或3个保守取代而不同于所述tpgvgx1nx2pyyfdr序列的氨基酸序列的重链可变区cdr3;
12.d.包含氨基酸序列qsvlcrsnnknc的轻链可变区cdr1;
13.或包含通过1、2或3个保守取代而不同于所述qsvlcrsnnknc序列的氨基酸序列的轻链可变区cdr1;
14.e.包含氨基酸序列wax1的轻链可变区cdr2,其中x1是s或c;
15.或包含通过1、2或3个保守取代而不同于所述wax1序列的氨基酸序列的轻链可变区cdr2;
16.f.包含氨基酸序列qqysntpqt的轻链可变区cdr3;
17.或包含通过1、2或3个保守取代而不同于所述qqysntpqt序列的氨基酸序列的轻链可变区cdr3。
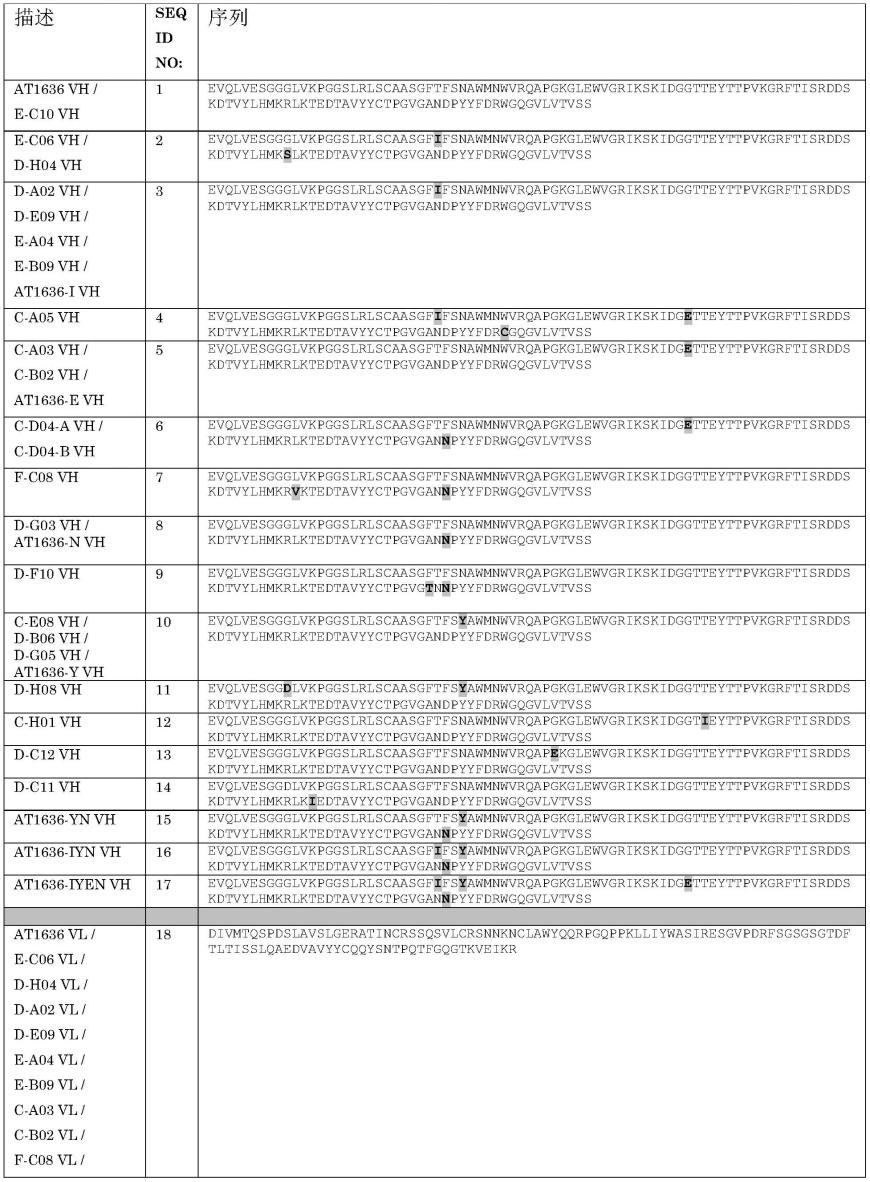
18.在某些实施方案中,所述抗体或抗原结合片段包含重链可变区,所述重链可变区包含与选自由seq id no:1-17组成的组的vh序列具有至少80%序列同一性的序列;和/或轻链可变区,所述轻链可变区包含与选自由seq id no:18-22组成的组的vl序列具有至少80%序列同一性的序列,如表1中描绘。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。
19.在各种实施方案中,根据本发明的抗体或抗原结合片段是全长抗体。
20.在各种实施方案中,根据本发明的抗体或抗原结合片段是人抗体或其抗原结合片段。
21.在各种实施方案中,根据本发明的抗体或抗原结合片段是iga同种型。在各种实施方案中,根据本发明的抗体或抗原结合片段是igm同种型。在各种实施方案中,根据本发明的抗体或抗原结合片段是igd同种型。在某些实施方案中,所述抗体或抗原结合片段是人iga、igm或igd。
22.在各种实施方案中,根据本发明的抗体或抗原结合片段是igg同种型。在某些实施方案中,所述抗体或抗原结合片段是igg1、igg2、igg3或igg4,优选地igg1。在某些实施方案中,所述抗体或抗原结合片段是人igg1、igg2、igg3或igg4,优选地人igg1。
23.在各种实施方案中,根据本发明的抗体或抗原结合片段是非岩藻糖基化的(afucosylated)。
24.某些实施方案提供了一种抗体或其抗原结合片段,其与选自由以下组成的组的抗体竞争结合o-甘露糖基化e-钙黏素、优选地与o-甘露糖基化的截短的70kda e-钙黏素:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、
f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。
25.在某些实施方案中,根据本发明的抗体或抗原结合片段具有以下特征中的一种或多种并且优选地每一种:
[0026]-与o-甘露糖基化e-钙黏素的细胞外3(ec3)结构域结合;
[0027]-与o-甘露糖基化全长e-钙黏素相比,更好地、至少2倍更好地、更优选地至少3倍更好地、更优选地至少4倍更好地、更优选地至少5倍更好地结合o-甘露糖基化的截短的70kda e-钙黏素;以及
[0028]-结合共表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的肿瘤细胞。
[0029]
在一些实施方案中,所述抗体或抗原结合片段还包含以下特征中的至少一种:
[0030]-结合结肠癌亚型cms1、cms2、cms3和cms4;
[0031]-与健康的髓质胸腺上皮细胞或树突细胞或朗格汉斯细胞相比,更好地结合结肠癌细胞系sw948。
[0032]
在某些实施方案中,根据本发明的抗体或抗原结合片段与另一种化合物偶联。在某些实施方案中,所述另一种化合物是治疗化合物。在某些实施方案中,所述另一种化合物是选自由以下组成的组的化合物:免疫调节化合物、t细胞结合化合物、自然杀伤细胞(nk细胞)结合化合物、自然杀伤t细胞(nkt细胞)结合化合物、γ-δt细胞结合化合物、cd3特异性结合化合物、tgfβ特异性结合化合物、细胞因子、第二抗体或其抗原结合部分、可检测标记、药物、化疗药物、细胞毒性剂、毒性部分、激素、酶和放射性化合物。在一些实施方案中,所述免疫调节化合物不是根据本发明的抗体的fc尾部。在一些实施方案中,所述免疫调节化合物是非天然免疫调节化合物。
[0033]
与治疗化合物直接或间接偶联的根据本发明的抗体或抗原结合片段在本文中也被称为根据本发明的抗体-药物缀合物(adc)。
[0034]
本发明还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性或多特异性结合化合物,优选地双特异性或多特异性抗体或其抗原结合片段,其包含:
[0035]-根据本发明的抗体或抗原结合片段;和
[0036]-免疫调节化合物。
[0037]
在一些实施方案中,所述免疫调节化合物不是根据本发明的抗体的fc尾部。在一些实施方案中,所述免疫调节化合物是非天然免疫调节化合物。
[0038]
本发明还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性或多特异性结合化合物,优选地双特异性或多特异性抗体或其抗原结合片段,其包含:
[0039]-根据本发明的抗体或抗原结合片段;和
[0040]-t细胞结合化合物或自然杀伤细胞(nk细胞)结合化合物或自然杀伤t细胞(nkt细胞)结合化合物或γ-δt细胞结合化合物。
[0041]
本发明还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性或多特异性结合化合物,优选地双特异性或多特异性抗体或其抗原结合片段,其包含:
[0042]-根据本发明的抗体或抗原结合片段;和
[0043]-cd3特异性结合化合物。
[0044]
本发明还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性或多特异性结
合化合物,优选地双特异性或多特异性抗体或其抗原结合片段,其包含:
[0045]-根据本发明的抗体或抗原结合片段;和
[0046]-klrg1特异性结合化合物。
[0047]
本发明还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性或多特异性结合化合物,优选地双特异性或多特异性抗体或其抗原结合片段,其包含:
[0048]-根据本发明的抗体或抗原结合片段;和
[0049]-cd103特异性结合化合物。
[0050]
本发明还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性或多特异性结合化合物,优选地双特异性或多特异性抗体或其抗原结合片段,其包含:
[0051]-根据本发明的抗体或抗原结合片段;和
[0052]-tgfβ特异性结合化合物。
[0053]
还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性抗体或其抗原结合片段,其包含:
[0054]-根据本发明的抗体或抗原结合片段的一个fab片段;和
[0055]-优选地对t细胞、nk细胞、nkt细胞或γ-δt细胞具有特异性的另一种抗体的一个fab片段。
[0056]
还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性抗体或其抗原结合片段,其包含:
[0057]-根据本发明的抗体或抗原结合片段的一个fab片段;和
[0058]-对cd3具有特异性的另一种抗体的一个fab片段。
[0059]
还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性抗体或其抗原结合片段,其包含:
[0060]-根据本发明的抗体或抗原结合片段的一个fab片段;和
[0061]-对klrg1或cd103具有特异性的另一种抗体的一个fab片段。
[0062]
还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性抗体或其抗原结合片段,其包含:
[0063]-根据本发明的抗体或抗原结合片段的一个fab片段;和
[0064]-对tgfβ具有特异性的另一种抗体的一个fab片段。
[0065]
某些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的嵌合抗原受体(car)t细胞,其中所述car t细胞包含根据本发明的抗体的重链cdr1、cdr2和cdr3序列。所述car t细胞优选地还包含根据本发明的抗体的轻链cdr1、cdr2和cdr3序列。优选地,所述cdr1-3序列以单链形式存在于所述car t细胞的表面处。
[0066]
本发明还提供了具有本文指定的结构和功能特征的核酸。在各种实施方案中,本发明提供了一种分离的、合成的或重组的核酸,其编码根据本发明的抗体或抗原结合片段、或至少编码根据本发明的抗体或抗原结合片段的重链可变区和/或轻链可变区。
[0067]
在某些实施方案中,本发明提供了一种核酸,其包含与选自由seq id no:23-39组成的组的序列具有至少80%序列同一性的序列,和/或包含与选自由seq id no:40-44组成的组的序列具有至少80%序列同一性的序列,如表1中描绘。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更
优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述序列变异位于cdr区之外。
[0068]
在某些实施方案中,根据本发明的核酸包含dna或rna。
[0069]
在某些实施方案中,根据本发明的核酸包括cdna、肽核酸(pna)、锁核酸(lna)或dna/rna螺旋。
[0070]
在某些实施方案中,根据本发明的核酸被密码子优化以在非人宿主细胞中表达。
[0071]
在某些实施方案中,根据本发明的核酸被密码子优化以在hek293t细胞或cho细胞中表达。
[0072]
本发明还提供了一种载体,其包含根据本发明的核酸。在一些实施方案中,所述载体是car t细胞载体,其包含编码抗原识别结构域和t细胞激活结构域的核酸序列。在一些实施方案中,所述car t细胞载体还包含编码跨膜结构域的核酸序列。
[0073]
本发明还提供了一种分离的或重组的宿主细胞或非人动物,其包含根据本发明的抗体、抗原结合片段、核酸、载体、adc或car t细胞。在某些实施方案中,所述宿主细胞是哺乳动物细胞、细菌细胞、植物细胞、hek293t细胞或cho细胞。
[0074]
本发明还提供了一种组合物,其包含根据本发明的抗体、抗原结合片段、核酸分子、载体、adc、car t细胞或宿主细胞。在各种实施方案中,所述组合物是还包含药学上可接受的载剂、稀释剂或赋形剂的药物组合物。
[0075]
本发明还提供了一种组分(parts)试剂盒,其包含根据本发明的抗体、抗原结合片段、核酸分子、载体、adc、car t细胞或宿主细胞。
[0076]
在某些实施方案中,根据本发明的组合物或组分试剂盒还包含至少一种其他治疗剂。
[0077]
本发明还提供了一种用于产生根据本发明的抗体或抗原结合片段的方法,所述方法包括培养包含根据本发明的核酸或载体的宿主细胞并允许所述宿主细胞翻译所述核酸或载体,从而产生根据本发明的所述抗体或抗原结合片段。所述方法优选地还包括从所述宿主细胞和/或从培养基中回收所述抗体或抗原结合片段。在一些实施方案中,所述宿主细胞提供有包含编码所述抗体的重链的核酸序列和编码所述抗体的轻链的核酸序列两者的载体。在一些实施方案中,所述宿主细胞提供有至少两个不同的载体,其中一个载体包含编码所述抗体的重链的核酸序列,并且第二载体包含编码所述抗体的轻链的核酸序列。
[0078]
还提供了一种抗体或抗原结合片段,其通过根据本发明的方法获得。
[0079]
本发明还提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用作药物、或预防剂、或诊断剂。
[0080]
还提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其使用于治疗或预防与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞相关联的病症的方法中。在一些优选实施方案中,所述病症是e-钙黏素阳性和tmtc3阳性癌症。在一些实施方案中,所述癌症还包括表达tgfβ的肿瘤细胞。
[0081]
各种实施方案提供了根据本发明的用于使用的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其中所述抗体或
抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞与适用于治疗和/或预防与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞相关联的病症的另一种治疗剂组合。
[0082]
本发明还提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞用于制造药物的用途。
[0083]
还提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞用于制造治疗或预防与表达e-钙黏素和o-甘露糖基转移酶的细胞相关联的病症的药物的用途。在特定实施方案中,所述细胞是肿瘤细胞。在特定实施方案中,所述o-甘露糖基转移酶是tmtc3。还提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞用于制备治疗或预防e-钙黏素阳性和tmtc3阳性癌症的药物的用途。在特定实施方案中,所述e-钙黏素阳性和tmtc3阳性癌症是上皮癌。在一些实施方案中,所述e-钙黏素阳性和tmtc3阳性癌症选自由以下组成的组:腺癌、鳞状细胞癌、腺鳞癌、间变性癌、大细胞癌、小细胞癌、结直肠癌、结肠癌、胃癌(stomach cancer)、胃癌(gastric cancer)、胃食管结合部癌、乳腺癌、胰腺癌、食管癌、胃食管结合部癌、膀胱癌、肺癌、小细胞肺癌、非小细胞肺癌、肺腺癌、泌尿道癌、前列腺癌、脑癌、甲状腺癌、喉癌、类癌、肝癌、肝细胞癌、头颈癌、卵巢癌(ovary cancer)、宫颈癌、卵巢癌(ovarian cancer)、子宫内膜癌、上皮内癌、透明细胞癌、黑色素瘤、多发性骨髓瘤、肾癌、肾细胞癌、肾移行细胞癌、输卵管癌和腹膜癌。
[0084]
在一些实施方案中,所述e-钙黏素阳性和tmtc3阳性癌症选自由以下组成的组:结直肠癌、结肠癌、结肠癌亚型cms1、结肠癌亚型cms2、结肠癌亚型cms3、结肠癌亚型cms4、喉癌、头颈癌、乳腺癌、胰腺癌、食管癌、膀胱癌、肺癌、胃癌、泌尿道癌、前列腺癌和卵巢癌。
[0085]
本发明还提供了一种用于治疗和/或预防与表达e-钙黏素和o-甘露糖基转移酶的细胞、优选地肿瘤细胞相关联的病症的方法,其包括向有需要的个体施用治疗有效量的根据本发明的抗体或抗原结合片段、和/或根据本发明的双特异性抗体或多特异性抗体、或adc、或car t细胞、和/或根据本发明的核酸、和/或根据本发明的载体或细胞、和/或根据本发明的组合物或组分试剂盒。还提供了一种用于至少部分地治疗和/或预防e-钙黏素阳性和tmtc3阳性癌症的方法,其包括向有需要的个体施用治疗有效量的根据本发明的抗体或抗原结合片段、和/或根据本发明的双特异性抗体或多特异性抗体、或adc、或car t细胞、和/或根据本发明的核酸、和/或根据本发明的载体或细胞、和/或根据本发明的组合物或组分试剂盒。所述组合物优选地是根据本发明的药物组合物。
[0086]
本发明还提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞用于确定样品是否包含含有o-甘露糖基化e-钙黏素的细胞、优选地肿瘤细胞的用途。
[0087]
还提供了一种用于确定包含o-甘露糖基化e-钙黏素的细胞、优选地肿瘤细胞是否存在于样品中的方法,所述方法包括:
[0088]-使所述样品与根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞接触,和
[0089]-允许所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞与包含o-甘露糖基化e-钙黏素的细胞、优选地包含o-甘露糖基化e-钙黏素的肿瘤细
胞结合,以及如果存在的话
[0090]-确定细胞是否与所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞结合,从而确定包含o-甘露糖基化e-钙黏素的细胞、优选地包含o-甘露糖基化e-钙黏素的肿瘤细胞是否存在于所述样品中。
[0091]
还提供了一种用于确定表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞是否存在于样品中的方法,所述方法包括:
[0092]-使所述样品与根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞接触,和
[0093]-允许所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞结合,以及如果存在的话
[0094]-确定细胞是否与所述抗体或抗原结合片段、或双特异性抗体、或多特异性抗体、或adc、或car t细胞结合,从而确定表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞是否存在于所述样品中。
[0095]
本发明还提供了一种用于确定人或非人个体是否患有o-甘露糖基化e-钙黏素阳性的癌症的方法,所述方法包括:
[0096]-使所述个体的肿瘤细胞与根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞接触,
[0097]-允许所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞与包含o-甘露糖基化e-钙黏素的肿瘤细胞结合,以及如果存在的话
[0098]-确定肿瘤细胞是否与所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞结合,从而确定所述个体是否患有o-甘露糖基化e-钙黏素阳性的癌症。
[0099]
在一些实施方案中,所述方法是离体方法。在其他实施方案中,所述方法在体内进行。
附图说明
[0100]
图1.(a)示出了全长e-钙黏素氨基酸序列(uniprot q9uii7),包括通篇使用的编号。(b)指示了e-钙黏素的不同结构域。改编自berx等人genomics 1995。at1636的预测结合表位呈红色。(c)示出了截短的70kda蛋白,在实施例中还指示为p70,包括跨膜(斜体)和细胞内结构域。
[0101]
图2.(a)sds-page解析了at1002和at1636抗体的免疫沉淀样品。箭头指示通过at1636免疫沉淀并通过质谱法分析的蛋白质“条带”,jkt=jurkat,阴性对照t细胞系,dld1是结肠癌细胞系,m=分子量标记物,ip=免疫沉淀,并且at1002是阴性对照抗体。(b)蛋白质印迹示出了ep700y兔抗体(abcam)和c尾细胞内定向抗体(bd biosciences)对全长e-钙黏素进行的免疫沉淀,以及通过at1636对p70蛋白进行的从dld1细胞的免疫沉淀。ep700y;结合细胞外膜近端ec5结构域;c尾内部,一种对e-钙黏素(bd bioscience)的c末端细胞内结构域具有特异性的小鼠抗e-钙黏素,也用于检测,并且at1636与优先暴露在p70 e-钙黏素形式上的表位反应。
[0102]
图3.呈现全长和截短p70 e-钙黏素的图形概述。黑色棒棒糖描绘了报告的o-甘露糖糖基化位点(larsen pnas(2017)和vester-christensen,pnas(2013)),而深灰色棒棒糖描述了预测的o-甘露糖糖基化位点,并且浅灰色棒棒糖描述了我们通过at1636免疫沉淀的p70 e-钙黏素的质谱法鉴定的潜在甘露糖基化的位点。以粗体指示的氨基酸残基对于如通过丙氨酸扫描确定的at1636结合是重要的。如larsen等人2017和vester-christensen等人2013所述,已知大写残基472和474是o-甘露糖基化的,并且预测470是甘露糖基化的。在全长e-钙黏素(顶部)中,描绘了sc10.17(抗cd324单克隆抗体及其用途,us9534058(b2))和ep700y的抗体结合区以及β-连环蛋白结合区。
[0103]
图4.at1636与用不同抑制剂预处理的dld1细胞的结合的流式细胞术分析。指示了在用mann(甘露糖基转移酶抑制剂:4-氧代-2-硫酮-3-噻唑烷基乙酸(sigma))或cmk(弗林蛋白酶,包括转化酶抑制剂:癸酰基-rvkr-cmk(tocris))抑制剂预处理48小时的dld1细胞上5μg/ml的at1636和对照抗体at1002和ep700y的直方图(实线,空心直方图)。填充直方图指示与未处理细胞的结合。
[0104]
图5.(a)与e-钙黏素克隆亲本克隆7g02的平均结合相比,与e-钙黏素重组蛋白结合增加的亚克隆(红框)的选择和分离。用重组e-钙黏素和igg(h+l)-alexa647和抗小鼠-fc-pe抗体对细胞进行染色。用细胞分选仪(facs aria,bd)进行门控细胞的单细胞克隆。(b)与亲本7g02克隆相比,e-钙黏素抗原结合增加的亚克隆的选择。将at1636 gfp低亲本细胞与gfp高亚克隆细胞混合。将此细胞混合物染色以用于e-钙黏素结合和bcr表达。示出了与亲本7g02细胞(橙色)相比,与亚克隆(蓝色)的bcr表达相关的抗原结合强度。
[0105]
图6.(a)指示了at1636和at1636高亲和力变体与人crc细胞系dld1、乳腺上皮细胞系mcf10a和小鼠crc细胞系cmt93的结合曲线,如通过流式细胞术检测(描绘了与山羊抗人二级抗体(invitrogen)缀合的alexa647染料的平均荧光强度(mfi))。ep700y和sc10.17抗体与小鼠e-钙黏素没有交叉反应性。(b)指示了皮肤上皮细胞系a431、肺a546和小鼠cmt93细胞系上如通过流式细胞术检测的at1636和at1636
–
yn和
–
iyn变体与对照抗体at1002的结合比率。
[0106]
图7.(a)at1636、at1636
–
ny和
–
iyn变体与可溶性p70 e-钙黏素的spr结合。在用2.0μg/ml p70 e-钙黏素固定的点上注射5.0μg/ml抗体。作为对照,使用对ec5结构域具有特异性的ep700y兔抗人e-钙黏素。使用ibis多重spr成像(b)elisa测定检测结合,以确定at1636和at1636
–
iyn变体与重组固定化全长e-钙黏素(左图)、p70 e-钙黏素(中图)和含有m470a取代(防止此残基的甘露糖基化)的e-钙黏素d3结构域(右图)的结合。使用sc10.17抗体作为与全长(ec1结构域)结合但不与p70和d3结构域结合的对照抗体。at1002是一种针对流感的阴性人体对照抗体。(c)elisa测定,使用广泛浓度范围的at1636及其变体与重组固定化全长e-钙黏素(左图)、p70 e-钙黏素(中图)和含有m470a取代(防止此残基的甘露糖基化)的e-钙黏素d3结构域(右图)结合。at1002是一种针对流感的阴性人体对照抗体。
[0107]
图8.(a)蛋白质印迹,示出了输入和at1636免疫沉淀之后的流通量(ft)以及使用高水平的吡喃甘露糖苷进行的p70从at1636免疫沉淀物的特异性洗脱。(b)elisa证明at1636与来源于hek细胞的全长e-钙黏素(sino biological)结合(左图)并且at1636与大肠杆菌来源的e-钙黏素(lsbio)缺乏结合(右图)。通过ep700y抗体识别大肠杆菌产生的e-钙黏素。
[0108]
图9.e-钙黏素p70截短ec3结构域(d3)的丙氨酸取代揭示了对于at1636的结合重要的若干氨基酸。通过elisa在抗小鼠fc捕获后研究at1636与重组小规模d3
–
flag-小鼠fc融合蛋白的结合。所有蛋白质在培养上清液中表达的量相似,并且d3
–
野生型结合设定为1,并且所有都标准化至抗flag检测。
[0109]
图10.描绘的计算分析是tmtc3和e-钙黏素在若干肿瘤特异性细胞系中的组合mrna表达;圆圈中间是每种组织类型包含的肿瘤细胞系的数量。浅灰色表示e-钙黏素和tmtc3表达均高(≥7倍)并且因此预期被at1636识别的肿瘤细胞系的百分比。基于流式细胞术分析选择截留值7,其证明此类细胞系可以被at1636抗体结合,参见表3。通常对tmtc3和e-钙黏素二者均呈阴性的组织是造血和淋巴组织、骨和软组织。(数据从布洛德研究所(broad institute)获得:https://portals.broadinstitute.org/ccle,j.barretina,nature(2012))。
[0110]
图11.流式细胞术分析指示at1636与用含有全长e-钙黏素的构建体转导的sk-mel-5细胞的结合增加。sk-mel-5通常对e-钙黏素呈阴性,但确实表达tmtc3。at1636(实线)不结合sk-mel-5(左),但在e-钙黏素过表达时结合(中)。另外,ep700y(右)当前正在结合sk-mel-5。浅灰色曲线是同种型对照的背景染色。
[0111]
图12.shrna诱导的tmtc3敲低导致at1636结合减少,如通过流式细胞术确定。除对照加扰的shrna载体外,还开发和测试了tmtc3靶向shrna探针。tmtc3表达被强烈减少,如通过qpcr(左)确定。tmtc3敲低导致at1636结合减少》3倍(右图,实线)。
[0112]
图13.(a)由与抗cd3 ucht1融合的at1636或at1636-iyn组成的单价t细胞接合器(mtce)结构的图形表示。(b)在2d细胞培养模型中测试化合物,其中荧光素酶和gfp阳性crc细胞系dld1、ht29和hct116在5000c/w(96w)下培养o/n,然后与作为效应细胞的未刺激的总pbmc一起温育2天。通过测量在48小时过程内表达的荧光素酶来建立细胞的细胞毒性。(c)对于at1636、at1636-iyn或at1002均单价的杵臼(knob-in-hole,kih)双特异性形式和源自ucht1抗体的cd3εscfv的结构的图形表示。(d)在2d细胞培养模型中测试化合物,其中荧光素酶和gfp阳性crc细胞系dld1和ht29以及黑色素瘤细胞系a375在5000c/w(96w)下培养o/n,然后与kih双特异性单价at1636、at1636-iyn和at1002以及ucht1 scfv cd3ε一起温育,并且随后与作为效应细胞的未刺激的总pbmc一起温育2天。通过在48小时温育时间结束时测量荧光素酶活性来评估细胞的细胞毒性。
[0113]
图14.p70 e-钙黏素和全长e-钙黏素在通常表达e-钙黏素的细胞系(dld1、hct116和ht29)和对于e-钙黏素通常呈阴性的细胞(sk-mel-5)中的稳定过表达。左列示出了用空载体转导的细胞。在p70 e-钙黏素过表达后,所有细胞都表现出脱粘形态表型(指示emt表型)。
[0114]
图15.与不存在tgfβ的情况下培养的细胞相比,at1636与tgfβ培养延长时间段的dld1细胞的结合的流式细胞术分析。
[0115]
图16.在添加tgfβ和at1636-iyn之后细胞生长和细胞数量减少。(a)在tgfβ和at1636以及at1636-iyn变体不存在和存在的情况下的a431细胞培养。顶行图示出了在组织培养物处理的塑料上培养5天的a431细胞,底行图示出了在纤连蛋白涂覆的塑料上培养的a431细胞,使用10x放大率。左图示出了在培养基中培养的细胞,中间图示出了tgfβ存在的情况,并且右图示出了tgfβ和at1636-iyn存在的情况。在tgfβ和at1636-iyn存在的情况下
培养的孔中,观察到减少的(活)细胞和较少的贴壁细胞。在塑料或纤连蛋白涂覆板中培养的细胞之间没有观察到差异,并且对于at1636-wt或at1002对照抗体(未示出)没有观察到影响。(b)在tgfβ(左图)及tgfβ和at1636-iyn(右图)存在的情况下7d培养之后,在纤连蛋白涂覆孔中培养的a431细胞的使用20x放大率的详细代表性概述。在右图中,观察到更圆的正在死亡的单细胞和更少的贴壁细胞。
[0116]
图17.使用ph敏感的zenon phrodo ifl染料通过荧光显微镜(incucyte)检测的dld1细胞中at1636及其变体的内化的时程分析。除阴性对照at1002外的所有抗体均被内化。
[0117]
图18.指示了在与at1636及其变体和cd103特异性抗体(mca708)温育之后,在结合全长和p70 e-钙黏素的板上温育的cfse标记的cd103+t细胞的细胞表面覆盖率。
具体实施方式
[0118]
e-钙黏素
[0119]
e-钙黏素在人类中由cdh1基因编码,所述基因也被称为cd324。当前已知的人e-钙黏素的氨基酸序列在图1a中描绘。e-钙黏素是120-kda跨膜糖蛋白,位于上皮细胞的粘附连接处。e-钙黏素是钙黏素大家族的成员,可以分为若干亚型:i型经典钙黏素,诸如e-钙黏素(cdh1)、n-钙黏素(cdh2)和p-钙黏素(cdh3);ii型经典钙黏素,诸如ve-钙黏素(cdh5)和ob-钙黏素(cdh11);桥粒钙黏素;七次跨膜钙黏素;fat和dachsous(dchs)组钙黏素;和原钙黏素(pcdh)。e-钙黏素是具有三个组分的跨膜蛋白:(1)负责同型钙黏素-钙黏素相互作用的细胞外钙黏素结构域(ec),(2)单次跨膜结构域或七次跨膜结构域,和(3)充当细胞表面、相关联的细胞质连环蛋白和细胞骨架之间的连接器的细胞质结构域。钙黏素涉及生物体的生长(胚胎发生)、伤口愈合以及肿瘤侵袭和转移。
[0120]
除作为钙依赖性粘附分子之外,e-钙黏素还是上皮连接形成的关键调节剂。它与连环蛋白的缔合是细胞-细胞粘附和侧膜与顶膜之间上皮细胞/上皮片的极化所必需的。酪氨酸磷酸化可以破坏这些复合物,从而导致细胞粘附特性的变化。e-钙黏素表达经常在高侵袭性、低分化癌中下调。这些细胞中e-钙黏素表达增加降低了侵袭性。因此,e-钙黏素表达或功能的丧失似乎是致瘤进展中的一个重要步骤。此外,钙黏素通过上皮间质转化(emt,这是一个可逆的过程)在细胞的侵袭和迁移中发挥重要作用。emt是一个非常多样化的过程,可以通过许多外部信号(炎症、应激、缺氧、免疫应答等)进行协调。普遍认为,特别是emt诱导转录因子(snail、e47、twist和zeb家族)的强调节是emt的基础,其例如通过tgfβ、wnt、整联蛋白和生长因子与细胞的结合,将导致e-钙黏素、zo-1、桥粒斑蛋白的下调和波形蛋白、纤连蛋白、n-钙黏素等的上调。所述细胞经历了一个过程,在所述过程中它们类似于更像“干性”的表型。最近,此模型一直在发生变化,因为观察到细胞也可以“显示”emt,而无需下调或上调已知的emt标记物。这被命名为部分emt、混合emt/met和准emt,大部分新模型提出了一个系统,在所述系统中细胞能够调节蛋白质表达(例如,蛋白质内化、高/低蛋白质周转)或者细胞一起(集群)具有不同的活动/侵入模式。e-钙黏素在这些过程中起主导作用,并且在这方面,e-钙黏素o-甘露糖基化被认为是肿瘤细胞在与周围基质相互作用时调节粘附和形态变化的额外工具。
[0121]
抗e-钙黏素抗体及其抗原结合片段
[0122]
本发明提供了能够特异性结合o-甘露糖基化e-钙黏素的抗体及其抗原结合片段。在一些实施方案中,所述抗体是分离的。在其他实施方案中,所述抗体是合成的或重组的。有趣的是,本发明提供了包含vh和vl序列的抗体及其抗原结合片段,所述序列是基于人抗体的vh和vl序列,所述人抗体来源于患有具有转移的iv期结肠癌但已经在化疗之后完全缓解多年的人类个体。相比之下,许多当前已知的治疗抗体通常通过使非人动物诸如小鼠、大鼠、骆驼、兔或山羊免疫化,任选地接着进行人源化过程来获得。由于接受者对非人序列的免疫反应,此类人源化抗体仍涉及不良副作用的风险。另外,许多现有技术的治疗抗体或其片段来源于其中免疫球蛋白重链和轻链随机配对的人工噬菌体展示文库。相比之下,本发明提供了具有天然配对的重链和轻链的抗体和抗原结合片段,其基于已在完全缓解的人患者体内进化的抗体序列。
[0123]
因为e-钙黏素在许多上皮组织中广泛表达,因此在本发明之前,本领域不认为它是治疗应用的抗原选择,特别是考虑到e-钙黏素在肿瘤细胞中经常下调而促进emt的事实。然而,本发明提供了能够特异性结合截短形式的e-钙黏素的抗体及其抗原结合片段,所述e-钙黏素的分子量为约70kda,在肿瘤细胞中经常上调。
[0124]
如本文所用,术语“抗体”涵盖蛋白质分子以及其任何抗原结合片段。所述蛋白质分子优选地是免疫球蛋白,这意味着它们属于免疫球蛋白类蛋白质。在一些实施方案中,抗体或其抗原结合片段包含一个或多个结合抗原上的表位的结构域,其中此类结构域优选地来源于抗体的可变结构域或与抗体的可变结构域共享序列同源性。
[0125]
互补决定区(cdr)是存在于重链可变结构域和轻链可变结构域中的高变区。在全长抗体的情况下,重链的cdr 1-3和连接的轻链的cdr 1-3一起形成抗原结合位点。
[0126]
天然抗体的可结晶片段(fc)区由两条重链的ch2和ch3结构域构成。
[0127]
通常,抗体的抗原结合片段能够结合与所述抗体相同的抗原,尽管不一定以相同的程度结合。在一些实施方案中,抗原结合片段至少包含抗体的重链cdr3区。在一些实施方案中,抗原结合片段至少包含抗体的重链cdr3区和轻链cdr3区。在一些实施方案中,所述重链和轻链cdr3区彼此配对。
[0128]
在各种实施方案中,抗体的抗原结合片段至少包含抗体的重链cdr1、cdr2和cdr3区。在各种实施方案中,抗体的抗原结合片段至少包含vh结构域。在各种实施方案中,抗体的抗原结合片段至少包含抗体的重链cdr1、cdr2和cdr3区以及轻链cdr1、cdr2和cdr3区。在各种实施方案中,抗体的抗原结合片段至少包含vl结构域。在各种实施方案中,抗体的抗原结合片段至少包含vh和vl结构域。
[0129]
根据本发明的抗体或抗原结合片段的非限制性实例是全长抗体、(含有两个不同igg1的双特异性抗体)、单结构域抗体或纳米抗体(含有单个vh或vl结构域)、单链可变片段(scfv;含有vh结构域和vl结构域,通常通过短接头肽连接)、fv片段(含有vh结构域和vl结构域,通常没有接头)、unibody
tm
、fd片段(含有vh结构域和ch1结构域)、双抗体(含有两个vh结构域和两个vl结构域,其中vh通过一种短接头连接至vl,使得它们不能彼此配对,而是与另一条链的vl和vh配对,从而产生两个抗原结合位点)、fab片段(含有重链恒定结构域ch1、轻链恒定结构域cl以及重链和轻链可变结构域vh和vl)和f(ab')2片段(含有两个通过二硫键连接的fab片段)。
[0130]
在各种实施方案中,本发明的抗体或抗原结合片段包含重链可变区(vh)和轻链可
变区(vl)。在一些实施方案中,所述vh与所述vl配对。
[0131]
用于治疗用途的抗体优选地尽可能接近待治疗受试者的天然抗体(例如,用于人受试者的人抗体)。在各种实施方案中,本发明的抗体是全长抗体,优选地igg或igm或iga全长抗体。如本文所用,igg全长抗体是包含两条γ类重链和两条轻链的二价分子。如技术人员所熟知的,抗体的重链是构成免疫球蛋白分子的两种类型的链中较大的。天然重链通常包含恒定结构域ch,其包含恒定区ch1、ch2和ch3;和可变结构域(vh),所述可变结构域涉及抗原结合。抗体的轻链是构成免疫球蛋白分子的两种类型的链中较小的。天然轻链通常包含恒定结构域(cl)和可变结构域(vl)。轻链可变结构域经常但不总是与涉及抗原结合的重链的可变结构域一起。
[0132]
全长igd抗体是包含两条δ类重链和两条轻链的二价分子。
[0133]
在igm的情况下,全长抗体是包含5或6个连接的免疫球蛋白的十价或十二价分子,在所述免疫球蛋白中,每个单体具有由重链和轻链形成的两个抗原结合位点。
[0134]
在iga的情况下,全长抗体可以是单体或二聚体。
[0135]
在一些实施方案中,根据本发明的抗体或抗原结合片段是人抗体或其抗原结合片段。与鼠或人源化抗体相反,人氨基酸序列的存在减少了在人患者的治疗使用期间出现不良副作用的机会,其中非人cdr或可变区或恒定区序列涉及在人接受者中出现抗鼠免疫应答的风险。
[0136]
在各种实施方案中,根据本发明的抗体或抗原结合片段是igg同种型,优选地igg1。这对于人类的医学应用是有益的,例如,因为igg1抗体在体内施用至人类个体后通常具有良好的半衰期。此外,igg1的fc尾部允许实现效应子功能,像抗体依赖性细胞介导的细胞毒性(adcc)、补体依赖性细胞毒性(cdc)和抗体依赖性细胞吞噬作用(adcp)。在一些实施方案中,根据本发明的抗体或抗原结合片段是人igg,优选地人igg1。
[0137]
在一些实施方案中,根据本发明的抗体或抗原结合片段是igg2同种型。在一些实施方案中,根据本发明的抗体或抗原结合片段是igg3同种型。在一些实施方案中,根据本发明的抗体或抗原结合片段是igg4同种型。
[0138]
在一些实施方案中,根据本发明的抗体或抗原结合片段是igm同种型。在一些实施方案中,根据本发明的抗体或抗原结合片段是iga同种型。在一些实施方案中,根据本发明的抗体或抗原结合片段是igd同种型。
[0139]
在各种实施方案中,抗体或其抗原结合片段包含一个或多个突变。此类突变例如包括氨基酸取代、插入或缺失。如本文所用,其中一个或若干个、优选至多20个氨基酸残基缺失而基本上不改变所得抗体的结合特征的全长抗体仍被认为是全长抗体。
[0140]
在一些实施方案中,根据本发明的抗体或抗原结合片段具有修饰的fc尾部。在一些实施方案中,所述fc尾部已通过一个或多个氨基酸置换和/或通过糖基化改变进行修饰。在一些实施方案中,所述fc尾部已进行修饰以降低adcc活性。在一些实施方案中,所述fc尾部已进行修饰以增强adcc活性。在一些实施方案中,根据本发明的抗体或抗原结合片段进行非岩藻糖基化,从而增强adcc活性。
[0141]
术语“能够结合”、“对
…
具有特异性”、“能够特异性结合(able to specifically bind)”、“能够特异性结合(capable of specifically binding)”和“结合”在本文中可互换使用,并且是指抗体或其抗原结合片段与其靶(也称为其抗原)之间的相互作用。这意味
着所述抗体或抗原结合片段相对于其他抗原或氨基酸序列优选结合所述抗原。因此,尽管抗体或抗原结合片段可以与其他抗原或氨基酸序列非特异性结合,但所述抗体或抗原结合片段对其抗原的结合亲和力显著高于所述抗体或抗原结合片段对其他抗原或氨基酸序列的非特异性结合亲和力。
[0142]
通常,以某种方式修饰的本发明的抗体或抗原结合片段保留其结合活性的至少50%(当与亲本抗体相比时)。优选地,与亲本抗体相比,本发明的抗体或抗原结合片段保留其结合活性的至少60%、70%、80%、90%、95%或100%。
[0143]
在一些实施方案中,本发明的抗体或抗原结合片段包含不明显改变其生物学活性的保守或非保守氨基酸取代(所得变体在本文中分别被称为“保守变体”或“功能保守变体”)。在一些实施方案中,与亲本抗体相比,此类保守变体或功能保守变体保留其结合活性的至少80%、90%、95%或100%。
[0144]
如本文所用,保守取代是氨基酸残基被具有通常相似特性(大小、疏水性等)的另一个残基取代、使得抗体的整体功能基本上不受影响的取代。通常,表2中描绘的同一类别内氨基酸残基的取代被认为是保守氨基酸取代。
[0145]
如果由根据本发明的抗体或抗原结合片段结合的o-甘露糖基化e-钙黏素表位也恰好存在于另一种化合物中,则能够结合o-甘露糖基化e-钙黏素的所述抗体或抗原结合片段也可以对所述另一种化合物具有特异性。在这种情况下,本文被称为对o-甘露糖基化e-钙黏素具有特异性的抗体或抗原结合片段也对包含相同种类的o-甘露糖基化表位的这种另一种化合物具有特异性。这种其他o-甘露糖基化表位可以通过另一种o-甘露糖基转移酶在体内产生,而不是通过在体内产生o-甘露糖基化e-钙黏素的o-甘露糖基转移酶产生。因此,术语“结合”或“对
…
具有特异性”不排除本发明的抗体或抗原结合片段与含有相同种类的o-甘露糖基化表位的另一种或多种蛋白质的结合。
[0146]“结合亲和力”是指抗体或抗原结合片段的单一结合位点与其结合配偶体(例如,抗原)之间的非共价相互作用的总和的强度。除非另有指示,否则如本文所用,“结合亲和力”是指反映结合对(例如,抗体和抗原)的成员之间的1:1相互作用的固有结合亲和力。亲和力通常可以由平衡解离常数(kd)表示,其计算为ka与kd的比率,参见例如,chen,y.等人,(1999)j.mol biol 293:865-881。可以通过本领域已知的常见方法测量亲和力,例如像表面等离子体共振(spr)测定,诸如biacore(ge healthcare)、octet(fortebio)或ibis technologies bv(hengelo,the netherlands)的ibis-ispr仪器或溶液相测定,诸如kinexa。
[0147]
如本文所用,术语“核酸”和“核酸分子”可互换使用。在一些实施方案中,根据本发明的核酸或核酸分子包含核苷酸链,更优选地dna、cdna或rna。在一些实施方案中,根据本发明的核酸或核酸分子包含非天然核苷酸、修饰的核苷酸和/或表现出与天然核苷酸相同功能的非核苷酸构建模块,例如像dna/rna螺旋、肽核酸(pna)和/或锁核酸(lna)。
[0148]
氨基酸或核酸序列的同一性百分比或术语“%序列同一性”在本文中定义为在比对两个序列并在必要时引入空位以实现最大同一性百分比之后候选氨基酸或核酸序列中与参考序列中的残基相同的残基的百分比。用于比对的方法和计算机程序在本领域中是熟知的,例如“align 2”。
[0149]
如本文所用,单数术语“一个/种”涵盖术语“一个/种或多个/种”。
[0150]
示例性e-钙黏素特异性抗体
[0151]
本发明提供了对o-甘露糖基化e-钙黏素具有特异性并具有指定的结构和功能特征的抗体及其抗原结合片段,以及其用于治疗或预防疾病的治疗用途。此类疾病的非限制性实例是具有o-甘露糖基化e-钙黏素的癌症。
[0152]
如本文所用,术语“o-甘露糖基化e-钙黏素”是指包含具有o-连接的甘露糖的至少一个苏氨酸或丝氨酸残基的e-钙黏素蛋白,这意味着甘露糖附接至所述苏氨酸或丝氨酸的氧原子。在一些实施方案中,所述e-钙黏素蛋白包含至少一个单一o-甘露糖基化苏氨酸或丝氨酸残基。术语“单一o-甘露糖基化苏氨酸残基”是指含有o-连接的甘露糖而没有另一个糖部分附接至所述o-连接的甘露糖的苏氨酸残基。术语“单一o-甘露糖基化丝氨酸残基”是指含有o-连接的甘露糖而没有另一个糖部分附接至所述o-连接的甘露糖的丝氨酸残基。
[0153]
各种实施方案提供了根据本发明的对o-甘露糖基化e-钙黏素具有特异性的抗体或抗原结合片段,其中所述抗体或抗原结合片段与所述e-钙黏素的结合依赖于如图1a中描绘的e-钙黏素序列的位置467处o-甘露糖基化苏氨酸残基、位置468处o-甘露糖基化苏氨酸残基、位置470处o-甘露糖基化苏氨酸残基、位置472处o-甘露糖基化苏氨酸残基、位置463处谷氨酸残基、位置465处丝氨酸残基、位置469处丝氨酸残基和/或位置477处缬氨酸残基的存在。
[0154]
一些实施方案提供了对o-甘露糖基化e-钙黏素具有特异性的抗体及其抗原结合片段,并且其中所述抗体或抗原结合片段与所述e-钙黏素的结合依赖于如图1a中描绘的e-钙黏素氨基酸区域467-472内一个或多个o-甘露糖基化苏氨酸残基的存在。在一些实施方案中,所述抗体或抗原结合片段依赖于如图1a中描绘的e-钙黏素序列的位置467处o-甘露糖基化苏氨酸残基、和/或位置468处o-甘露糖基化苏氨酸残基、和/或位置470处o-甘露糖基化苏氨酸残基、和/或位置472处o-甘露糖基化苏氨酸残基的存在。在一些实施方案中,所述抗体或抗原结合片段依赖于如图1a中描绘的e-钙黏素序列的位置468处o-甘露糖基化苏氨酸残基和位置470处o-甘露糖基化苏氨酸残基的存在。在一些实施方案中,所述抗体或抗原结合片段依赖于如图1a中描绘的e-钙黏素序列的位置467处o-甘露糖基化苏氨酸残基、和位置468处o-甘露糖基化苏氨酸残基、和位置470处o-甘露糖基化苏氨酸残基的存在。在一些实施方案中,所述抗体或抗原结合片段依赖于如图1a中描绘的e-钙黏素序列的位置467处o-甘露糖基化苏氨酸残基、和位置468处o-甘露糖基化苏氨酸残基、和位置470处o-甘露糖基化苏氨酸残基、和位置472处o-甘露糖基化苏氨酸残基的存在。在一些实施方案中,所述抗体或抗原结合片段与所述e-钙黏素的结合依赖于如图1a中描绘的e-钙黏素序列的位置463处谷氨酸残基、和/或位置465处丝氨酸残基、和/或位置469处丝氨酸残基、和/或位置477处缬氨酸残基的存在。在一些实施方案中,位置465和/或位置469处的所述丝氨酸残基是o-甘露糖基化的。
[0155]
如本文所用,如果用丙氨酸置换某一氨基酸残基使抗体或抗原结合片段与其抗原的结合降低至少40%、优选地至少50%、优选地至少60%、优选地至少70%、优选地至少80%、优选地至少85%、更优选地至少90%、更优选地至少95%,则所述抗体或抗原结合片段的结合“依赖于”所述氨基酸残基。
[0156]
一些实施方案提供了根据本发明的抗体或抗原结合片段,其对o-甘露糖基化e-钙黏素具有特异性,并且特异性结合如图1a中描绘的e-钙黏素序列的位置467处的o-甘露糖
基化苏氨酸残基、和/或位置468处的o-甘露糖基化苏氨酸残基、和/或位置470处的o-甘露糖基化苏氨酸残基、和/或位置472处的o-甘露糖基化苏氨酸残基、和/或位置463处的谷氨酸残基、和/或位置465处的丝氨酸残基、和/或位置469处的丝氨酸残基和/或位置477处的缬氨酸残基。在一些实施方案中,位置465和/或位置469处的所述丝氨酸残基是o-甘露糖基化的。
[0157]
本发明的一些实施方案提供了一种抗体或其抗原结合片段,其对o-甘露糖基化e-钙黏素具有特异性,并且特异性结合e-钙黏素的一个或多个o-甘露糖基化苏氨酸残基,其中所述一个或多个o-甘露糖基化苏氨酸残基存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内。
[0158]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合选自由以下组成的组的一个或多个o-甘露糖基化苏氨酸残基:如图1a中描绘的e-钙黏素序列的位置467处的o-甘露糖基化苏氨酸残基、位置468处的o-甘露糖基化苏氨酸残基、位置470处的o-甘露糖基化苏氨酸残基、和位置472处的o-甘露糖基化苏氨酸残基。一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的位置467处的o-甘露糖基化苏氨酸残基。一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的位置468处的o-甘露糖基化苏氨酸残基。一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的位置470处的o-甘露糖基化苏氨酸残基。一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的如图1a中描绘的e-钙黏素序列的位置472处的o-甘露糖基化苏氨酸残基。
[0159]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的位置468处的o-甘露糖基化苏氨酸残基和位置470处的o-甘露糖基化苏氨酸残基。
[0160]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的位置467处的o-甘露糖基化苏氨酸残基、和位置468处的o-甘露糖基化苏氨酸残基、和位置470处的o-甘露糖基化苏氨酸残基。
[0161]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的位置467处的o-甘露糖基化苏氨酸残基、和位置468处的o-甘露糖基化苏氨酸残基、和位置470处的o-甘露糖基化苏氨酸残基、和位置472处的o-甘露糖基化苏氨酸残基。
[0162]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的包含t468和t470的e-钙黏素区域,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,两个苏氨酸残基均是o-甘露糖基化的。
[0163]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的包含t467、t468和t470的e-钙黏素区域,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的两个是o-甘露糖基化的。在一些实施方案中,全部三个苏氨酸残基是o-甘露糖基化的。
[0164]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的包含t467、t468、t470和t472的e-钙黏素区域,其中所述苏氨酸残基是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的两个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的三个是o-甘露糖基化的。在一些实施方案中,全部四个苏氨酸残基
是o-甘露糖基化的。
[0165]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的包含t468、s469和t470的e-钙黏素区域,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,两个苏氨酸残基均是o-甘露糖基化的。在一些实施方案中,所述丝氨酸残基是o-甘露糖基化的。
[0166]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的包含t467、t468、s469和t470的e-钙黏素区域,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少两个是o-甘露糖基化的。在一些实施方案中,全部所述苏氨酸残基是o-甘露糖基化的。在一些实施方案中,所述丝氨酸残基是o-甘露糖基化的。
[0167]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的包含s465、t467、t468、s469和t470的e-钙黏素区域,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少两个是o-甘露糖基化的。在一些实施方案中,全部所述苏氨酸残基是o-甘露糖基化的。在一些实施方案中,至少一个丝氨酸残基是o-甘露糖基化的。在一些实施方案中,两个丝氨酸残基均是o-甘露糖基化的。
[0168]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的包含s465、t467、t468、s469、t470和t472的e-钙黏素区域,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少两个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少三个是o-甘露糖基化的。在一些实施方案中,全部所述苏氨酸残基是o-甘露糖基化的。在一些实施方案中,至少一个丝氨酸残基是o-甘露糖基化的。在一些实施方案中,两个丝氨酸残基均是o-甘露糖基化的。
[0169]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的包含e463、s465、t467、t468、s469、t470和t472的e-钙黏素区域,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少两个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少三个是o-甘露糖基化的。在一些实施方案中,全部所述苏氨酸残基是o-甘露糖基化的。在一些实施方案中,至少一个丝氨酸残基是o-甘露糖基化的。在一些实施方案中,两个丝氨酸残基均是o-甘露糖基化的。
[0170]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合如图1a中描绘的e-钙黏素序列的包含e463、s465、t467、t468、s469、t470、t472和v477的e-钙黏素区域,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少两个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少三个是o-甘露糖基化的。在一些实施方案中,全部所述苏氨酸残基是o-甘露糖基化的。在一些实施方案中,至少一个丝氨酸残基是o-甘露糖基化的。在一些实施方案中,两个丝氨酸残基均是o-甘露糖基化的。
[0171]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合包含序列tst的e-钙黏素的表位,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,两个苏氨酸残基均是o-甘露糖基化的。在一些实施方案中,所述丝氨酸残基是o-甘露糖基化
的。
[0172]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合包含序列ttst的e-钙黏素的表位,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少两个是o-甘露糖基化的。在一些实施方案中,全部所述苏氨酸残基是o-甘露糖基化的。在一些实施方案中,所述丝氨酸残基是o-甘露糖基化的。
[0173]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合包含序列sttst的e-钙黏素的表位,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少两个是o-甘露糖基化的。在一些实施方案中,全部所述苏氨酸残基是o-甘露糖基化的。在一些实施方案中,至少一个丝氨酸残基是o-甘露糖基化的。在一些实施方案中,两个丝氨酸残基均是o-甘露糖基化的。
[0174]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合包含序列sttstt的e-钙黏素的表位,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少两个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少三个是o-甘露糖基化的。在一些实施方案中,全部所述苏氨酸残基是o-甘露糖基化的。在一些实施方案中,至少一个丝氨酸残基是o-甘露糖基化的。在一些实施方案中,两个丝氨酸残基均是o-甘露糖基化的。
[0175]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合包含序列esttstt的e-钙黏素的表位,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少两个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少三个是o-甘露糖基化的。在一些实施方案中,全部所述苏氨酸残基是o-甘露糖基化的。在一些实施方案中,至少一个丝氨酸残基是o-甘露糖基化的。在一些实施方案中,两个丝氨酸残基均是o-甘露糖基化的。
[0176]
一些实施方案提供了抗体及其抗原结合片段,其特异性结合包含序列esttsttv的e-钙黏素的表位,其中所述苏氨酸残基中的至少一个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少两个是o-甘露糖基化的。在一些实施方案中,所述苏氨酸残基中的至少三个是o-甘露糖基化的。在一些实施方案中,全部所述苏氨酸残基是o-甘露糖基化的。在一些实施方案中,至少一个丝氨酸残基是o-甘露糖基化的。在一些实施方案中,两个丝氨酸残基均是o-甘露糖基化的。
[0177]
e-钙黏素在本领域中已知为cdh1基因的产物,其在人类中的分子量为约120kda。然而,本发明提供了令人意外的见解,即o-甘露糖基化的截短的e钙黏素形式也存在于自然界中。这种截短形式,分子量为约70kda,缺乏全长e-钙黏素的细胞外结构域ec1和ec2。细胞外结构域5、4和细胞外结构域ec3的一部分仍存在于截短的70kda形式中。本发明人提供了以下见解,即这种截短的70kda形式的e-钙黏素存在于多种上皮细胞的表面上,并且在肿瘤细胞上经常被上调。不受任何理论的束缚,据信70kda形式的e-钙黏素的上调促进肿瘤生长,尤其是因为截短的70kda形式刺激上皮间质转化(emt),如实施例中所示,从而增加肿瘤细胞的迁移和转移。此外,据信70kda形式的e-钙黏素的上调促进肿瘤的免疫逃逸机制,因为与120kda全长形式的e-钙黏素相比,截短的70kda形式的e-钙黏素结合免疫细胞的能力较低。根据本发明,o-甘露糖基化的70kda e-钙黏素形式的过表达可以促进逃避通过cd3或klrg1或cd103进行的免疫细胞识别并促进emt而不完全下调e-钙黏素。因此,肿瘤细胞上
70kda截短形式的上调可以减弱这些肿瘤细胞与免疫细胞之间的相互作用,从而帮助肿瘤逃避免疫应答。
[0178]
在一些实施方案中,本发明提供了抗体及其抗原结合部分,与熟知的约120kda的o-甘露糖基化全长e-钙黏素相比,其更好地结合以上所述的o-甘露糖基化的截短的70kda e-钙黏素。优选实施方案提供了抗体及其抗原结合部分,与o-甘露糖基化全长e-钙黏素相比,其至少2倍更好地、更优选地至少3倍更好地、更优选地至少4倍更好地、更优选地至少5倍更好地结合o-甘露糖基化的截短的70kda e-钙黏素。在截断的70kda e-钙黏素形式在肿瘤细胞上显著上调的情况下,这种特征允许增加肿瘤特异性并减少由健康组织结合引起的不良副作用。如本文所用,术语“全长e-钙黏素”是指已知的cdh1基因产物,其在人类中的分子量为约120kda,如例如在图1a中描绘。术语“截短的70kda e-钙黏素”或“70kda e-钙黏素形式”是指较小的e-钙黏素形式,其分子量在60与80kda之间,通常为约70kda,在自然界中也存在于上皮细胞的表面上。如图1c所示,这种天然存在的截短的e-钙黏素形式,分子量在60与80kda之间,缺乏全长e-钙黏素的细胞外结构域ec1和ec2。细胞外结构域5、4和细胞外结构域ec3的一部分仍存在于这种截短的70kda形式中。术语“o-甘露糖基化的截短的70kda e-钙黏素”是指以上提及的截短的70kda e-钙黏素蛋白,其包含至少一个o-甘露糖基化苏氨酸或丝氨酸残基,优选地至少一个如图1a中描绘的位置467、和/或位置468、和/或位置470处的o-甘露糖基化苏氨酸残基。
[0179]
在某些实施方案中,本发明的抗e-钙黏素抗体或抗原结合片段包含:
[0180]-包含氨基酸序列tpgvgx1nx2pyyfdr的重链可变区cdr3,其中x1是a或t,并且其中x2是d或n;和
[0181]-包含氨基酸序列qqysntpqt的轻链可变区cdr3。
[0182]
某些实施方案提供了一种抗体或其抗原结合片段,其能够结合o-甘露糖基化e-钙黏素,其中所述抗体或抗原结合片段包含以下中的一个或多个并且任选地每一个:
[0183]
a.包含氨基酸序列gfx1fsx2aw的重链可变区cdr1,其中x1是t或i,并且其中x2是n或y;
[0184]
b.包含氨基酸序列ikskidg x1t x2的重链可变区cdr2,其中x1是g或e,并且其中x2是t或i;
[0185]
c.包含氨基酸序列tpgvgx1nx2pyyfdr的重链可变区cdr3,其中x1是a或t,并且其中x2是d或n;
[0186]
d.包含氨基酸序列qsvlcrsnnknc的轻链可变区cdr1;
[0187]
e.包含氨基酸序列wax1的轻链可变区cdr2,其中x1是s或c;
[0188]
f.包含氨基酸序列qqysntpqt的轻链可变区cdr3;
[0189]
或包含通过1、2或3个保守取代而不同于所述qqysntpqt序列的氨基酸序列的轻链可变区cdr3。
[0190]
任选地,将保守氨基酸取代应用于以上提及的cdr序列中的至少一个。在一些实施方案中,所述保守取代包括用相同氨基酸类别的另一个氨基酸残基取代如表2中描绘的氨基酸类别的一个或多个氨基酸残基。保守氨基酸取代的非限制性实例包括一个疏水性残基诸如异亮氨酸、缬氨酸、亮氨酸或甲硫氨酸被另一个疏水性残基取代,以及一个极性残基被另一个极性残基取代,诸如精氨酸被赖氨酸取代,谷氨酸被天冬氨酸取代,或谷氨酰胺被天
冬酰胺取代。优选地,在保守氨基酸取代之后,亲本抗体的有利的e-钙黏素结合特征得以维持甚至改善。优选地,此类变体的cdr序列与亲本序列的不同之处不超过三个、优选地不超过两个、优选地不超过一个氨基酸。
[0191]
因此,一些实施方案提供了本发明的抗e-钙黏素抗体或抗原结合片段,其包含:
[0192]-包含氨基酸序列tpgvgx1nx2pyyfdr的重链可变区cdr3,其中x1是a或t,并且其中x2是d或n;或包含通过1、2或3个保守取代而不同于所述tpgvgx1nx2pyyfdr序列的氨基酸序列的重链可变区cdr3;以及
[0193]-包含氨基酸序列qqysntpqt的轻链可变区cdr3,或包含通过1、2或3个保守取代而不同于所述qqysntpqt序列的氨基酸序列的轻链可变区cdr3。
[0194]
还提供了一种抗体或其抗原结合片段,其能够结合o-甘露糖基化e-钙黏素,其中所述抗体或抗原结合片段包含以下中的一个或多个并且任选地每一个:
[0195]
a.包含氨基酸序列gfx1fsx2aw的重链可变区cdr1,其中x1是t或i,并且其中x2是n或y;
[0196]
或包含通过1、2或3个保守取代而不同于所述gfx1fsx2aw序列的氨基酸序列的重链可变区cdr1;
[0197]
b.包含氨基酸序列ikskidgx1tx2的重链可变区cdr2,其中x1是g或e,并且其中x2是t或i;
[0198]
或包含通过1、2或3个保守取代而不同于所述ikskidgx1tx2序列的氨基酸序列的重链可变区cdr2;
[0199]
c.包含氨基酸序列tpgvgx1nx2pyyfdr的重链可变区cdr3,其中x1是a或t,并且其中x2是d或n;
[0200]
或包含通过1、2或3个保守取代而不同于所述tpgvgx1nx2pyyfdr序列的氨基酸序列的重链可变区cdr3;
[0201]
d.包含氨基酸序列qsvlcrsnnknc的轻链可变区cdr1;
[0202]
或包含通过1、2或3个保守取代而不同于所述qsvlcrsnnknc序列的氨基酸序列的轻链可变区cdr1;
[0203]
e.包含氨基酸序列wax1的轻链可变区cdr2,其中x1是s或c;
[0204]
或包含通过1、2或3个保守取代而不同于所述wax1序列的氨基酸序列的轻链可变区cdr2;
[0205]
f.包含氨基酸序列qqysntpqt的轻链可变区cdr3;
[0206]
或包含通过1、2或3个保守取代而不同于所述qqysntpqt序列的氨基酸序列的轻链可变区cdr3。
[0207]
表1提供了根据本发明的优选抗体的序列。这些优选抗体在本文中被称为抗体at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。这些抗体结合o-甘露糖基化e-钙黏素,特别是新发现的约70kda的截短的e-钙黏素形式,如上文所述。这些优选抗体的重链和轻链cdr序列依照cdr序列gfx1fsx2aw、ikskidgx1tx2、tpgvgx1nx2pyyfdr、qsvlcrsnnknc、wax1和qqysntpqt,如以上a)至f)中所述。
[0208]
如本文所用,术语“at1636”、“e-c06”、“d-h04”、“d-a02”、“d-e09”、“e-a04”、“e-b09”、“c-a05”、“c-a03”、“c-b02”、“c-d04-a”、“c-d04-b”、“f-c08”、“d-g03”、“d-f10”、“c-e08”、“d-b06”、“d-g05”、“d-h08”、“c-h01”、“d-c12”、“d-c11”、“e-c10”、“at1636-i”、“at1636-y”、“at1636-e”、“at1636-n”、“at1636-yn”、“at1636-iyn”和“at1636-iyen”涵盖至少具有如表1中描绘的这些抗体的重链和轻链cdr1-3区、优选地重链和轻链可变区的所有抗体和抗原结合片段。
[0209]
基于表1中描绘的抗体,可能产生结合o-甘露糖基化e-钙黏素并且包含表1中描绘的抗体的至少一个cdr序列的抗体或其抗原结合片段。因此,提供了一种抗体或其抗原结合片段,其包含如表1中描绘的抗体的至少一个cdr序列。所述cdr序列优选地是如表1中描绘的抗体的cdr3序列。在一些实施方案中,提供了一种抗体或抗原结合片段,其包含如表1中描绘的抗体的重链cdr3序列和轻链cdr3序列。因此,一些实施方案提供了一种抗体或其抗原结合片段,其包含选自由以下组成的组的抗体的重链和轻链cdr3序列:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。
[0210]
一些实施方案提供了一种抗体或其抗原结合片段,其结合o-甘露糖基化e-钙黏素并且包含如表1中描绘的一个或多个抗体的重链cdr 1-3序列。
[0211]
在一些实施方案中,提供了一种抗体或抗原结合片段,其包含表1中指示的相同抗体的重链cdr1、cdr2和cdr3序列。因此,根据此实施方案,抗体at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn或at1636-iyen的重链cdr1、cdr2和cdr3序列共同存在于一个抗体或抗原结合片段中。这种抗体或抗原结合片段还可以包含共同轻链,其在本文中定义为能够与多个不同重链在功能上配对的轻链,由此维持所述重链的抗原特异性。这种方法是基于熟知的事实,即重链经常是亲和力和特异性的主要驱动因素。共同轻链与给定重链的配对通常提供有利的构象,而这种共同轻链对抗原特异性没有显著贡献。
[0212]
在一些实施方案中,根据本发明的抗体或抗原结合片段包含表1中描绘的相同抗体的所有三个重链cdr和所有三个轻链cdr。因此,还提供了一种抗体或其抗原结合片段,其包含选自由以下组成的组的抗体的重链和轻链cdr1-3序列:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。
[0213]
抗体at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen的重链可变区(vh)和轻链可变区(vl)也在表1中描绘。基于这些vh和/或vl序列,还可能产生结合o-甘露糖基化e-钙黏素并且包含表1中描绘的抗体的重链可变区(vh)和/或轻链可变区(vl)或与其具有至少80%序列同一性的序列的抗体或其抗原结合片段。通常,在维持抗原特异性的同时,尤其是当cdr区域保持不变时,允许80%与99%之间的vh和vl序列变异。因
此,本文还提供了抗体和抗原结合片段,其包含与如表1中描绘的vh或vl序列具有至少80%序列同一性的vh或vl序列。
[0214]
因此,提供了一种抗体或其抗原结合片段,其包含表1中描绘的抗体的重链可变区(vh)或与其具有至少80%序列同一性的序列。还提供了一种抗体或其抗原结合片段,其包含表1中描绘的抗体的轻链可变区(vl)或与其具有至少80%序列同一性的序列。一些实施方案提供了一种抗体或其抗原结合片段,其包含表1中描绘的抗体的重链可变区(vh)和轻链可变区(vl)或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种抗体或其抗原结合片段,其包含表1中描绘的抗体的重链可变区(vh)和/或轻链可变区(vl)或与其具有至少80%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体的重链cdr3序列和轻链cdr3序列。优选地,所述抗体或抗原结合片段包含如表1中描绘的抗体的重链cdr 1-3序列和轻链cdr1-3序列。
[0215]
例如,在一些实施方案中,表1中描绘的vh或vl序列的一个或多个框架残基被修饰以降低免疫原性和/或以增加所得抗体或抗原结合片段的结合功效或稳定性。框架序列例如通过使编码这种框架序列的核酸分子突变来优化,其中之后优选地测试所得抗体或其抗原结合片段的特征。以这种方式,可能获得改善的结合化合物。
[0216]
在一些实施方案中,将一个或多个框架残基突变回从中衍生抗体at1636的种系序列以降低免疫原性。用于将给定抗体的框架区与从中衍生抗体的种系序列进行比较的方法在本领域中是熟知的。
[0217]
在一些实施方案中,表1中描绘的vh或vl序列的一个或多个框架残基被修饰以去除一个或多个t细胞表位,从而降低所得抗体或抗原结合片段的潜在免疫原性。这被称为去免疫。用于使给定抗体或抗原结合片段的框架区去免疫的方法在本领域中也是熟知的,例如在de groot等人,2005中描述。
[0218]
在一些实施方案中,与如表1中描绘的vh或vl序列相比,如表1中描绘的所述vh或vl序列的框架残基的至多10个氨基酸残基被修饰。在一些实施方案中,如表1中描绘的vh或vl序列的框架残基的至多8个氨基酸残基被修饰。在一些实施方案中,如表1中描绘的vh或vl序列的框架残基的至多5个氨基酸残基被修饰。在一些实施方案中,如表1中描绘的vh或vl序列的框架残基的至多3或2个氨基酸残基被修饰。在一些实施方案中,如表1中描绘的vh或vl序列的框架残基的1个氨基酸残基被修饰。
[0219]
一些实施方案提供了根据本发明的能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:
[0220]-包含与选自由seq id no:1-17组成的组的vh序列具有至少80%序列同一性的序列的重链可变区;和/或
[0221]-包含与选自由seq id no:18-22组成的组的vl序列具有至少80%序列同一性的序列的轻链可变区。
[0222]
根据本发明的优选抗体是抗体at1636。此抗体是优选的,因为它能够结合在肿瘤
细胞上表达的o-甘露糖基化e-钙黏素,特别是新发现的约70kda的截短的e-钙黏素形式,如上文所述。at1636的特定优点是以下事实,即与约120kda的全长e-钙黏素相比,它更好地结合此截短的70kda e-钙黏素形式。在o-甘露糖基化的截短的70kda e-钙黏素在肿瘤细胞上上调的情况下,at1636的此特征通常允许增加肿瘤特异性。at1636对截短的70kda e-钙黏素形式具有偏好的另一个优点是全长e-钙黏素被广泛地表达。因此,在对截短的70kda e-钙黏素形式的偏好不存在的情况下,广泛表达的全长e-钙黏素可能充当槽(sink)和/或引入不希望的影响。此外,全长e-钙黏素的表达水平非常高,并且因此经常在健康与肿瘤上皮细胞之间无法区分,而对截短的70kda e-钙黏素形式的偏好允许更多的肿瘤特异性。另外,e-钙黏素具有重要的屏障功能,所以优选避免显著干扰e-钙黏素的健康功能。
[0223]
此外,at1636来源于患有具有转移的iv期结肠癌转移但已经化疗之后完全缓解多年(这指示治疗功效)的人类个体。有趣的是,at1636具有igg3同种型。人氨基酸序列的存在减少了在人患者的治疗使用期间出现不良副作用的机会。
[0224]
另外,选择at1636是因为它能够结合表达o-甘露糖基化e-钙黏素的结肠癌亚型cms1、cms2、cms3和cms4。at1636与肿瘤细胞,具体地上皮肿瘤细胞,更具体地表达o-甘露糖基化e-钙黏素的癌细胞结合,所述癌细胞例如像表达o-甘露糖基化e-钙黏素的结肠癌细胞、乳腺癌细胞、胰腺癌细胞、膀胱癌细胞、子宫内膜癌细胞、肺癌细胞和食管癌细胞,如实施例中所示。因此,抗体at1636特别适于治疗和/或诊断与表达o-甘露糖基化e-钙黏素的细胞的存在相关联的病症,所述细胞诸如表达o-甘露糖基化e-钙黏素的癌细胞,特别是表达新发现的约70kda的截短的e-钙黏素形式的癌细胞。
[0225]
表1中描绘的抗体e-c10、d-c12和d-c11具有与at1636相同的重链和轻链cdr 1-3序列,并且因此具有相同的结合特异性。这些抗体也是根据本发明的优选抗体,尤其是因为它们能够结合在细胞上表达的o-甘露糖基化e-钙黏素,特别是如本文所述的新发现的约70kda的截短的e-钙黏素形式,更特别地存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基,并且因此它们非常适于治疗和/或诊断与表达这种o-甘露糖基化e-钙黏素的细胞,特别是癌细胞的存在相关联的病症。人氨基酸序列的存在减少了在人患者的治疗使用期间出现不良副作用的机会。
[0226]
如表1中描绘的抗体at1636、e-c10、d-c12和d-c11的重链cdr1-3序列是gftfsnaw、ikskidggtt和tpgvgandpyyfdr。这些抗体at1636、e-c10、d-c12和d-c11的轻链cdr1-3序列是qsvlcrsnnknc、was和qqysntpqt。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gftfsnaw的重链cdr1、和包含序列ikskidggtt的重链cdr2、和包含序列tpgvgandpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列was的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0227]
抗体at1636的vh序列在表1中描绘为seq id no:1。抗体at1636的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:1中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至
少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:1中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体at1636的重链cdr 1-3序列和轻链cdr 1-3序列。
[0228]
抗体e-c10的vh序列在表1中描绘为seq id no:1。抗体e-c10的vl序列在表1中描绘为seq id no:22。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:1中描绘的vh序列和如seq id no:22中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:1中描绘的vh序列和如seq id no:22中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体e-c10的重链cdr 1-3序列和轻链cdr 1-3序列。
[0229]
抗体d-c12的vh序列在表1中描绘为seq id no:13。抗体d-c12的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:13中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:13中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体d-c12的重链cdr 1-3序列和轻链cdr 1-3序列。
[0230]
抗体d-c11的vh序列在表1中描绘为seq id no:14。抗体d-c11的vl序列在表1中描
绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:14中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:14中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体d-c11的重链cdr 1-3序列和轻链cdr 1-3序列。
[0231]
还提供了一种抗体或其抗原结合片段,其与抗体at1636、或e-c10、或d-c12、或d-c11竞争结合o-甘露糖基化e-钙黏素,优选地竞争结合存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基。
[0232]
还提供了一种抗体或其抗原结合片段,其与抗体at1636、或e-c10、或d-c12、或d-c11竞争结合包含o-甘露糖基化e-钙黏素的细胞、优选地o-甘露糖基化e-钙黏素阳性肿瘤细胞。所述细胞优选地在其表面上表达o-甘露糖基化e-钙黏素。
[0233]
还提供了一种抗体或其抗原结合片段,其与抗体at1636、或e-c10、或d-c12、或d-c11竞争结合表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞。
[0234]
表1中描绘的抗体e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、at1636-i、at1636-y、at1636-e和at1636-n也是根据本发明的优选抗体。这些抗体也能够结合在细胞上表达的o-甘露糖基化e-钙黏素,特别是新发现的约70kda的截短的e-钙黏素形式,更特别地存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基,并且因此非常适于治疗和/或诊断与表达这种o-甘露糖基化e-钙黏素的细胞,特别是癌细胞的存在相关联的病症。这些抗体中人氨基酸序列的存在减少了在人患者的治疗使用期间出现不良副作用的机会。
[0235]
表1中描绘的抗体e-c06、d-h04、d-a02、d-e09、e-a04、e-b09和at1636-i的重链cdr1-3序列是gfifsnaw、ikskidggtt和tpgvgandpyyfdr。这些抗体e-c06、d-h04、d-a02、d-e09、e-a04、e-b09和at1636-i的轻链cdr1-3序列是qsvlcrsnnknc、was和qqysntpqt。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gfifsnaw的重链cdr1、和包含序列ikskidggtt的重链cdr2、和包含序列tpgvgandpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列was的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0236]
抗体e-c06和d-h04的vh序列在表1中描绘为seq id no:2。抗体e-c06和d-h04的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化
e-钙黏素的抗体或抗原结合片段,其包含如seq id no:2中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:2中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体e-c06或d-h04的重链cdr 1-3序列和轻链cdr 1-3序列。
[0237]
抗体d-a02、d-e09、e-a04、e-b09和at1636-i的vh序列在表1中描绘为seq id no:3。抗体d-a02、d-e09、e-a04、e-b09和at1636-i的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:3中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:3中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体d-a02、d-e09、e-a04、e-b09或at1636-i的重链cdr 1-3序列和轻链cdr 1-3序列。
[0238]
还提供了一种抗体或其抗原结合片段,其与抗体e-c06、或d-h04、或d-a02或d-e09、或e-a04、或e-b09、或at1636-i竞争与o-甘露糖基化e-钙黏素结合,优选地竞争与存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基结合。
[0239]
还提供了一种抗体或其抗原结合片段,其与抗体e-c06、或d-h04、或d-a02或d-e09、或e-a04、或e-b09、或at1636-i竞争与包含o-甘露糖基化e-钙黏素的细胞、优选地o-甘露糖基化e-钙黏素阳性肿瘤细胞结合。所述细胞优选地在其表面上表达o-甘露糖基化e-钙黏素。
[0240]
还提供了一种抗体或其抗原结合片段,其与抗体e-c06、或d-h04、或d-a02、或d-e09、或e-a04、或e-b09、或at1636-i竞争与表达e-钙黏素和o-甘露糖基转移酶、优选地
tmtc3的细胞、优选地肿瘤细胞结合。
[0241]
表1中描绘的抗体c-a05的重链cdr1-3序列是gfifsnaw、ikskidgett和tpgvgandpyyfdr。此抗体c-a05的轻链cdr1-3序列是qsvlcrsnnknc、was和qqysntpqt。
[0242]
因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gfifsnaw的重链cdr1、和包含序列ikskidgett的重链cdr2、和包含序列tpgvgandpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列was的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0243]
抗体c-a05的vh序列在表1中描绘为seq id no:4。抗体c-a05的vl序列在表1中描绘为seq id no:19。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:4中描绘的vh序列和如seq id no:19中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:4中描绘的vh序列和如seq id no:19中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体c-a05的重链cdr 1-3序列和轻链cdr 1-3序列。
[0244]
还提供了一种抗体或其抗原结合片段,其与抗体c-a05竞争与o-甘露糖基化e-钙黏素结合,优选地竞争与存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基结合。
[0245]
还提供了一种抗体或其抗原结合片段,其与抗体c-a05竞争与包含o-甘露糖基化e-钙黏素的细胞、优选地o-甘露糖基化e-钙黏素阳性肿瘤细胞结合。所述细胞优选地在其表面上表达o-甘露糖基化e-钙黏素。
[0246]
还提供了一种抗体或其抗原结合片段,其与抗体c-a05竞争与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞结合。
[0247]
表1中描绘的抗体c-a03、c-b02和at1636-e的重链cdr1-3序列是gftfsnaw、ikskidgett和tpgvgandpyyfdr。这些抗体c-a03、c-b02和at1636-e的轻链cdr1-3序列是qsvlcrsnnknc、was和qqysntpqt。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gftfsnaw的重链cdr1、和包含序列ikskidgett的重链cdr2、和包含序列tpgvgandpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列was的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0248]
抗体c-a03、c-b02和at1636-e的vh序列在表1中描绘为seq id no:5。抗体c-a03、c-b02和at1636-e的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:5中描绘的
vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:5中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体c-a03、或c-b02、或at1636-e的重链cdr1-3序列和轻链cdr 1-3序列。
[0249]
还提供了一种抗体或其抗原结合片段,其与抗体c-a03、或c-b02、或at1636-e竞争与o-甘露糖基化e-钙黏素结合,优选地竞争与存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基结合。
[0250]
还提供了一种抗体或其抗原结合片段,其与抗体c-a03、或c-b02、或at1636-e竞争与包含o-甘露糖基化e-钙黏素的细胞、优选地o-甘露糖基化e-钙黏素阳性肿瘤细胞结合。所述细胞优选地在其表面上表达o-甘露糖基化e-钙黏素。
[0251]
还提供了一种抗体或其抗原结合片段,其与抗体c-a03、或c-b02、或at1636-e竞争与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞结合。
[0252]
表1中描绘的抗体c-d04-a的重链cdr1-3序列是gftfsnaw、ikskidgett和tpgvgannpyyfdr。此抗体c-d04-a的轻链cdr1-3序列是qsvlcrsnnknc、was和qqysntpqt。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gftfsnaw的重链cdr1、和包含序列ikskidgett的重链cdr2、和包含序列tpgvgannpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列was的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0253]
抗体c-d04-a的vh序列在表1中描绘为seq id no:6。抗体c-d04-a的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:6中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:6中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少
93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体c-d04-a的重链cdr 1-3序列和轻链cdr 1-3序列。
[0254]
还提供了一种抗体或其抗原结合片段,其与抗体c-d04-a竞争与o-甘露糖基化e-钙黏素结合,优选地竞争与存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基结合。
[0255]
还提供了一种抗体或其抗原结合片段,其与抗体c-d04-a竞争与包含o-甘露糖基化e-钙黏素的细胞、优选地o-甘露糖基化e-钙黏素阳性肿瘤细胞结合。所述细胞优选地在其表面上表达o-甘露糖基化e-钙黏素。
[0256]
还提供了一种抗体或其抗原结合片段,其与抗体c-d04-a竞争与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞结合。
[0257]
表1中描绘的抗体c-d04-b的重链cdr1-3序列是gftfsnaw、ikskidgett和tpgvgannpyyfdr。此抗体c-d04-b的轻链cdr1-3序列是qsvlcrsnnknc、wac和qqysntpqt。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gftfsnaw的重链cdr1、和包含序列ikskidgett的重链cdr2、和包含序列tpgvgannpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列wac的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0258]
抗体c-d04-b的vh序列在表1中描绘为seq id no:6。抗体c-d04-b的vl序列在表1中描绘为seq id no:20。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:6中描绘的vh序列和如seq id no:20中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:6中描绘的vh序列和如seq id no:20中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体c-d04-b的重链cdr 1-3序列和轻链cdr 1-3序列。
[0259]
还提供了一种抗体或其抗原结合片段,其与抗体c-d04-b竞争与o-甘露糖基化e-钙黏素结合,优选地竞争与存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基结合。
[0260]
还提供了一种抗体或其抗原结合片段,其与抗体c-d04-b竞争与包含o-甘露糖基化e-钙黏素的细胞、优选地o-甘露糖基化e-钙黏素阳性肿瘤细胞结合。所述细胞优选地在其表面上表达o-甘露糖基化e-钙黏素。
[0261]
还提供了一种抗体或其抗原结合片段,其与抗体c-d04-b竞争与表达e-钙黏素和
o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞结合。
[0262]
表1中描绘的抗体f-c08、d-g03和at1636-n的重链cdr1-3序列是gftfsnaw、ikskidggtt和tpgvgannpyyfdr。这些抗体f-c08、d-g03和at1636-n的轻链cdr1-3序列是qsvlcrsnnknc、was和qqysntpqt。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gftfsnaw的重链cdr1、和包含序列ikskidggtt的重链cdr2、和包含序列tpgvgannpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列was的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0263]
抗体f-c08的vh序列在表1中描绘为seq id no:7。抗体f-c08的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:7中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:7中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体f-c08的重链cdr 1-3序列和轻链cdr 1-3序列。
[0264]
抗体d-g03和at1636-n的vh序列在表1中描绘为seq id no:8。抗体d-g03和at1636-n的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:8中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:8中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体d-g03或at1636-n的重链cdr 1-3序列和轻链cdr 1-3序列。
[0265]
还提供了一种抗体或其抗原结合片段,其与抗体f-c08、或d-g03、或at1636-n竞争
甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gftfsyaw的重链cdr1、和包含序列ikskidggtt的重链cdr2、和包含序列tpgvgandpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列was的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0274]
抗体c-e08、d-b06和at1636-y的vh序列在表1中描绘为seq id no:10。抗体c-e08、d-b06和at1636-y的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:10中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:10中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体c-e08、或d-b06、或at1636-y的重链cdr1-3序列和轻链cdr 1-3序列。
[0275]
抗体d-g05的vh序列在表1中描绘为seq id no:10。抗体d-g05的vl序列在表1中描绘为seq id no:21。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:10中描绘的vh序列和如seq id no:21中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:10中描绘的vh序列和如seq id no:21中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体d-g05的重链cdr 1-3序列和轻链cdr 1-3序列。
[0276]
抗体d-h08的vh序列在表1中描绘为seq id no:11。抗体d-h08的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:11中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少
90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:11中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体d-h08的重链cdr 1-3序列和轻链cdr 1-3序列。
[0277]
还提供了一种抗体或其抗原结合片段,其与抗体c-e08、或d-b06、或d-g05、或d-h08、或at1636-y竞争与o-甘露糖基化e-钙黏素结合,优选地竞争与存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基结合。
[0278]
还提供了一种抗体或其抗原结合片段,其与抗体c-e08、或d-b06、或d-g05、或d-h08、或at1636-y竞争与包含o-甘露糖基化e-钙黏素的细胞、优选地o-甘露糖基化e-钙黏素阳性肿瘤细胞结合。所述细胞优选地在其表面上表达o-甘露糖基化e-钙黏素。
[0279]
还提供了一种抗体或其抗原结合片段,其与抗体c-e08、或d-b06、或d-g05、或d-h08、或at1636-y竞争与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞结合。
[0280]
表1中描绘的抗体c-h01的重链cdr1-3序列是gftfsnaw、ikskidggti和tpgvgandpyyfdr。此抗体c-h01的轻链cdr1-3序列是qsvlcrsnnknc、was和qqysntpqt。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gftfsnaw的重链cdr1、和包含序列ikskidggti的重链cdr2、和包含序列tpgvgandpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列was的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0281]
抗体c-h01的vh序列在表1中描绘为seq id no:12。抗体c-h01的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:12中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:12中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中
描绘的抗体c-h01的重链cdr 1-3序列和轻链cdr 1-3序列。
[0282]
还提供了一种抗体或其抗原结合片段,其与抗体c-h01竞争与o-甘露糖基化e-钙黏素结合,优选地竞争与存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基结合。
[0283]
还提供了一种抗体或其抗原结合片段,其与抗体c-h01竞争与包含o-甘露糖基化e-钙黏素的细胞、优选地o-甘露糖基化e-钙黏素阳性肿瘤细胞结合。所述细胞优选地在其表面上表达o-甘露糖基化e-钙黏素。
[0284]
还提供了一种抗体或其抗原结合片段,其与抗体c-h01竞争与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞结合。
[0285]
根据本发明的另一个优选抗体是抗体at1636-yn。此抗体是优选的,因为它能够结合在肿瘤细胞上表达的o-甘露糖基化e-钙黏素,特别是新发现的约70kda的截短的e-钙黏素形式。at1636-yn的特定优点是以下事实,即与约120kda的全长e-钙黏素相比,它更好地结合此截短的70kda e-钙黏素形式。如上文所述,在o-甘露糖基化的截短的70kda e-钙黏素在肿瘤细胞上上调的情况下,此特征通常允许增加肿瘤特异性。at1636-yn对截短的70kda e-钙黏素形式具有偏好的另一个优点是全长e-钙黏素被广泛地表达。因此,在不存在对截短的70kda e-钙黏素形式的偏好的情况下,广泛表达的全长e-钙黏素可能充当槽和/或引入不希望的影响。此外,全长e-钙黏素的表达水平非常高,并且因此经常在健康与肿瘤上皮细胞之间无法区分,而对截短的70kda e-钙黏素形式的偏好允许更多的肿瘤特异性。另外,e-钙黏素具有重要的屏障功能,所以优选避免显著干扰e-钙黏素的健康功能。
[0286]
另外,at1636-yn能够结合表达o-甘露糖基化e-钙黏素的结肠癌亚型cms1、cms2、cms3和cms4。at1636-yn与肿瘤细胞,具体地上皮肿瘤细胞,更具体地表达o-甘露糖基化e-钙黏素的癌细胞结合,所述癌细胞例如像表达o-甘露糖基化e-钙黏素的结肠癌细胞、乳腺癌细胞、胰腺癌细胞、膀胱癌细胞、子宫内膜癌细胞、肺癌细胞和食管癌细胞。因此,抗体at1636-yn特别适于治疗和/或诊断与表达o-甘露糖基化e-钙黏素的细胞的存在相关联的病症,所述细胞诸如表达o-甘露糖基化e-钙黏素的癌细胞,特别是表达新发现的约70kda的截短的e-钙黏素形式的癌细胞。人氨基酸序列的存在减少了在人患者的治疗使用期间出现不良副作用的机会。
[0287]
此外,与抗体at1636相比,抗体at1636-yn更好地结合表皮样癌细胞系a431、肺癌细胞系a549和小鼠肿瘤细胞系cmt93(参见图6b)。
[0288]
表1中描绘的抗体at1636-yn的重链cdr1-3序列是gftfsyaw、ikskidggtt和tpgvgannpyyfdr。此抗体at1636-yn的轻链cdr1-3序列是qsvlcrsnnknc、was和qqysntpqt。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gftfsyaw的重链cdr1、和包含序列ikskidggtt的重链cdr2、和包含序列tpgvgannpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列was的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0289]
抗体at1636-yn的vh序列在表1中描绘为seq id no:15。抗体at1636-yn的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:15中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少
85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:15中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体at1636-yn的重链cdr 1-3序列和轻链cdr 1-3序列。
[0290]
还提供了一种抗体或其抗原结合片段,其与抗体at1636-yn竞争与o-甘露糖基化e-钙黏素结合,优选地竞争与存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基结合。
[0291]
还提供了一种抗体或其抗原结合片段,其与抗体at1636-yn竞争与包含o-甘露糖基化e-钙黏素的细胞、优选地o-甘露糖基化e-钙黏素阳性肿瘤细胞结合。所述细胞优选地在其表面上表达o-甘露糖基化e-钙黏素。
[0292]
还提供了一种抗体或其抗原结合片段,其与抗体at1636-yn竞争与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞结合。
[0293]
根据本发明的另一个优选抗体是抗体at1636-iyn。此抗体是优选的,因为它能够结合在肿瘤细胞上表达的o-甘露糖基化e-钙黏素,特别是新发现的约70kda的截短的e-钙黏素形式。at1636-iyn的特定优点是以下事实,即与约120kda的全长e-钙黏素相比,它更好地结合此截短的70kda e-钙黏素形式。如上文所述,在o-甘露糖基化的截短的70kda e-钙黏素在肿瘤细胞上上调的情况下,此特征通常允许增加肿瘤特异性。at1636-iyn对截短的70kda e-钙黏素形式具有偏好的另一个优点是全长e-钙黏素被广泛地表达。因此,在不存在对截短的70kda e-钙黏素形式的偏好的情况下,广泛表达的全长e-钙黏素可能充当槽和/或引入不希望的影响。此外,全长e-钙黏素的表达水平非常高,并且因此经常在健康与肿瘤上皮细胞之间无法区分,而对截短的70kda e-钙黏素形式的偏好允许更多的肿瘤特异性。另外,e-钙黏素具有重要的屏障功能,所以优选避免显著干扰e-钙黏素的健康功能。
[0294]
另外,at1636-iyn能够结合表达o-甘露糖基化e-钙黏素的结肠癌亚型cms1、cms2、cms3和cms4。at1636-iyn与肿瘤细胞,具体地上皮肿瘤细胞,更具体地表达o-甘露糖基化e-钙黏素的癌细胞结合,所述癌细胞例如像表达o-甘露糖基化e-钙黏素的结肠癌细胞、乳腺癌细胞、胰腺癌细胞、膀胱癌细胞、子宫内膜癌细胞、肺癌细胞和食管癌细胞。因此,抗体at1636-iyn特别适于治疗和/或诊断与表达o-甘露糖基化e-钙黏素的细胞的存在相关联的病症,所述细胞诸如表达o-甘露糖基化e-钙黏素的癌细胞,特别是表达新发现的约70kda的截短的e-钙黏素形式的癌细胞。人氨基酸序列的存在减少了在人患者的治疗使用期间出现不良副作用的机会。
[0295]
此外,与抗体at1636相比,抗体at1636-iyn更好地结合结肠细胞系dld1、乳腺上皮细胞系mcf10a、表皮样癌细胞系a431、肺癌细胞系a549和小鼠肿瘤细胞系cmt93(参见图6a
和6b)。
[0296]
表1中描绘的抗体at1636-iyn的重链cdr1-3序列是gfifsyaw、ikskidggtt和tpgvgannpyyfdr。此抗体at1636-iyn的轻链cdr1-3序列是qsvlcrsnnknc、was和qqysntpqt。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gfifsyaw的重链cdr1、和包含序列ikskidggtt的重链cdr2、和包含序列tpgvgannpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列was的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0297]
抗体at1636-iyn的vh序列在表1中描绘为seq id no:16。抗体at1636-iyn的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:16中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:16中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体at1636-iyn的重链cdr 1-3序列和轻链cdr 1-3序列。
[0298]
还提供了一种抗体或其抗原结合片段,其与抗体at1636-iyn竞争与o-甘露糖基化e-钙黏素结合,优选地竞争与存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基结合。
[0299]
还提供了一种抗体或其抗原结合片段,其与抗体at1636-iyn竞争与包含o-甘露糖基化e-钙黏素的细胞、优选地o-甘露糖基化e-钙黏素阳性肿瘤细胞结合。所述细胞优选地在其表面上表达o-甘露糖基化e-钙黏素。
[0300]
还提供了一种抗体或其抗原结合片段,其与抗体at1636-iyn竞争与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞结合。
[0301]
根据本发明的另一个优选抗体是抗体at1636-iyen。此抗体是优选的,因为它能够结合在肿瘤细胞上表达的o-甘露糖基化e-钙黏素,特别是新发现的约70kda的截短的e-钙黏素形式。at1636-iyen的特定优点是以下事实,即与约120kda的全长e-钙黏素相比,它更好地结合此截短的70kda e-钙黏素形式。如上文所述,在o-甘露糖基化的截短的70kda e-钙黏素在肿瘤细胞上上调的情况下,此特征通常允许增加肿瘤特异性。at1636-iyen对截短的70kda e-钙黏素形式具有偏好的另一个优点是全长e-钙黏素被广泛地表达。因此,在不存在对截短的70kda e-钙黏素形式的偏好的情况下,广泛表达的全长e-钙黏素可能充当槽和/或引入不希望的影响。此外,全长e-钙黏素的表达水平非常高,并且因此经常在健康与肿瘤上皮细胞之间无法区分,而对截短的70kda e-钙黏素形式的偏好允许更多的肿瘤特异
性。另外,e-钙黏素具有重要的屏障功能,所以优选避免显著干扰e-钙黏素的健康功能。
[0302]
另外,at1636-iyen能够结合表达o-甘露糖基化e-钙黏素的结肠癌亚型cms1、cms2、cms3和cms4。at1636-iyen与肿瘤细胞,具体地上皮肿瘤细胞,更具体地表达o-甘露糖基化e-钙黏素的癌细胞结合,所述癌细胞例如像表达o-甘露糖基化e-钙黏素的结肠癌细胞、乳腺癌细胞、胰腺癌细胞、膀胱癌细胞、子宫内膜癌细胞、肺癌细胞和食管癌细胞。因此,抗体at1636-iyen特别适于治疗和/或诊断与表达o-甘露糖基化e-钙黏素的细胞的存在相关联的病症,所述细胞诸如表达o-甘露糖基化e-钙黏素的癌细胞,特别是表达新发现的约70kda的截短的e-钙黏素形式的癌细胞。人氨基酸序列的存在减少了在人患者的治疗使用期间出现不良副作用的机会。
[0303]
此外,与抗体at1636相比,抗体at1636-iyen更好地结肠细胞系dld1、乳腺上皮细胞系mcf10a和小鼠肿瘤细胞系cmt93(参见图6a)。
[0304]
表1中描绘的抗体at1636-iyen的重链cdr1-3序列是gfifsyaw、ikskidgett和tpgvgannpyyfdr。此抗体at1636-iyen的轻链cdr1-3序列是qsvlcrsnnknc、was和qqysntpqt。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含:包含序列gfifsyaw的重链cdr1、和包含序列ikskidgett的重链cdr2、和包含序列tpgvgannpyyfdr的重链cdr3、和包含序列qsvlcrsnnknc的轻链cdr1、和包含序列was的轻链cdr2、和包含序列qqysntpqt的轻链cdr3。
[0305]
抗体at1636-iyen的vh序列在表1中描绘为seq id no:17。抗体at1636-iyen的vl序列在表1中描绘为seq id no:18。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:17中描绘的vh序列和如seq id no:18中描绘的vl序列、或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的抗体或抗原结合片段,其包含如seq id no:17中描绘的vh序列和如seq id no:18中描绘的vl序列或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列,其中所述抗体或抗原结合片段包含如表1中描绘的抗体at1636-iyen的重链cdr 1-3序列和轻链cdr 1-3序列。
[0306]
还提供了一种抗体或其抗原结合片段,其与抗体at1636-iyen竞争与o-甘露糖基化e-钙黏素结合,优选地竞争与存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内的一个或多个o-甘露糖基化苏氨酸残基结合。
[0307]
还提供了一种抗体或其抗原结合片段,其与抗体at1636-iyen竞争与包含o-甘露糖基化e-钙黏素的细胞、优选地o-甘露糖基化e-钙黏素阳性肿瘤细胞结合。所述细胞优选地在其表面上表达o-甘露糖基化e-钙黏素。
[0308]
还提供了一种抗体或其抗原结合片段,其与抗体at1636-iyen竞争与表达e-钙黏
素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞结合。
[0309]
在一些实施方案中,以上所述的抗体的重链和轻链cdr1-3序列由所记载的重链和轻链cdr1-3序列组成。
[0310]
在一些实施方案中,抗体at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn或at1636-iyen的重链和轻链cdr1-3序列接枝到不同抗体的框架序列上。所述框架序列优选地是人框架序列。人框架区的序列可从公共dna数据库获得。在一些优选实施方案中,人种系序列用于根据本发明的抗体和抗原结合片段中的框架区。人种系序列的使用使所述抗体的免疫原性风险最小化,因为这些种系序列通常没有可能引起免疫原性应答的体细胞超突变。
[0311]
在一些实施方案中,根据本发明的抗体或抗原结合片段是人抗体或其抗原结合片段。如非人抗体相比,人氨基酸序列的存在减少了在人患者的治疗使用期间出现不良副作用的机会。
[0312]
一些实施方案提供了根据本发明的抗体,其是全长抗体。因为它们的有利的半衰期,全长抗体是有利的。本发明的抗体优选地具有igg同种型。具体地,igg1因其在人体中较长的循环半衰期而受到青睐。此外,igg1抗体易于商业生产,并且它们的fc尾部允许实现效应子功能,像抗体依赖性细胞介导的细胞毒性(adcc)、补体依赖性细胞毒性(cdc)和抗体依赖性细胞吞噬作用(adcp)。为了防止人体内的免疫原性,优选根据本发明的抗体是人抗体或其抗原结合片段。
[0313]
如上文所述,抗体at1636具有igg3同种型。因为igg3同种型抗体具有聚集倾向,所以难以商业化开发,因此一些实施方案提供了包含抗体at1636的重链cdr1-3和轻链cdr1-3序列的igg1同种型抗体。一些实施方案提供了igg1抗体,其包含选自由以下组成的组的抗体的重链cdr1-3和轻链cdr1-3序列:抗体at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。
[0314]
一些实施方案提供了igg1抗体,其包含选自由以下组成的组的抗体的vh序列和vl序列、或与其具有至少80%、优选地至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%序列同一性的序列:抗体at1636、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。
[0315]
根据本发明的全长igg抗体涵盖其中存在提供所需特征的突变的抗体。此类突变不应是任何抗体区的实质性部分的缺失。然而,如上文所述,其中一个或若干个氨基酸残基缺失而基本上不改变所得抗体的结合特征的抗体仍包括在术语“全长抗体”内。例如,igg抗体在恒定区中可以具有1-20个氨基酸残基插入、缺失或其组合。例如,可以减少糖基化并且可以改变adcc或cdc活性,如下文所述。
[0316]
在一些实施方案中,根据本发明的抗体或抗原结合片段包含以下特征中的一种或多种并且优选地每一种:
[0317]-与o-甘露糖基化e-钙黏素的细胞外(ec)3结构域结合;
[0318]-与o-甘露糖基化全长e-钙黏素相比,更好地、优选至少2倍更好地、更优选地至少3倍更好地、更优选地至少4倍更好地、更优选地至少5倍更好地结合o-甘露糖基化的截短的70kda e-钙黏素;
[0319]-结合共表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的肿瘤细胞。
[0320]
在一些实施方案中,所述抗体或抗原结合片段还包含以下特征中的至少一种:
[0321]-结合结肠癌亚型cms1、cms2、cms3和cms4;
[0322]-与健康的髓质胸腺上皮细胞、或树突细胞、或朗格汉斯细胞相比,更好地结合结肠癌细胞系sw948。
[0323]
一些优选实施方案提供了根据本发明的抗体和抗原结合片段,其具有以上列出的每个特征。鉴于它们结合不同癌症类型和不同结肠癌亚型的能力,此类抗体和抗原结合片段具有广泛的抗肿瘤适用性。此外,如上文详细解释的,鉴于与全长e-钙黏素相比它们对截短的70kda e-钙黏素的偏好,在截短的70kda e-钙黏素形式在肿瘤细胞上显著上调的情况下,此类抗体和抗原结合片段适于增加肿瘤特异性。
[0324]
如实施例中所示,提供了特异性结合e-钙黏素的一个或多个o-甘露糖基化苏氨酸和/或丝氨酸残基的抗体,其中所述一个或多个o-甘露糖基化苏氨酸和/或丝氨酸残基存在于如图1a中描绘的e-钙黏素序列的氨基酸位置467-472内。由于知道了这一点,就有可能获得或生成竞争o-甘露糖基化e-钙黏素的相同表位的另外的抗体。例如,这可以通过用包含如图1a中描绘的e-钙黏素序列的以上提及的氨基酸残基467-472的o-甘露糖基化e-钙黏素肽、或用包含这种肽的免疫原性化合物、或用编码这种肽的核酸分子使非人动物免疫化、优选地接着进行一次或多次加强施用来完成。可替代地,可以用表达tmtc3和e-钙黏素的细胞使非人动物免疫化,以在细胞表面上表达o-甘露糖基化e-钙黏素。另外,可以通过所谓的dna免疫化技术用表达tmtc3和e-钙黏素两者的核酸(例如,像cdna)使非人类动物免疫化。
[0325]
随后,可以从所述非人动物中收获对所述表位或肽具有特异性的抗体和/或b细胞。在一些实施方案中,使获得的抗体人源化以将其优化而用于人类疗法。在一些实施方案中,针对与选自由以下组成的组的抗体或其抗原结合片段竞争与所述肽或与o-甘露糖基化e-钙黏素或与其70kda截短形式结合测试获得的抗体或b细胞:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。
[0326]
动物免疫化方案,包括合适的施用程序和佐剂、从此类免疫动物获得和纯化抗体和/或免疫细胞的程序、非人抗体的竞争实验和人源化程序在本领域中是熟知的。例如参考hanly等人,1995。
[0327]
可替代地或另外,所述肽或tmct3
–
e-钙黏素共表达细胞用于筛选噬菌体展示文库,以鉴定和/或分离o-甘露糖基化e-钙黏素特异性免疫球蛋白,通常是fab片段。获得的抗体、b细胞或fab片段通常将与选自由以下组成的组的抗体或其抗原结合片段竞争与所述肽或与o-甘露糖基化e-钙黏素或与其70kda截短形式结合:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。在一些实施方案中,进行竞争测定。
[0328]
本文还提供了编码根据本发明的抗体或抗原结合片段的至少一个cdr序列的核酸分子和载体。因此,一些实施方案提供了分离的、合成的或重组的核酸或载体,其编码根据本发明的抗体或抗原结合片段的至少一个cdr序列。在一些实施方案中,至少编码根据本发明的抗体或抗原结合片段的重链cdr3序列和轻链cdr3序列。因此,还提供了一种分离的、合成的或重组的核酸或载体,其至少编码根据本发明的抗体或抗原结合片段的重链cdr3序列和轻链cdr3序列。优选地,至少编码根据本发明的抗体或抗原结合片段的重链cdr1-3序列和轻链cdr 1-3序列。因此,还提供了一种分离的、合成的或重组的核酸或载体,其至少编码根据本发明的抗体或抗原结合片段的重链cdr1-3序列和轻链cdr1-3序列。优选地,所述cdr序列是如表1中描绘的抗体的cdr序列。
[0329]
特定实施方案提供了一种分离的、合成的或重组的核酸,其至少编码根据本发明的抗体或抗原结合片段的重链可变区和/或轻链可变区。在一些实施方案中,所述核酸编码根据本发明的抗体或抗原结合片段的重链可变区和轻链可变区两者。此类核酸特别适于在生产细胞中产生本发明的抗体或抗原结合片段。在一些实施方案中,所述核酸包含已针对特定生产细胞(例如像大肠杆菌、中国仓鼠卵巢(cho)、nso(小鼠骨髓瘤)或t293细胞)进行密码子优化的核酸序列,从而能够在这些生产细胞中有效产生本发明的抗体或抗原结合片段。应注意抗体产生可以通过任何重组抗体产生系统进行;以上提及的四种生产细胞系统只是迄今为止可用的许多系统中的几个实例。如本文所用,术语“密码子”意指编码特定氨基酸残基的三联核苷酸。术语“密码子优化”意指来自原始的、优选人的核酸序列的一个或多个密码子被某个生产细胞优选的一个或多个密码子置换。这些置换密码子优选编码与已被置换的原始密码子相同的氨基酸残基。可替代地,一个或多个置换密码子编码不同的氨基酸残基。这优选地产生保守氨基酸取代,尽管这不是必需的。在恒定区和框架区中,通常允许一个或多个氨基酸取代。在cdr区中,优选使用编码与已被置换的原始密码子相同的氨基酸残基的密码子,使得所得产物具有与原始抗体相同的cdr氨基酸序列。
[0330]
根据本发明的优选抗体的vh和vl氨基酸和核苷酸序列列在表1中列出。因为许多氨基酸残基由多于一种不同的核酸密码子编码,所以不同的密码子可以用于某一氨基酸残基,例如以优化某一生产细胞的密码子使用,如以上解释的。此外,通常还允许一些产生不同氨基酸残基的核酸序列变异,特别是在cdr编码序列以外。因此,特定实施方案提供了一种分离的、合成的或重组的核酸,其至少编码表1中描绘的抗体的重链可变区和/或轻链可变区。一些实施方案提供了一种分离的、合成的或重组的核酸,其编码选自由seq id no 1-17组成的组的重链可变区氨基酸序列,或编码与其具有至少80%序列同一性的氨基酸序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh区的所述序列变异位于cdr区之外。一些实施方案提供了一种分离的、合成的或重组的核酸,其编码选自由seq id no 18-22组成的组的轻链可变区氨基酸序列,或编码与其具有至少80%序列同一性的氨基酸序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优
选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vl区的所述序列变异位于cdr区之外。一些实施方案提供了一种分离的、合成的或重组的核酸,其编码选自由seq id no 1-17组成的组的重链可变区氨基酸序列和选自由seq id no 18-22组成的组的轻链可变区氨基酸序列,或编码与其具有至少80%序列同一性的氨基酸序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。
[0331]
一些实施方案提供了一种分离的、合成的或重组的核酸,其与如表1中描绘的vh或vl序列具有至少80%序列同一性。根据本发明的优选抗体的vh核酸序列在表1中作为seq id no 23-39列出。根据本发明的优选抗体的vl核酸序列在表1中作为seq id no 40-44列出。因此,还提供了一种核酸,其包含与选自由seq id no 23-39组成的组的序列具有至少80%序列同一性的序列,和/或包含与选自由seq id no 40-44组成的组的序列具有至少80%序列同一性的序列。优选地,根据本发明的核酸分子包含如表1中描绘的相同抗体的可变重链编码序列以及可变轻链编码序列。因此,还提供了一种核酸,其包含与选自由seq id no 23-39组成的组的序列具有至少80%序列同一性的序列,并且包含与选自由seq id no 40-44组成的组的序列具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。
[0332]
在一些实施方案中,提供了编码根据本发明的抗体或抗原结合片段的核酸分子。还提供了一种核酸分子,其编码选自由以下组成的组的抗体:抗体at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。在一些实施方案中,所述核酸被密码子优化以在非人宿主细胞中表达。
[0333]
还提供了一种载体,其包含根据本发明的核酸分子。如本文所用,“包含根据本发明的核酸分子的载体”也被称为“根据本发明的载体”。
[0334]
用于构建包含根据本发明的一种或多种核酸分子的载体的方法在本领域中是熟知的。合适的载体和生产平台的非限制性实例是逆转录病毒和慢病毒载体、细菌或酵母质粒、sv40载体、杆状病毒载体、噬菌体dna载体、puc载体、质粒载体像pbr322、由lonza制造的载体例如像pcon plus载体、由rentschler biopharma制造的生产系统例如像turbocell
tm
表达平台和fujifilm diosynth的表达平台例如像apollo
tm
哺乳动物表达平台。
[0335]
在一些实施方案中,根据本发明的载体包含编码如表1中描绘的抗体的vh和vl序列的核酸序列。这些抗体的vh核酸序列在表1中作为seq id no 23-39列出,并且这些抗体的vl核酸序列在表1中作为seq id no 40-44列出。因此,还提供了一种载体,其包含与选自由seq id no 23-39组成的组的序列具有至少80%序列同一性的核酸序列,和/或包含与选
自由seq id no 40-44组成的组的序列具有至少80%序列同一性的核酸序列。优选地,根据本发明的载体包含如表1中描绘的抗体的可变重链编码序列以及可变轻链编码序列。因此,还提供了一种载体,其包含与选自由seq id no 23-39组成的组的序列具有至少80%序列同一性的核酸序列,并且包含与选自由seq id no 40-44组成的组的序列具有至少80%序列同一性的核酸序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于所述抗体的cdr区抗体之外。
[0336]
一些实施方案提供了一种载体,其包含:
[0337]-如seq id no:23中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0338]-如seq id no:23中描绘的vh编码核酸序列和如seq id no:44中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0339]-如seq id no:24中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;
[0340]-如seq id no:25中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0341]-如seq id no:26中描绘的vh编码核酸序列和如seq id no:41中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0342]-如seq id no:27中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0343]-如seq id no:28中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0344]-如seq id no:28中描绘的vh编码核酸序列和如seq id no:42中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0345]-如seq id no:29中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0346]-如seq id no:30中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0347]-如seq id no:31中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0348]
如seq id no:32中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0349]
如seq id no:32中描绘的vh编码核酸序列和如seq id no:43中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0350]
如seq id no:33中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0351]
如seq id no:34中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核
酸序列,或与其具有至少80%序列同一性的序列;或
[0352]
如seq id no:35中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0353]
如seq id no:36中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0354]
如seq id no:37中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0355]
如seq id no:38中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列;或
[0356]
如seq id no:39中描绘的vh编码核酸序列和如seq id no:40中描绘的vl编码核酸序列,或与其具有至少80%序列同一性的序列。
[0357]
优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。
[0358]
在一些实施方案中,根据本发明的载体是car t细胞载体,其包含编码抗原识别结构域和t细胞激活结构域的核酸序列。在一些实施方案中,所述抗原识别结构域至少包含根据本发明的抗体的重链cdr1-3序列。在一些实施方案中,所述抗原识别结构域至少包含根据本发明的抗体的轻链cdr1-3序列。在一些实施方案中,所述抗原识别结构域包含根据本发明的抗体的重链cdr1-3序列和轻链cdr1-3序列。在一些实施方案中,所述抗原识别结构域包含根据本发明的抗体的vh序列,或与其具有至少80%序列同一性的序列。在一些实施方案中,所述抗原识别结构域包含根据本发明的抗体的vl序列,或与其具有至少80%序列同一性的序列。在一些实施方案中,所述抗原识别结构域包含根据本发明的抗体的vh和vl序列,或与其具有至少80%序列同一性的序列。优选地,所述序列同一性是至少85%、更优选地至少86%、更优选地至少87%、更优选地至少88%、更优选地至少89%、更优选地至少90%、更优选地至少91%、更优选地至少92%、更优选地至少93%、更优选地至少94%、更优选地至少95%、更优选地至少96%、更优选地至少97%、更优选地至少98%、更优选地至少99%、更优选地100%。优选地,所述vh和/或vl区的所述序列变异位于cdr区之外。
[0359]
在一些实施方案中,所述抗原识别结构域呈单链形式。在一些实施方案中,所述car t细胞载体还包含编码跨膜结构域的核酸序列。
[0360]
根据本发明的载体例如可用于体外产生本发明的抗体或抗原结合片段或car t细胞。这例如通过将此类核酸分子或载体引入细胞中,使得细胞的核酸翻译机器将产生编码的抗体、或抗原结合片段、或car t细胞来完成。在一些实施方案中,根据本发明的至少一种核酸分子或载体在所谓的生产细胞中表达,所述生产细胞例如为大肠杆菌、cho、nso或t293细胞,其中一些适于商业抗体生产。如上文所述,在此类情况下,优选使用核酸分子,其中如本文提供的原始人序列针对生产细胞进行密码子优化。所述生产细胞的增殖产生能够产生根据本发明的抗体或抗原结合片段的生产细胞系。优选地,所述生产细胞系适于产生用于人类的抗体。因此,所述生产细胞系优选地不含致病因子,诸如致病微生物。在一些实施方
案中,由这种生产细胞系生成由人序列组成的抗体。
[0361]
在一些实施方案中,将根据本发明的car t细胞载体引入t细胞以产生car t细胞。
[0362]
因此,还提供了一种分离的或重组的宿主细胞,其包含至少一种根据本发明的抗体、或抗原结合片段、或核酸分子、或载体。这种细胞优选地是抗体生产细胞,其能够进行大规模抗体生产。在一些实施方案中,所述细胞是哺乳动物细胞、t细胞、细菌细胞、植物细胞、hek293t细胞、cho细胞、由lonza制造的生产系统例如像pcon plus生产系统、由rentschler biopharma制造的生产系统例如像turbocell
tm
表达平台或fujifilm diosynth的表达平台例如像apollo
tm
哺乳动物表达平台。
[0363]
还提供了一种用于产生根据本发明的抗体或抗原结合片段的方法,所述方法包括培养包含根据本发明的核酸或载体的宿主细胞并允许所述宿主细胞翻译所述核酸或载体,从而产生根据本发明的所述抗体或抗原结合片段。根据本发明的所述方法优选地还包括从所述宿主细胞和/或从培养基中回收所述抗体或抗原结合片段的步骤。在一些实施方案中,所述抗体或抗原结合片段是如表1中描述的抗体及其抗原结合片段,优选选自由以下组成的组的抗体:at1636、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。在一些优选实施方案中,所述抗体或抗原结合片段是选自由at1636-yn、at1636-iyn和at1636-iyen组成的组的抗体及其抗原结合片段。
[0364]
本文还提供了一种抗体或抗原结合片段,其通过根据本发明的方法获得。根据本发明获得的结合化合物任选地在额外的纯化、分离或加工步骤之后例如适于人类治疗或诊断。
[0365]
在一些实施方案中,将根据本发明的至少一种核酸分子或载体引入非人动物中,例如用于在体内产生抗体。因此,还提供了一种分离的或重组的非人动物,其包含根据本发明的抗体、抗原结合片段、核酸分子或载体。用于产生转基因非人动物的方法在本领域中是已知的。
[0366]
额外的抗体修饰
[0367]
还提供了根据本发明的抗体,其中恒定区的一个或多个氨基酸残基被修饰。在一些实施方案中,fc区中的一个或多个氨基酸被修饰以减少糖基化。n-糖基化是一种常见的抗体翻译后修饰,并且已知发生在含有共有序列n-x-s或n-x-t的糖基化基序处,其中n代表天冬酰胺,x代表任何氨基酸残基,s代表丝氨酸,并且t代表苏氨酸。fc糖基化影响抗体的fc部分的结构特征,从而影响效应子功能和药代动力学。由于fc糖基化可能导致半衰期降低和/或免疫原性增加,因此糖基化对于治疗抗体可能是不希望的。在一些实施方案中,与原始亲本抗体相比,fc糖基化区中的一个或多个氨基酸被修饰,以减少或避免糖基化。例如,以上提及的糖基化基序的n、s和t残基中的至少一个被改变。在一些实施方案中,ch2区的位置47(n47)处的天冬酰胺残基被改变。在一些实施方案中,ch2区的位置95(t95)处的苏氨酸被改变。
[0368]
可替代地或另外,根据本发明的抗体的可变框架区中的一个或多个糖基化位点被改变以减少或避免糖基化。
[0369]
抗体的恒定结构域在各种抗体特征中发挥作用,例如抗体依赖性细胞介导的细胞毒性(adcc)、抗体依赖性细胞吞噬作用(adcp)和补体依赖性细胞毒性(cdc)。fc区通过与免疫效应细胞(诸如巨噬细胞、自然杀伤细胞、b细胞和嗜中性粒细胞)上的不同受体结合来介
导抗体功能。这些受体中的一些,诸如cd16a(fcγriiia)和cd32a (fcγriia),激活免疫效应细胞以建立针对抗原的应答。其他受体,诸如cd32b,抑制免疫细胞的激活。在一些实施方案中,根据本发明的抗体进行工程化以增强adcc活性。用于增强抗体的adcc活性的一种技术是非岩藻糖基化。因此,还提供了根据本发明的抗体或抗原结合片段,其是非岩藻糖基化的。
[0370]
可以应用本领域已知的用于获得非岩藻糖基化抗体的任何手段。非岩藻糖基化抗体例如通过使用具有降低的岩藻糖基化能力的生产细胞系、例如像lec13 cho突变体(patnaik&stanley,2006)来获得。也可能在细胞系诸如cho中敲除编码α1,6-岩藻糖基转移酶的fut8基因(技术)(yamane-ohnuki等人,2004)。
[0371]
可替代地,可以使用产生抗体的细胞系,其中n-乙酰氨基葡糖转移酶iii(gnt iii)过表达,从而产生非岩藻糖基化抗体(glycomab
tm
技术)。
[0372]
可替代地或另外,可以使用多种其他策略来实现adcc增强,例如包括糖工程化(kyowa hakko/biowa、glycart(roche)和eureka therapeutics)和诱变(xencor和macrogenics),所有这些都寻求改善fc与低亲和力激活的fcγriiia的结合,和/或减少与低亲和力抑制性fcγriib的结合。化学-酶促修饰也已用于修饰fc结合的n-聚糖。
[0373]
除了岩藻糖,其他糖部分也已知在adcc活性中起作用。在一些实施方案中,根据本发明的抗体或抗原结合片段进行高半乳糖基化以增强adcc。
[0374]
在一些实施方案中,本发明的抗体的fc结构域内的fcγr结合位点的至少一个氨基酸被修饰以操纵fc/fcr相互作用。在一些实施方案中,将氨基酸突变s298a、e333a和k334a引入本发明的抗体的fc结构域中。据报告,这些突变增强adcc活性(shields等人,2001)。在一些实施方案中,本发明的抗体的adcc活性通过引入氨基酸突变s239d和i332e,任选地与氨基酸突变a330l组合来增强(lazar等人,2006)。在一些实施方案中,本发明的抗体的adcc活性通过引入氨基酸突变l235v、f243l、r292p、y300l和p396l来增强(stavenhagen等人,2007)。因此,还提供了根据本发明的抗体或抗原结合片段,其包含选自下组的氨基酸突变:
[0375]-s298a、e333a、k334a;
[0376]-s239d、i332e;
[0377]-s239d、i332e、a330l;以及
[0378]-l235v、f243l、r292p、y300l、p396l。
[0379]
存在若干种用于确定抗体在引发adcc中的功效的体外方法。其中包括铬-51[cr51]释放测定、铕[eu]释放测定和硫-35[s35]释放测定。通常,将表达某种表面暴露抗原的标记靶细胞系与对此抗原具有特异性的抗体一起温育。洗涤之后,通常将表达fc受体cd16的效应细胞与抗体标记的靶细胞共温育。随后通常通过释放细胞内标记,例如通过闪烁计数器或分光光度法来测量靶细胞裂解。可替代地,可以使用基于萤光素酶的细胞毒性测定,其中将表达萤火虫萤光素酶的靶细胞与抗体,例如像双特异性或多特异性抗体一起温育。洗涤之后,添加效应细胞并共温育。随后通常通过裂解剩余的靶细胞并通过分光光度法测量荧光素发光来测量靶细胞杀伤。
[0380]
在一些实施方案中,根据本发明的抗体进行工程化以增强cdc活性。增强cdc的一种方式是将氨基酸突变k326w和/或e333s引入fc结构域中(idusogie等人,2001)。在一些实
施方案中,将氨基酸突变s267e、h268f和s324t引入本发明的抗体的fc结构域中以增强cdc活性。由于据报告这些突变减弱adcc活性,因此优选地还引入氨基酸取代g236a和i332e以恢复adcc活性(moore等人,2010)。
[0381]
在一些实施方案中,将氨基酸突变e345r引入本发明的抗体的fc结构域中以增强cdc活性。在一些实施方案中,将氨基酸突变e345k和/或e430g引入本发明的抗体的fc结构域中以增强cdc和adcc活性(de jong等人,2016)。
[0382]
因此,还提供了根据本发明的抗体或抗原结合片段,其包含选自下组的一个或多个氨基酸突变:
[0383]-k326w;
[0384]-e333s;
[0385]-k326w、e333s;
[0386]-e345r;
[0387]-e345k;
[0388]-e430g;
[0389]-e345k、e430g;
[0390]-s267e、h268f、s324t;以及
[0391]-s267e、h268f、s324t、g236a、i332e。
[0392]
虽然免疫效应子功能像adcc和cdc在许多治疗应用中是有益的,但在其他应用中减弱它们是有益的。例如,此类应用包括治疗方法,其中作用机制特别在于fab臂或与fc区融合的其他部分。在此类情况下,减少fc/fcr和/或fc/c1q相互作用可能有益于减少由免疫效应子功能引起的组织损伤。因此,在根据本发明的抗体的使用不需要adcc或cdc的情况下,减少免疫效应子功能可能是优选的。根据本发明的抗体的效应子功能可以例如通过使用与igg1相比具有减少的效应子功能的igg2或igg4形式来减弱。在一些实施方案中,根据本发明的抗体的效应子功能通过在fc区中引入l235e突变,或通过在氨基酸位置234-237内引入一个或多个其他突变来减弱。在一些实施方案中,本发明的igg1抗体具有氨基酸取代l234a和l235a (lala突变)以减弱效应子功能(lund等人,1992)。在一些实施方案中,本发明的igg1抗体具有氨基酸取代l234a、l235a和p329g(lala-pg突变)以减弱效应子功能。在一些实施方案中,本发明的igg4抗体具有氨基酸取代s228p和l235e(sple突变)。引入氨基酸取代p329g也有益于减弱效应子功能。
[0393]
因此,还提供了根据本发明的抗体或抗原结合片段,其包含选自下组的一个或多个氨基酸突变:
[0394]-l235e;
[0395]-l234a、l235a;
[0396]-l234a、l235a、p329g;
[0397]-s228p、l235e;以及
[0398]-s228p、l235e、p329g。
[0399]
双特异性或多特异性结合化合物
[0400]
本发明的另一方面提供了根据本发明的抗体或抗原结合片段,其与另一种化合物偶联。在一些实施方案中,根据本发明的抗体或抗原结合片段与另一个治疗部分偶联,所述
另一个治疗部分例如像药物、化疗药物、毒性部分、细胞毒剂或放射性化合物,以形成所谓的“抗体-药物缀合物”(adc)。
[0401]
一些实施方案提供adc,其中adc包含根据本发明的抗体或抗原结合片段和细胞抑制或细胞毒性药物单元。该药物单元可以例如破坏dna链(例如,倍癌霉素、卡奇霉素、吡咯并苯二氮卓类[pbd]和sn-38[伊立替康的活性代谢物])或微管(例如,美登素和澳瑞他汀),或发挥拓扑异构酶或rna聚合酶抑制作用,从而导致细胞死亡(chau等人,2019)。在一些实施方案中,所述adc包含细胞抑制或细胞毒性药物单元与抗体单元之间的化学接头单元(tsuchikama,2018)。在一些实施方案中,接头在细胞内条件下是可切割的,使得接头的切割从细胞内环境中的抗体或抗原结合片段释放药物单元。在一些实施方案中,接头单元是不可切割的,并且药物例如通过抗体降解释放。在一些实施方案中,接头可通过存在于细胞内环境中(例如,在溶酶体或核内体或小凹内)的可切割剂切割。可切割接头的非限制性实例包括可通过二硫键交换切割的含二硫键接头、在酸性ph下可切割的酸不稳定接头和可通过水解酶、酯酶、肽酶和葡糖苷酸酶切割的接头。
[0402]
在一些实施方案中,抗体或抗原结合片段与核酸缀合,所述核酸可以是细胞毒性核糖核酸酶、反义核酸、抑制性rna分子(例如,sirna分子)或免疫刺激性核酸(例如,含有免疫刺激性cpg基序的dna分子)。在一些实施方案中,抗体或抗原结合片段与适体或核酶缀合,而不是与澳瑞他汀或其功能性肽类似物或衍生物缀合。
[0403]
在一些实施方案中,根据本发明的抗体药物缀合物包含一种或多种放射性标记的氨基酸,其可用于诊断和治疗目的。用于制备放射性标记的氨基酸和相关肽衍生物的方法在本领域中是已知的(参见例如junghans等人1996、us 4,681,581、us 4,735,210、us 5,101,827、us 5,102,990(us re35,50g)、us5,648,471和us 5,697,902)。在一些实施方案中,根据本发明的抗体或抗原结合片段与放射性同位素或与含有放射性同位素的螯合物缀合。
[0404]
本文公开的抗体及其抗原结合片段也可以与诸如以下标记缀合:
99
tc、
90
y、
111
in、
32
p、
14
c、
125
i、3h、
13
1i、
11
c、
15
0、
13
n、
18
f、
35
s、
51
cr、51to、226ra、6oco、59fe、51se、152eu、67cu、2nci、211at、212pb、47sc、109pd、234th和4ok、151gd、
55
mn、
52
tr和
56
fe。
[0405]
在一些实施方案中,与根据本发明的抗体或抗原结合片段偶联的部分是免疫调节化合物。这种免疫调节化合物的优选实例是t细胞结合化合物、nk细胞结合化合物、nkt细胞结合化合物或γ-δt细胞结合化合物。在一些优选实施方案中,所述t细胞结合化合物是cd3特异性结合化合物、klrg1特异性结合化合物或cd103特异性结合化合物。如果与根据本发明的抗体或抗原结合片段偶联,这种结合t细胞的化合物将t细胞靶向表达e-钙黏素和o-甘露糖基转移酶的细胞,诸如癌细胞,从而诱导或增强针对所述(癌)细胞的细胞毒性t-细胞应答。
[0406]
同样地,nk细胞结合化合物、nkt细胞结合化合物或γ-δt细胞结合化合物适于分别靶向nk细胞、nkt细胞或γ-δ-t细胞,以将它们吸引至表达e-钙黏素和o-甘露糖基转移酶的细胞并诱导细胞毒性或其他免疫介导的活性。
[0407]
在一些优选实施方案中,所述t细胞结合化合物是cd3特异性结合化合物。在一些优选实施方案中,所述t细胞结合化合物是klrg1特异性结合化合物。在一些优选实施方案中,所述t细胞结合化合物是cd103特异性结合化合物。
[0408]
在一些实施方案中,根据本发明的抗体或抗原结合片段与tgfβ特异性结合化合物偶联。这对于将根据本发明的抗体或抗原结合片段靶向包含o-甘露糖基化e-钙黏素和tgfβ的细胞,优选地疾病特异性细胞诸如肿瘤细胞是特别有用的。如实施例中所示,当所述肿瘤表达o-甘露糖基化e-钙黏素和tgfβ两者时,根据本发明的抗体或抗原结合片段特别良好地能够抑制肿瘤细胞生长和/或增加肿瘤细胞死亡。
[0409]
suurs等人,2019中提供了对肿瘤学中双特异性抗体和抗体构建体的综述。
[0410]
因此,一些实施方案提供了一种双特异性或多特异性结合化合物,其包含根据本发明的抗体或抗原结合片段以及免疫调节分子。
[0411]
一些实施方案提供了一种双特异性或多特异性结合化合物,其包含根据本发明的抗体或抗原结合片段以及选自由以下组成的组的化合物:t细胞结合化合物、nk细胞结合化合物、nkt细胞结合化合物和γ-δ-t细胞结合化合物。
[0412]
一些实施方案提供了一种双特异性或多特异性结合化合物,其包含根据本发明的抗体或抗原结合片段以及cd3特异性结合化合物。
[0413]
一些实施方案提供了一种双特异性或多特异性结合化合物,其包含根据本发明的抗体或抗原结合片段以及cd103特异性结合化合物。
[0414]
一些实施方案提供了一种双特异性或多特异性结合化合物,其包含根据本发明的抗体或抗原结合片段以及klrg1特异性结合化合物。
[0415]
一些实施方案提供了一种双特异性或多特异性结合化合物,其包含根据本发明的抗体或抗原结合片段以及tgfβ特异性结合化合物。
[0416]
一些实施方案提供了根据本发明的抗体或抗原结合片段,其与另一种肿瘤结合化合物偶联。例如,此类双特异性或多特异性化合物允许增加的或更具有特异性的肿瘤细胞结合,尤其是当两种或更多种偶联的结合化合物对肿瘤细胞上的不同表位具有特异性时更是如此。这种双特异性或多特异性化合物因此非常适于治疗或诊断应用。
[0417]
在一些实施方案中,根据本发明的抗体或抗原结合片段与标记偶联。这允许使用这种标记的结合化合物检测含有e-钙黏素的细胞,诸如e-钙黏素阳性癌细胞。在一些实施方案中,根据本发明的抗体或抗原结合片段与激素或酶偶联。这允许将这种激素或酶靶向含有e-钙黏素的(癌)细胞。其他实施方案提供了根据本发明的抗体或抗原结合片段,其与第二抗体或其抗原结合片段偶联。
[0418]
因此,一些实施方案提供了根据本发明的抗体或抗原结合片段,其与另一种化合物偶联,优选地与选自由以下组成的组的化合物偶联:免疫调节化合物、t细胞结合化合物、nk细胞结合化合物、nkt细胞结合化合物和γ-δt细胞结合化合物、cd3特异性结合化合物、tgfβ特异性结合化合物、细胞因子、第二抗体或其抗原结合片段、可检测标记、药物、化疗药物、细胞毒剂、毒性部分、激素、酶和放射性化合物。
[0419]
在一些实施方案中,所述第二抗体或其抗原结合片段对o-甘露糖基化e-钙黏素也具有特异性。因此,提供了一种双特异性或多特异性结合化合物,其包含根据本发明的抗体或抗原结合片段和对o-甘露糖基化e-钙黏素也具有特异性的第二抗体或其抗原结合片段。所得的结合化合物对e-钙黏素具有单特异性,并且每个fab臂通常结合自己的e-钙黏素表位。在一些实施方案中,被fab片段识别的表位彼此不同。在其他实施方案中,所述表位是相同的。fab臂可以以不同的亲和力结合表位。可替代地,fab臂以基本上相同的亲和力结合它
们的表位,这意味着fab臂的kd彼此相差不超过30%、优选地不超过20%或不超过10%。
[0420]
在一些实施方案中,所述第二抗体或其抗原结合片段也是根据本发明的抗体或抗原结合片段。因此,提供了一种双特异性或多特异性结合化合物,其包含至少两个根据本发明的抗体或抗原结合片段。在一些实施方案中,所述至少两个根据本发明的抗体或抗原结合片段彼此偶联。在一些实施方案中,所述双特异性或多特异性结合化合物包含至少两个at1636抗体或其抗原结合部分。在一些实施方案中,所述双特异性或多特异性结合化合物包含至少两个at1636-i抗体或其抗原结合部分。在一些实施方案中,所述双特异性或多特异性结合化合物包含至少两个at1636-e抗体或其抗原结合部分。在一些实施方案中,所述双特异性或多特异性结合化合物包含至少两个at1636-n抗体或其抗原结合部分。在一些实施方案中,所述双特异性或多特异性结合化合物包含至少两个at1636-y抗体或其抗原结合部分。在一些实施方案中,所述双特异性或多特异性结合化合物包含至少两个at1636-yn抗体或其抗原结合部分。在一些实施方案中,所述双特异性或多特异性结合化合物包含至少两个at1636-iyn抗体或其抗原结合部分。在一些实施方案中,所述双特异性或多特异性结合化合物包含至少两个at1636-iyen抗体或其抗原结合部分。
[0421]
一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的结合化合物,其中所述化合物包含根据本发明的抗体或抗原结合片段以及治疗药物、或放射性化合物、或毒性部分。
[0422]
在一些实施方案中,根据本发明的抗体或抗原结合片段与另一种e-钙黏素特异性结合化合物、例如像当前已知的抗e-钙黏素抗体或其抗原结合片段偶联,以产生双特异性或多特异性化合物。在一些实施方案中,根据本发明的抗体或抗原结合片段的重链与另一种e-钙黏素特异性抗体的重链配对,以产生双特异性抗体或其抗原结合片段。根据本发明的双特异性或多特异性化合物例如允许增加与含有e-钙黏素的细胞的结合。这种双特异性或多特异性化合物因此非常适于治疗或诊断应用。也可能在其中不同的含有e-钙黏素的细胞与相同的双特异性或多特异性结合化合物结合的测定中使用根据本发明的双特异性或多特异性化合物。
[0423]
一些实施方案提供一种双特异性抗体或其抗原结合片段,其包含根据本发明的抗体的一个fab片段以及另一个抗体的一个fab片段。在一些实施方案中,这种双特异性抗体包含根据本发明的抗体的一个fab片段和另一个抗体的一个fab片段,其优选地对t细胞、nk细胞、nkt细胞或γ-δt细胞具有特异性,例如像对cd3、klrg1或cd103具有特异性的fab片段。
[0424]
因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性抗体或其抗原结合片段,其包含:
[0425]-根据本发明的抗体或抗原结合片段的一个fab片段;和
[0426]-优选地对t细胞、nk细胞、nkt细胞或γ-δt细胞具有特异性的另一种抗体的一个fab片段。
[0427]
还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性抗体或其抗原结合片段,其包含:
[0428]-根据本发明的抗体或抗原结合片段的一个fab片段;和
[0429]-对cd3具有特异性的另一种抗体的一个fab片段。
[0430]
还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性抗体或其抗原结合片段,其包含:
[0431]-根据本发明的抗体或抗原结合片段的一个fab片段;和
[0432]-对klrg1具有特异性的另一种抗体的一个fab片段。
[0433]
还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性抗体或其抗原结合片段,其包含:
[0434]-根据本发明的抗体或抗原结合片段的一个fab片段;和
[0435]-对cd103具有特异性的另一种抗体的一个fab片段。
[0436]
还提供了一种能够结合o-甘露糖基化e-钙黏素的双特异性抗体或其抗原结合片段,其包含:
[0437]-根据本发明的抗体或抗原结合片段的一个fab片段;和
[0438]-对tgfβ具有特异性的另一种抗体的一个fab片段。
[0439]
根据本发明的抗体或抗原结合片段可以通过接头例如像酸不稳定的腙接头、或通过肽接头像瓜氨酸-缬氨酸、或通过硫醚键、或通过转肽酶催化的转酰胺基作用(其在wo 2010/087994中详细描述)与另一个部分例如像药物或免疫调节化合物或标记偶联。
[0440]
转肽酶催化的转酰胺基作用涉及在抗体的重链上、优选地在重链的c-末端部分上以及在与所述抗体偶联的部分上对转肽酶识别位点(lpetgg)进行工程化。所述抗体和部分通常还含有ggggs序列和用于纯化目的的标签,诸如his标签。随后进行转肽酶催化的转酰胺基作用,接着进行点击化学键联。在转肽酶催化的转酰胺基作用中,“点击化学键联”通常涉及例如含炔试剂和例如含叠氮化物试剂的化学偶联,通过将甘氨酸添加到抗体的重链的转肽酶基序上并添加到与抗体偶联的部分(诸如蛋白质、肽或抗体)上的转肽酶基序上而通过转肽酶来添加所述试剂。在一个实施方案中,本发明因此提供了根据本发明的抗体,其中转肽酶识别位点(lpetgg)在抗体的重链上、优选地在重链的c末端部分上被工程化,所述抗体优选地还含有ggggs序列和纯化标签,诸如his标签。
[0441]
在一些实施方案中,根据本发明的抗体或抗原结合片段通过硫醚键与另一个部分偶联。在此类情况下,优选地将一个或多个半胱氨酸并入根据本发明的抗体或抗原结合片段中。半胱氨酸含有硫醇基团,并且因此将一个或多个半胱氨酸并入根据本发明的抗体或抗原结合片段中,或用一个或多个半胱氨酸置换一个或多个氨基酸,使得能够将所述抗体或抗原结合片段与另一个部分偶联。所述一个或多个半胱氨酸优选地在其不显著影响所述抗体或抗原结合片段的折叠并且不显著改变抗原结合或效应子功能的位置处引入。因此,本发明还提供了根据本发明的抗体或抗原结合片段,其包含选自由以下组成的组的抗体的重链序列:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen,其中所述抗体的至少一个氨基酸(半胱氨酸除外)已被半胱氨酸置换。
[0442]
本发明还提供了嵌合抗原受体(car)t细胞,其包含根据本发明的抗体的重链cdr1、cdr2和cdr3序列。在一些实施方案中,所述car t细胞还包含根据本发明的抗体的轻链cdr1、cdr2和cdr3序列。
[0443]
嵌合抗原受体(car,也被称为嵌合免疫受体、嵌合t细胞受体或人工t细胞受体)是
工程化的受体蛋白,其可以赋予细胞结合新的特异性靶的能力。car将抗原结合和细胞激活功能两者结合到单个受体中。car通常具有模块化设计,其包括抗原结合结构域和一个或多个直接或间接结合的传递激活信号的细胞内结构域。根据共刺激结构域的数量,car可以分为第一代(仅cd3z)、第二代(一个共刺激结构域+cd3z)或第三代car(多于一个共刺激结构域+cd3z)。将car基因引入t细胞中成功地重定向具有额外抗原特异性的t细胞,并且提供驱动完全t细胞激活的必需信号。可替代地,car基因也可以引入其他免疫细胞,诸如nk、nkt或γ-δ-t细胞中(rafiq等人2019)。
[0444]
car的抗原结合特征优选地由细胞外scfv定义。scfv的形式通常是两个可变结构域,通过柔性肽序列连接,取向为vh-接头-vl或vl-接头-vh。本领域已知的其他形式包括串联car、环状串联car和结合常见接头分子的car。(guedan等人mol ther 2019)。
[0445]
car的细胞内信号传导结构域通常包含激活结构域和一个或多个共刺激结构域。在本领域中,绝大多数car通过基于cd3ζ衍生的免疫受体酪氨酸的激活基序来激活car t细胞。研究最广泛的共刺激结构域来源于cd28家族(包括cd28和icos)或肿瘤坏死因子受体(tnfr)基因家族(包括4-1bb(cd137)、ox40和cd27)的共刺激分子。替代结构域包括衍生自myd88或杀伤细胞免疫球蛋白样受体2ds2(kir2ds2;与tyro蛋白酪氨酸激酶结合蛋白的共表达组合,也被称为dap12)的那些。可替代地,用于car-t细胞的结合结构域可以与五个其他tcr亚基中的任一个的细胞外n末端融合,从而将相应的tcr融合构建体(truc)并入tcr复合物中。(bauerle等人,2019)。
[0446]
本领域中用于对细胞进行基因修饰以表达car的策略包括基于病毒和非病毒的基因工程化工具,诸如γ逆转录病毒和慢病毒载体。其他方法包括例如转座子系统像睡美人(sb)和piggybac、mrna、非整合性慢病毒、核酸内切酶(guedan等人2019)和用于原位细胞编程的dna纳米载剂。
[0447]
根据本发明的car t细胞结合o-甘露糖基化e-钙黏素,优选地其70kda截短形式,并且因此非常适用于针对o-甘露糖基化e-钙黏素阳性癌细胞的免疫疗法。因此,一些实施方案提供了一种能够结合o-甘露糖基化e-钙黏素的嵌合抗原受体(car)t细胞,其中所述car t细胞包含根据本发明的抗体的重链cdr1、cdr2和cdr3序列。在一些实施方案中,所述car t细胞包含如表1中描绘的抗体的重链cdr1、cdr2和cdr3序列。在一些实施方案中,所述car t细胞还包含如表1中描绘的抗体的轻链cdr1、cdr2和cdr3序列。在一些实施方案中,所述car t细胞包含选自由以下组成的组的抗体的重链cdr1、cdr2和cdr3序列和轻链cdr1、cdr2和cdr3序列:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。
[0448]
一些实施方案提供了一种分离的或重组的宿主细胞或非人动物,其包含根据本发明的双特异性抗体或多特异性抗体或car t细胞。
[0449]
抗e-钙黏素抗体的治疗用途
[0450]
根据本发明的抗体或抗原结合片段、或adc、或car t细胞适于针对表达o-甘露糖基化e-钙黏素的细胞的用途。还提供了用于治疗需要用根据本发明的抗体或抗原结合片段、或adc、或car t细胞进行治疗的受试者、包括人受试者的方法。还提供了根据本发明的核酸分子或载体,或包含根据本发明的核酸的细胞,其用作药物和/或预防剂。当施用根据
本发明的一种或多种核酸分子(包含其的载体)时,所述一种或多种核酸分子将被原位翻译成根据本发明的抗体或抗原结合片段。根据本发明的所得抗体或抗原结合片段随后将抵抗或预防与表达o-甘露糖基化e-钙黏素的细胞相关联的病症,例如像e-钙黏素阳性和tmtc3阳性肿瘤。同样,将根据本发明的细胞引入有需要的患者中将使得体内生成根据本发明的治疗性或预防性抗o-甘露糖基化e-钙黏素抗体或抗原结合片段。
[0451]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用作药物或预防剂。在一些实施方案中,所述药物或预防剂是针对与表达e-钙黏素的细胞相关联的病症。在特定实施方案中,所述细胞还表达o-甘露糖基转移酶,使得e-钙黏素能够o-甘露糖基化并通过对o-甘露糖基化e-钙黏素具有特异性的抗体及其抗原结合片段对其结合。因此,一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防与表达e-钙黏素和o-甘露糖基转移酶的细胞、优选地肿瘤细胞相关联的病症的方法中。
[0452]
在特定实施方案中,所述o-甘露糖基转移酶是tmtc3,其以其e-钙黏素o-甘露糖基化活性而被熟知。因此,还提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防与表达e-钙黏素和tmtc3的细胞、优选地肿瘤细胞相关联的病症的方法中。
[0453]
在一些实施方案中,与表达e-钙黏素和o-甘露糖基转移酶的肿瘤细胞相关联的所述病症是上皮癌。在一些实施方案中,与表达e-钙黏素和o-甘露糖基转移酶的肿瘤细胞相关联的所述病症选自由以下组成的组:腺癌、鳞状细胞癌、腺鳞癌、间变性癌、大细胞癌、小细胞癌、结直肠癌、结肠癌、胃癌(stomach cancer)、胃癌(gastric cancer)、胃食管结合部癌、乳腺癌、胰腺癌、食管癌、胃食管结合部癌、膀胱癌、肺癌、小细胞肺癌、非小细胞肺癌、肺腺癌、泌尿道癌、前列腺癌、脑癌、甲状腺癌、喉癌、类癌、肝癌、肝细胞癌、头颈癌、卵巢癌(ovary cancer)、宫颈癌、卵巢癌(ovarian cancer)、子宫内膜癌、上皮内癌、透明细胞癌、黑色素瘤、多发性骨髓瘤、肾癌、肾细胞癌、肾移行细胞癌、输卵管癌和腹膜癌。在一些实施方案中,与表达e-钙黏素和o-甘露糖基转移酶的肿瘤细胞相关联的所述病症选自由以下组成的组:结直肠癌、结肠癌、结肠癌亚型cms1、结肠癌亚型cms2、结肠癌亚型cms3、结肠癌亚型cms4、喉癌、头颈癌、乳腺癌、胰腺癌、食管癌、膀胱癌、肺癌、胃癌、泌尿道癌、前列腺癌和卵巢癌。
[0454]
如本文所用,表达e-钙黏素的肿瘤细胞还被称为“表达e-钙黏素的肿瘤细胞”或“e-钙黏素阳性肿瘤细胞”。表达e-钙黏素和tmtc3的肿瘤细胞在本文中也被称为“表达e-钙黏素和表达tmtc3的肿瘤细胞”或“表达e-钙黏素和tmtc3的肿瘤细胞”或“e-钙黏素阳性和tmtc3阳性肿瘤细胞”或“e-钙黏素和tmtc3阳性肿瘤细胞”。包含表达e-钙黏素和tmtc3的肿瘤细胞的癌症在本文中被称为“e-钙黏素阳性和tmtc3阳性癌症”。
[0455]“受试者”可以是人或动物个体。在一些实施方案中,受试者是哺乳动物个体,例如像人、猫、狗、兔、小鼠、大鼠、牛、山羊、马、猪、猴、猿或大猩猩。在特定实施方案中,所述受试者是人个体。
[0456]
如本文所用,术语“与表达e-钙黏素和o-甘露糖基转移酶的细胞相关联的病症”意指涉及存在表达e-钙黏素和o-甘露糖基转移酶的疾病特异性细胞的任何疾病。在一些实施
方案中,此类细胞是疾病的致病因素,就像表达e-钙黏素和o-甘露糖基转移酶的肿瘤细胞的情况一样。在一些实施方案中,此类细胞的存在引起不良症状,例如像炎症和/或疼痛。
[0457]
术语“治疗或预防与表达e-钙黏素和o-甘露糖基转移酶的细胞相关联的病症”可以是指抵抗所述病症的发作或进展,和/或减轻由所述病症引起的症状。例如,术语“治疗或预防与表达e-钙黏素和o-甘露糖基转移酶的肿瘤细胞相关联的病症”可以包括预防、抵抗和/或减缓所述肿瘤细胞的生长,和/或减轻由患者体内存在所述肿瘤细胞引起的症状。
[0458]
一些实施方案提供了一种抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性癌症的方法中。根据本发明的o-甘露糖基化e-钙黏素特异性抗体和抗原结合片段的优点是它们对表达e-钙黏素和tmtc3两者的(肿瘤)细胞具有特异性,而它们与不表达tmtc3的e-钙黏素阳性细胞结合的程度显著更低。这能够减少不良副作用,使得可以耐受更高的剂量。
[0459]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性上皮癌的方法中。
[0460]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防选自由以下组成的组的e-钙黏素阳性和tmtc3阳性癌症的方法中:腺癌、鳞状细胞癌、腺鳞癌、间变性癌、大细胞癌、小细胞癌、结直肠癌、结肠癌、胃癌、胃癌、胃食管结合部癌、乳腺癌、胰腺癌、食管癌、胃食管结合部癌、膀胱癌、肺癌、小细胞肺癌、非小细胞肺癌、肺腺癌、泌尿道癌、前列腺癌、脑癌、甲状腺癌、喉癌、类癌、肝癌、肝细胞癌、头颈癌、卵巢癌、宫颈癌、卵巢癌、子宫内膜癌、上皮内癌、透明细胞癌、黑色素瘤、多发性骨髓瘤、肾癌、肾细胞癌、肾移行细胞癌、输卵管癌和腹膜癌。
[0461]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性结直肠癌的方法中。
[0462]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性结肠癌的方法中。
[0463]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性结肠癌亚型cms1的方法中。
[0464]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性结肠癌亚型cms2的方法中。
[0465]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性结肠癌亚型cms3的方法中。
[0466]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特
异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性结肠癌亚型cms4的方法中。
[0467]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性喉癌的方法中。
[0468]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性头颈癌的方法中。
[0469]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性乳腺癌的方法中。
[0470]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性胰腺癌的方法中。
[0471]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性食管癌的方法中。
[0472]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性膀胱癌的方法中。
[0473]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性肺癌的方法中。
[0474]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性胃癌的方法中。
[0475]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性泌尿道癌的方法中。
[0476]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性前列腺癌或卵巢癌的方法中。
[0477]
在一些实施方案中,根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞针对也包含表达转化生长因子β(tgfβ)、优选地tgfβ1的肿瘤细胞的e-钙黏素阳性和tmtc3阳性癌症使用。如本文所用,包含表达e-钙黏素的肿瘤细胞和表达tmtc3的肿瘤细胞及表达tgfβ的肿瘤细胞的癌症被称为“e-钙黏素阳性和tmtc3阳性及tgfβ阳性癌症”。如实施例中所示,如果存在tgfβ,则根据本发明的抗体或功能片段特别良好地与肿瘤细胞结合。根据本发明的抗体或抗原结合片段与tgfβ的组合特别适于抑制肿瘤细胞生长和/或增加肿瘤细胞死亡。因此,还提供了根据本发
明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性及tgfβ阳性癌症的方法中。在存在tgfβ的情况下改善肿瘤细胞生长抑制的优点是可以使用较低的剂量。
[0478]
用于在任何所记载的方法中使用的优选抗体是选自由以下组成的组的抗体及其具有相同结合特异性的抗原结合片段:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。
[0479]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞用于制造药物的用途。
[0480]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞用于制造治疗或预防与表达e-钙黏素和o-甘露糖基转移酶的细胞相关联的病症的药物的用途。在特定实施方案中,所述细胞是肿瘤细胞。在特定实施方案中,所述o-甘露糖基转移酶是tmtc3。一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞用于制备治疗或预防e-钙黏素阳性和tmtc3阳性癌症的药物的用途。在一些实施方案中,所述e-钙黏素阳性和tmtc3阳性癌症是上皮癌。在一些实施方案中,所述e-钙黏素阳性和tmtc3阳性癌症选自由以下组成的组:腺癌、鳞状细胞癌、腺鳞癌、间变性癌、大细胞癌、小细胞癌、结直肠癌、结肠癌、胃癌、胃癌、胃食管结合部癌、乳腺癌、胰腺癌、食管癌、胃食管结合部癌、膀胱癌、肺癌、小细胞肺癌、非小细胞肺癌、肺腺癌、泌尿道癌、前列腺癌、脑癌、甲状腺癌、喉癌、类癌、肝癌、肝细胞癌、头颈癌、卵巢癌、宫颈癌、卵巢癌、子宫内膜癌、上皮内癌、透明细胞癌、黑色素瘤、多发性骨髓瘤、肾癌、肾细胞癌、肾移行细胞癌、输卵管癌和腹膜癌。在一些实施方案中,所述e-钙黏素阳性和tmtc3阳性癌症选自由以下组成的组:结直肠癌、结肠癌、结肠癌亚型cms1、结肠癌亚型cms2、结肠癌亚型cms3、结肠癌亚型cms4、喉癌、头颈癌、乳腺癌、胰腺癌、食管癌、膀胱癌、肺癌、胃癌、泌尿道癌、前列腺癌和卵巢癌。
[0481]
另外的实施方案提供了一种组合物,其包含根据本发明的抗体或抗原结合片段。一些实施方案提供了一种组合物,其包含根据本发明的双特异性抗体、多特异性抗体、adc或car t细胞。还提供了一种包含根据本发明的核酸分子的组合物,以及包含根据本发明的载体或细胞的组合物。在一些实施方案中,所述抗体是选自由以下组成的组的抗体:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。在一些实施方案中,根据本发明的组合物包含根据本发明的抗体和另一种e-钙黏素特异性抗体。与根据本发明的抗体相比,所述其他e-钙黏素特异性抗体优选地结合不同的e-钙黏素表位。这种不同e-钙黏素特异性抗体的组合特别适于结合和/或抵抗e-钙黏素阳性细胞,诸如e-钙黏素和tmtc3阳性肿瘤细胞。
[0482]
在一些实施方案中,根据本发明的组合物是药物组合物。这种药物组合物优选地还包含药学上可接受的载剂、稀释剂和/或赋形剂。合适载剂的非限制性实例例如包括钥孔
戚血蓝蛋白(klh)、血清白蛋白(例如,bsa或rsa)和卵清蛋白。在一些特定实施方案中,所述合适载剂包括溶液,例如像盐水。根据本发明的药物组合物优选地适于人类使用。
[0483]
本发明还提供了一种用于治疗和/或预防与表达e-钙黏素和o-甘露糖基转移酶的细胞、优选地但不限于肿瘤细胞相关联的病症的方法,其包括向有需要的个体施用治疗有效量的根据本发明的抗体或抗原结合片段、和/或根据本发明的双特异性抗体或多特异性抗体、或adc、或car t细胞、和/或根据本发明的核酸、和/或根据本发明的载体或细胞、和/或根据本发明的组合物或组分试剂盒。还提供了一种用于至少部分地治疗和/或预防e-钙黏素阳性和tmtc3阳性癌症的方法,其包括向有需要的个体施用治疗有效量的根据本发明的抗体或抗原结合片段、和/或根据本发明的双特异性抗体或多特异性抗体、或adc、或car t细胞、和/或根据本发明的核酸、和/或根据本发明的载体或细胞、和/或根据本发明的组合物或组分试剂盒。所述组合物优选地是根据本发明的药物组合物。根据本发明的抗体或抗原结合片段、或核酸分子、或载体、或adc、或car t细胞、或药物组合物优选地通过一次或多次注射来施用。在一些实施方案中,根据本发明的抗体或抗原结合片段、或核酸分子、或载体、或adc、或car t细胞、或药物组合物通过静脉内施用来施用。可替代地,使用本领域中已知的其他施用途径。根据本发明的结合化合物的施用剂量的非限制性实例是0.1至10mg/kg体重。
[0484]
一些实施方案提供了根据本发明的抗体或抗原结合片段、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其与另一种治疗剂、优选地抗癌治疗剂和/或免疫调节化合物组合。例如,根据本发明的抗体或抗原结合片段与可用于治疗和/或预防与表达e-钙黏素和o-甘露糖基转移酶诸如tmtc3的细胞、优选地肿瘤细胞相关联的病症的另一种药剂组合。因此,提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞相关联的病症的方法中,其中根据本发明的所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞与可用于治疗和/或预防与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞相关联的所述病症的另一种治疗剂组合。
[0485]
还提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于治疗或预防e-钙黏素阳性和tmtc3阳性癌症的方法中,其中根据本发明的所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞与用于治疗和/或预防所述癌症的另一种治疗剂组合。
[0486]
在一些实施方案中,所述另一种治疗剂是化疗剂。
[0487]
在一些实施方案中,所述另一种治疗剂是细胞抑制或细胞毒性药物。
[0488]
在一些实施方案中,所述另一种治疗剂是治疗性核酸。在一些实施方案中,所述核酸是细胞毒性核糖核酸酶、反义核酸、抑制性rna分子(例如,sirna分子)或免疫刺激性核酸(例如,含有免疫刺激性cpg基序的dna分子)。在一些实施方案中,所述核酸是适体或核酶。
[0489]
在一些实施方案中,所述另一种治疗剂包含放射性标记的氨基酸。
[0490]
在一些实施方案中,所述另一种治疗剂包含放射性同位素或含有放射性同位素的螯合物。
[0491]
与表达e-钙黏素和o-甘露糖基转移酶的肿瘤细胞相关联的所述病症优选地是e-钙黏素阳性和tmtc3阳性癌症。在一些实施方案中,与表达e-钙黏素和o-甘露糖基转移酶的肿瘤细胞相关联的所述病症是上皮癌。在一些实施方案中,与表达e-钙黏素和o-甘露糖基转移酶的肿瘤细胞相关联的所述病症是选自由以下组成的组的癌症:腺癌、鳞状细胞癌、腺鳞癌、间变性癌、大细胞癌、小细胞癌、结直肠癌、结肠癌、胃癌、胃癌、胃食管结合部癌、乳腺癌、胰腺癌、食管癌、胃食管结合部癌、膀胱癌、肺癌、小细胞肺癌、非小细胞肺癌、肺腺癌、泌尿道癌、前列腺癌、脑癌、甲状腺癌、喉癌、类癌、肝癌、肝细胞癌、头颈癌、卵巢癌、宫颈癌、卵巢癌、子宫内膜癌、上皮内癌、透明细胞癌、黑色素瘤、多发性骨髓瘤、肾癌、肾细胞癌、肾移行细胞癌、输卵管癌和腹膜癌。在一些特定实施方案中,与表达e-钙黏素和o-甘露糖基转移酶的肿瘤细胞相关联的所述病症是选自由以下组成的组的癌症:结直肠癌、结肠癌、结肠癌亚型cms1、结肠癌亚型cms2、结肠癌亚型cms3、结肠癌亚型cms4、喉癌、头颈癌、乳腺癌、胰腺癌、食管癌、膀胱癌、肺癌、胃癌、泌尿道癌、前列腺癌和卵巢癌。
[0492]
本文还提供了组合物和组分试剂盒,其包含根据本发明的抗体或抗原结合片段、或adc、或car t细胞、或核酸、或载体、或宿主细胞与另一种治疗剂的组合。一些实施方案提供了一种组分试剂或组合物,其包含根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸分子、或载体、或宿主细胞和用于治疗或预防与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞相关联的病症的另一种治疗剂。在一些实施方案中,所述组合物是药物组合物。所述病症优选地是e-钙黏素阳性和tmtc3阳性癌症。
[0493]
在一些实施方案中,所述组合物是药物组合物。所述病症优选地是e-钙黏素阳性和tmtc3阳性癌症。
[0494]
根据本发明的组分试剂盒可以包含一个或多个容器,所述容器填充有包含根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸分子、或载体、或宿主细胞的组合物以及包含另一种治疗剂的组合物。所述组分试剂盒或所述一个或多个容器还任选地包含一种或多种药学上可接受的载剂、稀释剂或赋形剂。与此类一个或多个组分试剂盒或容器关联的可以是各种书面材料诸如使用说明书,或呈由管制药学产品的制造、使用或销售的政府机构开具的形式的通知书,所述通知书反映由制造、使用或销售机构核准。在一些实施方案中,根据本发明的组分试剂盒包含使用说明书。
[0495]
一些实施方案提供了一种用于治疗或预防人或非人个体的与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的细胞、优选地肿瘤细胞相关联的病症的方法,所述方法包括向所述个体施用治疗有效量的根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞、或组合物、或组分试剂盒与另一种治疗剂或治疗程序的组合。所述另一种治疗剂优选地是如上文所述的药剂。
[0496]
e-钙黏素特异性抗体的另外的应用
[0497]
根据本发明的抗体、抗原结合片段、adc和car t细胞也特别适用于检测表达o-甘露糖基化e-钙黏素的细胞。例如,如果个体,优选地人类被怀疑患有与表达o-甘露糖基化e-钙黏素的细胞相关联的病症,则可以使用根据本发明的抗体或抗原结合片段、或adc、或car t细胞测试来自所述个体的样品的表达o-甘露糖基化e-钙黏素的细胞(在本文中也被称为o-甘露糖基化e-钙黏素阳性细胞)的存在。在一些实施方案中,将所述样品与根据本发明的
抗体或抗原结合片段、或adc、或car t细胞混合,如果此类细胞存在于所述样品中,所述样品将特异性结合o-甘露糖基化e-钙黏素阳性细胞。与根据本发明的抗体或抗原结合片段、或adc、或car t细胞结合的o-甘露糖基化e-钙黏素阳性细胞,例如像o-甘露糖基化e-钙黏素阳性肿瘤细胞可以使用本领域已知的任何方法从样品中分离和/或检测,所述方法例如但不限于使用磁珠、链霉亲和素包被的珠分离,或通过使用固定在柱上的二级抗体分离。可替代地或另外,根据本发明的抗体或抗原结合片段、或adc、或car t细胞被标记以便能够检测它。此类抗体或抗原结合片段、或adc、或car t细胞例如被荧光标记、酶标记或放射性标记,例如使用荧光团诸如稀土螯合物、荧光素或其衍生物、罗丹明及其衍生物、异硫氰酸酯、藻红蛋白、藻蓝蛋白、别藻蓝蛋白、邻苯二甲醛、荧光胺、152e u、丹酰、伞形酮、荧光素、鲁米诺标记(luminal label)、异鲁米诺标记、芳香族吖啶酯标记、咪唑标记、吖啶盐标记、草酸酯标记、水母发光蛋白标记、2,3-二氢双酮酞嗪、生物素/亲和素、自旋标记或稳定的自由基。在一些实施方案中,使用针对所述抗体或抗原结合片段或adc或car t细胞的标记的二级抗体检测根据本发明的抗体或抗原结合片段或adc或car t细胞。
[0498]
如本文提供的筛选测定可以使用本领域中已知的方法进行,例如酶联免疫吸附测定(elisa)、放射免疫测定(ria)、蛋白质印迹测定和免疫组织化学染色测定。
[0499]
根据本发明的标记的抗体或抗原结合片段、或adc、或car t细胞例如与个体的含有细胞的样品(例如像血液样品或组织样品)一起温育,其中之后未结合的结合化合物被洗掉。随后,确定根据本发明的所述标记的抗体或抗原结合片段、或adc、或car t细胞是否与o-甘露糖基化e-钙黏素阳性细胞结合。在一些实施方案中,根据本发明的未标记的抗体或抗原结合片段、或adc、或car t细胞与含有细胞的样品接触。温育之后,优选地进行一个或多个洗涤步骤以去除未结合的结合化合物。随后,例如使用特异性地针对根据本发明的抗体或抗原结合片段、或adc、或car t细胞并与标记物例如像荧光化合物或例如辣根过氧化物酶或碱性磷酸酶偶联的检测抗体测试根据本发明的抗体或抗原结合片段、或adc、或car t细胞是否与o-甘露糖基化e-钙黏素阳性细胞结合。在另一个洗涤步骤之后,优选地例如通过测量光发射或通过添加辣根过氧化物酶或碱性磷酸酶的底物确定检测抗体是否已经结合。这些技术在本领域中是熟知的。
[0500]
如果根据本发明的抗体或抗原结合片段、或adc、或car t细胞似乎与患者样品的组分结合,则指示存在o-甘露糖基化e-钙黏素阳性细胞。以这种方式,可以检测疾病特异性细胞,像o-甘露糖基化e-钙黏素阳性肿瘤细胞。此外,疾病特异性o-甘露糖基化e-钙黏素阳性细胞像o-甘露糖基化e-钙黏素阳性肿瘤细胞的存在表明用根据本发明的抗体或抗原结合片段、或adc、或car t细胞进行的治疗将具有有益作用。因此,一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞用于确定样品是否包含表达o-甘露糖基化e-钙黏素的细胞的用途。在一些实施方案中,所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞用于确定样品是否包含表达o-甘露糖基化e-钙黏素的肿瘤细胞。
[0501]
还提供了一种用于确定表达o-甘露糖基化e-钙黏素的细胞、优选地肿瘤细胞是否存在于样品中的方法,所述方法包括:
[0502]-使所述样品与根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞接触,和
[0503]-允许所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞与表达o-甘露糖基化e-钙黏素的细胞、优选地肿瘤细胞结合,以及如果存在的话
[0504]-确定细胞是否与所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞结合,从而确定表达o-甘露糖基化e-钙黏素的细胞、优选地肿瘤细胞是否存在于所述样品中。
[0505]
抗体at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen及其抗原结合片段特别适于检测表达o-甘露糖基化e-钙黏素的细胞,例如像o-甘露糖基化e-钙黏素-阳性肿瘤细胞。因此,还提供了选自由以下组成的组的抗体或其抗原结合片段用于确定样品是否包含含有o-甘露糖基化e-钙黏素的细胞的用途:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。一些实施方案提供了选自由以下组成的组的抗体或其抗原结合片段用于确定样品是否包含含有o-甘露糖基化e-钙黏素的肿瘤细胞、例如像表达o-甘露糖基化e-钙黏素的上皮癌细胞,或选自由以下组成的组的癌症的细胞的用途,所述抗体选自由以下组成的组:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen;所述癌症选自由以下组成的组:腺癌、鳞状细胞癌、腺鳞癌、间变性癌、大细胞癌、小细胞癌、结直肠癌、结肠癌、胃癌、胃癌、胃食管结合部癌、乳腺癌、胰腺癌、食管癌、胃食管结合部癌、膀胱癌、肺癌、小细胞肺癌、非小细胞肺癌、肺腺癌、泌尿道癌、前列腺癌、脑癌、甲状腺癌、喉癌、类癌、肝癌、肝细胞癌、头颈癌、卵巢癌、宫颈癌、卵巢癌、子宫内膜癌、上皮内癌、透明细胞癌、黑色素瘤、多发性骨髓瘤、肾癌、肾细胞癌、肾移行细胞癌、输卵管癌和腹膜癌,优选地选自由以下组成的组:结直肠癌细胞、结肠癌细胞、结肠癌亚型cms1细胞、结肠癌亚型cms2细胞、结肠癌亚型cms3细胞、结肠癌亚型cms4细胞、喉癌细胞、头颈癌细胞、乳腺癌细胞、胰腺癌细胞、食管癌细胞、膀胱癌细胞、肺癌细胞、胃癌细胞、泌尿道癌细胞、前列腺癌细胞和卵巢癌细胞。
[0506]
还提供了一种用于确定包含o-甘露糖基化e-钙黏素的细胞、优选地肿瘤细胞是否存在于样品中的方法,所述方法包括:
[0507]-使所述样品与选自由以下组成的组的抗体或其抗原结合片段接触:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen,和
[0508]-允许所述抗体或抗原结合片段与包含o-甘露糖基化e-钙黏素的细胞、优选地肿瘤细胞结合,以及如果存在的话
[0509]-确定细胞是否与所述抗体或抗原结合片段结合,从而确定包含o-甘露糖基化e-钙黏素的细胞、优选地肿瘤细胞是否存在于所述样品中。
[0510]
一些实施方案提供了根据本发明的方法,其中所述样品包括血液样品或骨髓样品
或活检物。在一些实施方案中,所述活检物来自肠道,优选地用于测试胃肠癌、结肠直肠癌、结肠癌、食管癌或胃癌。在一些实施方案中,所述活检物来自胰腺组织或来自肺组织、或来自乳房组织或来自喉组织、或来自鳞状上皮组织、或来自肝组织、或来自卵巢组织、或来自前列腺组织、或来自泌尿道组织、或来自膀胱组织、或来自脑组织。在一些实施方案中,所述样品是血液样品,其例如可用于测试多发性骨髓瘤的存在和/或任何以上提及的实体瘤的转移。
[0511]
根据本发明的方法的测试结果可用于样品的分型。例如,如果个体的样品似乎含有恶性o-甘露糖基化e-钙黏素阳性细胞,则所述样品被分型为含有疾病相关细胞。这种分型随后可以用于诊断与表达o-甘露糖基化e-钙黏素的细胞相关联的病症。因此,一些实施方案提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用作诊断剂。还提供了根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞、或核酸、或载体、或宿主细胞,其用于诊断与包含o-甘露糖基化e-钙黏素的细胞、优选地肿瘤细胞相关联的病症。所述病症优选地是上皮癌,优选地选自由以下组成的组:腺癌、鳞状细胞癌、腺鳞癌、间变性癌、大细胞癌、小细胞癌、结直肠癌、结肠癌、胃癌、胃癌、胃食管结合部癌、乳腺癌、胰腺癌、食管癌、胃食管结合部癌、膀胱癌、肺癌、小细胞肺癌、非小细胞肺癌、肺腺癌、泌尿道癌、前列腺癌、脑癌、甲状腺癌、喉癌、类癌、肝癌、肝细胞癌、头颈癌、卵巢癌、宫颈癌、卵巢癌、子宫内膜癌、上皮内癌、透明细胞癌、黑色素瘤、多发性骨髓瘤、肾癌、肾细胞癌、肾移行细胞癌、输卵管癌和腹膜癌,更优选地选自由以下组成的组:结直肠癌、结肠癌、结肠癌亚型cms1、结肠癌亚型cms2、结肠癌亚型cms3、结肠癌亚型cms4、喉癌、头颈癌、乳腺癌、胰腺癌、食管癌、膀胱癌、肺癌、胃癌、泌尿道癌、前列腺癌和卵巢癌。
[0512]
在一些优选实施方案中,选自由以下组成的组的抗体或其抗原结合片段用于以上提及的检测和诊断:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。因此,还提供了选自由以下组成的组的抗体或其抗原结合片段:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen,其用于诊断与包含o-甘露糖基化e-钙黏素的细胞相关联的病症。一些实施方案提供了选自由以下组成的组的抗体或其抗原结合片段,其用于诊断e-钙黏素阳性和tmtc3阳性癌症:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen,所述癌症选自由以下组成的组:上皮癌、腺癌、鳞状细胞癌、腺鳞癌、间变性癌、大细胞癌、小细胞癌、结直肠癌、结肠癌、胃癌、胃癌、胃食管结合部癌、乳腺癌、胰腺癌、食管癌、胃食管结合部癌、膀胱癌、肺癌、小细胞肺癌、非小细胞肺癌、肺腺癌、泌尿道癌、前列腺癌、脑癌、甲状腺癌、喉癌、类癌、肝癌、肝细胞癌、头颈癌、卵巢癌、宫颈癌、卵巢癌、子宫内膜癌、上皮内癌、透明细胞癌、黑色素瘤、多发性骨髓瘤、肾癌、肾细胞癌、肾移行细胞癌、输卵管癌和腹膜癌,更优选地选自由以下组成的组:结直肠癌、结肠癌、结肠癌
亚型cms1、结肠癌亚型cms2、结肠癌亚型cms3、结肠癌亚型cms4、喉癌、头颈癌、乳腺癌、胰腺癌、食管癌、膀胱癌、肺癌、胃癌、泌尿道癌、前列腺癌和卵巢癌。
[0513]
还提供了一种用于确定人或非人个体是否患有包含o-甘露糖基化e-钙黏素的癌症的方法,所述方法包括:
[0514]-使所述个体的细胞与根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞接触,
[0515]-允许所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞与包含o-甘露糖基化e-钙黏素的肿瘤细胞结合,以及如果存在的话
[0516]-确定肿瘤细胞是否与所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞结合,从而确定所述个体是否患有包括o-甘露糖基化e-钙黏素的癌症。在一些实施方案中,所述方法是离体方法。在其他实施方案中,所述方法是体内成像方法。
[0517]
合适的成像技术包括spect成像(单光子发射计算机断层扫描)和pet成像(正电子发射断层扫描)。合适的标记包括例如碘-123(
123
1)和锝-99m(9m
9 tc),例如与spect成像或
11
c、
13
n、
15
0或
18
f结合,例如与pet成像或铟-111结合(参见例如,gordon等人,(2005)international rev.neurobiol.67:385-440)。
[0518]
o-甘露糖基化e-钙黏素阳性癌症的非限制性实例在以上列出。优选地,选自由以下组成的组的抗体或其抗原结合片段用于所述方法:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。因此,一些实施方案提供了一种用于确定人或非人个体是否患有表达o-甘露糖基化e-钙黏素的癌症的方法,所述方法包括:
[0519]-使所述个体的细胞与选自由以下组成的组的抗体或其抗原结合片段接触:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen,
[0520]-允许所述抗体或抗原结合片段与包含o-甘露糖基化e-钙黏素的肿瘤细胞结合,以及如果存在的话
[0521]-确定肿瘤细胞是否与所述抗体或抗原结合片段结合,从而确定所述个体是否患有包括o-甘露糖基化e-钙黏素的癌症。
[0522]
在一些实施方案中,确定个体是否患有表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的癌症。如上文解释的,包含o-甘露糖基化e-钙黏素的癌症的存在指示用根据本发明的抗体或抗原结合片段、或adc、或car t细胞进行的治疗将具有有益作用。因此,还提供了一种用于确定个体是否患有表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的癌症的方法,其包括:
[0523]-使来自所述个体的样品与根据本发明的抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞接触,和
[0524]-允许所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞与表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的肿瘤细胞结合,以及如果存在
的话
[0525]-确定肿瘤细胞是否与所述抗体或抗原结合片段、或双特异性抗体或多特异性抗体、或adc、或car t细胞结合,从而确定所述个体是否患有表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3的癌症。优选地,所述个体是人。
[0526]
本发明的另一方面提供了一种用于确定与平均癌症患者群体相比,用根据本发明的抗体或抗原结合片段、或adc、或car t细胞治疗癌症患者是否具有改善的积极治疗结果的机会的方法,所述方法包括确定所述癌症患者的样品是否包含o-甘露糖基化e-钙黏素阳性肿瘤细胞。如果是这种情况,则根据本发明的抗体,例如像选自由以下组成的组的抗体或其抗原结合片段特别适于抵抗这种癌症:at1636、e-c06、d-h04、d-a02、d-e09、e-a04、e-b09、c-a05、c-a03、c-b02、c-d04-a、c-d04-b、f-c08、d-g03、d-f10、c-e08、d-b06、d-g05、d-h08、c-h01、d-c12、d-c11、e-c10、at1636-i、at1636-y、at1636-e、at1636-n、at1636-yn、at1636-iyn和at1636-iyen。因此,如果已知个体的癌细胞在其表面上包含o-甘露糖基化e-钙黏素,则成功治疗的机会就会增加。因此,还提供了一种筛选方法,其包括确定个体的疾病特异性细胞、优选地肿瘤细胞是否在其表面上包含o-甘露糖基化e-钙黏素。在一些方面,确定所述疾病特异性细胞是否表达e-钙黏素和o-甘露糖基转移酶,优选地tmtc3。在一些方面,还确定所述疾病特异性细胞是否表达tgfβ。如果疾病特异性细胞像癌细胞表达e-钙黏素和o-甘露糖基转移酶、优选地tmtc3和tgfβ,则根据本发明的抗体或抗原结合片段、或adc、或car t细胞成功治疗的机会甚至更高。
[0527]
因为o-甘露糖基化e-钙黏素的存在通常是e-钙黏素和o-甘露糖基转移酶例如像tmtc3表达的结果,所以一些实施方案提供了一种筛选方法,其包括确定个体的疾病特异性细胞、优选地肿瘤细胞是否表达e-钙黏素和o-甘露糖基转移酶,特别是tmtc3。一些实施方案提供了一种筛选方法,其包括确定个体的疾病特异性细胞、优选肿瘤细胞是否表达e-钙黏素和o-甘露糖基转移酶,特别是tmtc3和tgfβ。
[0528]
在一些实施方案中,根据本发明的此类方法包括以下步骤:
[0529]-使来自个体的含有疾病特异性细胞的样品与对o-甘露糖基化e-钙黏素具有特异性的结合化合物、优选地抗体或抗原结合片段接触;
[0530]-允许所述结合化合物结合所述样品的疾病特异性细胞,以及
[0531]-确定所述结合化合物是否与所述样品的疾病特异性细胞结合,其中所述结合化合物与所述样品的疾病特异性细胞的结合指示所述患者具有用根据本发明的抗体或抗原结合片段、或adc、或car t细胞治疗的积极结果的显著机会。
[0532]
在一些实施方案中,所述疾病特异性细胞是肿瘤细胞。
[0533]
在一些实施方案中,还确定所述疾病特异性细胞是否也表达tgfβ。
[0534]
尽管本技术可以将特征描述为相同实施方案的一部分或单独实施方案的一部分,但是本发明的范围还包括具有本文所述的全部或一些特征的任何组合的实施方案。
[0535]
在以下实施例中进一步解释本发明。这些实施例不限制本发明的范围,而仅用于阐明本发明。
[0536]
表1-说明书中提及的氨基酸序列。突出显示了与at1636序列不同的氨基酸和核苷酸。
[0537]
[0538][0539]
说明书中提及的核酸序列
[0540]
[0541]
[0542][0543]
表2-关于保守氨基酸取代的氨基酸类别。
[0544]
氨基酸类别内的氨基酸残基的取代是保守氨基酸取代的非限制性实例。
[0545][0546]
表3.at1636与不同(癌)细胞类型的结合,如使用流式细胞术确定。e-钙黏素*和tmtc3*mrna (affy)表达数据来源于布洛德研究所的癌细胞系百科全书(https://portals.broadinstitute.org/ccle)。相对单位《6评分为阴性,6-7评分为+/-,并且》7评分为阳性。
[0547]
[0548]
[0549]
cadherin in cancer.oncotarget 7:65231
–
65246.
[0562]
chau c.等人,lancet 2019:394:793-804
[0563]
chen,y等人,(1999)j.mol.biol.293:865-881
[0564]
gauthier l.等人,(2019)cell 177,1701-1713
[0565]
de groot,a.s.等人,(2005)dev.biol.122:171-194
[0566]
guedan,s.等人,(2019)molecular therapy:methods&clinical development.vol 12:145-156
[0567]
hanly等人,(1995)ilar journal.37(3):93-118
[0568]
idusogie,ee等人,(2001)j.immunol.166:2571-2575
[0569]
junghans等人,in cancer chemotherapy and biotherapy 655-686(2d edition,chafner and longo,eds.,lippincott raven(1996))
[0570]
kwakkenbos,m.j.等人,genetic manipulation of b cells for the isolation of rare therapeutic antibodies from the human repertoire.methods 2013;1
–6[0571]
larsen,isb,narimatsu,y,joshi,hj,siukstaite,l,harrison,oj,brasch,j,goodman,km等人,discovery of an o-mannosylation pathway selectively serving cadherins and protocadherins.proc natl acad sci usa 2017;114:11163
–
11168.
[0572]
lazar,ga等人,(2006)proc.natl.acad.sci.usa 103:4005-4010
[0573]
lommel m等人,(2013)protein o-mannosylation is crucial for e-cadherin-mediated cell adhesion.proc natl acad sci usa 110:21024
–
21029.
[0574]
lund,j等人,(1992)mol.immunol.29:53-59.
[0575]
merchant,am,zhu,z,yuan,jq,goddard,a,adams,cw,presta,lg,carter,p.an efficient route to human bispecific igg.nature biotechnology,published online:01august 2008;|doi:10.1038/nbt0808-886 1998;16:677
–
681.
[0576]
moore,gl等人,(2010)mabs 2(2):181-189.
[0577]
padmanaban,v,krol,i,suhail,y,szczerba,bm,aceto,n,bader,js,ewald,aj.e-cadherin is required for metastasis in multiplemodels of breast cancer.nature 2019;1
–
31.
[0578]
patnaik&stanley(2006)methods enzymol.416:159-182
[0579]
racap
é
,m,duong van huyen,j-p,danger,r,giral,m,bleicher,f,foucher,y,pallier,a等人,the involvement of smile/tmtc3 in endoplasmic reticulum stress response.plos one 2011;6:e19321.
[0580]
rafiq等人,17december 2019,nature reviews,clinical oncology
[0581]
shields,rl等人,(2001)j.biol chem 276:6591-6604
[0582]
stavenhagen,jb等人,(2007)cancer res.67:8882-8890
[0583]
sunryd,jc,cheon,b,graham,jb,giorda,km,fissore,ra,hebert,dn.tmtc1 and tmtc2 are novel endoplasmic reticulum tetratricopeptide repeat-containing adapter proteins involved in calcium homeostasis.journal of biological chemistry 2014;289:16085
–
16099.
[0584]
suurs f.v.等人,(2019)pharmacology&therapeutics 201:103-119.
[0585]
tauriello,dvf,palomo-ponce,s,stork,d,berenguer-llergo,a,badia-ramentol,j,iglesias,m,sevillano,m等人,tgfβdrives immune evasion in genetically reconstituted colon cancer metastasis.nature 2018;554:538
–
543
[0586]
tsuchikama k.等人,(2018).protein cell 9(1):33-46.
[0587]
vester-christensen,mb,halim,a,joshi,hj,steentoft,c,bennett,ep,levery,sb,vakhrushev,sy等人,mining the o-mannose glycoproteome reveals cadherins as major o-mannosylated glycoproteins.proc natl acad sci usa 2013;110:21018
–
21023.
[0588]
yamane-ohnuki,n等人,(2004)biotechnol.bioeng 87:614-622.
[0589]
us 4,681,581
[0590]
us 4,735,210
[0591]
us 5,101,827
[0592]
us 5,102,990(us re35,50g)
[0593]
us 5,648,471
[0594]
us 5,697,902
[0595]
us9534058(b2)
[0596]
wo 2010/087994
[0597]
wo 2013/081463
[0598]
wo 2015/093949
[0599]
实施例
[0600]
实施例1 at1636抗体发现
[0601]
患者和健康人类材料
[0602]
研究方案经荷兰阿姆斯特丹学术医学中心医学伦理委员会(medical ethical committee of the academic medical centre)批准。所有参与者签署知情同意书。ficoll梯度离心之后从新鲜血液中分离总外周血单核细胞(pbmc)并冷冻,直至使用。
[0603]
结肠癌特异性克隆at1636的生成
[0604]
按照如wo 2015/093949和kwakkenbos等人,nat med(2010)中所述的程序,从患有林奇综合征的患者中分离原初和记忆igg b细胞,所述患者是msh6基因中致病基因变异的携带者并已被诊断出患有iv期结直肠癌(crc)和肝转移,并且已成功使用安维汀(avastin)、卡培他滨(capecitabine)和奥沙利铂(oxaliplatin)治疗。最后一次治疗9年之后从此患者获得的外周血中分离b细胞。通过逆转录病毒转导bcl6和bcl-xl基因以及报告基因gfp,使原初和记忆igg b细胞永生化。接下来,以每孔5、10或20个细胞的浓度接种永生化b细胞(以下称为微培养物),并用il-21和cd40l扩增。然后筛选扩增的b细胞微培养物的上清液中与以下结肠细胞系的混合物结合的特异性抗体:colo-205、caco-2和dld1细胞(atcc)。通过流式细胞术(bd)使用抗人igg-pe(southern biotech)作为二级抗体检测结合的抗体。
[0605]
在实验中包括特异性结合流感ha抗原的不相关对照抗体(at1002)(描述于wo 2013/081463中)作为阴性对照。
[0606]
选择上清液表现出与结肠细胞系特异性结合的微培养物,并以1个细胞/孔的浓度
接种以获得克隆培养物。扩增之后,再次使用如上所述的流式细胞术测试克隆培养物的上清液中与结肠细胞系特异性结合的抗体的存在。获得的结肠特异性b细胞克隆之一命名为7g02,其产生了igg3抗体,并结合三种结肠细胞系中的两种。
[0607]
结肠癌特异性抗体at1636的克隆
[0608]
为了鉴定由7g02产生的抗体,按照制造商的说明书使用tripure/氯仿方法(roche)分离总mrna。接下来,由逆转录酶(superscript iii,invitrogen)和随机六聚体(promega)生成cdna。按照制造商的程序,应用前导特异性引物与ch1(重链)和cκ(轻链)特异性引物的组合,通过pcr(faststart taq dna聚合酶,roche)扩增重链和轻链的igg可变结构域。使用扩增所用的同源引物,将扩增子用于双脱氧荧光测序(bdt,invitrogen)。为了排除逆转录酶或dna聚合酶诱导的突变,至少对5个克隆进行测序。
[0609]
接下来,将编码7g02的完整重链区和轻链区的合成密码子优化的dna片段(geneart)亚克隆到基于双基因pxc的表达载体(lonza)中。通过dna测序检查构建体的完整性。从这里开始,7g02的人igg1/κ重组抗体被标示为at1636。
[0610]
随后,将pxc双基因载体稳定转染到cho-gs细胞中以生成稳定池(gs xceed平台,lonza)。将稳定池扩增并用于摇瓶、分批补料细胞培养igg生产,持续7天。使用蛋白a色谱法,使用akta纯化系统(general electric lifesciences)收获并纯化含有重组at1636抗体的细胞澄清上清液。使用0.1m柠檬酸盐、150mm nacl、ph 3.5缓冲液洗脱抗体,随后在1m tris-hcl、ph 9.0中中和,并且然后通过尺寸排阻色谱法在tbs-ts中重新缓冲。使用nanodrop分光光度计(od280,thermofisher)建立浓度。使用尺寸排阻色谱法确认纯化抗体的单体含量》90%。通过sds-page建立纯化蛋白的完整性。
[0611]
at1636的流式细胞术结合特性
[0612]
使用流式细胞术测试重组at1636抗体与一组细胞系和原代细胞材料的结合。简而言之,将细胞与抗体溶液在4℃下温育30-60分钟,并且然后用150μl pbs 1%bsa洗涤两次。用抗人igg-rpe(southern biotech)或alexa fluor 647缀合的多克隆bcr抗体(invitrogen)检测抗体结合,并在facscanto ii或lsrfortessa(becton,dickinson and company)上进行分析。at1636显示与共表达e-钙黏素和tmct3的上皮细胞系(根据癌细胞系百科全书,(https://portals.broadinstitute.org/ccle))的结合(参见表3)。
[0613]
实施例2 at1636的靶标鉴定
[0614]
免疫沉淀
[0615]
为了鉴定at1636抗体的靶标,使用结肠癌细胞系dld1(atcc ccl-221)和t细胞系jurkat的细胞(阴性对照)对靶标进行免疫沉淀(ip)。使用补充有蛋白酶和磷酸酶抑制剂(roche)的裂解缓冲液(0,5%triton x114(sigma),0.5%doc;0.1%sds,150mm nacl,10mm tris-hcl ph7.4,1.5mm mgcl2)裂解细胞。裂解之后,通过离心去除不溶级分。然后用与蛋白-g dynabead(invitrogen)和链霉亲和素珠(invitrogen)结合的不相关抗体(rsv抗体帕利珠单抗(palivizumab))预先清除裂解物,以去除非特异性结合蛋白。然后将预先清除的裂解物与50μg蛋白-g dynabead结合的at1636抗体或与作为阴性对照的、珠结合的流感特异性抗体at1002在4℃下温育3小时。用裂解缓冲液洗涤抗体温育的珠三次,并且用1x sds-page样品缓冲液(biorad)+0.1m dtt从珠中洗脱结合的蛋白。将样品在sds-page凝胶上进行解析。将85%的ip样品在制备型sds-page上运行,并且用imperial蛋白质染色剂
(pierce)对免疫沉淀的蛋白质进行可视化。切除来自dld1相对于jurkat t细胞(作为阴性对照)的at1636与at1002(阴性对照)免疫沉淀物之间的差异免疫沉淀蛋白:70kda和85kda,参见图2a。将条带经受质谱法分析。用二硫苏糖醇将蛋白质经受还原,用碘乙酰胺进行烷基化,并使用proteineer dp消化机器人(bruker daltonics,bremen,germany)进行凝胶内胰蛋白酶消化。使用由easy nlc 1000梯度hplc系统(thermo,bremen,germany)和lumos质谱仪(thermo)组成的系统通过在线c18纳米hplc ms/ms分析胰蛋白酶肽。随后通过使用mascot算法(mascot v2.2.04,matrix science)针对人类uniprot数据库搜索质谱数据来鉴定蛋白质。使用10ppm的ms容差和0.02da的ms/ms容差。胰蛋白酶被指定为选择的酶,并且最多允许2个缺失的切割位点。选择脲甲基半胱氨酸(carbamidomethylcysteine)作为固定修饰,并且选择甲硫氨酸的氧化和n-末端乙酰化作为可变修饰。使用scaffold(www.proteomesoftware.com)对来自数据库搜索的结果进行分析和可视化。发现e-钙黏素被o-甘露糖基化。为了鉴定o-甘露糖基化,选择通过己糖对丝氨酸和苏氨酸的修饰作为可变修饰。半胰蛋白酶用作酶特异性以鉴定非胰蛋白酶n-末端。
[0616]
质谱法分析揭示了通过at1636免疫沉淀的蛋白质是截短的70kda形式的e-钙黏素(cdh1,截短形式在本文中被称为p70),在切除的70kda条带中具有24%的e-钙黏素序列覆盖率,而β连环蛋白存在于85kda条带中(76%的蛋白质覆盖率)。未检测到对应于e-钙黏素的最外侧c末端结构域的肽,这指示截短的蛋白质(参见图3中全长和截短的e-钙黏素的卡通片)。进一步的n末端乙酰化实验揭示了n末端残基是谷氨酸463(根据uniprot p12830条目编号)。
[0617]
蛋白质印迹
[0618]
通过蛋白质印迹证确认at1636与p70 e-钙黏素的特异性结合。将at1636反应性与可商购获得的ep700y(abcam,兔抗体)和对e-钙黏素的细胞质结构域具有特异性的小鼠抗体(克隆36/e,bd biosciences)进行比较。已经显示ep700y与人e-钙黏素的ec5结构域结合,并且因此将结合全长和p70 e-钙黏素两者,细胞内c尾抗体也是如此。用等量的裂解物(10mg)和抗体(2,5μg)由dld1细胞进行e-钙黏素抗体免疫沉淀。将输入(40μg)和ip样品(全部)在sds-page上运行并转移到pvdf膜(bio-rad)上进行免疫印迹。使用结合e-钙黏素的细胞内结构域的抗体以及ep700y抗体,使全长(120kda)e-钙黏素和70kda蛋白免疫沉淀,而at1636主要使70kda蛋白质免疫沉淀(图2b)。因此,at1636相对于全长e-钙黏素优先结合p70,如通过p70富集超过全长e-钙黏素所示。对信号进行密度计定量后,我们发现与ep700y ip相比,at1636 ip中p70的富集是全长的7倍。
[0619]
在图3中,图表总结了p70中发现的截短,它去除了全长e-钙黏素的ec1、ec2和大部分ec3结构域,并留下了d3结构域的短肽外加ec4和ec5结构域。还描绘了若干抗体的结合区和β-连环蛋白相互作用结构域。
[0620]
at1636靶标的蛋白水解切割
[0621]
为了研究e-钙黏素是否被蛋白水解切割以生成p70,我们通过添加到dld1细胞中的弗林蛋白酶/转化酶抑制剂(癸酰基-rvkr-cmk(tocris))来抑制弗林蛋白酶和相关转化酶。在不存在或存在指定浓度的抑制剂的情况下将细胞培养48小时并更新一次。收获细胞并用指定的抗体进行流式细胞术(图4)。dld1细胞与cmk的温育减少但没有完全消除at1636与dld1细胞的结合(图4),从而指示p70切割部分地由弗林蛋白酶和其他相关转化酶介导。
[0622]
除e-钙黏素在ec3结构域内的独特切割之外,已知e-钙黏素可以被o-甘露糖基化(i.s.b.larsen,pnas(2017),m.b.vester-christensen,pnas(2013),m.lommel,pnas(2013)和s.carvalho s,oncotarget(2016))。与at1636的切割位点和可能的结合结构域相邻的是至少两个o-甘露糖基化苏氨酸(thr残基472和474),还有一个可能在位置470处。为了研究p70的o-甘露糖基化对at1636结合的依赖性,用甘露糖基转移酶抑制剂(mann,氧代-2-硫酮-3-噻唑烷基乙酸,sigma)进行了类似于cmk实验的实验。图4中右两列示出了at1636与用mann处理的dld1细胞的结合减少,从而指示at1636结合区域内的p70 o-甘露糖基化是结合所必需的。
[0623]
实施例3高亲和力at1636变体的生成
[0624]
重组可溶性p70 e-钙黏素蛋白的产生
[0625]
全长e-钙黏素cdna和对应于ec5和ec4结构域以及ec3的部分直至位置463处的n末端的p70 e-钙黏素cdna(图1)均不包括细胞内和跨膜(tm)结构域,它们从geneart获得并且随后克隆到pcmv3、pcdna3和pxc19载体中,所述载体在配备有转肽酶和his标签的小鼠fc尾部上含有flag标签,或者产生仅含有c标签的蛋白质。在expi293或cho细胞中瞬时转染载体,并且用c标签亲和基质或蛋白a琼脂糖纯化重组蛋白。通过尺寸排阻色谱法在tbs-ts中重新缓冲洗脱的蛋白质。使用nanodrop分光光度计(od280,thermofisher)建立浓度。使用尺寸排阻色谱法确认纯化抗体的单体含量》90%。通过sds-page建立纯化蛋白的完整性。
[0626]
gfp高表达7g02 b细胞的生成
[0627]
在bcl6和bcl-xl的基因旁边,用于转导7g02 b细胞的逆转录病毒还含有gfp的基因作为成功转导b细胞的报告基因。使用含有bcl6、bcl-xl和gfp基因的逆转录病毒对7g02 b细胞进行第二轮逆转录病毒转导。这导致7g02 b细胞具有比原始7g02 b细胞更高的gfp表达。使用facsaria iii(bd biosciences)对高gfp表达的7g02 b细胞进行细胞分选,以产生稳定表达高水平gfp的7g02 b细胞的同质群体。按照制造商的方案,通过使用tripure/氯仿(roche/merck)分离总rna来确定7g02-gfp-高细胞的抗体重链和轻链的可变结构域的序列。接下来,使用逆转录酶(invitrogen)生成cdna。使用vh和vl引物通过pcr扩增编码抗体重链和轻链的可变结构域的cdna,并进行dna测序。7g02-gfp-高b细胞的抗体重链和轻链的可变结构域的序列与7g02-gfp-低b细胞的那些相同。
[0628]
具有增加的靶标结合的7g02 b细胞克隆的分离
[0629]
通过如kwakkenbos等人(m.j.kwakkenbos,methods(2013))所述的aimprove方法,使用可溶性e-钙黏素蛋白来选择与原始7g02 b细胞克隆相比抗原结合增加的亚克隆。简而言之,扩增7g02 b细胞gfp高克隆,并且将增殖的细胞与重组可溶性e-钙黏素小鼠-fc融合蛋白一起温育(参见上文)。随后,将细胞洗涤并且与特异性结合b细胞受体(bcr)的重链和轻链的alexa fluor 647缀合的多克隆抗体(invitrogen)共温育以评估bcr表达水平,并且与r-藻红蛋白标记的多克隆抗小鼠fc抗体(jackson immunoresearch)共温育以使结合的e-钙黏素蛋白可视化。通过流式细胞术分析细胞,并且使用facsaria iii(bd biosciences)对与平均7g02 b细胞群体相比表现出相对于其bcr表达的更高的重组e-钙黏素结合的细胞进行单细胞分选(图5中a)。将选择的克隆培养2至3周以允许扩增,并且然后在抗原竞争测定(参见下文)中测试与亲本7g02-gfp-低克隆相比增加的抗原结合。
[0630]
抗原竞争测定
[0631]
收获7g02 b细胞(7g02,gfp低)并以每孔10,000个细胞接种在96孔圆底微孔板中。随后,将10-50μl分选的亚克隆(gfp高)添加到这些孔中。将总细胞洗涤两次并与e-钙黏素-小鼠-fc蛋白在冰上温育1-3小时。随后,将细胞洗涤两次并与alexa fluor 647缀合的多克隆bcr抗体和r-藻红蛋白标记的多克隆抗小鼠-fc抗体(jackson immunoresearch)一起温育大约1小时。然后洗涤细胞,并且使用facs canto(bd biosciences)通过流式细胞术检测结合的抗体。将与亲本7g02-gfp-低细胞结合的重组e-钙黏素蛋白的量与与亚克隆(gfp高)结合的重组e-钙黏素蛋白的量进行比较。重组e-钙黏素与亚克隆(gfp-高)相对于亲本克隆(gfp-低)的相对于它们的bcr表达水平的的更高结合指示bcr具有更高的结合能力。在图5中b中绘制的是7g02-gfp-高亚克隆的实例,所述亚克隆显示与亲本7g02-gfp-低b细胞相比,相对于它们的bcr表达,其与e-钙黏素蛋白的结合增加。
[0632]
所选at1636亚克隆抗体的克隆和序列分析
[0633]
基于与亲本7g02克隆相比增强的重组e-钙黏素抗原结合来选择亚克隆的组。在这些亚克隆中,按照制造商的说明书使用tripure/氯仿方法(roche)分离总rna。接下来,由逆转录酶(superscript iii,invitrogen)和随机六聚体(promega)生成cdna。按照制造商的程序,应用前导特异性引物与ch1(重链)和cκ(轻链)特异性引物的组合,通过pcr(faststart taq dna聚合酶,roche)扩增重链和轻链的igg可变结构域。使用扩增所用的同源引物,将扩增子用于双脱氧荧光测序(bdt,invitrogen)。表1描绘了相对于b细胞亚克隆表面上的bcr量显示抗原结合增加的亚克隆的dna和氨基酸序列。基于此序列数据,重组产生重组抗体at1636-i(vh seq id no:3,vl seq id no:18)、at1636-y(vh seq id no:10,vl seq id no:18)、at1636-e(vh seq id no:5,vl seq id no:18)、at1636-n(vh seq id no:8,vl seq id no:18)、at1636-yn(vh seq id no:15,vl seq id no:18)、at1636-iyn(vh seq id no:16,vl seq id no:18)和at1636-iyen(vh seq id no:17,vl seq id no:18)。
[0634]
为了产生基于7g02亚克隆序列的重组抗体,将重和轻可变区与人igg1和κ恒定区框内克隆到基于双基因pxc的表达载体(lonza)中。通过dna测序检查构建体的完整性并转染到expicho-s细胞(gs xceed平台,lonza)中。将细胞扩增并用于摇瓶、分批补料细胞培养igg生产,持续7天。使用蛋白a色谱法,使用akta纯化系统(general electric lifesciences)收获并纯化含有重组at1636抗体的细胞澄清上清液。使用0.1m柠檬酸盐、150mm nacl、ph 3.5缓冲液洗脱抗体,随后在1m tris-hcl、ph 9.0中中和,并且然后通过尺寸排阻色谱法在tbs-ts中重新缓冲。使用nanodrop分光光度计(od280,thermofisher)建立浓度。使用尺寸排阻色谱法确认纯化抗体的单体含量》90%。通过sds-page建立纯化蛋白的完整性。
[0635]
接下来,比较重组抗体与不同细胞系的流式细胞术结合,所述细胞系包括结肠dld1、小鼠cmt93、乳腺mcf10a、皮肤a431和肺a547(图6a和6b)。从这些实验我们可以得出结论,与at1636和其他at1636变体相比,组合3个突变(vh seq id no:16,vl seq id no:18)的at1636-iyn抗体更有效地结合这些细胞。
[0636]
实施例4 at1636高亲和力变体的分析
[0637]
使用spr的at1636高亲和力变体的结合
[0638]
使用ibis mx96(ibis technologies)和cfm spotter(wasatch microfluidics),
测试at1636重组抗体和at1636-yn(本文中还被称为-ny;vh seq id:15和vl seq id:18)和at1636-iyn(本文中还被称为-iyn;vh seq id:16和vl seq id:18)变体与重组p70 e-钙黏素的结合,并与抗体ep700y e-钙黏素抗体进行比较。使用sprint软件(11.0.24版本,ibis)分析结果。使用scrubber2软件(biologic software)拟合结合曲线。
[0639]
向senseye g-strep芯片(ssens bv,enschede,netherlands)涂覆一系列浓度(0.2
–
2.0μg/ml)的人p70 e-钙黏素-小鼠fc-生物素(参见实施例3)。在2μl/min(交联+解离期间)、8μl/min(再生步骤)的流速下,均在25℃的温度下评估结合。随后在0.5-20μg/ml的一系列浓度下注射抗兔igg(山羊抗兔h+l,jackson)、抗小鼠igg(山羊抗小鼠h+l,jackson)、ep700y(abcam)、at1636和变体-iyn和-ny,一式两份进行。通过ibis多重spr成像确定结合。
[0640]
如图7a所示,at1636和变体-yn及-iyn与可溶性p70 e-钙黏素的结合得到证实。at1636 ny显示与at1636相比极大改善的结合,并且显示与at1636iyn相比大约相等的结合。尤其at1636抗体的结合速率增加,解离速率保持不变。
[0641]
通过elisa的at1636变体的稳态结合
[0642]
使用山羊抗小鼠igg fcy抗体(jackson)在96孔板(costar)上捕获重组e-钙黏素mfc蛋白。在用tbs/5%bsa/0.05%tween 20封闭,用pbs/0.05%tween洗涤两次,捕获并用pbs/0.05%tween洗涤两次之后,添加at1636和at1636亲和力变体(在4度下)并且在用pbs/0.05%tween洗涤2次之后使用山羊a-人igg h+l-hrp(jackson)检测这些抗体的结合。使用tmb底物(sigma)使结合的抗体可视化,并且用h2so4(merck)停止反应,并使用envision板读取器(perkin elmer)通过od450测量来定量。如图7b所示(两个左图),通过elisa观察到与at1636抗体相比,at1636-yn和-iyn抗体变体与全长e-钙黏素和p70的结合相似增加。at1636 iyn变体再次显示比-yn和at1636抗体更强的结合。在此,sc10.17(一种人源化ec1结构域特异性e-钙黏素抗体)结合全长e-钙黏素,但不结合p70截短变体。应注意,所有测试的抗体at1636变体以及at1636野生型与截短的70kda形式的e-钙黏素的结合比全长e-钙黏素更好。
[0643]
在另一个elisa中,我们测试了at1636及其变体与含有残基thr470的丙氨酸取代的d3-小鼠fc蛋白的结合。因为at1636结合依赖于o-甘露糖基化p70,如实施例2、图4中使用氧代-2-硫酮-3-噻唑烷基乙酸进行的甘露糖基转移酶抑制所示,所以我们进行了消除o-甘露糖基化的取代。残基470位于at1636表位的中心,并且可能被甘露糖基化。事实上,我们可以显示at1636几乎完全失去了与此thr470ala d3变体的结合(图7b,右图)。尽管与at1636-wt相比,at1636变体与p70的结合能力增加,但仍依赖于其结合表位内的适当o-甘露糖基化。
[0644]
为了评估相对于全长e-钙黏素对p70的结合偏好,我们针对与全长e-钙黏素、p70和含有残基thr470的丙氨酸取代的d3-小鼠fc蛋白(at1636与之的结合强烈降低的变体)的结合测试了宽浓度范围的at1636及其变体(在图7b中示出)。
[0645]
如图7c和表4所示,与at1636野生型相比,结合的增加对于-iyn和-yn变体最为显着。重要的是,它们分别保留了与全长e-钙黏素相比,与e-钙黏素的p70形式的优选结合((yn为56.5倍,并且iyn为67.1倍)和(yn为28.4倍,并且iyn为64.3倍))。
[0646]
实施例5表位作图
[0647]
p70 e-钙黏素与at1636的结合是甘露糖依赖性的
[0648]
在4℃下使用裂解缓冲液(0,5%triton x114(sigma),0.5%doc;0.1%sds,150mm nacl,10mm tris-hcl ph7.4,1.5mm mgcl2,补充有蛋白酶和磷酸酶抑制剂(roche))裂解dld1细胞(atcc ccl-221),进行3小时。裂解之后,通过离心去除不溶级分。接下来,用捕获到蛋白-g dynabead(invitrogen)和链霉亲和素珠(invitrogen)的不相关抗体(rsv抗体帕利珠单抗)预先清除裂解物,以去除非特异性结合蛋白。然后在4℃下将预先清除的裂解物与捕获到蛋白-g dynabead(invitrogen)的at1636抗体一起温育3小时,在裂解缓冲液中洗涤3次,并且用450mm甲基α-d-吡喃甘露糖苷(sigma)从珠中洗脱结合的蛋白质。在1x sds-page样品缓冲液(biorad)+0,1m dtt中通过sds-page凝胶分析洗脱液,接着在pvdf膜上进行蛋白质印迹。在用tbst/5%bsa封闭膜之后,将膜与兔抗e-钙黏素(ep700y,abcam)一起温育以检测e-钙黏素蛋白。如图8a所示,通过高甘露糖添加从at1636中洗脱p70 e-钙黏素,从而指示一个或多个甘露糖基团形成at1636结合表位的固有部分。通过elisa确认了at1636与e-钙黏素结合的甘露糖依赖性。使用山羊抗小鼠igg fcy抗体(jackson)在96孔板(costar)上捕获重组e-钙黏素蛋白。捕获了衍生自hek细胞的全长e-钙黏素(sino biologics)和衍生自大肠杆菌(lsbio)的全长e-钙黏素。在捕获并用tbs/0.05%tween洗涤2次之后,以剂量浓度添加at1636和ep700y(abcam)以及作为阴性对照的at1002。在用tbs/0.05%tween洗涤2次之后,使用山羊抗人igg fc(y)-hrp(jackson)或抗兔igg-hrp(dako)检测这些抗体的结合。使用tmb底物(sigma)使结合的抗体可视化,并且用h2so4(merck)停止反应,并使用envision板读取器(perkin elmer)通过od450测量来定量。虽然针对e-钙黏素的ec5结构域的兔抗体ep700y结合两种e-钙黏素重组蛋白,但at1636不结合大肠杆菌衍生的e-钙黏素(不携带翻译后修饰),其中它确实结合hek产生的重组e-钙黏素(参见图8b)。
[0649]
据报告,若干ser/thr残基被甘露糖基化;e-钙黏素的ec2结构域中有5个,ec3中有4个,ec4中有4个,并且ec5中有1个(larsen,pnas(2017),vester-christensen,pnas(2013)和lommel,pnas(2015))。在图3中,e-钙黏素上推定的o-甘露糖基化位点以黑色指示。在at1636免疫沉淀的p70 e-钙黏素蛋白的质谱法分析中,发现ser/thr残基被单一o-甘露糖基化。
[0650]
at1636与丙氨酸突变的ec3 e-钙黏素结构域的结合
[0651]
为了确定截短的e-钙黏素p70结构域内at1636抗体的精确结合表位,在截短的重组胞外结构域3(d3)内生成了多个丙氨酸突变。首先,生成了由氨基酸残基evslttstatvtvdvldvneapif组成的仅截短的细胞外结构域d3的结构域(图3)。另外,设计了每个残基的单个丙氨酸突变。将编码d3及其丙氨酸突变体的cdna克隆到pcdna3载体中,所述载体与flag标签和配备有转肽酶和his标签的小鼠fc尾部融合。在expi293或cho细胞中瞬时转染载体,并且在7天之后收获含有重组蛋白的上清液。在抗小鼠igg h+l(5ug/ml,jackson)涂覆的384孔光谱板hb(perkin elmer)上通过小鼠fc结构域捕获重组d3蛋白或其丙氨酸突变体。在温育并用tbs/0.05%tween洗涤2次之后,添加at1636-yn或对照ab at1002,并且在用tbs/0.05%tween洗涤2次之后使用二级山羊a-人igg fc(y)-hrp(jackson)检测这些抗体的结合。使用tmb底物使结合的抗体可视化,并且用h2so4停止反应。通过在envision板读取器(perkin elmer)上测量od450来建立结合抗体的定量。
[0652]
与以下野生型e-钙黏素相比,丙氨酸取代导致at1636-yn结合的部分消除:e463a、
s465a、t467a、s469a、t472a和v477a。t468a和t470a/g/n/d的取代完全消除了at1636-yn结合。实施例4图7b右图中还示出了残基470的重要性,其中at1636及其变体不能与在位置470处具有丙氨酸突变的d3-蛋白变体结合。总之,尤其是4个中心苏氨酸(467、468、470和472,至更小的程度)似乎控制at1636与e-钙黏素和p70 e-钙黏素的结合(参见图9)。
[0653]
实施例6 at1636的结合对应于tmtc3和e-钙黏素共表达
[0654]
larsen和同事报告了e-钙黏素甘露糖基化依赖于含有四-三-肽重复(tpr)重复的蛋白质(tmtc1
–
4)的存在(m.racap
é
m,plos one(2011),bartels mf,plos one(2016),j.c.sunryd,j biol chem(2014)和i.s.b.larsen,pnas(2017))。使用从布洛德研究所(https://portals.broadinstitute.org/ccle)的癌细胞系百科全书mrna数据库检索到的》1100个细胞系中全长e-钙黏素和tmtc3的mrna表达,建立e-钙黏素与tmtc3的共表达之间的强相关性,而对于其他tmtc1、2和4中的任一个都没有建立这种相关性。另外,可以建立e-钙黏素、tmtc3与at1636的结合之间的相关性(表3)。对于tmtc3和e-钙黏素的mrna表达使用7的截止值,所有显示tmtc3和e-钙黏素的mrna表达≥7的细胞系都被预测为at1636结合阳性。图10描绘了来自不同肿瘤类型且预测为at1636结合阳性的细胞系的百分比。一些实体瘤以高水平表达这两种基因,这表明大部分肿瘤细胞系,包括来自上(呼吸)消化道、食管、乳腺、结肠、前列腺、胰腺、胃、泌尿道、卵巢和肺的肿瘤,结合at1636或at1636高亲和力变体。
[0655]
在表达tmtc3的e-钙黏素阴性细胞系中表达全长e-钙黏素
[0656]
e-钙黏素完整编码序列从geneart获得并亚克隆到含有ires-gfp的phef慢病毒载体中。用vsv-g包膜产生慢病毒颗粒,并且用病毒转导sk-mel-5靶细胞(atcc htb-70),并在使用facs aria(bd)扩增至少一周之后针对gfp表达进行分选。使用山羊抗人-alexa647(invitrogen)和山羊抗兔-alexa647(jackson)抗体作为检测试剂,用at1002作为阴性对照抗体、at1636和ep700y e-钙黏素抗体对分离的细胞进行流式细胞术(图11)。在表达tmtc3但通常为e-钙黏素阴性的细胞sk-mel-5中过表达全长e-钙黏素导致at1636抗体的结合。
[0657]
at1636结合依赖于tmtc3
[0658]
设计了若干种shrna以靶向tmtc3 mrna(ncbi参考序列:nm_181783.4)。最终,所选的shtmtc3靶向最后一个编码外显子(14):22_mer:aggagacattctgatgaatcaa。将所选的shrna亚克隆到ptripz载体(thermo scientific)中,并且按照制造商的说明书生成具有vsv-g包膜的慢病毒颗粒。转导dld1细胞(atcc ccl-221),并且在添加1μg/ml多西环素(sigma)后诱导shrna的表达。培养4至7天之后,使用山羊抗人-alexa647(invitrogen)抗体针对at1636和at1002抗体的结合对细胞进行流式细胞术分析以检测结合的抗体。并行地,使用tripure分离试剂(roche)分离rna,并且用具有oligo-dt引物的superscriptiii逆转录酶试剂盒(invitrogen)生成cdna。使用tmtc3 qpcr正向引物5
’‑
ggtgtggttactgcctgctat-3’和反向引物5
’‑
ggacggtaagacttgtggct-3’并使用gapdh对照在具有iq sybrgreen超混液(biorad)的icycler(biorad)上进行定量pcr以检测tmtc3 mrna,从而定量mrna转录物。
[0659]
如图12所示,在tmtc3的shrna敲低后,at1636与dld1细胞的结合强烈地减少。
[0660]
实施例7靶向p70 e-钙黏素的t细胞接合器诱导对肿瘤细胞系的细胞毒性。
[0661]
t细胞接合抗体的生成
[0662]
t细胞接合抗体(tce)以tce格式生成,对于p70是二价的并且对于cd3ε结合(mtce)是单价的(图13a;s.atwell,journal of molecular biology(1997)和a.m.merchant,nature biotechnology(1998))。为了获得可以在仅一个重链c末端上配备单个抗cd3片段的抗体,使用在一个重链fc区中编码“杵(knob)”突变s354c和t366w(seq id)并且在另一个重链fc区中编码“臼(hole)”突变y349c、t366s、l368a、y407v(seq id)的at1636和at1636-iyn的序列。另外,在含有“杵”突变的重链序列中,c末端赖氨酸残基被c末端st-标签(氨基酸序列:ggggslpetgghhhhhh)置换。抗体在用三种不同的载体瞬时转染的cho细胞中表达,所述载体编码a)轻链,b)“杵”突变的含有st-标签的重链和c)“臼”突变的重链。生成mtce并且根据由l.bartels等人cancer res(2019)和l.bartels等人methods(2019)所述的方法进行纯化。培养7天之后,使用蛋白a色谱法,使用akta纯化系统(general electric lifesciences),从培养上清液中收获并纯化重组抗体。使用0.1m柠檬酸盐、150mm nacl、ph 3.5缓冲液洗脱抗体,随后在1m tris-hcl、ph 9.0中中和,并且然后通过尺寸排阻色谱法在tbs-ts中重新缓冲。使用nanodrop分光光度计(od280,thermofisher)建立浓度。使用尺寸排阻色谱法确认纯化抗体的单体含量》90%。通过sds-page建立纯化蛋白的完整性。
[0663]
接下来,使用转肽酶催化的转肽作用将st-标签修饰的重链c末端配备甲基四嗪点击手柄,并缀合到基于抗体ucht1的抗cd3单链可变片段,所述抗体已通过转肽酶催化的转肽作用进行修饰,类似于全长抗体,但具有互补的点击手柄反式环辛烯。
[0664]
类似地制备了基于抗体at1002的对照mtce(对第2组流感病毒的血凝素蛋白具有特异性)。
[0665]
使用pierce高容量内毒素去除离心柱(thermofisher)去除可能残留在mtce制剂中的内毒素,并且用endozyme测定试剂盒(hyglos)确认最终内毒素水平。
[0666]
在另一个实验中,我们生成了对于e-钙黏素和cd3ε二者为单价的t细胞接合器。将at1636变体重新格式化为由at1636、at1636-iyn或at1002的一条重链和轻链以及与fc尾部融合的单链抗cd3ε片段组成的杵臼(kih)双特异性形式(图13c)。抗体在用三种不同的载体瞬时转染的cho细胞中表达,所述载体编码a)at1636、at1636-iyn或at1002的轻链,b)携带突变s354c和t1636、at1636-iyn或at1002的t366w的“杵”突变的重链,以及c)携带
‘
臼’突变y349c、t366s、l368a和y407v的重链,其中vh-ch1区已经被ucht1单链可变片段(scfv)置换。使用hitrap mabselect sure柱(ge healthcare)作为其他抗体(如上所述)纯化kih双特异性抗体。
[0667]
at1636和-iyn的cd3 t细胞接合器诱导肿瘤细胞的细胞毒性
[0668]
在基于荧光素酶的细胞毒性测定中评估at1636和at1636-iyn的mtce变体。首先,用编码萤火虫荧光素酶的慢病毒载体转导dld1、hct116和ht29(所有crc细胞系),接着用由phiv或phcmv启动子(addgene)控制的zsgreen荧光蛋白进行转导。使用facs aria系统(bd)分选绿色荧光细胞。将转染和分离的细胞在平底组织培养板中与各种浓度的mtce并且与外周血单核细胞作为效应细胞在大约10:1的效应细胞与靶细胞比率中预温育过夜。在测定温育40-44小时之后,使用one-glo(一种含有荧光素的裂解溶液(promega))裂解细胞。使用envision板读取器(perkin elmer)获取发光。
[0669]
在t细胞接合测定中,at1636-iyn mtce诱导针对dld1、ht29和hct116靶细胞的细胞毒性,ec
50
值分别为139pm、476pm和926pm(图13b)。最大靶细胞裂解的范围是69%至91%。
at1636 mtce在较高浓度下诱导靶细胞裂解,并且在与阴性对照at1002 mtce温育之后未观察到裂解。
[0670]
at1636-iyn kih诱导针对dld1、ht29和a375靶细胞的细胞毒性,ec
50
值分别为160pm、2500pm和470pm(图13d)。最大靶细胞裂解的范围是34%至96%。at1636和at1002 kih仅在较高浓度下诱导靶细胞裂解。
[0671]
实施例8.p70 e-钙黏素的过表达起到去粘附分子的作用。
[0672]
e-钙黏素全长开放阅读框和p70 e-钙黏素编码序列从geneart获得并亚克隆到含有ires-gfp的phef慢病毒载体中。用vsv-g包膜产生慢病毒颗粒,并且用病毒转导靶细胞。选择转导细胞用于gfp表达并以等量接种。在48小时之后,过表达p70 e-钙黏素蛋白的细胞表现出异常的圆形细胞形态,如图14中描绘的,这表明细胞
–
细胞相互作用较弱、单细胞较多、以及上皮间质转化(emt)(v.padmanaban,nature(2019)和n.m.aiello,developmental cell(2018))。
[0673]
实施例9.在存在tgfβ的情况下,上皮细胞系上at1636的结合增加。
[0674]
tgfβ是熟知的促进其上皮间质转化的因子。将tgfβ(prospec,rehovot,israel)(v.padmanaban,nature(2019),d.v.f.tauriello,nature(2018)和n.m.aiello,developmental cell(2018))以10至40ng/ml添加到人crc细胞系dld1、小鼠结肠cmt93、人皮肤a431和人乳腺mcf7(一种细胞系)中,持续6至7天。每隔一天添加tgfβ,并且在第4天更新培养基。将细胞在24孔板中以低细胞密度在组织培养物处理的塑料上或在用纤连蛋白涂覆的孔中培养。另外,在适当的情况下,在存在或不存在tgfβ的情况下添加at1636或at1636-iyn(浓度在10与50μg/ml之间)。通过operetta(perkin elmer)监测细胞形态和细胞密度,并且通过流式细胞术监测at1636或at1636-iyn与细胞系的结合(mfi/细胞)。
[0675]
在图15中,示出了在存在或不存在tgfβ的情况下培养的细胞系之间at1636-iyn的结合比率。在存在tgfβ的情况下延长培养以3-4倍增加了at1636-iyn与a431和cmt93的结合,而发现对mcf7的诱导较小,如通过流式细胞术确定。观察到在存在tgfβ的情况下at1636与ht29细胞的结合的变化较小。
[0676]
在如上所述与tgfβ和at1636-iyn抗体共培养5-7天期间,观察到a431细胞的细胞生长和附着在孔表面的细胞数量减少(参见图16a(10x放大率)和图16b(20x放大率))。在直接在塑料或纤连蛋白涂覆孔上培养细胞的环境中观察到这种作用。
[0677]
实施例10.at1636和高亲和力变体的内化
[0678]
将8,000个dld1细胞接种在96孔板中,每孔100μl,并培养o/n。按照制造商的说明书,在15分钟温育期间,将at1636、at1636高亲和力变体、at1002和sc10.17抗体与山羊抗人fc fab标记的zenon phrodo ifl染料(invitrogen)缀合。接下来,将抗体添加到dld1细胞中,并且通过在incucyte(essenbio)中每小时检测一次,持续最多60小时来随时间监测phrodo缀合抗体的内化。
[0679]
在图17中,描绘了酸性环境诱导的phrodo染料荧光,这指示at1636和at1636高亲和力变体被内化到dld1细胞中。与at1636-yn、at1636或sc10.17抗体相比,at1636-iyn抗体在内化方面最有效。相比之下,作为阴性对照的at1002没有内化。
[0680]
实施例11.cd8+t细胞上全长和p70e-钙黏素与cd103的相互作用。
[0681]
使用ficoll梯度离心从收集在锂-肝素管中的血液中获得新鲜pbmc,并且按照制
造商的说明书,使用magnisort
tm
人cd8 t细胞富集试剂盒(thermo fisher)分离cd8+t细胞。随后,在10μg/ml pha、6000u/ml il-2和10ng/ml tgfβ存在的情况下,以1ml中1x106个pbmc的细胞密度,将cd8+细胞在rpmi 10%fcs青霉素/链霉素中培养。大约10天之后,通过流式细胞术确定cd8细胞上的cd103表达(ber act 8克隆,bd,fitc标记)。
[0682]
为了分析cd8+t细胞上的cd103与结合板的e-钙黏素蛋白的相互作用,在含有1mm ca
2+
和mg
2+
的dpbs中o/n涂覆全长和p70 e-钙黏素,并且在rt下将表达cd103的cd8+t细胞用5μm celltrace-cfse(thermo fisher)标记5分钟。接下来,将细胞以1x105/ml浓度重悬于具有1mm mn
2+
培养基中,并且与10μg/ml的at1002阴性对照抗体、抗cd103抗体和at1636及其-iyn变体预温育30分钟。将50.000个细胞(100μl)在37℃下添加到每个含有e-钙黏素蛋白的孔中30分钟之后,通过翻转板来清空孔,用dpbs洗涤并用在dpbs中的3.7%福尔马林固定,之后在荧光显微镜中分析。
[0683]
图18中描绘了cfse标记的cd103+cd8+t细胞的孔覆盖率。当细胞与cd103特异性抗体mca708预温育时,细胞不粘附到全长e-钙黏素上。当细胞与at1636预温育时,-iyn变体细胞仍然可以附着,这指示at1636不与细胞上的cd103蛋白相互作用。另外,我们观察到cd103+cd8+t细胞不附着到p70 e-钙黏素蛋白上。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1