液滴及其制造方法
1.相关申请的相互参照本技术主张基于2020年6月9日申请的日本专利申请第2020-100517号说明书(其公开的全部内容通过参照援引于本说明书中)的优先权。本发明涉及液滴及其制造方法。
背景技术:
2.液滴(droplet)作为连续酶反应等多阶段反应场逐渐为人所知,已知其构成因子是通过将基于rna、dna、atp等的第二级信使添加至天然变性蛋白质这种自然结构不规则蛋白质而形成。已知形成液滴的代表例即fus,由不具有结构的序列反复出现的低复杂性结构域(low complexity domain:lc结构域)构成液滴的核。作为控制该液滴的形成
·
解离的因子,已知伴侣蛋白,并有报告称其也包含在液滴内。伴侣蛋白是指控制蛋白质凝聚的蛋白质组的总称。但是,没有具有作为伴侣蛋白和酶的功能的蛋白质单独形成液滴的例子。作为赋予伴侣蛋白和酶的两种以上功能的蛋白质的结构域,已知硫氧还蛋白。已知硫氧还蛋白是低分子量的氧化还原蛋白质,通过促进其他蛋白质的半胱氨酸残基形成的二硫键的还原
·
切断,在各种生命反应中发挥重要的作用。现有技术文献非专利文献
3.非专利文献1:science,360(6391),922-927(2018)非专利文献2:proc.natl.acad.sci.usa,108(11),4334-4339(2011)非专利文献3:nat.rev.mol.cell biol.,18(5),285-298(2017)非专利文献4:cell,149(4),753-767(2012)非专利文献5:cell,149(4),768-779(2012)非专利文献6:int.j.biol.macromol.,10(pta),10-18(2018)非专利文献7:j.biol.chem.;289(39):27004-18(2014)非专利文献8:structure,29,1-14(2021)
技术实现要素:
发明所要解决的技术问题
4.目前为止,不知道具有伴侣蛋白和酶功能的蛋白质单独形成液滴,因此,本发明所要解决的技术问题是开发上述液滴的制备技术。用于解决技术问题的手段
5.在上述状况下,本发明人等进行了深入研究,结果发现:通过使用包含1个以上的硫氧还蛋白样结构域的蛋白质,能够制作液滴。基于上述新的见解,本发明人等研究了用于形成液滴的因子、包含硫氧还蛋白样结构域的蛋白质的优选结构等条件,从而完成了本发明。
6.因此本发明提供以下方案:
方案1.一种包含蛋白质的聚集体的液滴,该蛋白质为pdi家族蛋白和/或人造蛋白质,且包含硫氧还蛋白样结构域。
7.方案2.根据方案1记载的液滴,其中,上述蛋白质具有钙结合区域。
8.方案3.根据方案1或2记载的液滴,其中,上述蛋白质具有2个以上的硫氧还蛋白样结构域,该2个以上的硫氧还蛋白样结构域中的至少2个介由连接子(linker)而相互结合,该连接子包含选自丝氨酸、甘氨酸、脯氨酸、谷氨酸、谷氨酰胺、天冬氨酸、天冬酰胺、精氨酸、赖氨酸和酪氨酸中的至少1种的氨基酸残基。
9.方案4.根据方案1~3中任一项记载的液滴,其中,上述蛋白质为二聚体以上。
10.方案5.根据方案2~4中任一项记载的液滴,其中,所述pdi家族蛋白为p5。
11.方案6.一种液滴的制造方法,其包括:在钙离子的存在下,使蛋白质聚集的工序,其中,该蛋白质为pdi家族蛋白和/或人造蛋白质,且包含硫氧还蛋白样结构域,该蛋白质还具有钙结合区域。
12.方案7.根据方案6记载的方法,其中,上述2个以上的硫氧还蛋白样结构域中的至少2个介由连接子而相互结合,该连接子包含选自丝氨酸、甘氨酸、脯氨酸、谷氨酸、谷氨酰胺、天冬氨酸、天冬酰胺、精氨酸、赖氨酸和酪氨酸中的至少1种的氨基酸残基。
13.方案8.根据方案6或7记载的方法,其中,上述pdi家族蛋白为二聚体以上。
14.方案9.根据方案6~8中任一项记载的方法,其中,上述pdi家族蛋白为p5。发明效果
15.根据本发明,能够使用蛋白质来制备液滴,上述蛋白质为迄今为止不知道形成液滴的蛋白质。如后述所示,典型地在液滴中其构成蛋白质具有流动性且以能够相互接触的距离相互作用,因此,例如,在添加作为反应原料的物质的情况下,该物质进入液滴的构成蛋白质之间,且能够在该构成蛋白质具有的硫氧还蛋白附近被浓缩。因此,本发明的液滴作为硫氧还蛋白等酶反应、脱聚反应、不良蛋白质的保管的反应场使用等是有用的。以往由于没有具有硫氧还蛋白活性的蛋白质单独形成液滴的例子,因此本发明对酶反应,脱聚反应非常有用。
附图说明
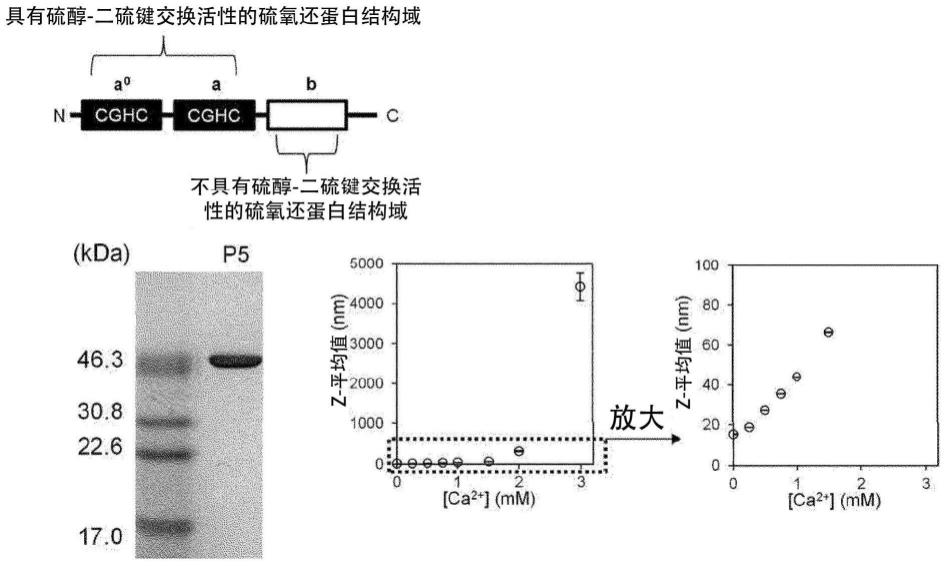
16.图1:左上表示纯化蛋白质的sds-page结果,表示其为高纯度纯化品。右边表示使用的pdi家族的硫氧还蛋白样结构域的组成和ss交换活性位点。左下表示通过dls检测得到的粒径的变化。pdi家族中p5钙依赖性地缔合。图2:左侧是将图1的粒径的长轴放大至5000nm得到的图。在3mm的钙存在下,p5形成4500nm左右的缔合体。在右图中,示出在左图中制作得到的缔合体中滴定edta的结果。在滴定的同时,p5缔合体恢复为非缔合体,意味着具有可逆性。图3:通过相差显微镜可知p5的缔合体为球形。随着时间变化,球形缔合体彼此融合,球形缔合体长大。图4:表示荧光显微镜图像和相差显微镜图像的重合的结果。通过照射强烈的激光,荧光暂时退却的球形聚集体随着时间变化而出现荧光恢复。下图是荧光恢复的分析结果,可知为约19秒的半衰期。通过该frap实验,证实球形缔合体为液滴。图5表示钙和p5的各浓度混合后,离心,上清液级分的浓度。
图6:通过itc测定确定p5的钙结合区域。上面表示p5的各种突变体,下面表示各个突变体与钙的itc实验结果。向上的热量表示因结合而产生的热量,可知位于c末端的结构不规则区域为钙结合区域。图7表示使用能够测量折射率的荧光显微镜对液滴进行的实时观察。正中表示捕捉到液滴彼此要融合的瞬间的图像。另外,由于液滴表面比较粗糙,因此意味着流动性高。图8表示在液滴内部各种酶
·
伴侣蛋白和谷胱甘肽能够浓缩。图中通过折射率(ri)证实其为液滴,通过荧光标记的各种酶
·
伴侣蛋白、谷胱甘肽表示局部存在。内质网内局部存在的酶
·
伴侣蛋白即erp46、erp72、erp57、erp44容易在液滴内部浓缩,但pdi难以进入液滴内部。另外,表示通过使用mcherry-erp57和gfp-erp72,能够在液滴内部浓缩至少两种酶
·
伴侣蛋白。另外,atto532标记的谷胱甘肽也能够在本液滴内部浓缩。图9表示液滴形成中的ph依赖性。液滴形成中优选ph7.4以下。图10表示液滴形成中的温度依赖性。液滴形成中优选低温。图11表示液滴形成中的p5的结构域的重要性。液滴形成中优选全长p5。图12是p5的新结构。各硫氧还蛋白样结构域之间的可动性高。另外,在溶液中形成二聚体。图13:在上面的图中,根据晶体结构可知,p5的二聚体形成是以位于最初的a0结构域中的第四个α螺旋的亮氨酸拉链模体(motif)作为驱动力。因此,如果将该位点置换为丙氨酸,则在溶液中成为单体(下图)。图14表示通过相差显微镜,p5单体的缔合体与野生型相同,能够形成液滴。图15:利用p5液滴浓缩谷胱甘肽。谷胱甘肽的分离采用反相hplc。可知液滴形成后谷胱甘肽几乎全部消失。图16:基于p5液滴的底物氧化折叠催化剂。底物的折叠状态采用反相hplc。可知液滴形成后,氧化折叠反应之后不久还原改性底物几乎全部消失。图17:针对p5液滴的有机溶剂的适用例。以v/v进行各种添加,通过相差显微镜进行观察。图18:盐对p5液滴的效果。通过相差显微镜进行观察。与图3的无盐条件相比,盐对液滴形成的大小产生影响,因此是液滴形成大小的控制因素。图19表示向液滴内部的摄取程度。制作利用gfp进行荧光标记的各种pdi家族,对其摄取情况进行评价,结果可知,pdi难以摄取,erp46容易摄取。图20表示各种生物的p5的氨基酸序列。图21表示液滴抑制淀粉样纤维形成。纵轴表示荧光强度,是使用特异性检测淀粉样纤维的硫磺素t的实验,如果添加液滴,则显示淀粉样纤维被抑制。
具体实施方式
17.本发明中,“蛋白质(蛋白)”以包含氨基酸通过肽键聚合而成的多肽的含义使用。另外,在本说明书中,只要没有特别提及,则“蛋白质”包含被糖链等修饰的蛋白质和非修饰的蛋白质这两者。这对于没有明确记载为蛋白质的蛋白质也是同样的。
18.液滴本发明提供一种包含蛋白质聚集体的液滴,该蛋白质为pdi家族蛋白和/或人造蛋
白质,且包含硫氧还蛋白样结构域。
19.液滴(droplet)是指蛋白质进行液液相分离的大致球状的聚集体,且与由热变性等引起的不规则的聚集体不同,表示上述蛋白质聚集体具有可逆性。在蛋白质聚集而形成液滴时,也可以任意选择与核酸(例如,dna、rna)、crowder(例如,ficol、甘油)等蛋白质以外的物质组合而形成液滴。另外,通过温度变化、ph变化也形成液滴。
20.在本发明中,聚集是指蛋白质聚集。在典型的实施方式中,液滴的形成通过基于分子水平的分子聚集的液滴形成、以及基于该液滴的融合而在显微镜下可观察水平的液滴生长而产生。
21.另外,如前述所示,聚集与热变性、化学变性等引起的蛋白质的不规则聚集体等不同,是蛋白质的具有可逆性的聚集。因此,通过调整周边环境中的条件(促进聚集的因子的浓度、温度、ph、基于crowder的排除体积效果等),能够控制由蛋白质的聚集引起的液滴的形成以及由构成液滴的蛋白质的解离引起的液滴的崩解。
22.另外,典型地,在形成液滴的状态下,蛋白质虽然以能够相互接触的距离相互作用,但与聚集体不同,其具有流动性。因此,蛋白质的分散体、液滴和聚集体有时也被比作物质的3个状态(气体、液体、固体)。具体而言,水溶液中蛋白质分散的状态被比作气体,蛋白质等构成成分具有流动性的液滴被比作液体,构成成分之间的相互作用强且不具有流动性的聚集体被比作固体。另外,生物学相分离是指介由蛋白质形成液滴的状态,以使得水和油不相互混合而进行液相分离。如上述所示,作为本发明主题的“液滴”是指,不是水、有机溶剂这样的液体的颗粒,也不是利用脂质双层膜等膜包裹液体而成的颗粒,而是蛋白质可逆性地聚集而成块的颗粒。因此,作为可逆的蛋白质聚集体的液滴,被报道作为酶底物反应的多阶段反应和高效的化学反应场,并具有作为超级增强剂的使用用途。
23.在本发明中,作为具有硫氧还蛋白样结构域的蛋白质,可举出pdi(蛋白质二硫化物异构酶:protein disulfide isomerase)家族蛋白、人造蛋白质。它们可以单独使用1种,也可以组合使用。作为pdi家族蛋白,例如可举出pdi、erp46、erp72、p5等,优选为p5等。作为人造蛋白质,例如可举出pdi家族蛋白的变异体等。具有硫氧还蛋白样结构域的蛋白质存在于所有的生物中,例如可举出源自人、猴子、小鼠、大鼠、兔、猫、狗、猪、牛、马、绵羊等哺乳动物;鸡等鸟类;酵母等微生物的蛋白质等。
24.作为上述具有硫氧还蛋白样结构域的蛋白质,优选具有伴侣蛋白功能的蛋白质。伴侣蛋白功能是指辅助蛋白质的适当折叠的功能,通过使用具有伴侣蛋白功能的蛋白质,可抑制蛋白质的不可逆聚集,促进可逆的聚集,故优选。另外,以往没有能够利用同时具有酶活性和伴侣蛋白功能的蛋白质形成液滴的报告,因此,在上述方面,本发明也是有用的。
25.在典型的实施方式中,作为上述蛋白质,优选为具有1个以上的硫氧还蛋白样结构域的蛋白质。每个蛋白质的硫氧还蛋白样结构域的数量下限没有限制,优选为1个以上,更优选为2个以上。每个蛋白质的硫氧还蛋白样结构域的数量上限也没有限制,优选为7个以下,更优选为6个以下,更优选为5个以下,更优选为4个以下。每个蛋白质的硫氧还蛋白样结构域的数量范围也没有限制。在本发明中,硫氧还蛋白样结构域在存在于所有生物的氧化还原反应等各种生命反应中承担重要的作用。本发明中,硫氧还蛋白样结构域的分子量例,如为,约10~15kda,典型地为13kda左右。具有氧化还原活性cxxc模体的硫氧还蛋白样结构域可介由该基序直
接催化靶分子的氧化还原反应,不具有氧化还原活性cxxc模体的硫氧还蛋白样结构域则参与底物识别等。二硫键的还原
·
切断活性,例如,可通过非专利文献7记载的方法进行测定。
26.作为具有二硫键的还原
·
切断活性的硫氧还蛋白样结构域,例如可举出pdi家族蛋白即p5中的a0结构域、a结构域等。另外,作为具有二硫键的还原
·
切断活性的硫氧还蛋白样结构域,如图20所示,优选具有cghc的氨基酸序列的结构域。作为a0结构域的氨基酸序列,可举出图20(的氨基酸序列)所示的各种生物的任意a0结构域的氨基酸序列和在该氨基酸序列中添加、置换或缺失1个以上(例如,1~5个、1~3个、1~2个)氨基酸的氨基酸序列等。作为a结构域的氨基酸序列,可举出图20(的氨基酸序列)所示的各种生物的任意a结构域的氨基酸序列和在该氨基酸序列中添加、置换或缺失1个以上(例如,1~5个、1~3个、1~2个)氨基酸的氨基酸序列等。在构成液滴的蛋白质具有包含上述的图20所示的a0结构域的氨基酸序列中添加、置换或缺失1个以上氨基酸的氨基酸序列的结构域作为硫氧还蛋白样结构域的情况下,作为添加、置换或缺失氨基酸的位点,优选在多种生物种中保存的氨基酸以外(例如,图20所示的7种中的4种以上、5种以上、6种以上或7种全部)的位点。在构成液滴的蛋白质具有包含在上述的图20所示的a结构域的氨基酸序列中添加、置换或缺失1个以上氨基酸的氨基酸序列的结构域作为硫氧还蛋白样结构域域的情况下,作为氨基酸添加、置换或缺失的位点,优选在多种生物种中保存的氨基酸以外(例如,图20所示的7种中的4种以上、5种以上、6种以上或7种全部)的位点。
27.作为不具有二硫键的还原
·
切断活性的硫氧还蛋白样结构域,例如,可举出p5中的b结构域等。作为b结构域的氨基酸序列,可举出图20(的氨基酸序列)所示的各种生物的任意b结构域的氨基酸序列和在该氨基酸序列中添加、置换或缺失1个以上(例如,1~5个、1~3个、1~2个)氨基酸的氨基酸序列等。构成液滴的蛋白质具有包含在上述的图20所示的b结构域的氨基酸序列中添加、置换或缺失1个以上氨基酸的氨基酸序列构成的结构域作为硫氧还蛋白样结构域的情况下,作为氨基酸添加、置换或缺失的位点,优选在多种生物种中保存的氨基酸以外(例如,图20所示的7种中的4种以上、5种以上、6种以上或7种全部)的位点。
28.另外,在本发明中,上述具有硫氧还蛋白样结构域的蛋白质,优选具有促进聚集的因子能够结合的区域(聚集促进因子结合区域)。作为聚集促进因子,可举出钙离子、其他金属离子等,优选钙离子等。在此,聚集促进因子结合区域是指包含e、d的序列,且能够结合聚集促进因子的区域。聚集促进因子结合区域可以存在于与本发明的蛋白质中的硫氧还蛋白样结构域等不同的区域,也可以包含于硫氧还蛋白样结构域等的一部分,也可以是这两者。
29.当聚集促进因子为钙离子时,有时将聚集促进因子结合区域表示为钙结合区域。钙结合区域也可以如ef-hand结构域那样形成结构域。作为钙结合区域,例如可举出p5中的钙结合区域等。作为p5中的钙结合区域的氨基酸序列,可举出图20所示的氨基酸序列中的钙结合区域部分,更具体而言,可举出ptiverepwdgrdgelpveddidlsdvelddlgkdel(序列号1)、ptitprepwdgkdgelpveddidlsdvelddlekdel(序列号2)、pkihavepwdgkdgelpveddidlsdvdlddiwdkdel(序列号3)、ptistrepwdgkdgelpveddidlsdvelddlekdel(序列号4)、paisvrdpwdgqdgvlpveddidlsdvelddlekdel(序列号5)、pkihtveawdgkdgvlpveddidlsdvdlddldkdel(序列号6)、pkintvqawdgkdgelpmeddidlsdvdlddlekdel(序列号7)的氨基酸序列,在该氨基酸序
列中添加、置换或缺失1个以上(例如,1~5个、1~3个、1~2个)氨基酸的氨基酸序列等。构成液滴的蛋白质具有包含在上述序列号1~7的氨基酸序列中添加、置换或缺失1个以上的氨基酸的氨基酸序列的结构域作为钙结合区域的情况下,作为氨基酸添加、置换或缺失的位点,优选在多种生物种中保存的氨基酸以外(例如,图20所示的7种中的4种以上、5种以上、6种以上或7种全部)保存的氨基酸以外)的位点。
30.在本发明中,聚集促进因子结合区域(钙结合区域等)也可以包含于硫氧还蛋白样结构域中的任意一部分,优选在硫氧还蛋白样结构域以外具有聚集促进因子结合区域。在本发明中,作为构成液滴的蛋白质,优选为具有:2个具有二硫键的还原
·
切断活性的硫氧还蛋白样结构域、1个不具有二硫键的还原
·
切断活性的硫氧还蛋白样结构域以及1个聚集促进因子结合区域的蛋白质。
31.另外,在本发明中,优选在硫氧还蛋白样结构域与硫氧还蛋白样结构域之间、聚集促进因子结合区域与聚集促进因子结合区域之间、硫氧还蛋白样结构域与聚集促进因子结合区域之间等具有连接子序列。另外,连接子优选含有选自丝氨酸、甘氨酸、脯氨酸、谷氨酸、谷氨酰胺、天冬氨酸、天冬酰胺、精氨酸、赖氨酸和酪氨酸中的至少1种的氨基酸残基。这些氨基酸残基难以成为空间位阻,因此介由该连接子而结合的各结构域能够灵活地移动,容易采取适于液滴形成的配置,故优选。另外,在本发明中,在具有硫氧还蛋白样结构域的蛋白质具有连接子序列的情况下,该连接子序列优选具有一定长度。可以预见:通过使该连接子序列具有一定长度,硫氧还蛋白样结构域的溶解性降低,对液滴形成做出适当的贡献。因此,在具有硫氧还蛋白样结构域的蛋白质具有连接子序列的情况下,至少1个连接子序列(例如,后述的a0结构域与a结构域之间的连接子序列、b结构域与钙结合区域之间的连接子序列等)优选为5个氨基酸以上,进一步优选为25个氨基酸以上。另外,各连接子序列长度的上限没有特别限制,例如优选为50个氨基酸以下。
32.另外,作为构成液滴的蛋白质,可以在具有上述结构域的蛋白质中融合内质网局部存在的信号序列。作为信号序列,可举出图20中作为信号序列表示的氨基酸序列以及在该氨基酸序列中添加、置换或缺失1个以上(例如,1~5个、1~3个、1~2个)氨基酸的氨基酸序列等。
33.在使用p5或其变体作为构成液滴的蛋白质的情况下,优选全部包含a0结构域、a结构域和b结构域。另外,作为上述蛋白质的氨基酸序列,例如可举出:具有图20所示的各种生物中任意的a0结构域、a结构域、b结构域和钙结合区域的氨基酸序列(作为上述氨基酸序列,优选举出:进一步具有a0结构域和a结构域之间的连接子序列、a结构域和b结构域之间的连接子序列以及b结构域与钙结合区域之间的连接子序列的氨基酸序列、上述连接子序列以外还具有信号序列的氨基酸序列等)、具有在该氨基酸序列中添加、置换或缺失1个以上(例如,1~5个、1~3个、1~2个)氨基酸的氨基酸序列的氨基酸序列等。在氨基酸从作为上述基准的氨基酸添加、置换或缺失的情况下,作为其位置,例如可举出上述位置等。另外,作为构成液滴的蛋白质,可举出具有图20所示的各种生物中任意的p5氨基酸序列的蛋白质、具有在该氨基酸序列中添加、置换或缺失1个以上(例如,1~5个、1~3个、1~2个)氨基酸的氨基酸序列的蛋白质等。
34.另外,在本发明中,具有硫氧还蛋白样结构域的蛋白质可以是单体,优选形成二聚体以上(二聚体、三聚体、四聚体或更大)。在本说明书中,有时也将形成二聚体以上的蛋白
质总称,表示为多聚体。在本发明中,具有硫氧还蛋白样结构域的蛋白质可以是选自这些单体和多聚体中的2种以上的混合物。
35.另外,在本发明中,构成液滴的蛋白质优选具有以下结构:具有结构不规则的区域,在该结构不规则区域的n和c末端中具有至少一个硫氧还蛋白结合区域。另外,在本发明中,优选每个蛋白质单体存在1处钙结合位点。特别优选钙与结构不规则的区域结合。构成本发明的液滴的蛋白质优选为均具有上述3个特征的结构。
36.在本发明的典型的实施方式中,液滴具有大致球形的形态。另外,在本发明的一个实施方式中,液滴的平均粒径优选为50nm以上。在本发明中,也存在液滴彼此能够融合的情况,液滴的平均粒径的上限没有限制,例如优选为20μm以下。在上述实施方式中,平均粒径可使用动态光散射装置进行测定,更具体而言,可通过后述的实施例记载的方法进行测定。
37.在本发明中,液滴能够以分散在水性或有机性的液体中的状态得到。因此,本发明还提供液滴的分散液。本发明的液滴的分散液典型地表现出凝胶状的特性。本发明的液滴的分散液的上限没有特别限制,优选为10以下,更优选为9以下,进一步优选为7.4以下。本发明的液滴的分散液中ph的范围没有特别限制,例如优选为2~10,更优选为5~9,进一步优选为6~7.4。
38.液滴的制造方法本发明提供一种液滴的制造方法,其包括:在聚集促进因子的存在下,使蛋白质聚集的工序,其中,该蛋白质为pdi家族蛋白和/或人造蛋白质,且包含硫氧还蛋白样结构域。聚集促进因子、包含硫氧还蛋白样结构域的蛋白质等如上文描述所示。
39.本发明的方法包括:在聚集促进因子的存在下使蛋白质聚集的工序。在典型的实施方式中,该工序通过使聚集促进因子与蛋白质混合来进行。另外,该工序通常在水性或有机性液体中进行,优选在水性液体中进行。作为水性液体,可举出水、乙醇、甲醇、三氟乙醇等。作为有机性液体,可举出甲酰胺、乙二醇等。这些液体可单独使用1种或混合使用2种以上。例如,可在水中混合使用选自乙醇、甲醇、三氟乙醇中的至少1种。在上述实施方式中,选自乙醇、甲醇、三氟乙醇中的至少1种亲水性液体的配合比例(v/v),以水与该亲水性液体的混合液的容量为基准,例如可设定为15%以下,优选设定为13%以下,更优选设定为10%以下。在上述实施方式中,上述亲水性液体的配合比例,以水与该亲水性液体的混合液的容量为基准,例如可设定为1%以上,优选设定为3%以上,更优选设定为5%以上。在液体中进行该工序的情况下,也可以在该液体中添加具有硫氧还蛋白样结构域的蛋白质和聚集促进因子以外的成分。作为具有硫氧还蛋白样结构域的蛋白质和聚集促进因子以外的成分,可举出氧化型谷胱甘肽、还原型谷胱甘肽等ph调节剂、hepes等缓冲剂等。这些成分可以单独使用1种或组合使用2种以上。
40.作为具有硫氧还蛋白样结构域的蛋白质的使用量,没有特别限制,例如,在液体中进行该工序的情况下,优选为5μm以上,更优选为20μm以上。聚集促进因子的使用量也没有特别限制,在液体中进行该工序的情况下,优选为500~μm,更优选为4mm以上。
41.在该工序中,ph的上限没有特别限制,优选为10以下,更优选为9以下,进一步优选为7.4以下。在该工序中,ph的范围没有特别限制,例如优选为2~10,更优选为5~9,进一步优选为6~7.4。进行该工序时的温度也没有特别限制,例如优选为0~70℃,更优选为0~20℃。进行该工序的时间也没有特别限制,例如优选为1分钟以上,更优选为10~60分钟。通过
进行该工序,具有硫氧还蛋白样结构域的蛋白质通过聚集促进因子的作用而聚集,形成液滴。
42.在本发明的方法中,还可以进行回收得到的液滴的工序。可适当使用本身公知的方法(过滤、离心分离、色谱等)。实施例
43.试验例1在大肠杆菌表达用pet15b载体(novagen)的限制性内切酶ndei-bamhi位点间插入添加有his
×
6标签的重组p5的碱基序列,制作质粒。将p5质粒转化至感受态细胞bl21(de3)后,利用la琼脂培养基(lb琼脂培养基+50mg/l氨苄青霉素)在37℃培养一晚。从琼脂培养基挑取单菌落,接种于100ml的la培养基(100ml的lb培养基+5mg氨苄青霉素),然后,在37℃振荡培养一夜。在2l的lb培养基中添加100mg氨苄青霉素、前培养液20ml,在37℃振荡培养4小时。4小时(od=0.5左右)后,添加异丙基-β-d-硫代半乳糖苷(isopropylβ-d-1-thiogalactopyranoside(iptg)),使终浓度为0.5mm,进而在37℃振荡培养4小时。4小时后,进行离心分离(5000
×
g,10分钟,4℃),进行集菌。利用缓冲液(50mm tris/hcl,ph8.1,0.3m nacl,1mm苯甲基磺酰氟(phenylmethylsulfonyl fluoride))将菌体溶菌后,利用均质机破碎。离心分离(12000
×
g,20min,4℃)破碎溶液,再对上清液进行超离心分离(38000rpm,30min,4℃),回收上清液。在上清液中添加利用缓冲液(50mm tris/hcl,ph8.1,0.3m nacl)平衡化后的ni-nta琼脂糖(qiagen),在4℃搅拌1小时。1小时后,施加于开放柱,利用40ml的缓冲液(50mm tris/hcl,ph8.1,0.3m nacl,20mm咪唑)清洗2次,利用10ml的缓冲液(50mm tris/hcl,ph8.1,0.3m nacl,200mm咪唑)洗脱5次。利用10%sds-page确认洗脱得到的试样后,利用amicon ultra(mwco,10000:millipore)将p5的洗脱级分浓缩至500μl。将浓缩得到的试样施加于利用akta色谱系统(ge helthcare)的强阴离子交换色谱(monoq10/100gl;ge healthcare)并进行纯化。此时,使用缓冲液a(50mm tris/hcl,ph8.1,1mm edta)、缓冲液b(50mm tris/hcl,ph8.1,0.5m nacl,1mm edta)。利用10%sds-page确认洗脱得到的试样后,利用amiconultra(mwco,10000:millipore)将p5的洗脱级分浓缩至250μl。进而,通过凝胶过滤色谱(superdex 200 10/300gl;ge healthcare)进行纯化。此时,使用缓冲液(50mm tris/hcl,ph8.1,0.3m nacl,1mm edta)。利用10%sds-page确认洗脱得到的试样后,利用amicon ultra(mwco,10000:millipore)将p5的洗脱级分浓缩至500μl,通过bca法进行浓度定量,得到高纯度纯化品(图1)。通过能够评价粒径的动态光散射装置dynamic light scattering(dls)发现:对高纯度精制品即p5滴定钙,p5会因钙滴定而缔合(图1)。p5蛋白质溶液以50mm hepes、ph7.2、50μm蛋白质浓度进行。如果滴定钙的螯合剂即edta至钙依赖性的p5缔合状态,则转化为非缔合状态p5(图2)。根据以上结果,p5能够钙依赖性可逆地聚集。
44.试验例2.利用安装有物镜ucplfln 20
×
ph(na0.7)的共聚焦激光扫描型生物显微镜(fv1000,olympus)对上述试验例1的钙依赖性的p5缔合体进行相差观察。可观察到钙依赖性的p5缔合体为大致正球状的颗粒。随着时间推移,还观察到缔合体之间融合的情形,表明缔合体增长(图3)。
45.试验例3.
与通常的聚集体不同,液滴具有流动性,因此在内外产生物质的出入。光漂白荧光恢复技术(frap)是用于研究液滴状缔合体的物质特性、相关分子传输动力学的常见方法(bracha 2019nat biotech)。因此,为了验证钙依赖性的p5缔合体是否为液滴,进行了frap实验。此时,除了与上述试验例1同样的组成以外,还制备使融合有荧光蛋白质(mcherry)的p5(mcherry-p5)共存的试样(50mm hepes、ph7.5、50μm p5、4μm mcherry-p5),与试验例2相同进行观察(图4)。mcherry-p5利用559nm的激光进行激发,获得相差和荧光图像。如上图所示,在相差图像中观察到的p5缔合体中可确认到mcherry-p5的荧光,显示在p5缔合体中摄取有mcherry-p5。然后,使缔合体进行光漂白,结果确认到缔合体的荧光伴随时间变化而恢复(图4、下图。测定进行3次,均得到相同的结果。图4左下图显示其中一次的图表。将统计分析结果示于图4右下图)。该结果表明:在缔合体内部漂白的mcherry-p5被排出,无损伤的mcherry-p5重新从外部流入,证实了钙依赖性的p5缔合体为具有流动性的液滴。
46.试验例4.为了验证液滴形成的最佳条件,研究了钙和p5浓度的条件。将并非通过试验例1记载的方法得到的液滴的p5溶液(5~100μm p5)和钙溶液以不同浓度混合并静置10分钟,然后通过15000g、4度、30分钟的离心分离将液滴分级为沉淀,并标定上清液级分的浓度。其结果显示:为了使p5形成液滴,临界浓度为20μm,钙为4mm以上是适当的(图5)。
47.试验例5.为了确定钙结合区域,制备了p5的各种突变体,并通过等温滴定型热量计itc进行了相互作用分析。为了确定p5的钙结合位点,如图6所示,制备了p5的各种突变体,在50mm hepes、ph7.5的条件下进行itc实验。其结果发现:钙与位于c末端的结构不规则区域结合(图6)。
48.试验例6.为了实时观察液滴形成,使用tomocube(http://www.tomocube.com/)测定折射率。在50mm hepes、ph7.2的条件下添加p5 50μm、4mm cacl2,除此以外,与试验例1同样进行,制备p5的缔合体,在添加cacl2后,在10分钟以内开始测定。图7表示测定开始不久(图7左)、测定开始约12秒后(图7正中)、约14秒后(图7右)的图像。其结果,正中的图表示捕捉到液滴彼此要融合的瞬间的图像。另外,液滴表面比较粗糙,因此意味着流动性高(图7)。
49.试验例7.为了验证各种酶
·
伴侣蛋白和谷胱甘肽能否在液滴内部浓缩,利用tomocube通过折射率和荧光观察进行了评价。在50mm hepes、ph7.2的条件下,添加p5 50μm、4mm cacl2,除此以外,与试验例1同样进行,制备p5的缔合体,添加cacl2后,在10分钟以内进行测定。此外,添加了gfp融合的各种酶
·
伴侣蛋白、荧光标记的谷胱甘肽5μm。图通过折射率(ri)证实为液滴,以荧光标记的各种酶
·
伴侣蛋白、谷胱甘肽表示局部存在。显示作为内质网内局部存在的酶
·
伴侣蛋白即erp46、erp72、erp57、erp44在液滴内部容易浓缩,但pdi难以进入液滴内部。另外,显示通过使用mcherry-erp57和gfp-erp72,在液滴内部能够浓缩至少两种酶
·
伴侣蛋白。另外,atto532标记的谷胱甘肽也能够在该液滴内部浓缩(图8)。如该图8所示,虽然不希望仅将pdi摄取至液滴内部,但能够浓缩其他pdi家族。因此,能够浓缩其他酶,期待应用于使用酶的产业。
50.试验例8.
通过能够评价粒径的动态光散射装置dynamic light scattering(dls)发现:对p5滴定钙,p5伴随钙滴定而缔合,并评价了p5液滴形成的ph依赖性(图9)。p5蛋白质溶液在50mm hepes、ph6.7、7.0、7.4、7.6、7.8或8.0、50μm蛋白质浓度下进行。如图9记载所示,液滴形成中优选ph7.4以下。
51.试验例9.通过能够评价粒径的动态光散射装置dynamic light scattering(dls),发现:对p5滴定钙,p5伴随钙滴定而缔合,并评价了p5液滴形成的温度依赖性(图10)。p5蛋白质溶液在50mm hepes、ph7.5、50μm蛋白质浓度下进行,在10℃、20℃或30℃下进行,除此以外,与试验例1相同,进行钙滴定。如图10所示,液滴形成中优选低温。
52.试验例10.为了确定滴定形成所需的p5内部区域,制作图11记载的各突变体p5,通过能够评价粒径的动态光散射装置dynamic light scattering(dls)进行功能位点的评价(图11)。p5和突变体蛋白质溶液以50mm hepes、ph7.2、50μm蛋白质浓度使用,除此以外,与试验例1相同,进行钙滴定。如图11所示,液滴形成中优选全长p5。
53.试验例11.25μm aβ40(淀粉样蛋白β1-40,株式会社肽研究所)的淀粉样纤维形成使用具有搅拌功能的荧光平板读取器(sh-9000lab,corona electric)检测。具体而言,在含有硫磺素t2.5μm和50mm hepes的水溶液(ph7.2)中添加aβ40,使其达到25μm。硫磺素t是能够进行纤维检测的荧光分子,如图21所示,能够确认淀粉样纤维的产生(图21“仅aβ40”)。另一方面,在含有硫磺素t2.5μm和50mm hepes的水溶液(ph7.2)中添加p5,使其达到50μm,在添加有ca2+为4mm的溶液中添加aβ40,使其达到25μm时,淀粉样纤维形成被完全抑制(图21“仅aβ40+p5液滴”)。在该条件中,p5形成液滴,因此可知液滴作为抑制淀粉样纤维形成的伴侣蛋白发挥作用。
54.试验例12.为了提取未结合钙的p5的结构信息,通过小角x射线散射法和x射线晶体结构分析来确定p5全长结构(图12)。p5全长结构的确定按照非专利文献8记载的方法进行。为了制备并非液滴的p5,在即将测定之前,将通过试验例1记载的方法得到的p5溶液利用缓冲液(20mm磷酸盐,ph8.0,150mm nacl,5%glycerol)供于凝胶过滤色谱(superdex 20010/300gl;ge healthcare)。使用amicon ultra(mwco,10000:millipore)将洗脱得到的试样浓缩至浓度3mg/ml。并非液滴的p5的小角x射线散射(small angle x-ray scattering:saxs)实验,通过spring-8 bl45xu,在检测器pilatus 3x 2m(dectris)、x射线波长x射线曝光时间1秒
×
20、照相机长度2.0m、温度20.2℃的条件下进行,得到各个散射图案。通过散射图案的吉尼尔(guinier)拟合计算出惯性半径,并通过gnom软件得到了距离分布函数。基于这些数据,通过gajoe软件构建了并非液滴的p5的分子结构。结果表明:各硫氧还蛋白样结构域之间富有柔软性,且形成了二聚体。根据晶体结构可知,二聚体形成区域呈现出亮氨酸拉链模体,通过将该位点置换为丙氨酸,能够制备单体化的p5突变体(图13)。应予说明,虽然该单体p5突变体与野生型相比液滴形成能力下降,但具有形成液滴的能力(图14)。
55.试验例13.为了验证p5液滴能否浓缩低分子即谷胱甘肽,在并非通过试验例1记载的方法得
到的500μm的液滴的p5溶液(终浓度:50μm p5)中,以1:9的比例(摩尔比)混合50mm hepes、ph7.5、4mm ca、[gsh]/[gssg]=[1mm]/[0.2mm],使p5的终浓度为50μm,在10度静置30分钟,在900g、15分钟、4度的条件下进行离心分离,检测上清液的谷胱甘肽浓度。其结果,与形成液滴前相比,谷胱甘肽几乎全部消失,且被液滴摄取,因此可知谷胱甘肽在p5中被浓缩(图15)。
[0056]
试验例14.为了验证p5液滴中的折叠催化剂,采用bpti(牛胰腺胰蛋白酶抑制剂:bovine pancreatic trypsin inhibitor)作为底物。未形成液滴的p5催化bpti的氧化折叠(图16左图)。另一方面,在并非500μm液滴的p5中以1:9的比例混合50mm hepes、ph7.5、50μm p5、4mm ca、[gsh]/[gssg]=[1mm]/[0.2mm],使p5的终浓度为50μm,在37度静置10分钟而形成液滴后,添加底物bpti 30μm,在形成液滴的条件下,1分钟内没有发生bpti的氧化折叠,可知被液滴摄取(图16右图)。这意味着p5液滴具有浓缩、储存改性底物的作用。另外,通过在反应液中添加20mm n-乙基马来酰亚胺来终止反应,利用bpti抗体进行检测,结果观察到:被认为是bpti的二聚体、三聚体的电泳条带。根据谷胱甘肽被具有硫氧还蛋白样结构域的蛋白质的液滴浓缩这一特殊状况,可认为发生了上述反应。
[0057]
试验例15.为了研究有机溶剂对p5液滴的影响,在试验例2中得到的p5液滴中添加5%v/v的甲醇、乙醇或三氟乙醇,通过相差显微镜进行观察。当v/v计添加5%左右的有机溶剂时,p5液滴保持形状(图17)。需要说明的是,在该试验例中使用p5制造了液滴,但在形成液滴p5后添加gfp-pdi家族,具有能够内包于内部的性质,因此可认为:利用p5以外的pdi家族蛋白和/或人造蛋白质、且具有硫氧蛋白样结构域的蛋白质也能够制造液滴。
[0058]
试验例16.为了研究蛋白质在p5液滴中的摄取,制备与试验例1同样进行而得到的、与荧光蛋白质gfp融合的pdi家族蛋白和p5的混合溶液(摩尔比1:5),通过添加钙而形成液滴后,以15000
×g·
15分钟进行离心,由此分离成凝缩层(相当于液滴内)和稀薄层(相当于液滴外)。通过测量液滴形成前的488nm吸光度和液滴形成
·
离心分离后的稀薄层的488nm吸光度,计算出摄取至液滴内部的gfp融合蛋白质的比例。将结果示于图18、19。试验的结果表明:融合有gfp的pdi家族蛋白以20%左右被摄取至p5液滴。产业上的可利用性
[0059]
可期待酶液滴(由酶蛋白质构成的液滴)等液滴在生物医药、美容行业、工业用酶、食品行业(酒精饮料行业等)中的应用。更具体而言,例如,可期待液滴技术应用于胰岛素、免疫球蛋白等含二硫键蛋白质制剂的品质管理、二硫键的修复(毛发的修复等)、氧化还原分子gsh的浓缩、递送中的使用、帕金森病、糖尿病等的治疗中的使用、伴侣蛋白浓缩引起的神经退行性疾病。本发明提供的新型液滴能够在上述领域中应用,因此在产业上非常有用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1