用于RAA恒温扩增的免提取快速释放核酸的裂解液及其应用的制作方法
用于raa恒温扩增的免提取快速释放核酸的裂解液及其应用
技术领域
1.本发明涉及核酸提取检测技术领域,特别涉及用于raa恒温扩增的免提取快速释放核酸的裂解液及其应用。
背景技术:
2.核酸是物种遗传性息的携带者,是基因表达的物质基础,无论是进行核酸结构研究还是功能研究,首先都需要对物种核酸进行分离和纯化。目前针对核酸提取,最主要的技术包括酚/氯仿抽提法、醇沉淀法、层析柱法、热裂解碱法、煮沸裂解法、纳米磁珠法、还有超声法、反复冻融法、酶解法及低渗裂解等等多种方法。这些方法使用的存在很大的局限性,需要专业的技术人员以及相关的技术设备和试剂,花费大量时间,才能达到提取核酸的目的,当如果出现需要大量样本前处理的时候,这些常规方法需要消耗大量人力和物力以及时间成本。因此建立快速提取核酸且适用于目前国内核酸检测这个需要大规模样本前处理的核酸提取方法和试剂具有重要的现实意义。
3.重组酶介导等温核酸扩增技术(recombinase aided amplification,raa)的简称,是一种利用重组酶、单链结合蛋白、dna聚合酶在等温条件下(最佳温度37℃-39℃)进行核酸扩增的技术,并结合荧光即时检测,实现5-20min输出结果,灵敏度达到10copies/测试。现有技术中,对于核酸的裂解普遍使用的裂解液为含有胍盐的裂解液。胍盐是一种强蛋白质变性剂,高浓度胍盐可迅速破坏裂解细胞,使核酸释放。但是这种使用含有胍盐的裂解液裂解之后,在荧光检测之前必须采用各种方式对裂解产物进行纯化处理,否则会严重影响荧光检测结果的准确度。
4.例如中国专利申请cn112680547a提供了一种实时荧光核酸恒温扩增检测试剂盒及其应用,公开的灭活裂解液的原料包括铵盐、异硫氰酸胍、氯化锂、乙二胺四乙酸、乙二醇双(2-氨基乙基醚)四乙酸、表面活性剂、抗坏血酸、二硫苏糖醇和缓冲剂。这种灭活裂解液就是利用的胍盐的特殊作用完成细胞裂解,其说明书就提到使用磁性材料(磁珠)进行吸附核酸,然后再用洗脱液进行相当长时间的洗涤和洗脱,非常不利于核酸快速检测。又例如中国专利申请cn113512546a提供了一种快速质粒dna抽提纯化试剂盒,虽然其裂解液原料只有koh或naoh 100mm-2m,1%十二烷基苯磺酸钠/十二烷基磺酸钠/十二烷基硫酸钠1g/100ml;但是还使用了原料为盐酸胍1m-6m,醋酸钾或醋酸钠100mm-1m,并用醋酸调节ph至2-8的中和液;在裂解后同样需要使用中和液处理裂解产物,然后还要过硅胶柱、清洗和洗脱,这同样耗费了相当长的时间。
5.现有技术中也有不使用胍盐为主要原料的核酸裂解液,例如中国授权专利cn105420230b提供了一种磁珠法提取核酸的裂解液,其原料包括0.2-0.4n naoh、0.3-0.6m kcl、0.01-0.05%n-月桂酰肌氨酸钠、5mm edta、0.3-0.6m tris-hcl和1-2%triton x-100组成。然而该专利主要研究的是磁珠法提取核酸,所要解决的是胍盐裂解液稀释度下降不利于dna回收效率,以及胍盐成分不稳定的技术问题;并且,该专利虽然未使用胍盐裂解液,并将裂解时间缩短至5-10min,但是在整个pcr扩增的过程中,需要先将这种裂解液与磁珠
混合静置,然后把磁珠进行分离和洗涤,这个过程时间也会很长。因此总体而言,操作仍然较为繁琐,总体耗时也较长。这种核酸裂解液组分复杂,未经过纯化的裂解产物会抑制后续的扩增检测。
6.又例如中国专利申请cn111074007a提供的检测sars-cov-2病毒的恒温扩增试剂盒,使用的灭活裂解液包括0.01-0.1m的naoh,体积比0.1%-0.5%的tween-20,体积比0.1%-1%的triton x-100。这种核酸裂解液表面活性剂的组分影响后续的扩增检测。
技术实现要素:
7.针对以上现有技术的不足,本发明提供了一种用于raa恒温扩增的免提取快速释放核酸的裂解液及其应用,具体通过以下技术实现。
8.用于raa恒温扩增的免提取快速释放核酸的裂解液,为50-200mm的naoh水溶液。
9.优选地,用于raa恒温扩增的免提取快速释放核酸的裂解液为50-100mm的naoh水溶液。
10.更优选地,用于raa恒温扩增的免提取快速释放核酸的裂解液为80mm的naoh水溶液。
11.一种核酸释放和荧光检测的方法,包括以下步骤:
12.s1、取保存在样本保存液中的拭子样本的上清液待用;
13.s2、在室温条件下,按照体积比1:(1-50),取本技术提供的任意一种裂解液和步骤s1的上清液,混合均匀,静置反应5-15min;
14.s3、以步骤s2所得混合液为模板,直接进行恒温扩增和荧光检测。
15.优选地,步骤s2中,免提取快速释放核酸的裂解液和步骤s1的上清液的体积比为1:25。
16.优选地,步骤s2中,混合均匀的方法为1500-3000rpm涡旋混合3-10s。
17.优选地,步骤s2中,静置反应的时间为15min。
18.优选地,针对hpv16病毒的核酸检测,在步骤s3中,恒温扩增的引物的核苷酸序列如seq id no.1、seq id no.2所示。
19.更优选地,针对hpv16病毒的核酸检测,步骤s3中,荧光检测所使用的探针是在如seq id no.3所示的序列上设计四个修饰位点:在距离5’端的32bp的中部位置插入dspacer作为核酸外切酶的识别位点;在dspacer的上游距离1个碱基的位置标记1个荧光基团;在dspacer的下游距离1个碱基的位置标记1个淬灭基团;再在3’端末端标记一个封闭基团。
20.进一步优选地,针对hpv16病毒的核酸检测,步骤s3中,所述封闭基团为胺基、磷酸基团、生物素、生物素-teg或者c3-spacer。
21.申请人基于单一变量的原则,通过设计大量的试验发现,当使用浓度为50-200mm的naoh水溶液作为免提取快速释放核酸的裂解液,能够达到快速裂解鼻咽拭子、体液等人体组织样本,释放出样本核酸的目的。最重要的是,相比于使用磁珠分离,或者使用含胍盐的裂解液,采用本技术的这种裂解液,在裂解之后不需要任何纯化、洗涤、离心、吸附等处理,可以直接将裂解后的混合液加入到恒温扩增仪中进行扩增;同时,还不会对荧光扩增检测数据产生不利影响,检测精度得以保证。
22.目前国内外现有的裂解液产品,或是专利/文献,均未提到过单独使用上述特定浓
度的naoh水溶液作为裂解液,在能够获得良好的核酸释放效果的前提下,不会对扩增检测结果产生影响,还能极大的缩短了核酸检测的整体检测时间。国内现有的裂解液,即使在裂解液中使用了naoh,不使用胍盐,也还含有其他原料,比如吐温(表面活性剂)、triton x-100、edta、海藻糖等多余成分,这些成分虽然能促进细胞裂解和核酸释放,但是组分较为复杂,个别组分还会抑制酶的作用,影响后续核酸扩增反应。
23.与现有技术相比,本发明的有益之处在于:本发明提供了一种能够用于raa恒温扩增的免提取快速释放核酸的裂解液,采用这种裂解液,可以在不需要加入任何额外原料,在热裂解或常温裂解都能适用;也不需要在裂解后进行任何洗涤纯化处理,直接进行恒温扩增检测,检测结果精度高,不产生干扰;操作简便,耗时短,裂解过程仅需5-15min,健康环保,可以常温运输,适用于出现需要大规模样本前处理以及现场检测的样本快速处理。
附图说明
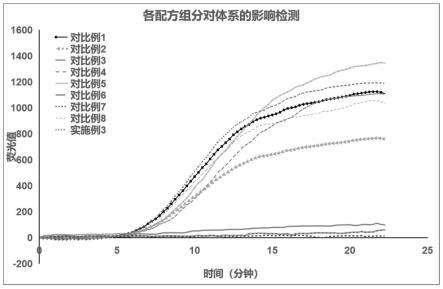
24.图1为实施例和对比例提供的裂解液对扩增反应体系的影响结果;
25.图2为热裂解效果的检测结果;
26.图3为室温裂解效果的检测结果;
27.图4为实施例的不同浓度裂解效果的检测结果;
28.图5为不同裂解时间的裂解效果的检测结果。
具体实施方式
29.下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动条件下所获得的所有其它实施例,都属于本发明保护的范围。
30.以下实施例和对比例中,配置裂解液的试剂中,naoh、tris、edta、海藻糖、硫酸胺、氯化钠、tritonx-100均购自国药集团,β-环糊精、甘油、醋酸钾购自麦克林公司,明胶、bsa购自sigma公司。
31.实施例1
32.本实施例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液为80mm的naoh水溶液。
33.实施例2
34.本实施例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液为50mm的naoh水溶液。
35.实施例3
36.本实施例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液为100mm的naoh水溶液。
37.实施例4
38.本实施例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液为200mm的naoh水溶液。
39.对比例1
40.本对比例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液为20mm的naoh
水溶液。
41.对比例2
42.本对比例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液为250mm的naoh水溶液。
43.对比例3
44.本对比例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液的原料为:tris(ph8.0)100mm、kcl 180mm、醋酸钾100mm、mgcl
2 6mm、甘油10.0%、海藻糖100mm、硫酸铵20mm,然后加水混匀制成。
45.对比例4
46.本对比例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液的原料为:tris(ph8.0)100mm、edta(ph8.0)2mm、nacl 0.90%、tritonx-100 0.20%、bsa 0.10%、明胶0.10%、硫酸铵0.20%,然后加水混匀制成。
47.对比例5
48.本对比例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液的原料为:tris(ph8.0)100mm、edta(ph8.0)2mm、nacl 0.90%、tritonx-100 2.0%、bsa 0.50%、明胶0.10%、硫酸铵0.40%,然后加水混匀制成。
49.对比例6
50.本对比例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液的原料为:tris(ph8.0)100mm、edta(ph8.0)2mm、nacl 0.90%、sds 0.10%、bsa 0.50%、β-环糊精0.50%、硫酸铵0.40%,然后加水混匀制成。
51.对比例7
52.本对比例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液的原料为:tris(ph8.0)100mm、kcl 180mm、醋酸钾100mm、mgcl
2 6mm、甘油10.0%、海藻糖100mm、硫酸铵20mm,然后加水混匀制成。
53.对比例8
54.本对比例提供的用于raa恒温扩增的免提取快速释放核酸的裂解液的原料为:生理盐水,即质量分数0.9%的nacl溶液。
55.试验例:实施例和对比例的裂解液的核酸释放效果检测
56.1、材料和仪器
57.(1)临床样本:来源于兰丁高科,拭子样本保存在样本保存液中,临床检测确认为hpv16阳性样本,样本编号:wqk2014223、wqk2014397、wqk2014500、wqk2014505。
58.(2)阳性对照:采用hpv16基因克隆的质粒(采购自上海生物工程技术有限公司)。所提取的dna浓度使用nanodrop仪器测定并换算为2.94
×
10^13copies/ml,用灭菌后te缓冲液(10mm tris+1mm edta)将其稀释至1000copies/μl,用作本实验的反应模板。使用下述的引物(如seq id no.1、seq id no.2所示)来扩增hpv16基因。
59.hpv16-f:5
’‑
ctgtcaaaagccactgtgtcctgaagaaaag-3’;
60.hpv16-r:5
’‑
gagatcagttgtctctggttgcaaatctaaca-3’;
61.(3)hpv16-p引物探针:本实验例所使用的探针是在如seq id no.3所示的序列上设计四个修饰位点:在距离5’端的32bp的中部位置插入dspacer(四氢呋喃,thf位点),作为
核酸外切酶的识别位点;在dspacer的上游距离该识别位点1个碱基的位置标记1个荧光基团(6-fam);在dspacer的下游距离该识别位点1个碱基的位置标记1个淬灭基团(bhq1);再在3’端末端标记一个封闭基团(例如胺基、磷酸基团、生物素、生物素-teg或者c3-spacer)。结构如下:
62.atcaagaacacgtagagaaacccagctg/i6famdt/c/idsp/a/ibhq1dt/catgcatggagata;
63.(4)阴性对照为:灭菌后的te缓冲液。
64.(5)配制恒温扩增的试剂盒:购自江苏奇天基因公司的raa核酸扩增试剂盒(荧光款),货号:f00001a,批号:fextbo。
65.(6)扩增仪器:恒温荧光检测仪器,购自杭州优米仪器有限公司,型号:umg-1600。
66.以上阳性样本以及阴性对照都在q-pcr反应条件下进行过验证,确认可以使用。
67.2、反应体系
[0068][0069]
3、试验方法
[0070]
(1)免提取快速释放核酸的裂解液对扩增反应体系的影响
[0071]
利用上述实施例和对比例提供的裂解液,检测判断对扩增反应体系的影响。以hpv16质粒1000copies/μl用作为模板,在反应体系中加入实施例3(选用50-200mm的中间浓度)和对比例1-8制备的裂解液(5μl),打开恒温荧光检测仪器,将微量反应管快速转移至仪器内,39℃预热30s,然后39℃扩增30min,每15s检测一次荧光强度,共检测120次,检测效果。检测结果如图1所示。
[0072]
从图中可以看到,实施例3,对比例1、2、4、5、8制备的裂解液,对扩增反应体系没有影响,可以进行裂解反应。
[0073]
(2)热裂解效果检测
[0074]
选用实施例1-4,对比例1、2、4、5、8制备的裂解液(50μl),与临床样本wqk2012505(2μl)按照体积比25:1,1500rpm涡旋混合3s,然后95℃加热裂解5min,以加热裂解后的样本作为模板,打开恒温荧光检测仪器,将微量反应管快速转移至仪器内,39℃预热30s,然后39℃扩增30min,每15s检测一次荧光强度,共检测120次,检测效果。
[0075]
结果如图2所示。根据图2的结果可以发现,采用实施例3和对比例3的热裂解效果
最好,对比例5和对比例8的热裂解效果次之。
[0076]
(3)室温裂解效果检测
[0077]
选用实施例3,对比例3、5、8制备的裂解液(50μl),与临床样本wqk2012505(2μl)按照体积比25:1,1500rpm涡旋混合3s,然后室温(约25℃)反应裂解5min;以室温裂解后的样本作为模板,打开恒温荧光检测仪器,,将微量反应管快速转移至仪器内,39℃预热30s,然后39℃扩增30min,每15s检测一次荧光强度,共检测120次,检测效果。
[0078]
结果如图3所示。根据图3的结果可以发现,采用实施例3的裂解效果最好。
[0079]
(4)实施例的不同浓度裂解效果的检测结果
[0080]
选择实施例1-4制备的裂解液,与临床样本wqk2012505按照体积比25:1,1500rpm涡旋混合3s,然后室温裂解5min,以室温裂解后的样本作为模板,进行raa恒温扩增,打开恒温荧光检测仪器,将反应管放入仪器,39℃预热30s,然后39℃扩增30min。检测效果如图4所示,实施例1-4皆有扩增曲线,均可释放样本中的病毒核酸,实施例1-4的检出时间一致,从荧光强度来对比,实施例1的效果最好。
[0081]
(5)最佳裂解液裂解时间的研究
[0082]
选择实施例1制备的裂解液,与临床样本wqk2012505按照体积比25:1,1500rpm涡旋混合3s,然后分别室温裂解5、10、15min,以室温裂解后的样本作为模板,打开恒温荧光检测仪器,将反应管放入仪器,39℃预热30s,然后39℃扩增30min,检测效果。
[0083]
结果如图5所示,样本裂解5、10、15min的检出时间是一致的,但随着裂解时间的增加,荧光值越大,说明裂解效果越好,因此常温裂解时间最优选择15min。适用于恒温扩增的核酸释放剂,即使当裂解20min时裂解效果更好,但是从经济效率、时间节约的角度,裂解15min就已经能够获得非常好的效果,裂解时间过长反而没有意义,因此不作对比。
[0084]
以上具体实施方式详细描述了本发明的实施,但是,本发明并不限于上述实施方式中的具体细节。在本发明的权利要求书和技术构思范围内,可以对本发明的技术方案进行多种简单改型和改变,这些简单变型均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1