一种用于RNA病毒核酸的闭管可视化检测方法与流程
一种用于rna病毒核酸的闭管可视化检测方法
技术领域
1.本发明专利涉及一种用于rna病毒核酸的闭管可视化检测方法,属于核酸检测技术领域。
背景技术:
2.近年来,由rna病毒感染所引起的流行性疾病给全球人类健康带来巨大危害。因此,很多基于核酸的病原体快速检测技术已经被广泛应用在流行性疾病的早期诊断和疫情防控中。聚合酶链式反应技术(polymerase chain reaction,pcr)作为核酸检测的“金标准”,主要采用taqman探针法或荧光染料法进行检测,该方法对实验设备要求高,需要复杂的荧光读取仪器,不利于在资源有限的地方推广使用。而基于可视化的核酸检测方法,无需借助昂贵的仪器,通过肉眼即可判读结果,因此受到越来越多研究者的关注。
3.用于即时检测(poct)的可视化检测方法主要包括比色法和横向流动试纸条。基于ph敏感指示剂和金属离子指示剂的比色法,在检测较低的病毒载量时,阴阳性结果的颜色差异不明显,肉眼判读难度大,容易出现结果误判的情况;横向流动试纸条作为一种低成本、操作简便的纸基可视化检测工具,虽然能给出一个明确的,肉眼易判读的结果,但是其检测对象为扩增产物,极易造成严重的气溶胶污染。而纳米金具有独特的光化学性质,可作为可视化检测的最佳材料,但是纳米金杂交显色反应灵敏度低、特异性差无法用于临床样本的检测。将纳米金杂交显色反应与核酸扩增反应和核酸侵入反应相偶联,建立一种高灵敏、高特异、无需依赖荧光设备的闭管可视化检测方法,为poct中核酸可视化检测提供一种新策略。
4.目前已经有一种集核酸扩增、级联核酸侵入反应及纳米金探针杂交反应的闭管核酸检测技术(见专利“耦合核酸扩增反应、核酸侵入反应及纳米颗粒显色反应的封闭式可视化核酸检测新方法”,专利申请号“201310478388.1”),但该方法需要dna作为初始模板,当检测rna病毒时,需要在管外将rna反转录成cdna,然后以cdna为模板加入封闭体系进行反应,操作繁琐和耗时。因此,我们开发了一种在单个闭管体系中可以依次进行反转录反应、核酸扩增偶联侵入反应及纳米金探针杂交显色反应的方法,实现rna病毒核酸的闭管可视化检测。
技术实现要素:
5.本发明的目的是提供hiscript ii反转录酶在进行rna病毒核酸的闭管可视化检测中的应用。
6.本发明还提供了一种用于rna病毒核酸的闭管可视化检测方法,其步骤包括:
7.(1)在反应管中加入反转录反应、核酸扩增反应偶联核酸侵入反应、纳米金探针杂交显色反应的所有组分,并加入靶核酸rna;
8.(2)将反应温度调至低于纳米金探针杂交显色反应的反应温度,进行反转录反应;
9.(3)将反应温度调高进行核酸扩增反应,同时将核酸扩增反应中的退火温度设置
为核酸侵入反应的反应温度,使核酸扩增反应和核酸侵入反应同时进行;
10.或者将反应温度调高进行核酸扩增反应,然后降温进行核酸侵入反应;
11.(4)降低反应温度至纳米金探针杂交显色温度,进行纳米金探针的杂交显色反应,通过肉眼观察颜色变化判断结果;
12.所述反转录反应使用的反转录酶是hiscript ii反转录酶。
13.优选的,其中所述的核酸侵入反应包括针对靶核酸特异性的上游探针和下游探针、5’flap外切酶或5’flap内切酶、以及一个发卡探针;上游探针的3’端含有一个侵入碱基,并且tm值高于核酸侵入反应的温度,可以与靶核酸稳定结合;下游探针5
‘
端含有翘起的flap片段,并且tm值接近核酸侵入反应的温度,上游探针、下游探针和靶核酸形成可被5’flap外切酶或5’flap内切酶识别并切割的三碱基重叠结构,并将flap片段切割下来;发卡探针5’端和3’端分别含有一段序列可以与纳米金颗粒表面修饰的两种核酸探针结合,中间部分还含有与flap片段互补的序列,与切割下的flap片段形成可被5’flap外切酶或5’flap内切酶识别并切割的三碱基重叠结构;
14.其中所述的纳米金探针杂交显色反应采用的纳米金颗粒表面通过巯基修饰有两种核酸探针,并对纳米金颗粒未修饰探针的部分进行封堵。
15.优选的,反转录反应的最高温度低于纳米金探针杂交显色反应的反应温度至少5℃。
16.优选的,所述纳米金颗粒表面采用硅烷化试剂、peg或寡肽进行封堵。
17.优选的,所述核酸侵入反应中的下游探针和发卡探针3’端进行封闭修饰。
18.优选的,所述核酸扩增反应中的退火温度为60-63℃,该温度同时也是核酸侵入反应的反应温度。
19.优选的,所述核酸扩增反应指的是聚合酶链式反应pcr、切刻内切酶辅助核酸扩增neaa、环介导等温扩增反应lamp或连接扩增反应lcr,优选的为聚合酶链式反应。
20.优选的,所述核酸扩增反应使用的酶是taq dna聚合酶、tth dna聚合酶或pfu dna聚合酶,优选的为taq dna聚合酶。
21.优选的,所述5’flap外切酶或5’flap内切酶指的是afu fen、mth fen或pfu fen,优选afu fen。
22.优选的,所述反转录反应的温度为35-45℃,优选的为45℃。
23.优选的,纳米金颗粒表面修饰的两种核酸探针分别与发卡探针的5’端片段和发卡探针的3’端片段结合,当待测样本中存在靶核酸序列时,发卡探针的5’端片段被切割,然后进行纳米金探针杂交显色反应,使纳米金探针呈分散状态,否则呈聚集状态。
24.优选的,纳米金探针杂交显色反应的温度为53-58℃。
25.优选的,所述反应体系包含5-30mm tris,4-10mm镁离子和20-80mm钠离子。
26.所述的用于纳米金探针杂交显色反应的两种纳米金探针序列分别为sh-aaaaaaaaaaatggttcatcacgat-c3和gcagtaccacaagacaaa aaaaaaa-sh;
27.所述的用于纳米金探针杂交显色反应的发卡探针序列为gtcttgtggtactgcactcgtctcggttttccgagacgagtcctcggcgcgatcgtga tgaaccat-c3。
28.本发明方法所述的温度控制可以在普通pcr仪、掌上pcr仪或具有循环温度控制的装置上进行,优选普通pcr仪。
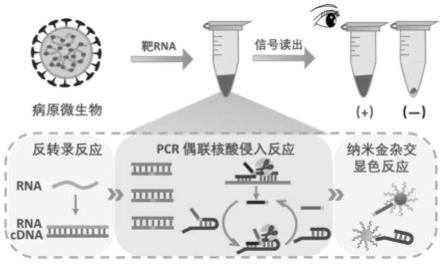
29.本发明的反应原理如图1所示,整个检测在封闭体系上进行,由三个部分组成,分别是靶核酸反转录反应、核酸扩增反应偶联核酸侵入反应和纳米金探针杂交显色反应,通过控制温度,依次进行上述三个反应。首先,靶核酸在反转录酶的作用下进行反转录反应合成cdna。然后,以cdna为模板进行高灵敏度的核酸扩增,并使用高特异且能区分单碱基差异的核酸侵入反应检测扩增产物。为了实现核酸扩增反应和核酸侵入反应同时进行,将退火温度设为核酸侵入反应的最佳温度。当上游探针、下游探针与靶核酸杂交形成三碱基重叠结构时,5’flap外切酶或5’flap内切酶可以识别该结构并切割含有flap片段的下游探针,释放flap-1部分。产生的flap-1序列又能侵入到发卡探针内再次形成三碱基重叠结构,5’flap外切酶或5’flap内切酶再次识别并切割产生flap-2和残余的发卡探针,使得信号不断放大。最后,产生的flap-2可以与纳米金探针(aunp-1)杂交,残余的发卡3’端可以与纳米金探针(aunp-2)杂交,离心后,纳米金探针仍然呈分散状态,溶液呈红色。相反,当靶标不存在时,无法形成三碱基重叠结构,flap片段无法被切割,而完整的发卡探针可以和纳米金上的多条核酸探针进行交联,形成aunp-1-发卡探针-aunp-2的空间网状结构,离心后,溶液呈无色并且底部有纳米金探针聚集交联的沉积物,因此可通过肉眼观察颜色变化对结果进行判读。本发明的反应体系中,反转录反应的温度最低,纳米金探针杂交反应的温度其次,扩增反应的温度最高,扩增反应的退火温度等于核酸侵入反应的温度,同时核酸侵入反应的温度仍大于纳米金探针杂交反应的温度。
30.其中用于核酸侵入反应的上游探针结构如图2所示,3’端含有一个侵入碱基,并且tm值高于核酸侵入反应的温度,可以与靶核酸稳定结合。
31.其中用于核酸侵入反应的下游探针结构如图3所示,5’端含有翘起的flap片段,并且tm值接近核酸侵入反应的温度,当翘起的flap片段被5’flap外切酶或5’flap内切酶切割时,tm值降低,下游探针脱离靶核酸。
32.其中用于核酸侵入反应的5’flap外切酶或5’flap内切酶是一种可以识别上游探针、下游探针和靶核酸形成的三碱基重叠结构,如图4所示,并对其进行切割,释放出5'-flap片段的结构特异性酶,在63℃下具有最高活性。
33.其中用于核酸侵入反应的发卡探针5’端和3’端分别含有一段序列可以与纳米金颗粒表面修饰的两种核酸探针结合,中间部分还含有与flap片段互补的序列,如图5所示,发卡探针与flap片段形成的三碱基重叠结构可被5’flap外切酶或5’flap内切酶识别并切割,如图6所示。
34.本发明的方法同样可用于中国专利文献cn201310478388.1公开的耦合核酸扩增反应、核酸侵入反应及纳米颗粒显色反应的封闭式可视化核酸检测新方法,只需要将靶序列换成rna病毒,同时在进行核酸扩增反应前加入hiscript ii反转录酶进行反转录反应即可。
35.本发明还发现,仅有hiscript ii反转录酶可用于本发明的一管式不开盖rna病毒核酸的闭管可视化检测,其他常见的反转录酶例如tth dna聚合酶、m-mlv反转录酶、amv反转录酶均无法用于本发明。
36.本发明的有益效果:
37.(1)在本发明方法中,将待测的病毒rna加入闭管体系中进行反应,无需额外操作步骤即可得到检测结果,实现病毒rna的直接检测。本方法操作步骤简单,缩短了整个检测
反应的时间,而且无需开管进行操作,大大减少气溶胶的污染。
38.(2)在本发明方法中,通过控制温度可实现四个反应在单个闭管体系中依次进行,包括反转录反应、核酸扩增反应偶联核酸侵入反应及纳米金探针杂交显色反应。
39.(3)在本发明方法中,核酸扩增反应与核酸侵入反应同时进行,提高了检测灵敏度。
40.(4)在本发明方法中,采用聚合酶链式反应(pcr)对模板进行指数扩增,其作为最经典的核酸扩增方法,具有高灵敏度、高稳定、成分简单等特点。
41.(5)在本发明方法中,将pcr与具有区分单碱基差异的高特异性核酸侵入反应相偶联,将产物检测转化为核酸片段检测,然后进一步将信号放大,实现高灵敏、高特异的核酸扩增检测。
42.(6)在本发明方法中,采用纳米金杂交显色反应将核酸片段检测转化为可视化检测,通过肉眼观察颜色的变化即可判读结果,阴性结果为无色,阳性结果为红色,此方法无需依赖荧光检测设备,成本大大降低。
43.在本发明方法中,闭管可视化检测反应体系组分包括缓冲液、反转录酶、dna聚合酶、afu fen1酶、发卡探针、纳米金探针都是通用的,仅有上下游引物和上下游探针需要根据不同的靶核酸进行设计,易推广使用。
附图说明
44.图1是关于本发明方法的原理示意图。
45.图2是关于本发明方法中3’端含有一个侵入碱基的上游探针。
46.图3是关于本发明方法中5’端含有翘起flap片段的下游探针。
47.图4是关于本发明方法中上游探针、下游探针和靶核酸形成的三碱基重叠结构。
48.图5是关于本发明方法中发卡探针示意图。
49.图6是关于本发明方法中发卡探针与flap片段形成的三碱基重叠结构。
50.图7是关于本发明方法中纳米金与纳米金探针在300~700nm间的吸收波长图。
51.图8是关于本发明方法中纳米金颗粒的透射电镜图。
52.图9是关于本发明方法中纳米金探针杂交显色反应在300~700nm间的吸收波长。
53.图10是关于本发明方法检测新冠病毒及突变体rna的灵敏度结果图。
54.图11是关于本发明方法检测新冠病毒及突变体分型的特异性结果图。
55.图12是关于本发明方法检测新冠病毒核酸样本的结果图。
56.图13是关于本发明方法反转录反应中反转录酶的筛选结果。
57.图14是关于本发明方法核酸扩增反应和核酸侵入反应同时或分步进行的检测结果。
58.图15是关于本发明方法的流程图。
具体实施方式
59.下面结合实施例对本发明作进一步的说明,但实施例的描述不对本发明的保护范围产生任何限制。图1展示了本发明的原理,图15展示了本发明的流程。
60.除非另有定义,本文所使用的所有的技术术语和科学术语与属于本发明的技术领
域的技术人员通常理解的含义相同,本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
61.下列实施例中所用的物质或仪器,如果未进行特殊说明的话,均可以从常规的商用渠道获取。
62.实施例1闭管可视化核酸检测反应所有相关组分的制备
63.(1)反应缓冲液的配制:取0.6057g tris,0.7624g mgcl2·
6h2o,0.8775g nacl,250μlnp-40和250μl tween-20至烧杯,加适量depc水,室温搅拌混匀,用hcl调ph至8.5,最后用depc水定容至50ml。
64.(2)pcr引物设计:由于退火温度设置为63℃,所以引物的tm值较普通的pcr引物高,通过增加引物的碱基数来提高tm值,引物长度在30~35个碱基最佳,否则引物过长会导致二级结构的形成;g/c含量控制在40%~60%之间;扩增产物长度为100~200bp最佳。
65.(3)核酸侵入反应的探针设计:根据靶核酸的序列信息,利用universal invadertm软件设计invader探针,并使用idt在线序列分析工具分析上游.探针和下游探针之间是否存在二聚体、发卡和茎环等特殊结构,尤其要排除在侵入位点处有特殊结构形成的探针对。
66.(4)fen1酶的表达:合成源于嗜热古球菌(archaeoglobus fulgidus)的fen1基因序列,以pet24a(+)为表达载体,构建了pet24a(+)-fen1-his重组质粒,将重组质粒转化入大肠杆菌bl21(de3),将大肠杆菌进行扩大培养,在37℃,200r/min摇床过夜培养8h后,加入诱导剂iptg至终浓度为0.05mmol/l,再于37℃,200r/min诱导表达11h,最终经镍亲和层析成功纯化得到了重组fen1。
67.(5)纳米金颗粒的制备:
68.采用柠檬酸钠还原氯金酸法制备纳米金溶液,用王水溶液(浓盐酸:浓硝酸=3:1混合)清洗所有容器。配制38.8mmol/l柠檬酸钠溶液和5mmol/l氯金酸溶液。取5mmol/l氯金酸溶液100ml及屈臣氏蒸馏水400ml加入1l的三颈圆底烧瓶中,通过磁力进行搅拌,硅油浴加热至沸腾。待冷凝水稳定回流后,迅速加入38.8mmol/l柠檬酸钠溶液50ml,待溶液颜色由黄色变成深红色后,继续加热、搅拌15min后移去热源使溶液自然冷却至室温,所制得的纳米金溶液于4℃避光储存,并取少量溶液测其在300~700nm间的吸收波长(如图7),并通过透射电镜检查粒径的均一性(如图8)。
69.(6)纳米金探针的制备:
70.取500μl纳米金溶液,7500g离心15min后去上清,加500μl h2o重悬。取90μl 0.1mol/l dtt溶液加入巯基修饰的核酸探针干粉中还原2.5h,并用nap-5柱纯化,收集纯化后的核酸溶液,吹打混匀后均分至水洗后的纳米金溶液中,26℃下避光孵育16h后向每管中加入100μl 0.01mol/l pb buffer(ph 7.5)和250μl 1.2mol/l nacl,26℃下避光孵育24h。孵育结束后,7500g离心水洗三次,最后加入1ml 10mmol/l pb buffer(ph 7.5)并吹打混匀,待硅烷化处理。向同一管中依次加入800μl pb buffer(10mmol/l,ph 7.5),100μl纳米金溶液及100μl 5mmol/l mptms溶液。室温避光孵育24h后水洗纳米金探针,7500g离心45min,弃上清用1ml h2o重悬。离心三次后最终使纳米金探针重悬于1ml h2o中。制备好的硅烷化修饰的纳米金探针需在4℃避光存放两周以上,通过预实验验证杂交性能及热稳定性后可用于后续实验,并取少量溶液测其在300~700nm间的吸收波长(如图9)。
71.实施例2利用闭管可视化核酸检测方法对新冠病毒及突变体(a570d、d80a和t547k)rna进行检测,并考察灵敏度。
72.反应体系配置如下:取2μl反应缓冲液,50u hiscript ii反转录酶,0.25mm dntps,0.5μm上游引物,0.5μm下游引物,0.25u gotaq dna 聚合酶,3.5% peg8000,0.1μm上游探针,0.4μm下游探针,0.2μm发卡探针,100ng fen1核酸内切酶,2μl纳米金探针-1和2μl纳米金探针-2于反应管中,加水补足至19μl,最后加入1μl不同浓度的rna模板。反应程序为:45℃ 20min,94℃ 30s,35循环(94℃ 10s,63℃ 20s,72℃ 30s),72℃2min,55℃ 20min。设计的引物如表1所示,探针如表2所示。
73.表1.pcr引物序列
[0074][0075][0076]
注释:f为上游引物;r为下游引物。
[0077]
表2.核酸侵入反应探针序列
[0078][0079]
注释:up为上游探针;dp为下游探针。
[0080]
结果如图10所示,该方法检测新冠n基因、orflab基因和d80a的灵敏度为5copies/反应,s基因、a570d和t547k的灵敏度为20copies/反应,表明该方法的灵敏度良好。
[0081]
实施例3利用闭管可视化核酸检测方法对新冠病毒n基因与5种呼吸道病原体(甲型流感病毒、乙型流感病毒、副流感1型病毒、副流感2型病毒和副流感3型病毒)rna进行检测及三种新冠病毒突变株分型检测,考察方法的特异性。
[0082]
反应体系配置如下:取2μl反应缓冲液,50u hiscript ii反转录酶,0.25mm dntps,0.5μm上游引物,0.5μm下游引物,0.25u gotaq dna 聚合酶,3.5% peg8000,0.1μm上游探针,0.4μm下游探针,0.2μm发卡探针,100ng fen1核酸内切酶,2μl纳米金探针-1和2μl纳米金探针-2于反应管中,加水补足至19μl,最后加入1μl rna模板。反应程序为:45℃ 20min,94℃ 30s,35循环(94℃ 10s,63℃ 20s,72℃ 30s),72℃ 2min,55℃ 20min。
[0083]
结果如图11所示,仅有新冠病毒n基因被检出阳性,说明闭管可视化核酸检测方法不会发生错检,表明该方法的特异性良好。同时进一步考察了在新冠病毒突变株分型检测中的特异性,本研究用交叉实验对三种新冠病毒突变株进行分型检测。结果均没有阳性信号产生,证明本方法在新冠病毒突变株分型检测中具有良好的特异性。
[0084]
实施例4利用闭管可视化核酸检测方法对50例新冠病毒核酸样本中n基因和orflab基因进行检测,考察方法可行性。
[0085]
反应体系配置如下:取2μl反应缓冲液,50u hiscript ii反转录酶,0.25mm dntps,0.5μm上游引物,0.5μm下游引物,0.25u gotaq dna聚合酶,3.5% peg8000,0.1μm上
游探针,0.4μm下游探针,0.2μm发卡探针,100ng fen1核酸内切酶,2μl纳米金探针-1和2μl纳米金探针-2于反应管中,加水补足至19μl,最后加入5μl临床样本核酸。反应程序为:45℃ 20min,94℃ 30s,35循环(94℃ 10s,63℃ 20s,72℃ 30s),72℃ 2min,55℃ 20min。
[0086]
结果如图12所示,发现检测结果为10例阳性,40例阴性,同时用商业化的新冠病毒核酸检测试剂盒(多重荧光rt-pcr法)做对比,结果一致,说明该方法有应用于临床检测的前景。
[0087]
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围,凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
[0088]
对比例1反转录酶的筛选
[0089]
反应体系配置如下:取2μl反应缓冲液,不同的反转录酶(5u tth dna聚合酶、200u m-mlv反转录酶、5u amv反转录酶或200u hiscript ii反转录酶),0.25mm dntps,0.5μm上游引物,0.5μm下游引物,0.25u gotaq dna聚合酶,加水补足至18μl,最后加入1μl 105拷贝/μln基因的rna模板,涡旋混匀,置于pcr扩增仪中进行反应。最后,取3.5μl rt-pcr产物进行琼脂糖凝胶电泳,琼脂糖凝胶浓度为2%,120v电压电泳30min。不同反转录酶对应不同的反应程序:
[0090]
采用tth dna聚合酶,rt-pcr反应程序为:65℃ 30min,94℃ 30s,40循环(94℃ 10s,63℃ 20s,72℃ 30s),72℃ 2min。
[0091]
采用m-mlv反转录酶或amv反转录酶,rt-pcr反应程序为:42℃ 30min,94℃ 30s,40循环(94℃ 10s,63℃ 20s,72℃ 30s),72℃ 2min。
[0092]
采用hiscript ii反转录酶,rt-pcr反应程序为:50℃ 30min,94℃ 30s,40循环(94℃10s,63℃ 20s,72℃ 30s),72℃ 2min。
[0093]
结果如图13所示,与阳性对照比较,只有hiscript ii反转录酶在闭管反应体系中成功将rna反转录成cdna,并在200bp左右有pcr产物条带,和阳性对照一致。而其他反转录酶(tth dna聚合酶、m-mlv反转录酶、amv反转录酶)生成的cdna的pcr产物条带小于100bp,可能是引物二聚体产生的非特异性扩增,说明这三种反转录酶不适应buffer的ph和离子强度,导致反转录反应失败。因此选择hiscript ii反转录酶用于rna病毒核酸的闭管可视化检测方法中的反转录反应。
[0094]
对比例2考察pcr核酸扩增反应与核酸侵入反应同时或分步进行的灵敏度
[0095]
反应体系配置如下:取2μl反应缓冲液,50u hiscript ii反转录酶,0.25mm dntps,0.5μm上游引物,0.5μm下游引物,0.25u gotaq dna聚合酶,3.5% peg8000,0.1μm上游探针,0.4μm下游探针,0.2μm发卡探针,100ng fen1核酸内切酶,2μl纳米金探针-1和2μl纳米金探针-2于反应管中,加水补足至19μl,最后加入1μl n基因的rna模板。
[0096]
(1)pcr核酸扩增反应与核酸侵入反应同时进行:
[0097]
反应程序为:45℃ 20min,94℃ 30s,35循环(94℃ 10s,63℃ 20s,72℃ 30s),72℃ 2min,55℃ 20min。
[0098]
(2)pcr核酸扩增反应与核酸侵入反应分步进行:
[0099]
反应程序为:45℃ 20min,94℃ 30s,35循环(94℃ 10s,72℃ 30s),72℃ 2min,63℃10min 55℃ 20min。
[0100]
结果如图14所示,当pcr核酸扩增反应与核酸侵入反应同时进行时,可以检测10拷贝的n基因rna模板,而pcr核酸扩增反应与核酸侵入反应分步进行时,无法检测出10拷贝的n基因rna模板,因此后续将pcr核酸扩增反应与核酸侵入反应同时进行,提高检测灵敏度。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1