一种固相合成RNA的去保护方法及应用与流程
本申请涉及生物,具体涉及一种固相合成rna的去保护方法及应用。
背景技术:
1、rna是由一定数量的核糖核酸或者其类似物等组合而成,主要包括有sirna、mirna及反义核酸等核酸小分子。这些核酸小分子含有特异性地沉默疾病基因的表达以及治愈特定疾病的核酸序列。与其他靶向蛋白的药物相比,核酸药物具有高特异性、高效性以及长效性等优势,并且rna核酸药物的适应症涵盖范围广,包括肿瘤、多种罕见病如肌萎缩性脊髓侧索硬化、杜氏肌营养不良、脊髓性肌萎缩等病毒性疾病、肾脏疾病、心血管疾病等,药物使用前景十分广阔。
2、rna核酸与dna核酸主要结构相似,在固相合成中戊糖的2号位羟基需要进行预保护如tbdms(叔丁基二甲基甲硅烷基)、tom(三异丙基甲硅烷基氧基甲基)等基团,固相合成结束后需要额外进行2-oh的去保护处理。目前,对于rna核酸的去保护处理技术中,采用氨解步骤,氨解步骤中用到氨水和长时间加热处理导致序列杂质增加,部分结构完整性遭到破坏,会导致制得的rna核酸粗品纯度低、回收量少。
技术实现思路
1、为了解决上述背景技术中提到的至少一个问题,本申请提供了一种固相合成rna的去保护方法及应用,所有去保护步骤都在合成固相载体上操作,从而提高rna核酸的纯度和最终收率,整个处理过程快速用时短,减少了脱保护试剂的残留便于进行后续的再次标记和纯化。
2、本申请实施例提供的具体技术方案如下:
3、第一方面,提供一种固相合成rna的去保护方法,所述方法包括:
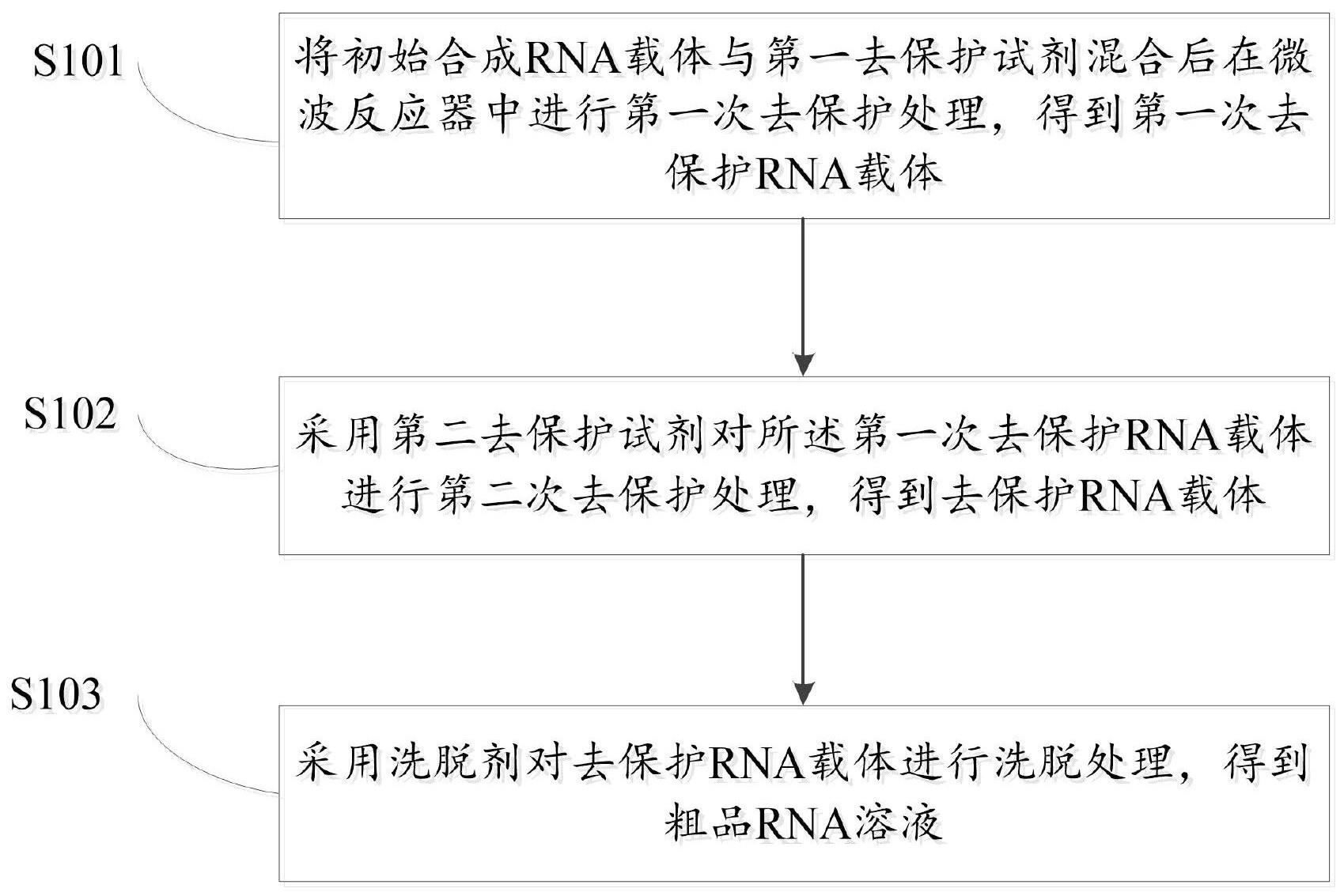
4、s1:将初始合成rna载体与第一去保护试剂混合后在微波反应器中进行第一次去保护处理,得到第一次去保护rna载体;
5、s2:采用第二去保护试剂对所述第一次去保护rna载体进行第二次去保护处理,得到去保护rna载体;
6、s3:采用洗脱剂对去保护rna载体进行洗脱处理,得到粗品rna溶液。
7、在一个具体的实施例中,所述初始合成rna载体与第一去保护试剂的用量设置为:初始合成rna载体中载体与第一去保护试剂的体积比为1:1~1.5v/v;
8、所述第一次去保护rna载体与第二去保护试剂的用量设置为:所述第一次去保护rna载体中载体与第二去保护试剂的体积比为1:1~1.5v/v。
9、在一个具体的实施例中,所述第一去保护试剂为醇类胺类复配溶液,所述醇类优选为甲醇、乙醇、丁醇或者叔丁醇;
10、所述胺类优选为叔丁胺、二乙醇胺、二异丙醇胺或者n-甲基二乙醇胺;
11、所述醇类胺类复配溶液中还包括复配溶剂,所述复配溶剂优选为dmso、乙醚或者丙酮;
12、所述醇类、胺类和复配溶剂的体积比为5~11:0.5~2:0.5~2v/v;优选为8:1:1、7:0.5:1、7:1:0.5、7:1.5:1、9:1.5:1、9:1:1.5、10:1:1.5、10:1.5:1.5或者11:2:2v/v。
13、在一个具体的实施例中,步骤s1中,将初始合成rna载体与第一去保护试剂混合后在微波反应器中进行反应第一次去保护处理,具体包括:
14、将合成柱与初始合成rna载体放入离心管中;
15、向离心管中加入第一去保护试剂,并将加入第一去保护试剂后的离心管置于微波反应器中进行反应。
16、在一个具体的实施例中,所述微波反应器中的反应条件为:
17、所述微波反应器功率为25~100w,优选为25w、28w、30w、40w、50w、55w、65w或者75w;
18、去保护时间为10~90min,优选为10min、15min、20min、25min、30min、40min、50min、60min、70min、80min或者90min。
19、在一个具体的实施例中,所述步骤s2中的第二去保护试剂优选为盐酸乙醇溶液、盐酸甲醇溶液、盐酸丁醇溶液或者盐酸叔丁醇溶液;
20、所述第二去保护试剂的浓度为0.5~2.5wt/%。
21、在一个具体的实施例中,所述步骤s2中的第二次去保护处理的条件为:
22、将所述第二去保护试剂与所述第一去保护rna载体混合后,静置处理;
23、静置处理温度为50~60℃,优选为50℃、52℃、54℃、55℃、56℃、57℃、58℃、59℃或60℃;
24、静置处理时间为10~20min,优选为10min、12min、15min、16min、17min、18min、19min或者20min。
25、在一个具体的实施例中,所述方法还包括:
26、在完成第一次去保护处理或者第二次去保护处理后,进行真空干燥;
27、干燥后采用第一清洗液进行清洗;
28、所述第一清洗液为乙醇、乙腈、乙醚、丙酮、丙二醇、二丙二醇、甘油、乙二醇、二乙二醇、三乙二醇、异己二醇中的一种;
29、其中,所述第一清洗液与去保护处理液的体积比为3~5:1v/v。
30、在一个具体的实施例中,所述方法还包括:
31、所述步骤s3中的洗脱剂为中性三乙胺醋酸盐。
32、第二方面,提供一种合成rna的方法,所述合成rna的方法包括:采用固相合成法合成rna核酸,所述rna核酸为不同长度的rna序列,使用如上所述的固相合成rna的去保护方法对所述rna序列进行后处理。
33、本申请实施例具有如下有益效果:
34、1.本申请实施例提供的将初始合成rna载体使用第一去保护试剂在微波反应器中进行第一次去保护处理,主要针对rna上四种碱基a、g、c、u的保护基和骨架上的腈乙基进行去除,然后采用第二去保护试剂进行第二次去保护处理,主要针对2-oh位置的保护基,两次去保护处理都是对附着在载体上的rna进行处理,最后使用洗脱剂洗脱,得到粗品rna溶液;本申请中的技术方案有效缩短了rna的后处理时间,将后处理时间控制在20min内,大大减少了副产物的产生以及减少了rna的降解,提高了产品的收率;同时采用盐酸乙醇溶液进行洗脱,减少了毒性较大的氟化物的使用,提高了实验操作的安全性,处理工艺中有机溶液的利用减少,降低了有机废液的产生,从而避免对环境造成污染。
技术特征:
1.一种固相合成rna的去保护方法,其特征在于,所述方法包括:
2.根据权利要求1所述的固相合成rna的去保护方法,其特征在于,所述初始合成rna载体与第一去保护试剂的用量设置为:初始合成rna载体中载体与第一去保护试剂的体积比为1:1~1.5v/v;
3.根据权利要求1或者2所述的固相合成rna的去保护方法,其特征在于,所述第一去保护试剂为醇类胺类复配溶液,所述醇类优选为甲醇、乙醇、丁醇或者叔丁醇;
4.根据权利要求1或者2所述的固相合成rna的去保护方法,其特征在于,步骤s1中,将初始合成rna载体与第一去保护试剂混合后在微波反应器中进行反应第一次去保护处理,具体包括:
5.根据权利要求4所述的固相合成rna的去保护方法,其特征在于,所述微波反应器中的反应条件为:
6.根据权利要求1或者2所述的固相合成rna的去保护方法,其特征在于,所述步骤s2中的第二去保护试剂优选为盐酸乙醇溶液、盐酸甲醇溶液、盐酸丁醇溶液或者盐酸叔丁醇溶液;
7.根据权利要求1所述的固相合成rna的去保护方法,其特征在于,所述步骤s2中的第二次去保护处理的条件为:
8.根据权利要求7所述的固相合成rna的去保护方法,其特征在于,所述方法还包括:
9.根据权利要求1、2或者8所述的固相合成rna的去保护方法,其特征在于,所述方法还包括:
10.一种合成rna的方法,其特征在于,所述合成rna的方法包括:采用固相合成法合成rna核酸,所述rna核酸为不同长度的rna序列,使用权利要求1~9中任一项所述的固相合成rna的去保护方法对所述rna序列进行后处理。
技术总结
本申请公开了一种固相合成RNA的去保护方法及应用,涉及生物技术领域,包括将初始合成RNA载体分别通过第一去保护试剂针对四种碱基A、G、C、U的保护基和骨架上的腈乙基进行去除,然后采用第二去保护试剂去除2‑OH位置的保护基,两次去保护处理都是对附着在载体上的RNA进行处理,最后使用洗脱剂洗脱,得到粗品RNA溶液。本申请中的方案能够缩短后处理的时间,并且副产物少、RNA降解的量较少,提高了RNA产品的产率;同时处理工艺中减少了有机溶液的利用,减少了有机废液的产生,从而避免对环境造成污染。
技术研发人员:陈鸿运,刘雷
受保护的技术使用者:上海捷瑞生物工程有限公司
技术研发日:
技术公布日:2024/1/14
- 还没有人留言评论。精彩留言会获得点赞!