基于肿瘤类器官模型筛选个体化肿瘤新抗原疫苗的方法与流程
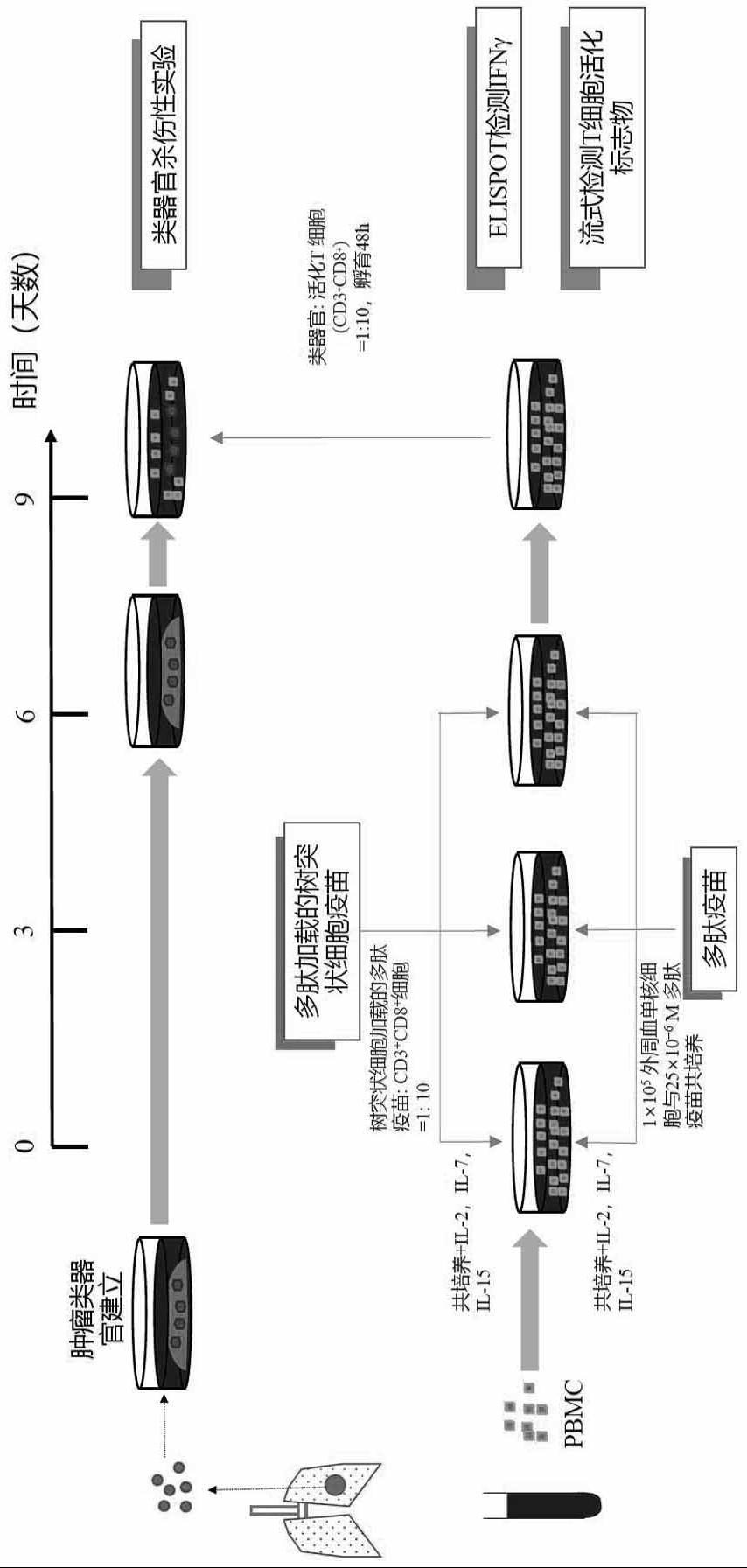
本技术涉及一种基于肿瘤类器官模型筛选个体化肿瘤新抗原疫苗的方法,具体包括个体化肿瘤类器官模型的建立,个体化肿瘤新抗原疫苗对患者来源pbmc中免疫细胞的激活,以及肿瘤类器官与免疫细胞共培养的肿瘤杀伤体系的建立。
背景技术:
1、近几十年来,人们对肿瘤发生发展的机制的认识有了很大的提高,癌症的诊断和治疗已经取得了很大的进展,但是癌症的治疗仍然是世界性的难题。免疫治疗是癌症治疗中进展最快和最具前景的方案之一。机体免疫系统在患者肿瘤发生发展中起了至关重要的作用,而免疫系统功能异常是引发癌症发病以及发展的重要原因。肿瘤免疫疗法是一种通过激活人体自身免疫系统,恢复机体的抗肿瘤反应,从而识别并清除肿瘤细胞的有效治疗方法。
2、肿瘤新抗原疫苗是目前最具前沿性及具有治愈癌症潜能的肿瘤免疫疗法之一,主要特点是特异性诱导患者自身免疫系统的免疫应答,有效的抑制肿瘤发展甚至清除肿瘤。肿瘤细胞的非同义体细胞突变可以产生肿瘤特异性的新抗原,在正常组织中不表达,新抗原通过mhc呈递到细胞表面被t细胞特异性识别并激活免疫应答反应,使患者获得动态的、持续的抗肿瘤免疫应答,降低肿瘤复发率,甚至可以真正实现临床治愈。肿瘤新抗原治疗性疫苗有多种形式,主要包括:多肽疫苗、核酸疫苗、肿瘤新抗原装载的树突状细胞(dc)疫苗等。如今临床上通常采用肿瘤新抗原疫苗与其他免疫治疗方案联合治疗,能更有效的增强免疫细胞的肿瘤杀伤效果,使得肿瘤新抗原疫苗研究成为癌症治疗领域研发的热点,而筛选到真正具有高免疫原性的肿瘤新抗原疫苗是个体化肿瘤新抗原疫苗治疗肿瘤临床应用和提高临床治疗效果中至关重要的部分。
3、随着精准医学、基因组学、高通量测序技术的快速发展,特别是单细胞测序和空间转录组学的出现极大推动了个体化肿瘤新抗原预测的精确性,但从高通量基因测序数据所得到的肿瘤的体细胞突变到可以真正引起t细胞表面受体tcr(t-cell receptor)特异性识别肿瘤新抗原从而产生免疫应答反应,这中间存在着大量的假阳性新抗原,这些候选假阳性新抗原无法激活t细胞的特异性免疫应答,为临床试验以及癌症治疗带来极大的不确定性。由于绝大部分新生抗原都是肿瘤体细胞随机突变产生的,在患者之间或者肿瘤之间完全不同,新生抗原疫苗只能是一对一针对每个患者个体或者针对每个肿瘤进行个性化治疗,属于个体化定制型的“一人一药”,因此筛选真正可以引起t细胞免疫应答的新抗原疫苗是个体化肿瘤新抗原疫苗制备中不可或缺的一环,而有效合理的筛选方案在临床转化研究以及癌症免疫治疗中具有极高的临床应用意义和广泛前景。
4、目前体外筛选个体化肿瘤新抗原疫苗采用的主要方法是检测个体化肿瘤新抗原疫苗激活的t细胞的免疫活性,例如新抗原疫苗与t细胞共刺激后通过流式细胞术、酶联免疫吸附斑点试验(eli spot)检测t细胞的活化程度,多色标记的mhc四聚体实验和新抗原活化后的t细胞测序分析等,进而通过验证新抗原疫苗的免疫原性来筛选个体化肿瘤新抗原疫苗。这些筛选方案只能在体外检测个体化肿瘤新抗原疫苗反应的t细胞的免疫活性,而个体化肿瘤新抗原疫苗反应的t细胞是否能真正在体内杀伤肿瘤细胞无法验证,所以有很大的局限性。而患者来源的肿瘤类器官模型能够在体外高效快速的模拟患者体内的肿瘤微环境,因为其可以保留患者体内组织学特征和遗传学特征,越来越多的被用在体外抗肿瘤药物筛选等方案中。在个体化肿瘤新抗原疫苗的筛选中,本技术把个体化肿瘤新抗原疫苗激活的t细胞(分离自同一患者的外周血单核细胞pbmc)与肿瘤类器官共培养后,通过检测个体化肿瘤新抗原疫苗激活的t细胞对类器官的杀伤水平对个体化肿瘤新抗原疫苗进行验证与筛选,很大程度的弥补了之前的筛选方法无法模拟患者体内肿瘤微环境,无法真正检测个体化肿瘤新抗原疫苗激活的t细胞的肿瘤杀伤效果的缺陷。
5、患者来源的肿瘤类器官模型可以为个体化肿瘤新抗原疫苗的免疫原性和功能鉴定进行快速高效的体外筛选。治疗性肿瘤疫苗的临床应用一个很大的挑战是无法准确的鉴定可以真正引起免疫应答的新抗原靶点,传统的肿瘤模型无法有效的模拟患者体内的免疫微环境及实体肿瘤的高度异质性。近几十年肿瘤研究的模型大多为2d肿瘤细胞系培养、患者来源的异种移植瘤(patient-derived xenograft,pdx)或基因工程小鼠,然而随着人们对肿瘤复杂性的深入了解,这几种模型都有很大的局限性。例如从患者肿瘤构建的2d细胞系缺乏肿瘤组织空间结构,难以模拟患者体内微环境的多样性,同时无法保留原始肿瘤细胞的异质性和遗传物质的异质性;动物模型相比体外2d培养能更好的模拟患者肿瘤的生物学特征,但是难以引入患者自身的微环境,而且构建成功率低,周期长,成本高,在临床应用上有很大的困难。而在肿瘤的免疫学研究中,这些传统的体外体内模型最大的缺点是无法充分的模拟患者体内的复杂免疫微环境,都不能作为肿瘤免疫治疗转化研究和临床研究中的理想模型。
6、近年来体外类器官培养的出现为肿瘤学尤其是肿瘤免疫学的研究提供了新的研究思路。类器官是指在体外三维环境中培养的一群有自我更新和自我组织能力的类似于体内组织排列和功能的细胞团落,通常来源于胚胎干细胞、诱导多能干细胞或成体干细胞。类器官不仅可以来源于正常成体组织,同时也可以来源于肿瘤组织,来源于肿瘤组织建立的类器官称之为患者来源的肿瘤类器官模型(patient-derived organoid,pdo)。自2011年sato等人首次成功构建了患者来源的肠癌类器官后,研究人员陆续实现了肝癌、胰腺癌、乳腺癌、肺癌等类器官模型的建立。相比较于肿瘤原代细胞2d培养和pdx模型,肿瘤类器官模型包含多种特异性细胞类型,空间结构与其对应肿瘤组织相似,组织来源也更加多样,除手术切除,穿刺活检样本外,还可以以循环肿瘤细胞和浆膜腔积液样本为来源建立类器官模型。
7、肿瘤类器官很好的维持了患者肿瘤的原始生理结构和功能特征。成功构建的肿瘤类器官模型可以长期传代并建立肿瘤类器官样本库,不仅在肿瘤学基础研究、转化研究、高通量药物筛选以及个体化精准医疗中发挥了至关重要的作用,同时也为肿瘤免疫治疗基础研究和转化研究提供了更为理想的模型。一直以来在体外模拟患者肿瘤的免疫微环境是肿瘤免疫学研究的重要挑战,而肿瘤免疫微环境类器官模型可以克服原代肿瘤细胞系无法满足患者肿瘤的异质性和pdx模型难以引入人体的免疫系统的局限性,最大限度的模拟患者肿瘤的免疫微环境。
8、免疫微环境类器官的构建有两种不同的实验方案,一种是直接从患者来源的肿瘤组织样本构建肿瘤类器官同时保留内源性免疫细胞共培养,另一种方案是在肿瘤类器官引入外源免疫细胞(pbmc分离或单独培养)进行共培养。肿瘤类器官内源性免疫细胞共培养方案采用的是气液平面法(air-liquid interphase,ali):肿瘤样本或者活检样本的细胞悬液接种于transwell小室上层的基质胶中,小室下层加入完全培养基,共培养体系建立在气液平面上促进了类器官与内源性免疫细胞的增殖。气液平面法中的内源性免疫细胞保留了原始t细胞受体(t cell receptor,tcr)的异质性,但在此体系中内源性免疫细胞只能存活30天左右且无法在传代中保留。另一种共培养方案是包埋法构建的患者来源的肿瘤类器官与同一患者的外周血单核细胞(pbmc)分离出来的免疫细胞进行共培养。这种方案在单独构建的类器官中引入了患者自身的免疫微环境,还原患者的原代组织和肿瘤细胞微环境,并维持其多样化的细胞群体,这一方案可以对肿瘤类器官进行长期的培养和扩增,随时对其进行免疫学研究,更利于肿瘤免疫学的广泛研究。
技术实现思路
1、本发明的目的是提供基于肿瘤类器官模型筛选个体化肿瘤新抗原疫苗的方法,与目前的新抗原免疫原性筛选模型相比,肿瘤免疫微环境类器官模型既能还原肿瘤内部的异质性、也可模拟患者个体化真实的肿瘤免疫微环境,从而能更真实的反映个体化肿瘤新抗原疫苗介导的抗肿瘤免疫反应,筛选出临床有效的个体化肿瘤新抗原疫苗,建立安全有效的个体化免疫治疗方案。
2、为实现上述目的,本发明采用如下技术方案:
3、基于肿瘤类器官模型筛选个体化肿瘤新抗原疫苗的方法,其特征在于:包括以下步骤:
4、s1、肿瘤类器官建立,包括取样及保存、样本酶解、类器官铺板、类器官传代、类器官冻存;
5、s2、对候选新抗原疫苗进行初步筛选,包括通过流式细胞术和elispot,检测被待筛选的候选新抗原疫苗刺激的pbmc中的免疫细胞的活化水平,从而初步验证和筛选高免疫原性的候选新抗原疫苗,形成初步筛选的新抗原疫苗;
6、s3、免疫微环境肿瘤类器官模型建立,用步骤s2中初步筛选的新抗原疫苗刺激步骤s1病人来源的pbmc的免疫细胞,把刺激后的pbmc与cfse标记的类器官共培养于t细胞培养基中共培养建立免疫微环境肿瘤类器官模型;
7、s4、通过杀伤实验筛选能引起免疫细胞杀伤效果的个体化新抗原疫苗,包括利用步骤s3中构建的免疫微环境肿瘤类器官模型进行类器官杀伤实验,进一步体外筛选高免疫原性的肿瘤治疗性疫苗。
8、进一步地,步骤s1具体包括:
9、s11:取样及保存,手术室新鲜切除的肿瘤组织或者活检组织放于冰预冷的addmem/f12+++培养基中迅速转运到实验室开始分离原代组织;
10、s12:样本酶解,将s11的组织块切成1-3mm3的小块,用组织解离液进行解离,不同癌组织解离液不同,解离完成的原代细胞用addmem/f12+++清洗重悬后用70µm或100µm细胞滤网进行过滤,过滤完成后加入红细胞裂解液4℃处理5min;
11、s13:类器官铺板,将裂解后的肿瘤原代细胞重悬在培养基稀释的基质胶中,整体浓度不能低于70%,将混有原代肿瘤细胞的基质胶滴加到37℃培养箱预热的6孔板上,待3-5min后迅速放置到培养箱倒置培养20min以形成稳定的dome并使基质胶凝固,待基质胶凝固后在培养皿中加入完全培养基,不同癌组织完全培养基不同;
12、s4:类器官冻存,待细胞状态较好时进行换液,隔天冻存,取用时复苏即可。
13、进一步优选地,步骤s2具体包括,
14、s21、初筛选环境准备:癌患者pbmc来源的免疫细胞获取,候选新抗原疫苗与pbmc共培养,以对pbmc中免疫细胞进行刺激;
15、s22、elispot实验验证对被新抗原疫苗刺激后的免疫细胞的免疫活性:在pbmc被候选新抗原疫苗刺激三个周期后,收集pbmc细胞培养上清液用于酶联免疫吸附实验,通过检测ifnγ的分泌来分析候选新抗原疫苗的免疫原性,根据数值的大小排序筛选出免疫原性较高的候选新抗原疫苗;
16、s23、流式细胞术验证被新抗原疫苗刺激后的免疫细胞的免疫活性:在pbmc被候选新抗原疫苗刺激三个周期后,收集pbmc并通过流式细胞术检测t细胞激活标记物评估免疫细胞的免疫活性,检测cd8+t细胞的ifnγ,cd107α,cd137的表达作为t细胞激活的指标,根据测定指标的大小排序并筛选出免疫原性较高的候选新抗原疫苗;
17、s24、综合评价:对s22和s23筛选出的候选新抗原疫苗,进行综合评价,进一步筛选形成初步筛选的新抗原疫苗。
18、进一步地,步骤s3具体包括,
19、s31,利用步骤s1冻存的类器官进行传代培养,复苏s1冻存的类器官,从含有类器官的6孔板中吸出培养基,每孔含有1-5×104个类器官,按类器官传代方式进行消化,待解离成单细胞后,用cfse标记肿瘤类器官;
20、s32,免疫微环境肿瘤类器官模型建立,用步骤s2中初步筛选的新抗原疫苗刺激步骤s1病人来源的pbmc的免疫细胞,把刺激后的pbmc与cfse标记的类器官共培养于t细胞培养基中,按免疫细胞比肿瘤类器官细胞10:1的比例进行混合,铺到24孔板中,每孔加500µl培养基,免疫微环境肿瘤类器官模型建立完成,备用。
21、更加优选地,步骤s4利用免疫微环境肿瘤类器官模型进行类器官杀伤实验具体为,对用初步筛选肿瘤新抗原刺激的pbmc构建的免疫微环境肿瘤类器官模型培养72h,后收集类器官和t细胞,在室温下用cd45抗体、annexinv抗体、7-aad抗体染色15分钟,用流式细胞仪分析cfse标记的类器官的凋亡水平,cfse+cd45-用于定义类器官,annexinv-7-aad-用于检测肿瘤类器官杀伤的细胞凋亡水平,根据不同个体化新抗原疫苗激活的免疫细胞杀伤后的类器官凋亡水平的高低进行排序,筛选出高免疫原性的肿瘤治疗性疫苗,或者,用光学显微成像,分析类器官杀伤实验候选新抗原疫苗激活免疫细胞的免疫杀伤效果,对不同个体化新抗原疫苗激活的免疫细胞杀伤引起的类器官凋亡水平的高低进行排序,筛选出高免疫原性的肿瘤治疗性疫苗。
22、与现有技术相比本发明具有以下特点和有益效果:
23、本技术创建了利用患者来源的肿瘤类器官和肿瘤免疫微环境的共培养体系进行个体化肿瘤新抗原疫苗杀伤肿瘤细胞功能的鉴定,分析候选肿瘤新抗原疫苗的免疫原性及被候选肿瘤新抗原疫苗激活的免疫细胞的肿瘤杀伤功能,从而筛选出真正具有高免疫原性和能引起肿瘤细胞杀伤功能的个体化肿瘤新抗原疫苗进入临床治疗应用。
24、基于基因检测、流式细胞术分析、免疫荧光染色、h&e染色或光学显微成像等检测方法,抗肿瘤效果可以从形态学、组织病理学、细胞生态学以及分子遗传学等多个维度确定候选新抗原疫苗的免疫原性和肿瘤杀伤功能鉴定,可以更准确地评估及预测候选个体化新抗原治疗性疫苗在肿瘤免疫治疗中的疗效,从而选定真正具有高免疫原性的个体化肿瘤新抗原疫苗进入肿瘤免疫治疗阶段,使病人真正受益。
- 还没有人留言评论。精彩留言会获得点赞!