2,3‑二酰亚胺苯并菲盘状液晶分子及其制备方法与流程
本发明涉及一种2,3-二酰亚胺苯并菲盘状液晶分子及其制备方法。
背景技术:
苯并菲最早是从苯的热裂解产物中分离得到,Mannich首次合成了苯并菲,并且对其结构进行了确定。苯并菲是一类具有平面离域的18π-π电子体系的多环芳烃,这类化合物发生亲电取代反应的时候,由于空间位阻等原因其2,3,6,7,10,11位的取代比其l,4,5,8,9,12位的取代更加有利,因此常见的苯并菲衍生物都是2,3,6,7,10,11位取代的苯并菲。
早期研究表明苯并菲类化合物具有抗艾滋病活性,除此之外苯并菲衍生物主要在光存储、有机半导体、光电导体、光电池电荷传输材料、发光二极管活性材料和液晶显示材料等方面显示出巨大的应用前景。目前研究较多的为六条烷氧基取代的苯并菲衍生物,该类苯并菲衍生物由于分子中存在绕轴旋转、柱内上下振动以及柱间滑动运动,具有较低的熔点和清亮点,是一种良好的盘状液晶化合物。有研究表明:含六条吸电子羧酸酯的苯并菲衍生物,由于吸电子基团的引入增强了液晶柱状相之间偶极-偶极相互作用,导致了在不同基质中具有大面积的垂直柱状取向,从而呈现出异乎寻常的二维晶格相关性,为宽范围定向液晶半导体材料的设计提供了新的方法,具有潜在的应用价值(Angew.Chem.Int.Ed.2012,51,7990)。近年来也有苯并菲三酰亚胺化合物的报道,这类化合物通过酰亚胺基团的引入将苯并菲中心核的结构拓宽,构成新的、扩大的苯并菲芳香核的衍生物,有利于一维的柱状结构的组装;同时由于酰亚胺基团强的吸电子能力,导致这类物质具有n-型半导体材料的特性,并且还可以通过酰亚胺基团引入不同长度的氮烷基链,可以调控物质的柱状温度范围(Org.Lett.2009,11,3028)。因此吸电子基团的引入对于苯并菲盘状液晶分子的研究具有重大意义。
现有的LCD产品存在以下技术困难:[1]设备的入射光的主要部分转换成热量,这限制了亮度和能源效率的提升。[2]液晶本身不发光,需要一个额外的背光光源,这也导致进一步的能量消耗。因此,具有良好发光性的荧光液晶材料能很好的克服这两个技术壁垒。而合成具稳定发射性能的荧光液晶化合物较为困难,特别是合成在固态或聚集态时有高发光效率的荧光液晶材料较少报道。而酰亚胺,尤其是苝酰亚胺化合物以及它的衍生物因具有n-型半导体性质在发光二极管,光电材料而存在潜在应用。而且酰亚胺与苝,蒽,萘等具有较大共轭体系的分子可形成用作具有荧光的酰亚胺染料和太阳能电池。这类化合物的优势是具有高的光化学稳定性,易于合成性,以及电荷传输的稳定性。基于前人的研究,我们推测:酰亚胺类化合物与苯并菲整合,不仅影响材料的特性和材料的相温度范围,还可能合成一类在固态或聚集态时有高发光效率的荧光液晶材料。因此,我们设计并合成了一类新型2,3-二酰亚胺苯并菲盘状液晶分子,希望这类分子同时具有良好的液晶性和发光性能。
传统上合成苯并菲骨架主要采用单苯的三偶联法(Chem.Commun.,1997,1615),主要得到六条相同取代基的对称苯并菲衍生物,受反应性的影响侧链取代基多为烷氧基、醚、酯等给电子基团;非对称苯并菲的合成是通过对两种1,2-二烷氧基苯的混合物进行氧化偶联反应或通过对对称苯并菲进行烷基取代而得到,然而通过这种方法合成出来的产品是对称和非对称取代苯并菲的混合物,需要通过柱分离将非对称的苯并菲分离出来(Mol.Cryst.Liq.Cryst.,1981,307);另外一种已被广泛研究的合成方法是金属参与的氧化偶联法。包括金属参与的联苯-苯的氧化偶联法(J.Chem.Soc.,Chem.Commun.,1994,465)和三联苯的氧化偶联法(J.Mater.Chem.,2001,1618),但以上方法具有需要特定官能团的底物,以及只适用于给电子的烷氧取代基类底物等局限性。而在苯并菲骨架上引入吸电子基团则较困难,以羧酸酯的引入为例,已有的方法是通过把与苯并菲直接相连的甲基氧化成羧基,再酯化的反应来制备(Eur.J.Org.Chem.,2006,2889);而酰亚胺基团的引入则更为困难,需要合成相应的二酸和酸酐等中间体来制备,因此对于含吸电子基团的苯并菲化合物的合成,都存在着反应步骤长、条件苛刻、产率低等缺点。
技术实现要素:
本发明的第一个发明目的就是提供一种2,3-二酰亚胺苯并菲盘状液晶分子。研究表明该类酰亚胺苯并菲衍生物具有较好的液晶性能和较宽的液晶范围,可作为良好的液晶材料。
本发明实现其第一个发明目的,所采用的技术方案是:一种2,3-二酰亚胺苯并菲盘状液晶分子,具有下述通式(Ⅰ)的结构,其中m表示含碳原子数为1至12的整数,R有以下三种方式:1)、R为含碳原子数1-12的全直链饱和烷基;2)、R为含碳原子数为4-18的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1,其中n和k分别表示含碳原子数为1至8的整数;3)、R为苯基。
与现有技术相比,本发明的通式(Ⅰ)的2,3-二酰亚胺苯并菲盘状液晶分子的有益效果是:
1、该类化合物很难由已报道的联苯-苯的氧化偶联法方法直接合成。
2、制备该类2,3-二酰亚胺苯并菲衍生物的前体化合物2,3-二羧酸甲酯苯并菲(通式Ⅱ中,m=6)具有一定的液晶性能,与六条烷氧基取代的苯并菲衍生物相比,酯基的引入使其液晶范围增加;而2,3-二酰亚胺苯并菲盘状液晶分子由于吸电子能力更强的酰亚胺基团的引入,使其清亮点较前体化合物2,3-二羧酸甲酯苯并菲大大增加,导致液晶范围明显增加
本发明的第二个发明目的是提供一种制备上述的2,3-二酰亚胺苯并菲盘状液晶分子的方法,该种制备方法,具有步骤短、操作简单等特点。
本发明实现其第二个发明目的,所采用的技术方案是:一种制备权利要求(Ⅰ)所述的2,3-二酰亚胺苯并菲盘状液晶分子的方法,其作法是:
A、2,3-二羧酸甲酯苯并菲衍生物的合成
以四烷氧基取代的二苯基乙炔为原料合成通式为(Ⅱ)的2,3-
二羧酸甲酯苯并菲衍生物,备用;
其中m表示含碳原子数为1至12的整数,
B、2,3-二羧酸甲酯苯并菲与有机胺的反应
通式(Ⅱ)中的2,3-二羧酸甲酯苯并菲衍生物与通式为RNH2的有机胺,在咪唑存在的条件下,回流反应得到通式为(Ⅰ)的2,3-二酰亚胺苯并菲化合物;R有以下三种方式:1)、R为含碳原子数1-12的全直链饱和烷基;2)、R为含碳原子数为4-18的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1其中n表示含碳原子数为1至8的整数,k表示含碳原子数为1至8的整数;3)、R为苯基。
上述A步的2,3-二羧酸甲酯苯并菲衍生物的具体合成步骤是:将二芳基乙炔、碘化亚铜和Grubbs二代催化剂(Grubbs-2催化剂)加入反应管中,密闭体系,在乙烯气氛下,用甲苯作溶剂,在80℃的油浴中加热搅拌24小时,稍冷,加入丁炔二羧酸二烷基酯,于100℃的油浴中继续加热搅拌24小时,体系冷却至室温,反应液通过一二氧化硅短柱,用二氯甲烷洗涤除掉不溶物,旋蒸除去滤液溶剂,得到的固体用二氯甲烷溶解后加入氧化剂三氯化铁(FeCl3),反应至点板检测原料点消失后,萃取、干燥、过滤,得到的反应混合物通过二氧化硅柱层析分离,得淡黄色固体即为产物,其中二芳基乙炔和碘化亚铜的摩尔比为1:0.05~1:0.1,二芳基乙炔和Grubbs-2催化剂的摩尔比为1:0.1~1:0.2,二芳基乙炔和丁炔二羧酸二甲酯的摩尔比为1:5~1:8,二芳基乙炔和氧化剂三氯化铁(FeCl3)的摩尔比为1:2.5~1:6。
上述B步的2,3-二羧酸甲酯苯并菲与有机胺的反应的具体合成步骤是:将2,3-二羧酸甲酯苯并菲、有机胺和咪唑加入反应管中,密闭体系,在氮气气氛下,用邻二氯苯作溶剂,在油浴中加热回流,反应至点板检测原料点消失后,萃取、干燥、过滤,得到的反应混合物通过二氧化硅柱层析分离,得黄色固体即为产物,其中2,3-二羧酸甲酯苯并菲和有机胺的摩尔比为1:3.5~1:5,2,3-二羧酸甲酯苯并菲和咪唑的摩尔比为1:600~1:900。
以上制备方法具有的优点是:
(1)与已报道的方法不同的是:该方法采用简单易得的二芳基乙炔做原料,通过多步串联反应快速构建苯并菲骨架后直接与与有机胺反应合成2,3-二酰亚胺苯并菲盘状液晶分子,不需要通过合成相应的二酸和酸酐等传统中间体来制备目标分子。
(2)更重要的是,通过这种方法,具有强吸电子能力的酰亚胺基团很容易被引入到苯并菲分子中,丰富了苯并菲化合物的结构。
附图说明
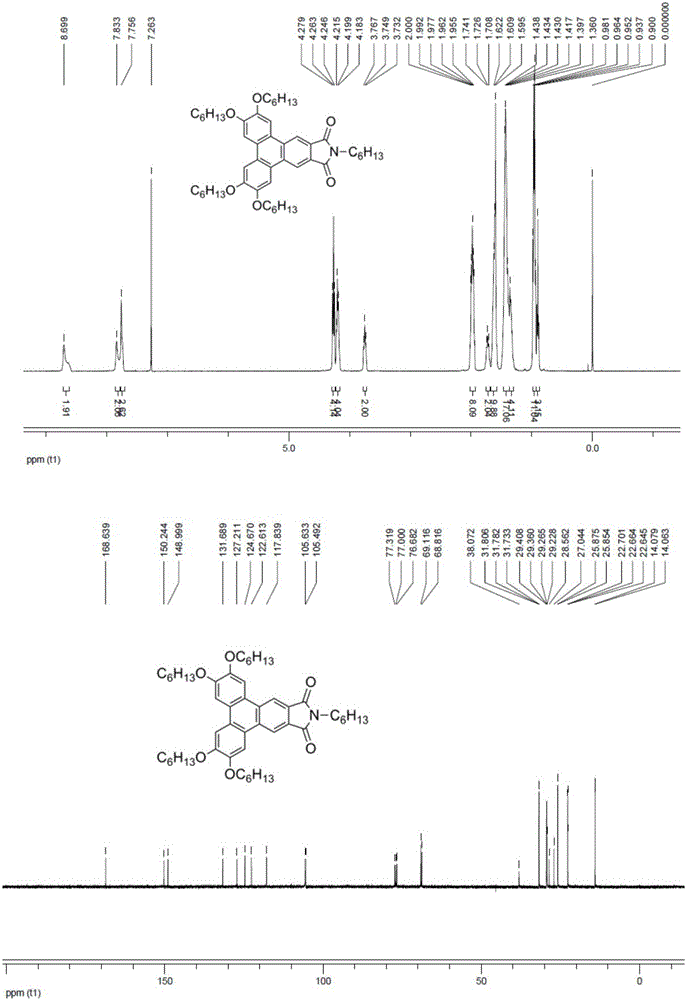
图1为实施例1中所获化合物的核磁共振氢谱和碳谱。
图2为实施例2中所获化合物的核磁共振氢谱和碳谱。
图3为实施例3中所获化合物的核磁共振氢谱和碳谱。
图4为实施例4中所获化合物的核磁共振氢谱和碳谱。
图5为实施例5中所获化合物的核磁共振氢谱和碳谱。
图6为实施例6中所获化合物的核磁共振氢谱和碳谱。
具体实施方式
下面给出实施例以对本发明进行具体描述,有必要在此指出的是以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术熟练人员根据上述本发明的内容对本发明做出的一些非本质的改进和调整仍属本发明的保护范围。
值得说明的是,以下各实施例所用的对称的二苯基乙炔的合成为现有技术,参见文献:J.Org.Chem.2010,75,6244–6251.
本制备方法总的化学反应式如下:
实施例1
本实施例提供的化合物是通式(Ⅰ)中的化合物,其中m表示含碳原子数为1至12的整数,R有以下三种方式:1)、R为含碳原子数1-12的全直链饱和烷基;2)、R为含碳原子数为4-18的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1,其中n和k分别表示含碳原子数为1至8的整数;3)、R为苯基。本例中m=6,R为含碳原子数为4的全直链饱和烷基。
其制备反应如下:
A、2,3-二羧酸甲酯苯并菲衍生物的合成
以四烷氧基取代的二苯基乙炔为原料合成通式为(Ⅱ)的2,3-
二羧酸甲酯苯并菲衍生物,本例中m=6;
具体的制备步骤如下:
将1摩尔每份的二芳基乙炔,0.05摩尔每份的碘化亚铜和0.1摩尔每份的Grubbs-2加入反应管中,用甲苯作溶剂,在乙烯气氛下于80℃的油浴中加热搅拌24小时,稍冷,加入5.0摩尔每份的丁炔二羧酸二甲酯(DMAD),于100℃的油浴中继续加热搅拌24小时。体系冷却至室温,反应液通过一二氧化硅短柱,用二氯甲烷洗涤除掉不溶物,旋蒸除去滤液溶剂,得到的固体在氩气气氛下加入4.0摩尔每份的三氯化铁、1毫升硝基甲烷和10毫升二氯甲烷,在0℃下反应1小时,用甲醇淬灭反应,二氯甲烷萃取,萃取液干燥,过滤,得到的反应混合物通过二氧化硅柱层析分离,得淡黄色固体即为产物,产率为55%。
以下的光谱数据表明本例A步制得中间产物即为通式(Ⅱ)中m=6的2,3-二羧酸甲酯苯并菲衍生物:
核磁氢谱1H-NMR(400MHz,CDCl3,TMS)8.82(s,1H),7.99(s,1H),7.82(s,1H),4.23~4.27(m,4H),4.01(s,3H),1.92~1.99(m,4H),1.55~1.63(m,4H),1.40~1.42(m,8H),0.92~0.96(m,6H);
核磁碳谱13C-NMR(100MHz,CDCl3,TMS)168.7,150.5,149.3,130.2,128.1,125.1,124.5,122.4,106.9,106.3,69.4,69.4,52.8,31.6,29.3,29.3,25.8,25.8,22.6,14.1;
高分辨率质谱HRMS(ESI):Anal.Calcd.(M+H+)745.4674,Found:745.4651;(M+Na+)767.4493,Found:767.4480;
红外光谱IR(KBr):ν(cm-1)2951,1723,1615,1515,1465,1387,1267,727.
B、2,3-二羧酸甲酯苯并菲与有机胺的反应
将A步制得的1摩尔每份的2,3-二羧酸甲酯苯并菲、3.5摩尔每份的正丁胺和600摩尔每份的咪唑加入反应管中,密闭体系,在氮气气氛下,用邻二氯苯作溶剂,在油浴中加热回流,反应至点板检测原料点消失后,萃取、干燥、过滤,得到的反应混合物通过二氧化硅柱层析分离,得黄色固体即为产物,产率为90%;
以下的光谱数据表明采用以上本例方法制得产物确为以下通式(Ⅰ)的化合物,且通式中m=6,R为碳原子数为4的全直链饱和烷基;
核磁氢谱1H-NMR(400MHz,CDCl3,TMS)8.80(s,2H),7.92(s,2H),7.79(s,2H),4.23-4.29(m,8H),3.77(t,J=7.2Hz,2H),1.94-2.02(m,8H),1.69-1.75(m,2H),1.58-1.61(m,10H),1.41-1.44(m,17H)0.93-1.01(m,14H);
核磁碳谱13C-NMR(100MHz,CDCl3,TMS)168.88,150.61,149.37,132.41,127.78,125.12,123.04,118.51,106.37,106.01,69.41,69.22,37.95,31.67,30.70,29.30,29.27,25.82,25.80,22.67,22.65,20.16,14.07,14.06,13.71;
高分辨率质谱HRMS(ESI):calc.m/z 754.5047(C48H68NO6),found m/z 754.4982[M+H]+;
红外光谱IR(KBr):ν(cm-1)3451,1712,1310,1266,1184,1128,925,747,606;
实施例2
本实施例提供的化合物是通式(Ⅰ)中的化合物,其中m表示含碳原子数为1至12的整数,R有以下三种方式:1)、R为含碳原子数1-12的全直链饱和烷基;2)、R为含碳原子数为4-18的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1,其中n和k分别表示含碳原子数为1至8的整数;3)、R为苯基。本例中m=6,R为含碳原子数为6的全直链饱和烷基。
其制备反应如下:
A、2,3-二羧酸甲酯苯并菲衍生物的合成
与实施例1的A步完全相同。
B、2,3-二羧酸甲酯苯并菲与有机胺的反应
将A步制得的1摩尔每份的2,3-二羧酸甲酯苯并菲、3.5摩尔每份的正已胺和600摩尔每份的咪唑加入反应管中,密闭体系,在氮气气氛下,用邻二氯苯作溶剂,在油浴中加热回流,反应至点板检测原料点消失后,萃取、干燥、过滤,得到的反应混合物通过二氧化硅柱层析分离,得黄色固体即为产物,产率为95%;
以下的光谱数据表明采用以上本例方法制得产物确为以下通式(Ⅰ)的化合物,且通式中m=6,R为碳原子数为6的全直链饱和烷基
该产物测得的光谱数据为:
核磁氢谱1H-NMR(400MHz,CDCl3,TMS)8.70(s,2H),7.83(s,2H),7.75(s,2H),4.26(t,J=6.4Hz,4H),4.20(t,J=6.4Hz,4H),3.75(t,J=7.2Hz,2H),1.94-2.02(m,8H),1.71-1.74(m,2H),1.60-1.62(m,8H),1.34-1.44(m,21H),0.94-0.98(m,11H),0.88-0.92(m,3H);
核磁碳谱13C-NMR(100MHz,CDCl3,TMS)168.82,150.56,149.32,132.25,127.67,125.03,122.96,118.34,106.26,105.96,69.37,69.14,38.18,31.70,31.68,31.43,29.34,29.31,28.60,26.64,25.84,25.82,22.67,22.65,22.58,14.06,14.05,14.04;
高分辨率质谱HRMS(ESI):calc.m/z 782.5360(C50H72NO6),found m/z 782.5315[M+H]+;
红外光谱IR(KBr):ν(cm-1)3657,1766,1715,1310,1127,927,745,609;
实施例3
本实施例提供的化合物是通式(Ⅰ)中的化合物,其中m表示含碳原子数为1至12的整数,R有以下三种方式:1)、R为含碳原子数1-12的全直链饱和烷基;2)、R为含碳原子数为4-18的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1,其中n和k分别表示含碳原子数为1至8的整数;3)、R为苯基。本例中m=6,R为含碳原子数为8的全直链饱和烷基。
其制备反应如下:
A、2,3-二羧酸甲酯苯并菲衍生物的合成
与实施例1的A步完全相同。
B、2,3-二羧酸甲酯苯并菲与有机胺的反应
将A步制得的1摩尔每份的2,3-二羧酸甲酯苯并菲、3.5摩尔每份的正辛胺和600摩尔每份的咪唑加入反应管中,密闭体系,在氮气气氛下,用邻二氯苯作溶剂,在油浴中加热回流,反应至点板检测原料点消失后,萃取、干燥、过滤,得到的反应混合物通过二氧化硅柱层析分离,得黄色固体即为产物,产率为92%;
以下的光谱数据表明采用以上本例方法制得产物确为以下通式(Ⅰ)的化合物,且通式中m=6,R为碳原子数为8的直链饱和烷基
该产物测得的光谱数据为:
核磁氢谱1H-NMR(400MHz,CDCl3,TMS)8.89(s,2H),7.99(s,2H),7.82(s,2H),4.23-4.29(m,8H),3.77(t,J=7.2Hz,2H),1.93-2.02(m,8H),1.73-1.76(m,2H),1.58-1.63(m,8H),1.28-1.45(m,27H),0.93-0.97(m,11H),0.86-0.89(m,3H);
核磁碳谱13C-NMR(100MHz,CDCl3,TMS)168.68,150.29,149.04,131.74,127.25,124.71,122.65,117.88,105.68,105.53,69.15,68.85,38.11,31.84,31.82,31.77,29.44,29.39,29.29,29.26,28.60,27.08,25.91,25.89,22.73,22.69,22.68,14.11,14.10;
高分辨率质谱HRMS(ESI):calc.m/z 810.5673(C52H76NO6),found m/z 810.5609[M+H]+;
红外光谱IR(KBr):ν(cm-1)3524,2854,1766,1613,1386,1127,925,746,729,608;
实施例4
本实施例提供的化合物是通式(Ⅰ)中的化合物,其中m表示含碳原子数为1至12的整数,R有以下三种方式:1)、R为含碳原子数1-12的全直链饱和烷基;2)、R为含碳原子数为4-18的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1,其中n和k分别表示含碳原子数为1至8的整数;3)、R为苯基。本例中m=6,R为含碳原子数为8的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1,其中n=2,k=4。
其制备反应如下:
A、2,3-二羧酸甲酯苯并菲衍生物的合成
与实施例1的A步完全相同。
B、2,3-二羧酸甲酯苯并菲与有机胺的反应
将A步制得的1摩尔每份的2,3-二羧酸甲酯苯并菲、3.5摩尔每份的2-乙基己胺和600摩尔每份的咪唑加入反应管中,密闭体系,在氮气气氛下,用邻二氯苯作溶剂,在油浴中加热回流,反应至点板检测原料点消失后,萃取、干燥、过滤,得到的反应混合物通过二氧化硅柱层析分离,得黄色固体即为产物,产率为90%;
以下的光谱数据表明采用以上本例方法制得产物确为以下通式(Ⅰ)的化合物,且通式中m=6,R为含碳原子数为8的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1,其中n=2,k=4。
该产物测得的光谱数据为:
核磁氢谱1H-NMR(400MHz,CDCl3,TMS)8.79(s,2H),7.91(s,2H),7.79(s,2H),4.29-4.20(m,8H),3.67(d,J=7.2Hz,2H),2.0-1.95(m,8H),1.61-1.59(m,8H),1.46-1.32(m,24H),0.98-0.88(m,17H);
核磁碳谱13C-NMR(100MHz,CDCl3,TMS)169.03,150.44,149.20,132.09,132.07,132.04,132.02,127.45,127.40,124.92,122.89,122.86,118.19,106.01,105.80,69.28,69.00,41.85,38.26,31.72,31.70,30.53,29.36,29.32,26.50,25.85,25.82,23.84,23.03,22.68,22.65,14.10,14.08,14.06,10.41;
高分辨率质谱HRMS(ESI):calc.m/z 810.5673(C52H76NO6),found m/z 810.5673[M+H]+;
红外光谱IR(KBr):ν(cm-1)2927,1765,1613,1387,1181,834,748,745,606;
实施例5
本实施例提供的化合物是通式(Ⅰ)中的化合物,其中m表示含碳原子数为1至12的整数,R有以下三种方式:1)、R为含碳原子数1-12的全直链饱和烷基;2)、R为含碳原子数为4-18的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1,其中n和k分别表示含碳原子数为1至8的整数;3)、R为苯基。本例中m=6,R为含碳原子数为16的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1,其中n=6,k=8。
其制备反应如下:
A、2,3-二羧酸甲酯苯并菲衍生物的合成
与实施例1的A步完全相同。
B、2,3-二羧酸甲酯苯并菲与有机胺的反应
将A步制得的1摩尔每份的2,3-二羧酸甲酯苯并菲、3.5摩尔每份的2-己基葵胺和600摩尔每份的咪唑加入反应管中,密闭体系,在氮气气氛下,用邻二氯苯作溶剂,在油浴中加热回流,反应至点板检测原料点消失后,萃取、干燥、过滤,得到的反应混合物通过二氧化硅柱层析分离,得黄色固体即为产物,产率为91%;
以下的光谱数据表明采用以上本例方法制得产物确为以下通式(Ⅰ)的化合物,且通式中m=6,R为含碳原子数为16的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1,其中n=6,k=8。
该产物测得的光谱数据为:
核磁氢谱1H-NMR(400MHz,CDCl3,TMS)8.83(s,2H),7.95(s,2H),7.79(s,2H),4.21-4.29(m,8H),3.66(d,J=7.2Hz,2H),1.95-2.02(m,9H),1.60-1.61(m,8H),1.41-1.44(m,18H),1.23-1.39(m,22H),0.95-0.98(m,11H),0.84-0.93(m,6H);
核磁碳谱13C-NMR(100MHz,CDCl3,TMS)169.03,150.46,149.23,132.09,127.48,124.94,122.88,118.20,106.05,105.87,69.30,69.03,42.29,37.03,31.88,31.86,31.73,31.71,31.55,31.52,30.02,29.71,29.59,29.37,29.34,29.33,26.32,26.29,25.86,25.83,22.68,22.66,14.09,14.07;
高分辨率质谱HRMS(ESI):calc.m/z 922.6925(C60H92NO6),found m/z 922.6923[M+H]+;
红外光谱IR(KBr):ν(cm-1)3702,1766,1613,1386,1184,926,748,725,611;
实施例6
本实施例提供的化合物是通式(Ⅰ)中的化合物,其中m表示含碳原子数为1至12的整数,R有以下三种方式:1)、R为含碳原子数1-12的全直链饱和烷基;2)、R为含碳原子数为4-18的支链烷基,其通式为-CH2CH(CnH2n+1)CkH2k+1,其中n和k分别表示含碳原子数为1至8的整数;3)、R为苯基。本例中m=6,R为苯基。
其制备反应如下:
A、2,3-二羧酸甲酯苯并菲衍生物的合成;
与实施例1的A步完全相同。
B、2,3-二羧酸甲酯苯并菲与有机胺的反应;
将A步制得的1摩尔每份的2,3-二羧酸甲酯苯并菲与3.5摩尔每份的苯胺,和600摩尔每份的咪唑加入反应管中,密闭体系,在氮气气氛下,用邻二氯苯作溶剂,在油浴中加热回流,反应至点板检测原料点消失后,萃取、干燥、过滤,得到的反应混合物通过二氧化硅柱层析分离,得黄色固体即为产物,产率为95%;
以下的光谱数据表明采用以上本例方法制得产物确为以下通式(Ⅰ)的化合物,且通式中m=6,R为R为苯基。
该产物测得的光谱数据为:
核磁氢谱1H-NMR(400MHz,CDCl3,TMS)8.94(s,2H),7.97(s,2H),7.80(s,2H),7.57-7.58(m,4H),7.44-7.48(m,1H),4.24-4.29(m,8H),1.94-2.01(m,8H),1.60-1.65(m,8H),1.39-1.45(m,16H),0.93-0.97(m,12H);
核磁碳谱13C-NMR(100MHz,CDCl3,TMS)167.74,150.69,149.33,132.65,131.98,129.00,128.07,127.10,127.01,125.12,122.83,119.03,106.27,105.74,69.33,69.20,31.70,31.67,29.32,29.23,25.80,22.67,22.65,14.08,14.07;
高分辨率质谱HRMS(ESI):calc.m/z 774.4734(C50H63NO6),found m/z 774.4694[M+H]+;
红外光谱IR(KBr):ν(cm-1)3677,1769,1546,1266,1177,927,749,687;
利用本发明方法制备得到的2,3-二酰亚胺苯并菲盘状液晶分子通过差示扫描量热仪、偏光显微镜摄像,发现实施例所得产物具有柱状液晶相织构,具有互变液晶相,并且实施例4和5所得产物为室温液晶,化合物相变温度详见表1:
表1中,Cr—晶态,Colh—六方柱状液晶相,Iso—液体;
表1本发明的2,3-二酰亚胺苯并菲盘状液晶分子的液晶性能
分析结果:
从表1可以看出:
实施例1制得的2,3-二酰亚胺苯并菲盘状液晶分子(Ⅰ)(m=6,R为正丁基)在加热过程中,123℃时从晶态转变为有序的六方柱状液晶相,275℃时从有序的六方柱状液晶相转变为各向同性的液体。
实施例2制得的2,3-二酰亚胺苯并菲盘状液晶分子(Ⅰ)(m=6,R为正己基)在加热过程中,44℃时从晶态转变为有序的六方柱状液晶相,274℃时从有序的六方柱状液晶相转变为各向同性的液体。
实施例3制得的2,3-二酰亚胺苯并菲盘状液晶分子(Ⅰ)(m=6,R为正辛基)在加热过程中,102℃时从晶态转变为有序的六方柱状液晶相,259℃时从有序的六方柱状液晶相转变为各向同性的液体。
实施例4制得的2,3-二酰亚胺苯并菲盘状液晶分子(Ⅰ)(m=6,R为-CH2CH(C2H5)C4H9)在加热过程中,263℃时从有序的六方柱状液晶相转变为各向同性的液体。
实施例5制得的2,3-二酰亚胺苯并菲盘状液晶分子(Ⅰ)(m=6,R为-CH2CH(C6H13)C8H17)在加热过程中,194℃时从有序的六方柱状液晶相转变为各向同性的液体。
实施例6制得的2,3-二酰亚胺苯并菲盘状液晶分子(Ⅰ)(m=6,R为苯基)在加热过程中,88℃时从晶态转变为有序的六方柱状液晶相,302℃时从有序的六方柱状液晶相转变为各向同性的液体。
总之,本发明的2,3-二酰亚胺苯并菲盘状液晶分子,均具有柱状液晶相织构,且从柱状相转变为液体的温度较高(最低的为194℃,最高的达302℃),是一种在较宽的温度范围内呈现液晶相的新型液晶材料,具有良好的应用价值和前景。
- 还没有人留言评论。精彩留言会获得点赞!
- 低介电常数树脂基材用处理铜箔及使用该处理铜箔的覆铜层压板以及印刷配线板的制造方法与工艺
- 含有色酮结构的吡唑类N‐对溴苯基马来酰亚胺衍生物及其制备方法与应用与制造工艺
- 一种双吲哚马来酰亚胺生物碱HD‑ZWM288在制备抗肿瘤微管抑制剂药物的应用的制造方法与工艺
- 马来酰亚胺膜的制造方法与工艺
- 多孔性酰亚胺系树脂膜制造系统、隔膜、及多孔性酰亚胺系树脂膜制造方法与制造工艺
- 聚苯并噁嗪前体及其制备方法与制造工艺
- 含酰亚胺结构的环三磷腈无卤阻燃剂、制备方法及用途与制造工艺
- 开关型硫醇荧光标记试剂及其合成方法和应用与制造工艺
- 一种耐高温表面自润滑的聚酰胺酰亚胺绝缘漆的制造方法与工艺
- 一种耐高温表面自润滑的聚酰胺酰亚胺绝缘漆的制造方法与工艺