一种功能化修饰纳米介孔材料的制备方法及介孔材料和应用与流程
本发明涉及功能化修饰纳米介孔材料用于糖基化肽段的富集,具体地说是一种内外表面分别功能化的介孔材料的制备及其用于糖基化肽段的亲水高效富集。
背景技术:
糖基化是最为普遍的蛋白质翻译后修饰之一,它对于蛋白质的折叠、蛋白质的构象、蛋白质的活性等都具有重要影响。据报道,哺乳动物体内50%以上的蛋白质都可能发生糖基化修饰。同时,蛋白质糖基化修饰参与了众多的生命过程,如蛋白质-蛋白质相互作用、细胞信号传导、细胞凋亡等。蛋白质的糖基化修饰与许多疾病的发生密切相关。目前,临床使用的疾病标记物大多为糖基化蛋白,如用于肝癌诊断的甲胎蛋白、卵巢癌诊断的癌症抗原CA125等。因此,蛋白质糖基化的分析具有重要的生物学意义。然而,由于糖基化蛋白质丰度低、糖基化肽段在酶解肽段比例低,采用常规的质谱分析时,糖基化肽段被高丰度的非糖基化干扰,很难实现复杂生物样品中蛋白质糖基化的分析。因此,糖基化蛋白质/多肽的高效富集成为糖基化分析的关键。
目前,糖基化的富集方法主要有凝集素亲和富集、酰肼化学富集、亲水作用富集和硼酸亲和富集等。凝集素亲和色谱法可以保留糖肽中完整的糖链结构信息,但是该方法的富集特异性和富集效率较低。酰肼化学法虽然提高了糖基化肽段的富集效率,但是它对糖链的不可逆破坏及其氧化过程中的副反应,限制了其在糖基化肽段富集中的应用范围。亲水作用富集具有较高的富集特异性,同时具有能够保持糖链的完整性和操作方便的优点,其被广泛用于糖基化肽段的富集。目前,常用的亲水材料主要包括琼脂糖(J.Cao,C.P.Shen,H.Wang,H.L.Shen,Y.C.Chen,A.Y.Nie,G.Q.Yan,H.J.Lu,Y.K.Liu and P.Y.Yang,J.Proteome Res.,2009,8,662-672)、酰胺型亲水固定相、两性离子亲水作用色谱(zwitterionic HILIC)(S.Di Palma,S.Mohammed,A.J.Heck,Nat.Protoc.,2012,7,2041-2055;M.Wuhrer,A.R.de Boer and A.M.Deelder,Mass Spectrom.Rev.,2009,28,192-206)和点击麦芽糖亲水作用色谱(L.Yu,X.L.Li,Z.M.Guo,X.L.Zhang and X.M.Liang,Chem-Eur J,2009,15,12618-12626;H.Huang,Y.Jin,M.Xue,L.Yu,Q.Fu,Y.Ke,C.Chu and X.Liang,Chem.Commun.,2009,6973-6975;Z.C.Xiong,H.Q.Qin,H.Wan,G.Huang,Z.Zhang,J.Dong,L.Y.Zhang,W.B.Zhang and H.F.Zou,Chem.Commun.,2013,49,9284-9286)等。然 而,发展高选择性的亲水作用色谱固定相仍然是糖基化高效富集的一个重要方向。
介孔材料是一类具有高比表面积(~1000m2/g)、大孔容、孔径尺寸单一分散、孔道结构可控及表面可功能化修饰官能团诸多优点,其在催化、生物医学、色谱分离以及环境检测等领域应用广泛。其中,有序碳介孔材料、硅介孔材料等广泛用于内源性多肽的高效富集。然而,基于亲水作用色谱的介孔材料尚未报道,这主要是由于材料表面的非特异性吸附会降低富集的选择性和富集效率。因此,我们制备了选择性功能化修饰的亲水纳米介孔材料,通过尺寸排阻和亲水的协同作用,显著提高了糖基化肽段的富集选择性和富集效率。
技术实现要素:
介孔材料具有比表面积大、稳定性好,易于修饰的优势,将其经过表面特定官能团的功能化,可以用于翻译后修饰蛋白质样品的富集。本发明的目的是提供一种亲水性好的介孔纳米粒子,我们制备了内表面亲水性和外表面疏水性的纳米介孔材料,并通过其尺寸排阻和亲水性间的协同作用,显著提高糖基化肽段的富集选择性和富集效率,进而用于蛋白质糖基化的高效质谱分析。
为实现上述目的,本发明采用的技术方案为:
以四乙氧基硅烷(TEOS)为单体,以十六烷基溴化铵(CTAB)或P123中的一种或二种为造孔剂制备纳米介孔材料前体,然后利用模板剂的排阻效应,使用疏水性硅烷偶联试剂选择性修饰纳米材料的外表面;然后使用溶剂萃取去除模板剂,并在材料内表面修饰亲水基团,形成内表面亲水并且外表面疏水的纳米介孔材料。
具体包括以下步骤:
(1)硅基介孔纳米粒子前体的制备:在水溶液体系中加入模板剂(CTAB)和碱源(NaOH或氨水),升温加热后加入四乙氧基硅烷(TEOS)作为单体,机械搅拌进行反应后,抽滤分离固体产物;
(2)硅基介孔纳米粒子的修饰:取上述步骤(1)制备的固体产物分散于无水甲苯中得到其混悬液,将其混悬液加入到充氮气保护的三口烧瓶中,加热回流;加入三乙胺,滴加硅烷偶联试剂,继续加热回流,分离固体产物。
(3)将上述步骤(2)制备得到的固体产物加入到乙醇中,并加入浓盐酸,加热回流,抽滤后重复以上操作,进而实现致孔剂的去除,真空干燥过夜。
(4)取上述步骤(3)所得产物分散到无水甲苯中得到其混悬液,将其混悬液加入到充氮气保护的三口烧瓶中,机械搅拌并加热回流;加入三乙胺,滴加氨基硅烷偶联试剂,继续加热回流,分离固体产物。
步骤(1)中,所述模板剂(CTAB)与四乙氧基硅烷的比例为 0.05-0.45(w/w);所述碱源为NaOH,碱源与模板剂(CTAB)的比例为0.2-0.6(w/w);反应体系为水溶液,模板剂(CTAB)在体系中的终浓度为1-4.5mg/ml;反应温度为55-75℃,反应时间为2-5h;所述分离固体产物的方法为抽滤,用双蒸水和乙醇洗涤,真空干燥。
所述步骤(2)中,步骤(1)所得固体产物纳米材料与甲苯用量的比例为0.005-0.200(w/w);加热温度为100-120℃,加入三乙胺催化剂,用量与步骤(1)所得固体产物纳米材料的比例为0.1-0.4(w/w);缓慢滴加硅烷偶联试剂,所述硅烷偶联试剂为疏水性的功能化硅烷耦联试剂,为C1、C4、C8、C18或苯基中的一种或二种以上,硅烷偶联试剂与步骤(1)所得固体产物纳米材料的比例为0.5-2.0(w/w);回流温度为100-120℃,加热回流6-12h;所述分离固体产物的方法为抽滤,依次用甲苯、丙酮、乙醇洗涤,真空干燥。
步骤(3)中,步骤(2)所得固体与乙醇的用量比例为0.01-0.03(w/w);所述加入浓盐酸与乙醇的用量比例为0.005-0.02(v/v);回流温度为60-80℃,时间为8-12h;所述重复操作的次数为2-4次。
步骤(4)中,步骤(3)所得固体与无水甲苯用量的比例为0.005-0.200(w/w);回流加热温度为100-120℃,回流时间为5-30min;加入三乙胺催化剂与步骤(3)所得固体比例为0.1-0.4(w/w);缓慢滴加氨基硅烷偶联试剂,所述氨基硅烷偶联试剂为氨丙基三甲氧基硅烷,纳米材料与硅烷偶联试剂用量的比例为0.5-2.0(w/w);继续回流,回流温度为100-120℃,回流时间为12-16h;所述分离固体产物的方法为抽滤,依次用甲苯、丙酮、乙醇洗涤,真空干燥。
制得的功能化修饰纳米介孔材料可以应用在糖基化多肽的亲水富集中。
本发明具有如下优点:
1.本发明采用硅基介孔纳米材料进行后功能化修饰,具有制备过程简单、形貌规则、比表面积高的优点。
2.本发明采用未除膜板的硅基介孔纳米材料进行外表面修饰,无需进行内表面的保护,操作步骤简单。
3.本发明采用分步修饰介孔纳米材料的内、外表面修饰,可拓展到其它介孔材料的内外表面正交性修饰。
4.本发明制备的材料具有孔外疏水、孔内亲水的特性,结合介孔材料的限域效应和亲水作用,具有很高的糖基化肽富集特异性和富集效率。
附图说明
图1功能化硅基介孔纳米材料的制备及糖基化肽富集流程图。
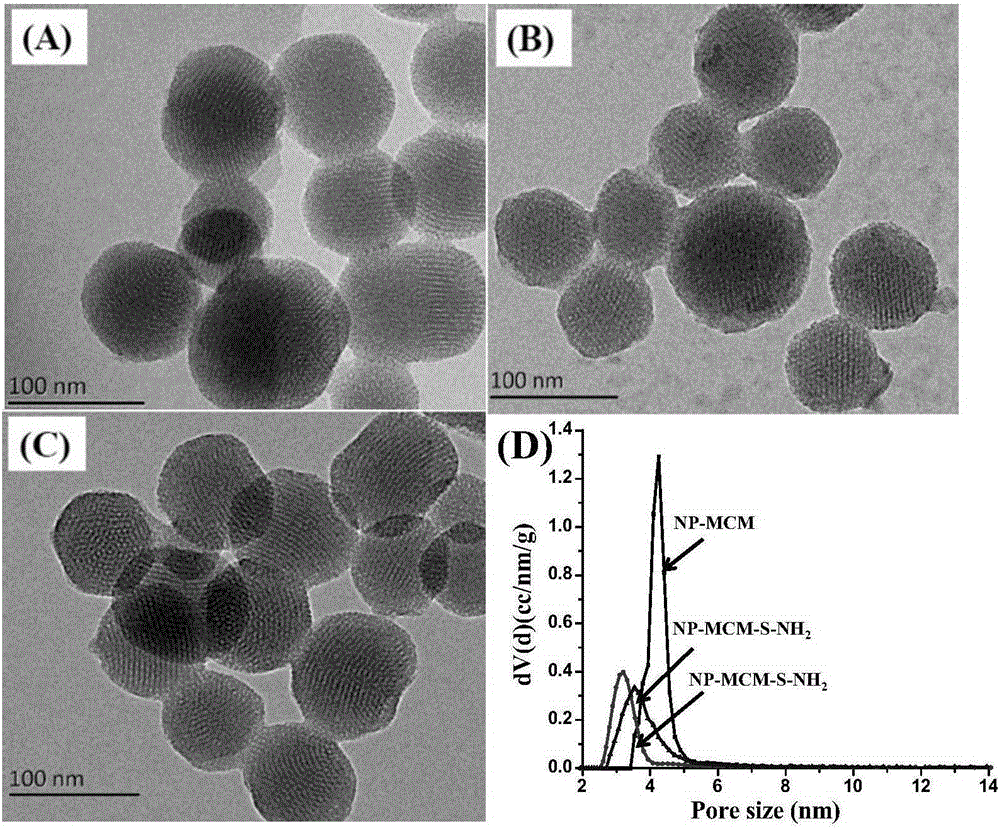
图2制备的功能化硅基介孔纳米材料的扫描电镜图:(A)修饰前,(B)选择性胺基修饰,(C)非选择性胺基化修饰,(D)三种材料的孔径分布。
图3功能化硅基介孔纳米材料对糖基化蛋白质(人源免疫球蛋白,IgG)与非糖基化蛋白(牛血清白蛋白,BSA)混合溶液酶解产物(质量比1:25)的富集效果图:A)原液;B)上清液;C)富集产物。(*,标准糖蛋白IgG中的糖基化肽段)。
具体实施方式
下面通过实施例对本发明提供的方法进行详述,但不以任何形式限制本发明。
实施例1
1.功能化硅基介孔纳米材料的制备
如图1所示,按如下流程制备:
1)硅基介孔纳米粒子前体的制备:取0.5g模板剂CTAB溶于250mL水中,加入2M的NaOH溶液1.75mL。将上述液加入到三口烧瓶中,并升温至60℃,机械搅拌0.5h。加入1.5-2.5mL TEOS,快速搅拌2h,后静置0.5h。将沉淀抽滤后水洗至中性。
2)硅基介孔纳米粒子的修饰:
将1)制备的材料真空干燥过夜,取0.5g材料分散于100mL无水甲苯中,将混悬液加入到充氮气保护的三口烧瓶中,加热110℃甲苯回流0.5h。加入三乙胺200uL,回流0.5h后滴加1mL的硅烷偶联试剂,110℃回流8h。将沉淀抽滤后,依次用甲苯、丙酮、甲醇洗涤,真空干燥。
将制备材料加入到100ml乙醇溶液中,并加入0.75mL浓盐酸,75℃回流12h。将沉淀抽滤后再次重复以上操作。将去除致孔剂的材料真空干燥过夜。
将去除模板的材料分散到100mL无水甲苯中,将混悬液加入到充氮气保护的三口烧瓶中,加热110℃甲苯回流0.5h。加入三乙胺200uL,回流0.5h后滴加0.75mL的氨基硅烷偶联试剂,110℃回流12h。将沉淀抽滤后,依次用甲苯、丙酮、甲醇洗涤,真空干燥。
2.所制备的修饰的亲水硅基介孔纳米粒子的透射电镜图如图2所示
3.所制备的修饰的亲水硅基介孔纳米粒子中氮含量是采用EDS元素分析法测定的(如表1所示)。
表1功能化硅基介孔纳米材料的EDS元素分析
实施例2
为了考察饰的亲水硅基介孔纳米粒子对糖基化肽段的富集选择性以及非特异吸附,进一步进行干扰实验。
1.糖基化蛋白质的酶解
将糖基化蛋白质(目标蛋白,人源免疫球蛋白,HRP)与非糖基化蛋白(干扰蛋白,牛血清白蛋白,BSA)按质量比1:25混合,取100ug溶解于50mM碳酸氢铵(pH 8.2),经95℃灭活,加入10mM DTT 60℃反应1h,进一步加入20mM IAA避光反应30min,还原保护其中的二硫键,后将样品经胰蛋白酶过夜酶后,产生混合蛋白的酶解产物。
2.糖基化肽段的选择性富集
取实施例1制备的亲水硅基介孔纳米粒子,用80%ACN超声洗涤,配制成30mg/mL的悬浊液。取悬浊液50uL,加入15微克的混合蛋白质酶解液,并加入92%ACN/2%TFA上样液400uL,涡旋震荡45min。20000g离心3min后去除上清液,沉淀用400uL的92%ACN/2%TFA清洗三次,20000g离心后去除上清液。向沉淀中加入60%ACN/1%FA洗脱液10uL,超声15min。20000g离心3min,收集上清液。分别取起始样品、上样流出组分和洗脱样品通过MALDI-TOF MS进行糖肽的质谱检测。
3.MALDI-TOF MS分析
依次取混合蛋白酶解样品、步骤2富集样品的上清液及洗脱液各0.5uL点于MALDI的不锈钢靶板上,待样品点干燥,加0.5uL基质(2,5-二羟基苯甲酸,25mg/ml.70%ACN/29%H2O/1%H3PO4(V/V)),干燥后进行质谱分析。MALDI-TOF MS实验是在AB Sciex5800 MALDI-TOF/TOF mass spectrometer(AB Sciex,CA)上进行,检测时采用反射正离子模式。
如图3a所示,原液中糖基化肽段由于浓度极低,使得质谱响应信号被抑制而无法检测;经亲水的硅基介孔纳米粒子富集后,非糖基化肽段得到去除(图3b),糖基化肽段信号强度显著提高(图3c)。表明该材料对糖基化肽段具有很好的选择性和富集效率。
- 还没有人留言评论。精彩留言会获得点赞!