一种磁性纳米复合材料及其制备方法和应用与流程
本发明涉及一种磁性纳米复合材料及其制备方法和应用,属于纳米材料技术领域。
背景技术:
在科技快速发展和人们生活质量提高的同时,环境污染问题也越演越烈,其中水污染尤为严重。而水质的好坏密切影响着人们的身体健康状况。现有的污水处理技术有离子交换法、膜过滤法、电化学法、光催化降解法、生物降解法、吸附法。其中吸附法因其效率高、操作简单、价格低廉等优点成为污水处理中最常用的方法之一。但吸附法目前还存在吸附容量低、回收困难、选择性差、二次污染严重等缺点,这严重限制了其进一步应用,而解决这些问题的关键就是开发性能优良的吸附剂。
壳聚糖是一种环境友好型的天然高分子聚合物,具有良好的成膜性、生物相容性、生物降解性,还具有优良的吸附性能,可有效地提高吸附剂的吸附能力和分离性能。石墨烯是一种性能优异的新型碳材料,具有极大的比表面积,具有较大的吸附容量和吸附性能。因此,目前以壳聚糖和石墨烯做吸附剂进行污水处理的技术,已有广泛而深入的研究。中国专利“CN201310434322.2一种石墨烯/壳聚糖吸附树脂的制备方法”、“CN201510858159.1一种氧化石墨烯/壳聚糖微球及其制备方法”、“CN201610174840.9氧化石墨烯/壳聚糖多孔复合微球及其制备方法和应用”等都报道了石墨烯/壳聚糖吸附剂在污水处理中的应用。
近年来,磁分离技术已被应用到水处理行业中,它是借助磁场力的作用,对不同磁性的物质进行分离的一种技术。中国专利“CN201510513108.5一种锌铁氧体@壳聚糖/氧化石墨烯复合材料及其制备方法和应用”、“CN201610310180.2一种氧化石墨烯与磁性壳聚糖复合物的制备方法及其应用”等报道了采用磁性物质将壳聚糖磁化,制备磁性壳聚糖,然后以磁性壳聚糖为基体,将石墨烯共价结合到磁性壳聚糖表面,制备出石墨烯/壳聚糖磁性吸附剂用于污水处理。
造成水体污染的因素很多,其中重金属废水的排放和有机染料废水的排放是造成目前水体污染的两大主要因素,而目前的石墨烯/壳聚糖吸附剂作用种类比较单一,通常仅能有效吸附其中一类的污染物,并且目前的石墨烯/壳聚糖磁性吸附剂其磁性较低,对金属离子尤其是重金属离子的吸附性能较低,目前还没有能同时有效处理金属废水和染料废水的石墨烯/壳聚糖类吸附剂的相关报道。
技术实现要素:
针对现有技术存在的上述问题,本发明的目的是提供一种磁性纳米复合材料及其制备方法和应用,以扩大磁性纳米复合材料的种类和应用。
为实现上述发明目的,本发明采用的技术方案如下:
一种磁性纳米复合材料,是首先由二氧化硅包覆四氧化三铁得到Fe3O4@SiO2磁性纳米微球,然后在Fe3O4@SiO2磁性纳米微球表面依次层层包覆壳聚糖(简称CS)、三乙烯四胺(简称TETA)、氧化石墨烯(简称GO)得到,简记为:Fe3O4@SiO2@CS-TETA-GO。
一种制备本发明所述的磁性纳米复合材料的方法,包括如下步骤:
a)采用溶剂热法制备四氧化三铁纳米微球;
b)采用法在四氧化三铁纳米微球表面包覆二氧化硅,得到核壳结构的Fe3O4@SiO2磁性纳米微球;
c)采用硅烷偶联剂和一氯乙酸对Fe3O4@SiO2磁性纳米微球表面进行羧基化改性,得到Fe3O4@SiO2-COOH复合材料,然后采用戊二醛交联法将壳聚糖交联在Fe3O4@SiO2-COOH复合材料表面,得到壳聚糖包覆Fe3O4@SiO2的复合材料,简记为:Fe3O4@SiO2@CS;
d)采用表氯醇(即环氧氯丙烷)对Fe3O4@SiO2@CS进行改性处理,然后接枝三乙烯四胺,得到三乙烯四胺包覆Fe3O4@SiO2@CS的复合材料,简记为:Fe3O4@SiO2@CS-TETA;
e)通过酰胺化反应,将Fe3O4@SiO2@CS-TETA接枝到氧化石墨烯表面,得到氧化石墨烯包覆Fe3O4@SiO2@CS-TETA的复合材料,即得到所述的磁性纳米复合材料Fe3O4@SiO2@CS-TETA-GO。
作为优选方案,所述步骤a)包括如下操作:
将六水合三氯化铁,二水合柠檬酸三钠和醋酸钠分散于乙二醇中,搅拌均匀后转移至反应釜中,然后在150~300℃下保温反应7~15小时,结束反应,磁分离,对收集的固体进行洗涤、干燥,即得到所述的四氧化三铁纳米微球。
作为进一步优选方案,六水合三氯化铁:二水合柠檬酸三钠:醋酸钠的质量比为(1~5):(0.7~1):(4~5)。
作为进一步优选方案,1~5g三氯化铁使用60~80mL乙二醇。
作为优选方案,所述步骤b)包括如下操作:
将制得的四氧化三铁纳米微球分散于醇水混合液中,超声均匀后加入氨水,然后搅拌下滴加硅酸四乙酯的醇溶液,然后在室温下反应10~18小时,结束反应,磁分离,对收集的固体进行洗涤、干燥,即得到所述的Fe3O4@SiO2磁性纳米微球。
作为进一步优选方案,所用醇溶剂为乙醇。
作为进一步优选方案,醇水混合液中,醇溶剂与水的体积比为(80~100):(1~10)。
作为进一步优选方案,硅酸四乙酯的醇溶液中,硅酸四乙酯与醇溶剂的体积比为1:10~1:20。
作为进一步优选方案,100~120mg四氧化三铁需要使用1~8mL氨水和100~500μL硅酸四乙酯。
作为优选方案,所述步骤c)中的羧基化改性包括如下操作:
将制得的Fe3O4@SiO2磁性纳米微球分散于醇水混合液中,超声均匀后加入硅烷偶联剂APTES(化学名称为氨丙基三乙氧基硅烷),然后在45~55℃下保温反应7~15小时,结束反应,固液分离,分离出的固体洗涤后重新分散于一氯乙酸的醇溶液中,调节反应溶液的pH值至7.5~8.5,再在75~85℃下反应7~15小时,结束反应,磁分离,对收集的固体进行洗涤、干燥,即得到所述的Fe3O4@SiO2-COOH复合材料。
作为进一步优选方案,150~300mg Fe3O4@SiO2磁性纳米微球需要使用1~3mL APTES和5~15mL一氯乙酸。
作为进一步优选方案,醇溶剂为乙醇;醇水混合液中醇溶剂与水的体积比为30:1~50:1;一氯乙酸的醇溶液中醇溶剂与一氯乙酸的体积比为5:1~1:1。
作为优选方案,所述步骤c)中的戊二醛交联法包括如下操作:
将壳聚糖溶解于2~8wt%乙酸溶液中,然后加入Fe3O4@SiO2-COOH复合材料,在室温下反应7~15小时,结束反应,磁分离,分离出的固体重新分散于2~8wt%乙酸溶液中,加入25wt%戊二醛,于30~70℃下搅拌反应3~5小时,结束反应,磁分离,对收集的固体进行洗涤、干燥,即得到所述的Fe3O4@SiO2@CS。
作为进一步优选方案,80~150mg壳聚糖溶解于10~20mL乙酸溶液中。
作为进一步优选方案,5~15mg Fe3O4@SiO2-COOH复合材料需要使用80~150mg壳聚糖和0.1~1mL戊二醛。
作为优选方案,所述步骤d)包括如下操作:
将Fe3O4@SiO2@CS分散于异丙醇,于35~45℃下搅拌0.5~1.5小时,然后加入表氯醇,保温反应7~15小时,结束反应,磁分离,分离出的固体洗涤后重新分散于N,N-二甲基甲酰胺中,在45~60℃下搅拌反应0.5~1.5小时,然后加入三亚乙基四胺,保温反应3~5小时,结束反应,磁分离,对收集的固体进行洗涤、干燥,即得到所述的Fe3O4@SiO2@CS-TETA。
作为进一步优选方案,450~600mg Fe3O4@SiO2@CS需要使用40~80mL异丙醇、5~15mL表氯醇、20~40mL N,N-二甲基甲酰胺和10~30mL三亚乙基四胺。
作为优选方案,所述步骤e)包括如下操作:
将氧化石墨烯分散于水中,超声均匀,加入EDC(化学名称为1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐)和NHS(化学名称为N-羟基琥珀酰亚胺),调节溶液至中性,加入Fe3O4@SiO2@CS-TETA,然后在60~70℃下搅拌反应2~3小时,结束反应,磁分离,对收集的固体进行洗涤、干燥,即得到所述的磁性纳米复合材料Fe3O4@SiO2@CS-TETA-GO。
作为进一步优选方案,氧化石墨烯与Fe3O4@SiO2@CS-TETA的质量比为(6~10):(15~25)。
作为进一步优选方案,氧化石墨烯:EDC:NHS的质量比为(60~100):(1~8):(1~5)。
本发明所述的磁性纳米复合材料可用作重金属离子的吸附剂,尤其可用作铜离子的吸附剂。
本发明所述的磁性纳米复合材料还可用作有机染料的吸附剂,尤其可用作亚甲基蓝的吸附剂。
与现有技术相比,本发明具有如下显著性有益效果:
1、本发明首先使用二氧化硅包覆四氧化三铁得到Fe3O4@SiO2磁性纳米微球,然后在Fe3O4@SiO2磁性纳米微球表面依次层层包覆壳聚糖、三乙烯四胺、氧化石墨烯得到核壳结构的磁性纳米复合材料Fe3O4@SiO2@CS-TETA-GO;经测试:本发明所提供的磁性纳米复合材料Fe3O4@SiO2@CS-TETA-GO具有比表面积大、形貌结构好、磁性较强、吸附性能优良等优点,尤其是既可吸附金属离子也可吸附有机染料,吸附容量大(对水中的甲基蓝和铜离子的最大吸附量分别达到529.10mg/g和324.68mg/g),且20分钟即可达到吸附平衡,在环境、水处理等领域具有较好的使用价值和应用前景;
2、本发明采用层层包覆法,依次在Fe3O4@SiO2表面包覆壳聚糖、三乙烯四胺、氧化石墨烯,相较于传统的一锅法交联壳聚糖和氧化石墨烯而言,可在材料表面包覆均匀的壳聚糖层和氧化石墨烯层,避免了壳聚糖、氧化石墨烯分子自身交联,制备过程可控,工艺简单,纳米粒子的粒径大小可通过改变四氧化三铁核的大小来调节,绿色温和,环境友好、避免了二次污染,并且制备的产品形貌稳定,适合规模化生产。
附图说明
图1为实施例中制备得到的Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@CS以及Fe3O4@SiO2@CS-TETA-GO的扫描电镜图和透射电镜图;
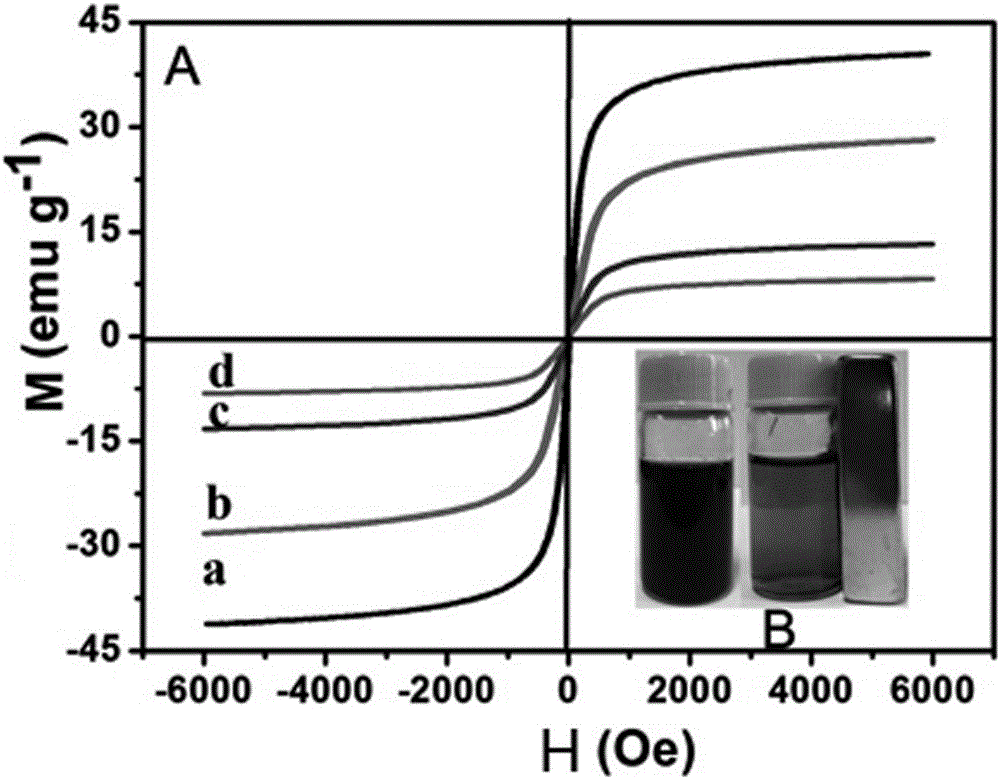
图2为实施例中制备得到的Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@CS以及Fe3O4@SiO2@CS-TETA-GO的磁滞响应曲线;
图3为实施例中制备得到的Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@CS以及Fe3O4@SiO2@CS-TETA-GO的X-射线衍射图谱;
图4为应用例1中磁性纳米复合材料对亚甲基蓝和铜离子的吸附容量随pH的变化曲线;
图5为应用例2中磁性纳米复合材料对亚甲基蓝和铜离子的等温吸附图;
图6为应用例3中磁性纳米复合材料对亚甲基蓝和铜离子的循环吸附效果图。
具体实施方式
下面结合实施例和应用例对本发明技术方案做进一步详细、完整地说明。
实施例
一、四氧化三铁纳米微球的制备:
将3.13g六水合三氯化铁,0.81g二水合柠檬酸三钠加入到70mL乙二醇中,室温下搅拌至全溶后,加入4.81g醋酸钠,继续搅拌至溶清后转移至反应釜中,然后在280℃下保温反应10小时,结束反应,磁分离,对收集的固体用去离子水洗涤至中性,然后干燥,即得到所述的四氧化三铁纳米微球,备用。
二、Fe3O4@SiO2磁性纳米微球的制备:
将0.12g制得的四氧化三铁纳米微球分散于102mL乙醇水溶液(96mL乙醇+6mL水)中,超声20分钟使分散均匀后加入3mL氨水,然后搅拌下滴加硅酸四乙酯的乙醇溶液(300μLTEOS分散于5mL乙醇得到),滴加完毕后室温反应15小时,结束反应,磁分离,对收集的固体依次分别用水和乙醇进行洗涤,然后干燥,即得到所述的Fe3O4@SiO2磁性纳米微球,备用。
三、Fe3O4@SiO2@CS复合材料的制备:
1)将0.22g制得的Fe3O4@SiO2磁性纳米微球分散于92mL的乙醇水溶液(90mL乙醇+2mL水)中,超声均匀后缓慢滴加1.8mL硅烷偶联剂APTES(化学名称为氨丙基三乙氧基硅烷),然后在50℃下保温反应10小时,结束反应,固液分离,分离出的固体用水洗涤三遍后重新分散于一氯乙酸的乙醇溶液(10mL一氯乙醇+30mL乙醇)中,调节反应溶液的pH值至8,80℃下反应10小时,结束反应,磁分离,对收集的固体依次分别用水和乙醇进行洗涤,然后干燥,即得到所述的Fe3O4@SiO2-COOH复合材料,备用;
2)将0.11g壳聚糖分散于15mL、5wt%乙酸溶液中,40℃下搅拌搅拌至全溶,然后加入0.01gFe3O4@SiO2-COOH复合材料,室温反应12小时,结束反应,磁分离以移除多余的壳聚糖,分离出的固体重新分散于15mL、5wt%乙酸溶液中,缓慢滴加0.5mL、25wt%戊二醛,于60℃下搅拌反应3小时,结束反应,磁分离,对收集的固体依次分别用水和乙醇进行洗涤,然后干燥,即得到所述的Fe3O4@SiO2@CS复合材料,备用。
四、Fe3O4@SiO2@CS-TETA复合材料的制备:
将0.31g制得的Fe3O4@SiO2@CS分散于50mL异丙醇,于40℃下搅拌1小时,然后加入10mL表氯醇,保温反应10小时,结束反应,磁分离,分离出的固体用去离子水洗涤以除去未反应的表氯醇后重新分散于30mL N,N-二甲基甲酰胺中,在50℃下搅拌反应1小时,然后加入20mL三亚乙基四胺,保温反应4小时,结束反应,磁分离,对收集的固体依次分别用水和乙醇进行洗涤,然后干燥,即得到所述的Fe3O4@SiO2@CS-TETA复合材料,备用。
五、磁性纳米复合材料Fe3O4@SiO2@CS-TETA-GO的制备:
将0.08g氧化石墨烯分散于300mL水中,超声均匀,加入3.80g EDC(化学名称为1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐)和2.32g NHS(化学名称为N-羟基琥珀酰亚胺),调节溶液至中性并于40℃下搅拌2小时(以去活化氧化石墨烯上的羧基),然后加入0.02gFe3O4@SiO2@CS-TETA,然后在65℃下搅拌反应2小时,结束反应,磁分离,对收集的固体依次分别用水和乙醇进行洗涤,然后干燥,即得到所述的磁性纳米复合材料Fe3O4@SiO2@CS-TETA-GO。
图1为实施例中制备得到的Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@CS以及Fe3O4@SiO2@CS-TETA-GO的扫描电镜图和透射电镜图,其中a、b、c、d依次分别为Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@CS、Fe3O4@SiO2@CS-TETA-GO的扫描电镜图;e、f、g、h依次分别为Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@CS、Fe3O4@SiO2@CS-TETA-GO的透射电镜图;从图1(a-d)可见,采用本实施例所述制备方法,可得到大小均一、表面光滑、形貌结构好的Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@CS以及Fe3O4@SiO2@CS-TETA-GO;从图1(e-h)可见,采用本实施例所述制备方法,可以得到负载均匀、整体形貌结构好的Fe3O4@SiO2@CS-TETA-GO纳米材料,并且二氧化硅、壳聚糖、氧化石墨烯是层层包覆在Fe3O4表面的,且包覆均匀;从透射电镜图可以看出,本实施例中二氧化硅层的厚度约为50~60nm之间,该二氧化硅层的厚度可以通过改变加入TEOS的量来自由调节;同理,负载的壳聚糖、氧化石墨烯层的厚度也可以通过加入壳聚糖、氧化石墨烯的量来自由调节。
图2为实施例中制备得到的Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@CS以及Fe3O4@SiO2@CS-TETA-GO的磁滞响应曲线,其中a、b、c、d依次分别为Fe3O4@SiO2@CS-TETA-GO、Fe3O4@SiO2@CS、Fe3O4@SiO2、Fe3O4,从图中可见,采用本实施例制备的Fe3O4@SiO2@CS-TETA-GO具有优异的超顺磁性,将其作为吸附剂使用能够很好地实现固液分离和回收利用。
图3为实施例中制备得到的Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@CS以及Fe3O4@SiO2@CS-TETA-GO的X-射线衍射图谱;其中a、b、c、d依次分别为Fe3O4@SiO2@CS-TETA-GO、Fe3O4@SiO2@CS、Fe3O4@SiO2、Fe3O4,从图中可见,随着二氧化硅、壳聚糖、氧化石墨烯的层层包覆,制备得到的纳米材料XRD图谱的峰强度越强且越窄,说明磁性纳米材料的磁性也随之增大。
应用例1
不同pH条件下吸附性能考察:
亚甲基蓝和铜离子的初始浓度都为500mg/L;根据亚甲基蓝和铜离子在不同pH下的稳定性,设置亚甲基蓝(简称MB)的pH测试范围为2-10;铜离子的pH测试范围为2-6;分别取500mg/L的亚甲基蓝和铜离子溶液20mL于离心管中,加入20mg实施例制备的Fe3O4@SiO2@CS-TETA-GO后放入水浴振荡器中25℃下震荡24小时;吸附完成后,剩余亚甲基蓝的浓度用紫外分光光度计测试,剩余铜离子的浓度用ICP等离子体原子发射光谱仪测试;检测结果详见图4所示。
图4为Fe3O4@SiO2@CS-TETA-GO对亚甲基蓝和铜离子的吸附容量随pH变化曲线;从图中可见,本实施例制备的Fe3O4@SiO2@CS-TETA-GO耐酸性好,在较宽的pH条件下对亚甲基蓝和铜离子都具有优良的吸附作用,其中在pH=6时对铜离子的吸附量最大,在pH=10时对亚甲基蓝的吸附量最大。
应用例2
等温吸附性能考察:
亚甲基蓝的初始浓度范围定为50~1000mg/L;铜离子的初始浓度范围定为50~500mg/L;两者的吸附pH值分别定为10、6;吸附时间定为24小时;吸附温度25℃;吸附完成后,剩余亚甲基蓝的浓度用紫外分光光度计测试,剩余铜离子的浓度用ICP等离子体原子发射光谱仪测试;检测结果详见图5所示。
图5为Fe3O4@SiO2@CS-TETA-GO对亚甲基蓝和铜离子的等温吸附图;从图中可见,本实施例制备的Fe3O4@SiO2@CS-TETA-GO对亚甲基蓝和铜离子都具有优良的等温吸附作用,其中亚甲基蓝在900mg/L时到达吸附平衡;铜离子在500mg/L时到达吸附平衡。
应用例3
循环吸附性能考察:
等温吸附结束后,将Fe3O4@SiO2@CS-TETA-GO离心洗涤后真空干燥,循环用于吸附亚甲基蓝和铜离子,以检测其循环使用活性;检测结果详见图6所示。
图6为Fe3O4@SiO2@CS-TETA-GO对亚甲基蓝和铜离子的循环吸附效果图。从图中可见,Fe3O4@SiO2@CS-TETA-GO循环使用6次后,对亚甲基蓝和铜离子的吸附率基本没有变化,说明具有优良的吸附性能。
最后需要在此指出的是:以上仅是本发明的部分优选实施例,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容做出的一些非本质的改进和调整均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!