一种高效捕集分离H2S和CO2及资源化的方法与流程
本发明属于化工过程中气体净化领域和污染控制领域,尤其涉及一种新型脱硫脱碳剂,以及高效捕集分离h2s和co2及资源化的方法。
背景技术:
在当今的化石能源、可再生能源的原料气以及化工废气中的大多数气体都是含酸性气体体系,例如天然气、生物质燃气沼气中含有大量的co2、h2s等酸性气体;同样水煤气、石油炼制的炼厂气及酸性水气体尾气的废气中也含有大量co2、h2s等酸性气体。
上述气体中存在的co2、h2s往往给这些气体的净化或使用带来困难。当气体在管路中流动时,由于水蒸气的存在,水与气体中的h2s共同作用,加速了金属管道、阀门及流量计的腐蚀或堵塞。另外,能源气体中的h2s燃烧后生成so2,它与燃烧产物中的水蒸气结合生成亚硫酸,使燃烧设备的低温部位金属表面产生腐蚀;利用能源气体发电时,气体中的h2s、so2等含硫杂质严重腐蚀柴油机机件。而co2作为一种温室气体,导致全球气候变化。近年来,世界各国出现了几百年来历史上最热的天气,厄尔尼诺现象也频繁发生,给各国造成了巨大经济损失。按现在的一些发展趋势,科学家预测有可能出现的影响和危害有:1)海平面上升,有关部门预计2100年将上升0.2m~1.65m。2)影响农业和自然生态系统。3)加剧洪涝、干旱及其他气象灾害。4)影响人类健康。5)气候变化,气温上升高达2℃,粮食的产量将会下降3%~17%,也会导致害虫增加10%~13%。综上所述,h2s和co2如果不加以脱除会严重破坏人类赖以生存的生活环境和身体健康。
目前,对于含h2s和co2酸性气体的原料气,工业中多用湿法脱酸性气体。湿法脱酸性气体法分为湿法吸收和湿法氧化两大类。湿法吸收脱除酸性气体的主导工艺为以下过程:
此工艺中采用的吸收剂为醇胺或环丁砜-醇胺,醇胺吸收剂是以一定比例的醇胺和水构成的碱性吸收剂,属于化学吸收,工业中常用的醇胺有:一乙醇胺(mea)、二乙醇胺(dea)、二甘醇按(dga)和甲基二乙醇胺(mdea)等。醇胺吸收剂对酸性气体有较强的吸收能力,但是在脱硫脱碳的过程中经常存在一些问题:1)溶剂的降解,醇胺的降解大致有化学降解、物理降解、氧化降解三种,其中化学降解是占主要地位,即醇胺与原料气中的co2和有机硫发生副反应,生成难以完全再生的副产物。如mea与co2发生副反应生成的碳酸盐可转变为噁唑烷酮,再经一系列反应生成乙二胺的衍生物。由于乙二胺衍生物比mea碱性强,故难以再生复原,从而导致溶剂损失,而且还加速设备的腐蚀。dea同样也会和co2发生副反应。mdea是叔胺,具有选择性吸收脱硫能力,而不吸收co2,但是近年来的生产实践和研究表明,mdea会发生氧化变质,so2、o2对mdea的变质影响很大;其次温度过高还会导致mdea发生热变质。2)水分损失严重,由于离开吸收塔的湿净化气和离开再生塔的回流冷凝器的湿酸气都含有饱和的水蒸气,而且湿净化气的离塔温度远高于原料气的进塔温度,所以会造成吸收液中的水分损失严重。3)胺液的损失,醇胺水溶液的蒸气压比较高,吸收塔、再生塔中的气相中的醇胺量会被净化气和再生用气体带走,带走的醇胺会对净化气造成二次污染。
工艺角度上,胺法或砜胺法吸收的酸气,需要先脱水,然后再采用克劳斯装置回收硫磺,有的甚至需要尾气处理装置,而且克劳斯硫磺回收工艺对酸气中的成分有一定的要求,酸气中不同范围内硫化氢浓度要采取不同的克劳斯工艺流程,这一过程工艺存在流程复杂,投资大的问题。同时,该工艺可对反应后的硫磺加以利用,但未考虑co2与h2s的分离,以及co2的资源化利用。
直接氧化法如lo-cat(一种湿法脱硫技术),可将天然气中的h2s直接转化为硫磺,但因其为水相碱性条件下的反应体系,随着反应进行,副产物水不断稀释该催化反应体系,导致催化剂活性降低,且硫容量低,循环量大,故电耗高。同时,其不具有co2脱除能力,因而在以原料气深度脱硫脱碳工艺中并不适用。
为克服上述问题,并且实现h2s、co2资源化的过程,需要开发一种新的高效捕集分离h2s和co2的体系,并构建相应的高效捕集分离h2s和co2的绿色工艺,该捕集分离h2s和co2的体系不仅要具备传统湿法氧化脱硫高效、可循环利用的优势,以及吸收co2的特点,还应该能够克服水存在导致的一系列问题,通过简单的分离过程即可实现脱硫脱碳体系与水的分离;该绿色工艺同时满足安全可靠,不产生二次污染,低处理成本的特点。
技术实现要素:
为了解决上述问题,本发明人进行了锐意研究,结果发现:通过具有较强的疏水特性、良好的氧化性和热稳定性的铁基离子液体为脱硫剂,辅以助溶剂的添加构成脱硫脱碳剂,在设定的反应条件下,可同步吸收原料气中的h2s和co2,经铁基离子液体的氧化作用将h2s转化为硫磺单质,通过闪蒸作用从脱硫脱碳剂中分离回收co2,实现h2s与co2的100%分离;在氧气的作用下将脱硫后的铁基离子液体再生后可循环使用。整个净化处理过程不产生废气废水,是一种绿色的脱硫脱碳工艺,克服了现有的水相湿法氧化脱硫、脱碳工艺因水相中碱液反应对co2和h2s选择性差,难以调控,易产生大量难处理高盐废水的二次污染问题,从而完成了本发明。
本发明的目的在于提供以下技术方案:
(1)一种新型脱硫脱碳剂,其中,所述脱硫脱碳剂包括以下重量配比的组分:
铁基离子液体200份;
助溶剂1~100份。
其中,所述铁基离子液体为咪唑类铁基离子液体,如1-丁基-3-甲基氯代咪唑铁基离子液体bmimfecl4;
所述助溶剂选自聚乙二醇二甲醚、n,n-二甲基乙酰胺(dmac)、碳酸丙烯酯、n-甲基吡咯烷酮中任意一种或多种,优选为n,n-二甲基乙酰胺。
(2)一种高效捕集分离h2s和co2的方法,优选使用上述(1)所述的脱硫脱碳剂进行h2s和co2的捕集分离,所述方法包括以下步骤:
步骤1,制备脱硫脱碳剂;
步骤2,将原料气通入脱硫脱碳剂中,进行h2s和co2的捕集分离;
步骤2中包括以下子步骤:
子步骤1),在设定条件下,将原料气通入脱硫脱碳剂中,h2s被脱硫脱碳剂吸收氧化为硫磺,co2同步被吸收;
子步骤2),通过闪蒸将co2从脱硫脱碳剂中分离;
子步骤3),富集脱硫脱碳剂中的硫磺,通过热熔方式分离硫磺产物;
子步骤4),向分离硫磺后的脱硫脱碳剂中通入含氧气体,进行脱硫脱碳剂再生,再生后的脱硫脱碳剂循环使用。
(3)一种实施h2s和co2捕集分离的处理系统,其用于实施上述(2)所述的方法,其中,
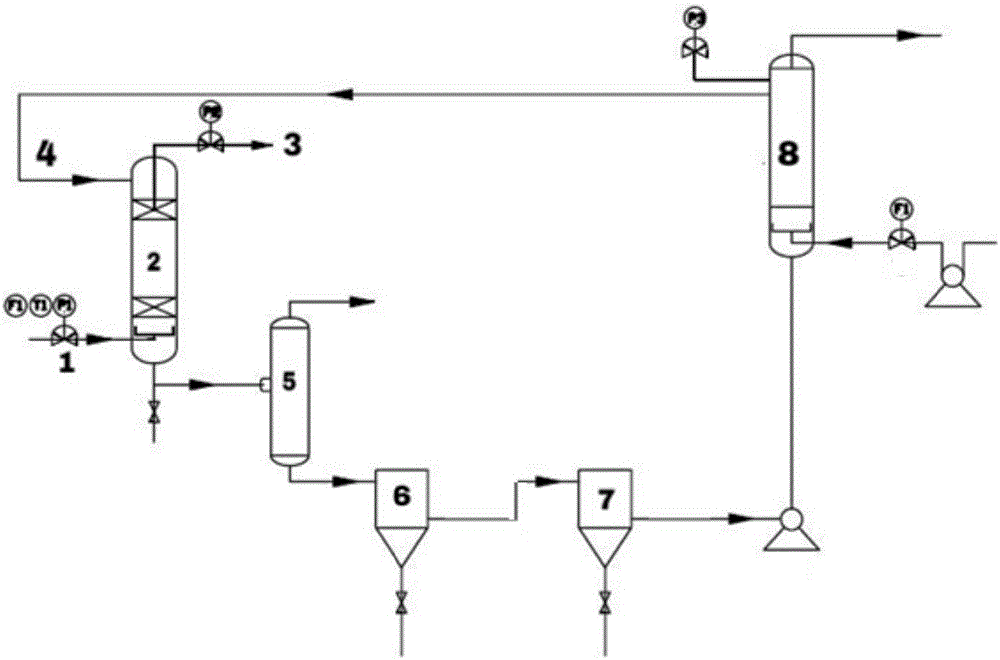
所述处理系统包括依次连接的高压吸收塔2、闪蒸罐5、沉降罐6、熔硫釜7和再生塔8,其中,
高压吸收塔2盛装脱硫脱碳剂,通过脱硫脱碳剂将原料气1中h2s氧化为固体硫磺并吸收co2,净化后的气体3由高压吸收塔2的塔顶排出;
闪蒸罐5接收高压吸收塔2输出的脱硫脱碳剂,通过减压使co2从脱硫脱碳剂中分离,并将脱硫脱碳剂输送至沉降罐6;
沉降罐6中通过自然沉降、过滤或离心方式富集硫磺,并进行脱硫脱碳剂的初步分离,将分离后的下层固液混合物传输至熔硫釜7,上层液体进入再生塔8;
熔硫釜7对初步分离得到的固液混合物进行加热,分离下层熔融态硫磺,剩余脱硫脱碳液进入再生塔8;
再生塔8中通有含氧气体,将反应后的脱硫脱碳剂进行再生,再生后的脱硫脱碳剂4返回至高压吸收塔2。
根据本发明提供的一种高效捕集分离h2s和co2及资源化的方法,具有以下有益效果:
(1)工艺简单,安全性好:本发明的脱硫脱碳剂热稳定性高,可以在高温高压体系中使用;且脱硫脱碳剂为非水相体系,无需调节ph,产物水与脱硫脱碳剂自动分离,不会造成脱硫脱碳剂的稀释和流失。
(2)吸收效果好,氧化性能强:助溶剂的加入提高了铁基离子液体对h2s和co2的吸收溶解性,有利于氧化脱硫过程;
利用脱硫脱碳剂中的铁基离子液体脱除h2s,将待净化气中的h2s直接转化为硫磺,且硫容量高,净化过程中脱硫脱碳剂循环量小。
(3)助溶剂为dmac时,dmac能够将h2s转化为hs-促进h2s转化,对铁基离子液体的改善效果更强。
(4)硫磺纯度高品质好:采用热熔方式分离纯化硫磺产物,将固液分离所得的硫磺滤饼在熔硫釜中加热,直接分离液体硫磺,纯度达到99.0(重量)%以上。
(5)再生性能好:脱硫脱碳剂可通过氧气或空气再生,再生后性能较好,实现高效循环利用。
附图说明
图1示出本发明中脱硫脱碳工艺装置图;
图2示出实施例2中制得的2#和3#脱硫脱碳剂、对比例1中d1#~d4#脱硫脱碳剂及bmimfecl4在不同温度下的粘度曲线图;
图3示出实施例2中制得的2#和3#脱硫脱碳剂、对比例1中d1#~d4#脱硫脱碳剂及bmimfecl4在不同温度下的密度曲线图;
图4a示出实施例3制得的铁基离子液体的循环伏安曲线;
图4b示出实施例3制得的6#脱硫脱碳剂的循环伏安曲线;
图5示出实施例3制得的铁基离子液体在25℃和180℃下的红外光谱图;
图6示出实施例3中的6#脱硫脱碳剂在脱硫前后的红外光谱图;
图7示出实施例1中制得的bmimfecl4和1#脱硫脱碳剂的脱硫曲线图;
图8示出实施例3中制得的4#~8#脱硫脱碳剂的脱硫曲线图;
图9示出实施例3中制备得到的6#脱硫脱碳剂在不同温度下的脱硫曲线图;
图10示出bmimfecl4-dmac脱硫脱碳剂与bmimfecl4-dmac+10%水脱硫性能对比图;
图11示出不同再生次数下脱硫性能对比图。
附图标号说明:
1-原料气;
2-高压吸收塔;
3-净化后的气体;
4-再生后的脱硫脱碳剂;
5-闪蒸罐;
6-沉降罐;
7-熔硫釜;
8-再生塔。
具体实施方式
下面通过对本发明进行详细说明,本发明的特点和优点将随着这些说明而变得更为清楚、明确。
在本发明中,需要说明的是,术语“连接”、“安装”等可以做广义理解,例如,可以是活接、直接等机械连接,也可以是通过其他媒介相连。对于本领域的普通技术人员而言,可以根据实际情况理解这些术语在本发明中的含义。
由于传统醇胺法在脱硫脱碳的过程中存在溶剂降解、水分损失严重、醇胺损失等问题,直接氧化法存在需要不断添加药剂保持体系弱碱性环境、脱硫剂稀释流失、大量废弃的脱硫液造成严重的二次污染、不能脱除co2等问题,本发明人经过大量的研究试验,提出了一种新型非水相脱硫脱碳剂,及采用该脱硫脱碳剂进行h2s和co2捕集分离及资源化的方法。
本发明的目的在于提供一种新型非水相脱硫脱碳剂,所述脱硫脱碳剂包括以下重量配比的组分:
铁基离子液体200份;
助溶剂1~100份。
其中,所述铁基离子液体为咪唑类铁基离子液体,如1-丁基-3-甲基氯代咪唑(bmimcl)铁基离子液体bmimfecl4。其中,铁基离子液体通过三氯化铁、硝酸铁或硫酸铁与目标配体如1-丁基-3-甲基氯代咪唑进行反应制备得到。
铁基离子液体通过fe3+向fe2+的转化将h2s氧化为s单质即固体硫磺,实现脱硫,且铁基离子液体对低碳烃的吸收极少,进一步确定了其可应用于低碳烃的脱硫。
然而,对于co2的吸收,铁基离子液体对co2的吸收能力虽然相较于其他低碳烃高,但吸收能力仍旧有限,原料气中co2含量较高时,铁基离子液体的吸收能力无法满足要求。同时,铁基离子液体用于工业生产尚需考虑较多因素,如铁基离子液体粘度较大的问题,其高粘度可降低气液传质效率,限制对h2s的转化速率。
针对上述铁基离子液体对co2的吸收能力不足和粘度较大的问题,本发明人经过研究,确定了向铁基离子液体中加入助溶剂的方法。然而,可用于提高对co2吸收的有机溶剂有较多种,可用于降低铁基离子液体粘度的有机溶剂的种类也较多,但同时满足上述要求,且不影响铁基离子液体脱硫效果或提高脱硫效果的溶剂,现在还少有人报道。
本发明经过大量研究和实验,确定选择聚乙二醇二甲醚、n,n-二甲基乙酰胺(dmac)、碳酸丙烯酯、n-甲基吡咯烷酮中任意一种或多种作为助溶剂。所选择的助溶剂具备以下优点:粘度低;高沸点,可减少有机溶剂的挥发性损失;较强的吸收h2s和co2的能力;助溶剂与铁基离子液体的互溶性好,体系不分层;稳定性好,不改变铁基离子液体化学构成,不影响将硫化氢转化为硫单质的过程;与铁基离子液体以适当比例互溶后得到的混合体系的密度与固体硫磺密度(2.36g·ml-1)或熔融硫磺密度(1.80g·ml-1)有较明显差距,便于产生的硫单质的分离。
进一步地,所述助溶剂为dmac。dmac有一个氢键受体,具有缚酸作用,可将h2s中的h束缚产生hs-根离子,hs-根离子更容易被铁基离子液体中fe3+氧化,因此,dmac的复合使用对脱硫过程有促进作用。
本发明中,铁基离子液体与助溶剂的重量比为200:(1~100)。本发明人经过研究发现,只有在上述范围内,脱硫剂对h2s具有较好的脱硫效果,且满足对co2的有效吸收。在上述范围内,随着助溶剂比例的提高,对co2的吸收能力逐渐加强,脱硫能力先提高后降低:
首先是因为在助溶剂比例较低的情况下,脱硫剂体系粘度较高,且助溶剂含量低,对于h2s和co2的吸收能力较弱(若助溶剂为dmac,吸收后的h2s仅有少部分能够产生缚酸效应转化为hs-)。气液传质及吸收h2s和co2的速率成为整个反应过程的决速步。因此,在继续提高助溶剂比例时,脱硫脱碳性能有较大的提高。当助溶剂进一步提高到200:100时,对co2的吸收能力随着助溶剂比例的增加而升高,而助溶剂所产生的作用不再成为制约脱硫反应的步骤,fe3+氧化h2s的过程成为决速步,而这一过程与fe3+的浓度有着直接的关系。虽然随着助溶剂比例的进一步提高,脱硫性能会有所下降,但是脱硫曲线依然平稳、高效,脱硫初期都能够达到100%脱硫率。
在一种优选的实施方式中,铁基离子液体与助溶剂的重量比为200:(20~90)。
值得注意的是,较多种铁基离子液体如盐酸三乙胺铁基离子液体(et3nhfecl4)或含铁基离子液体的脱硫剂在脱硫过程中都会产生较多泡沫,发泡严重会导致液泛等问题,造成脱硫剂流失;同时,泡沫过多会增大压力损失。本发明中含铁基离子液体的脱硫脱碳剂,不存在严重发泡的现象,无需额外加入消泡剂即可顺利实施脱硫脱碳。
本发明的另一方面在于,提供了一种利用上述脱硫脱碳剂高效捕集分离h2s和co2的方法。所述捕集分离h2s和co2的方法包括以下步骤:
步骤1,制备脱硫脱碳剂;
步骤2,将原料气通入脱硫脱碳剂中,进行h2s和co2的捕集分离。
步骤1中,合成铁基离子液体,将铁基离子液体与助溶剂按设定比例混合均匀,制备脱硫脱碳剂。
本发明中,所述铁基离子液体为咪唑类铁基离子液体,如1-丁基-3-甲基氯代咪唑铁基离子液体bmimfecl4,其通过三氯化铁、硝酸铁或硫酸铁与1-丁基-3-甲基氯代咪唑在室温下反应24h,分离纯化后得到bmimfecl4。其中,1-丁基-3-甲基氯代咪唑与三价铁离子的摩尔比为1:(1.9~2.1)。
在上述范围内,fe3+稍微过量,可有效保证铁基离子液体中fe3+含量;整个脱硫过程中,fe3+氧化脱硫起主要作用,fe3+含量越高,脱硫性能越好,过多的1-丁基-3-甲基氯代咪唑降低了fe3+含量,进而降低了脱硫性能。
本发明中,为提高脱硫脱碳剂对co2的吸收能力,且降低制备得到的铁基离子液体粘度,增加气液传质效率,向铁基离子液体中加入低粘度的助溶剂。助溶剂选自聚乙二醇二甲醚、n,n-二甲基乙酰胺、碳酸丙烯酯、n-甲基吡咯烷酮中任意一种或多种,优选为n,n-二甲基乙酰胺。
进一步的,铁基离子液体与助溶剂的重量比为200:(1~100),优选为200:(20~90)。
步骤2中,将原料气通入脱硫脱碳剂中,进行h2s和co2的捕集分离。具体地,步骤2包括以下子步骤:
子步骤1),在高压条件下,h2s被脱硫脱碳剂吸收后氧化为固体硫磺,co2同步被吸收,原料气得到脱硫脱碳净化。
在本发明中,脱硫脱碳的反应温度介于10~80℃之间,压力介于0.40~3.0mpa之间,优选反应温度介于为20~40℃之间,压力介于0.80~2.4mpa之间。
温度低于10℃,化学反应活性低;温度高于80℃,h2s和co2溶解度小,部分h2s和co2未溶解直接逃离脱硫脱碳剂。在10~80℃之间,特别是20~40℃之间,脱硫脱碳剂对h2s和co2的吸收脱除效果较佳。
在0.40~3.0mpa压力之间,脱硫脱碳剂可实现对h2s和co2的有效吸收,压力低于0.40mpa,促吸收效果不明显,压力高于3.0mpa时,吸收效果无明显提升,且增加了设备的损耗。
若原料气中不含或含有微量co2,则在低压(常压)条件下,h2s被脱硫脱碳剂氧化为固体硫磺,微量co2直接随脱硫净化后的原料气排放,不影响原料气的净化要求。此时,不需要进行后续的针对co2的分离的步骤。即脱硫脱碳剂可用于h2s和co2的共同脱除,或者h2s的单独脱除。
子步骤2),通过闪蒸将co2从脱硫脱碳剂中分离,收集后用于其他生产活动。
由于脱硫脱碳剂对co2为物理吸收,降低压力,将高压条件下溶于脱硫脱碳剂中的co2解吸,收集利用。
子步骤3),富集脱硫脱碳剂中的硫磺,通过热熔方式分离硫磺产物。
在一种优选的实施方式中,脱硫反应后的体系为非水相铁基离子液体和有机溶剂组成的脱硫脱碳剂与反应生成的固态硫磺组成的固液混合物。通过自然沉降、过滤或离心富集硫磺,并进行初步分离后,得到富集硫磺的固液混合物,再通过热熔方式分离纯化硫磺产物。初步分离后,固体硫磺富集,提高了热熔分离的效率。
对初步分离后得到的富集硫磺的固液混合物于常压下在105℃~140℃加热,优选115℃~125℃加热,使固态硫磺成熔融态,静置,使脱硫脱碳液和熔融态硫磺分离;经容器底部放出分离后的熔融态硫磺,经冷却结晶后得到固态硫磺,其纯度≥99.0(重量)%;分离后的脱硫脱碳液再生后循环使用。
湿式氧化吸收法在反应过程中产生的硫磺粒径非常小,且具有特殊表面性质,易吸附于反应器、管道表面或填料而不易沉降,造成体系严重的硫堵问题,造成经济损失;而通过添加分散剂、絮凝剂等方法提高硫磺的沉降比,不仅解决硫堵的效果并不理想,而且还影响了硫磺品质,干扰脱硫脱碳剂的循环使用。对硫磺和反应体系的分离是影响整个工艺的高难度问题。
本发明提供的热熔法对硫磺和反应体系进行分离可有效解决湿式氧化吸收法所产生的问题,且操作简单,不需特殊装置,成本低。
子步骤4),向分离硫磺后的脱硫脱碳剂中通入含氧气体,进行脱硫脱碳剂再生,再生后的脱硫脱碳剂循环使用。
在本发明中,脱硫反应进行设定时间后,随着fe3+逐渐转化为fe2+,脱硫效率下降,需要进行脱硫剂的再生。可通过向脱硫剂中通入氧气或空气实现脱硫剂的再生。
优选地,通过向脱硫剂中通入氧气实现脱硫剂的再生。
在纯氧条件下,脱硫脱碳液可基本再生完全,仅有极微量的fe2+存在于该体系中,基本可以忽略不计。而以空气为再生气体的条件下,再生速率相对较慢,且再生后会有一定浓度的fe2+存在,不能够实现彻底再生。这主要是因为相同进气流量条件下,纯氧浓度为99.9%,空气中氧气浓度为21%,供氧量是制约再生的关键因素。同时,在相同的停留时间下,空气中n2的存在会降低氧气与fe2+接触概率,因此制约着再生反应的进行。
在一种优选的实施方式中,再生温度为20~100℃,优选为40~70℃,再生时间不超过30min,如15~30min。
温度的升高能够提高反应活性,同时也能够增强气液传质过程,然而温度超过100℃,再生性能受氧气溶解性影响较大,氧气溶解度低,不利于再生的进行。
在本发明中,采用铁基离子液体-助溶剂脱硫脱碳剂,经至少100次脱硫脱碳-再生过程,其在100min内仍可实现100%脱硫脱碳。
本发明中脱硫脱碳剂以及高效捕集分离h2s和co2的方法,适用于净化含有一定浓度的h2s和co2杂质酸性气的工业过程气和废气,包括粗天然气、生物质燃气(沼气)、酸性水汽提尾气以及克劳斯加氢尾气等。其中,工业过程气和废气中h2s的体积含量在0~100%之间,co2的体积含量在0~60%之间。
粗天然气的主要成分为60%~98%的c1、0~30%的h2s、0~10%的co2,其他0~3%;
沼气的主要成分是甲烷。沼气由50%~80%ch4、20%~50%co2、0%~5%n2、小于1%的h2、小于0.4%的o2与0.1%~3%h2s等气体组成;
酸性水汽提尾气的成分为:40%~90%h2s、0%~10%co2气体,以及小于1%的c1~c2烃类。
克劳斯加氢尾气的成分为:含1%~10%h2s、10%~30%co2气体。
本发明中,如无特别说明,气体含量均为体积含量。
本发明的另一方面在于,提供了一种进行h2s和co2捕集分离的处理系统,所述处理系统的结构示意图如图1所示。
所述处理系统包括依次连接的高压吸收塔2、闪蒸罐5、沉降罐6、熔硫釜7和再生塔8,其中,
高压吸收塔2盛装脱硫脱碳剂,通过脱硫脱碳剂将原料气1中h2s氧化为固体硫磺并吸收co2,高压吸收塔2底部带有鼓泡装置,含h2s和co2的原料气1由底部进入高压吸收塔2,通过鼓泡装置时被分化为细小的气泡,原料气1以小气泡的形式进入高压吸收塔2,增加了反应界面,可提高对h2s和co2的脱除率,净化后的气体3由高压吸收塔2的塔顶排出;
此时,脱硫脱碳反应后的体系为脱硫脱碳剂与反应生成的固态硫磺组成的固液混合物;
闪蒸罐5接收高压吸收塔2输出的脱硫脱碳剂,通过减压使co2从脱硫脱碳剂中分离,并将脱硫脱碳剂输送至沉降罐6;
沉降罐6中通过自然沉降、过滤或离心方式富集硫磺,并进行脱硫脱碳剂的初步分离,将分离后的下层固液混合物传输至熔硫釜7,上层液体进入再生塔8;
熔硫釜7对经初步分离后得到的固液混合物进行加热,分离下层熔融态硫磺,经冷却结晶得到固态硫磺,剩余脱硫脱碳液进入再生塔8;
再生塔8中通有含氧气体,将反应后的脱硫脱碳剂进行再生,再生后的脱硫脱碳剂4返回至高压吸收塔2。
实施例
实施例1脱硫脱碳剂的制备
1、铁基离子液体的制备:
向1000ml的烧杯中加入500g(1.85mol)六水合三氯化铁(fecl3·6h2o)固体,放置于70℃的水浴锅中,待六水合三氯化铁固体融化后,边搅拌边缓慢加入1-丁基-3-甲基咪唑氯盐(bmimcl)161.55g,于室温下搅拌反应24h后溶液分为两相,离心分离区上层墨绿色液体,在80℃真空干燥24h所得溶液即为咪唑类铁基离子液体bmimfecl4。
2、脱硫脱碳剂的制备:
500ml烧杯中放入200g合成的bmimfecl4,在合成的铁基离子液体中放入86gdmac,密封后常温搅拌2h,得到bmimfecl4-dmac,为1#脱硫脱碳剂。
实施例2脱硫脱碳剂的制备
脱硫脱碳剂的制备步骤同实施例1,区别仅在于:脱硫脱碳剂制备中,铁基离子液体与dmac以重量比分别以90:10、70:30、均匀混合,分别为2#、3#脱硫脱碳剂。
实施例3脱硫脱碳剂的制备
脱硫脱碳剂的制备步骤同实施例1,区别仅在于:脱硫脱碳剂制备中,铁基离子液体与dmac以重量比分别以200:10、200:30、200:40、200:50和200:70均匀混合,分别为4#、5#、6#、7#、8#脱硫脱碳剂。
对比例
对比例1脱硫脱碳剂的制备
脱硫脱碳剂的制备步骤同实施例1,区别仅在于:脱硫脱碳剂制备中,铁基离子液体与dmac以重量比为50:50、30:70、10:90、和0:100均匀混合;分别形成d1#、d2#、d3#和d4#脱硫脱碳剂。
表1实施例/对比例物料量简表
实验例
红外光谱表征
红外光谱仪定性分析反应前后脱硫剂官能团变化。溴化钾压片法制片,扫描频率为32次,分辨率4cm-1,波数范围400~4000cm-1。
电化学-循环伏安法
通过循环伏安法分析脱硫剂氧化还原性能。由铂盘、铂片和ag/agcl组成电极体系,饱和kcl溶液为盐桥。
粘度测定
使用数字粘度计测定不同体系粘度数值,根据粘度范围选择合适的转子和转速。温度控制则采用外加温控油浴锅。
脱硫试验装置及脱硫方法
脱硫实验装置如图1所示,主要由高压吸收塔(反应器)、闪蒸罐、沉降罐、熔硫釜和再生塔组成。
本实验为进行对比实验,量取适量脱硫液加入到反应器,设置一定的反应温度与进气流量,选择合适的h2s浓度。在h2s脱除过程中,定时抽取脱硫尾气,测定其h2s浓度,脱硫效率计算如下式所示。
其中,c为初始h2s浓度,ct为t时刻脱硫尾气中h2s浓度。
实验例1bmimfecl4-dmac物化性质测试
实施例1.1粘度测试
本发明中,将实施例1制得的铁基离子液体和脱硫脱碳剂进行粘度测定,检测结果见下表2。
进一步地,将实施例2中制得的2#和3#脱硫脱碳剂(图中简称铁液)、对比例1中d1#~d4#脱硫脱碳剂及bmimfecl4铁基离子液体进行不同温度下粘度测试,结果见图2所示。
表2不同温度下的粘度结果(mpa·s)
粘度对于生产过程中的动力成本有着很大的关系,而温度对粘度影响最大,所以在不同温度下进行了粘度测定。由表2和图2可知,dmac的加入有效降低了铁基离子液体的粘度,dmac量越多粘度越低,且随着温度的升高,粘度进一步降低。体系的粘度与气液传质效率有关,低的粘度有利于体系的气液传质。
实施例1.2密度测试
本发明中,将实施例1制得的铁基离子液体和脱硫脱碳剂在常温下进行密度测定,检测结果见下表3。
进一步地,将实施例2中制得的2#和3#脱硫脱碳剂(图中简称铁液)、对比例1中d1#~d4#脱硫脱碳剂及bmimfecl4铁基离子液体进行不同温度下密度测试,结果见图3所示。
表3密度数据
由表3和图3可以看出,bmimfecl4-dmac体系的密度要比bmimfecl4体系、硫磺、熔融硫磺的小,所以无论是硫磺沉降分离还是高温熔融硫磺分离,从密度上看,都可以得到有效分离,实现硫磺提取。
实施例1.3循环伏安曲线测定
本发明中,将实施例3制得的铁基离子液体和6#脱硫脱碳剂进行循环伏安曲线测定,检测结果分别如图4a和图4b所示。
由图4a和图4b可知,铁基离子液体中加入溶剂后,氧化峰位和还原峰位都出现了一定程度的左移,说明加入dmac后,铁基离子液体能够更好的进行氧化脱硫过程。同时,也可以从图中看出,加入dmac后,脱硫剂的峰电流大约提高了2倍,说明加入dmac后有利于电子的传递,这主要受益于dmac降低体系粘度的作用。粘度降低,能够增强电极附近e-的传递,使得电极表面有更多的粒子参与氧化还原过程中,所以加入dmac后峰电流显著提高。
实施例1.4稳定性测试
本发明中,将实施例3制得的铁基离子液体进行常温25℃和高温180℃下红外光谱测定,检测结果如图5所示。
由图5可见,铁基离子液体bmimfecl4在25℃和180℃条件下的红外光谱相吻合,不同温度下相同的红外光谱体现了bminfecl4良好的热稳定性。
进一步地,脱硫脱碳剂的稳定性对脱硫-再生工艺的实现至关重要。对实施例3中的6#脱硫脱碳剂在脱硫前后分别进行红外表征,测定脱硫脱碳剂的稳定性,结果见图6所示。
由图6可见,脱硫剂反应前后峰数,峰位基本无明显差别,只有个别峰强度有微弱变化,说明反应后骨架未被破坏,体系稳定性良好,能够满足脱硫稳定性需求。
实验例2bmimfecl4-dmac对co2的吸附和解吸
实验例2.1不同压力下bmimfecl4-dmac对co2的吸收测试
分别取bmimfecl4、实施例1中1#bmimfecl4-dmac脱硫脱碳剂30ml,在温度为70℃真空干燥24h,分别放入体积为200ml的高压反应器中,高压反应器置于温度为25℃的恒温水浴锅中,待系统恒温后,通入co2气体,改变气体的压力,吸收结果如下表4所示。
表4不同压力下bmimfecl4-dmac对co2的吸收(molco2/l)
由表4可以看出,相对于纯的bmimfecl4,bmimfecl4-dmac对co2具有优良的吸收能力,dmac作为助溶剂,改变了原有溶剂的形态结构,增强了体系对co2的吸收能力;同时,随着压力的升高,bmimfecl4-dmac对co2的吸收能力增强。
实验例2.2不同温度下bmimfecl4-dmac对co2的吸收测试
分别取bmimfecl4、实施例1中1#bmimfecl4-dmac脱硫脱碳剂30ml,在温度为70℃真空干燥24h,分别放入体积为200ml的高压反应器中,高压反应器置于恒温水浴锅中,压力控制为1.20mpa,通入co2气体,改变反应器内温度,吸收结果如下表5所示。
表5不同温度下bmimfecl4-dmac对co2的吸收(molco2/l)
由表5可以看出,随着温度的增强,bmimfecl4-dmac对co2的溶解能力略有下降,在上述温度范围内,仍可保证对co2的吸收。
实验例2.3bmimfecl4-dmac对co2的吸收-解吸重复性
取实施例1中1#bmimfecl4-dmac脱硫脱碳剂30ml,在温度为70℃真空干燥24h,分别放入体积为200ml的高压反应器中,高压反应器置于温度为25℃的恒温水浴锅中,待系统恒温后,通入co2气体,初始压力控制为1.20mpa,待吸收液吸收平衡(气相压力恒定),减压至常压,加搅拌进行co2解吸;30min后再次用该吸收液进行吸收,初始压力为1.20mpa。重复进行五次吸收-解吸实验,每次的吸收量相同,说明该体系用于吸收co2具有很高的解吸以及重复利用能力。
实验例3dmac对h2s的吸收力测试
本发明实施方式中优选dmac为助溶剂。为验证dmac对h2s的吸收力,取20mldmac注入玻璃反应器中,反应温度为40℃,1000ppm浓度h2s,进气量为20ml·min-1,同时选择了另一种在工业上作为物理脱除h2s的溶剂tbp作为对比参照。吸收结果如表6所示。
表6dmac与tbp吸收h2s后尾气浓度表
由表6可以看出,dmac对h2s的吸收能力要强于工业物理吸收脱硫剂tbp。tbp作为吸收剂,主要是以物理溶解的方式将分子态的h2s吸收,而dmac不仅具有物理吸收h2s的特性,同时还能够与h2s中的h元素通过氢键等强化学作用,具备了一定的化学吸收能力。因此可以证明dmac本身对h2s的吸收有利于脱硫脱碳剂吸收-氧化的过程。
实验例4脱硫脱碳剂测试
实验例4.1助溶剂的添加对脱h2s的影响
本发明中,将实施例1中制得的bmimfecl4和1#脱硫脱碳剂进行脱硫实验。分别取bmimfecl4、bmimfecl4-dmac20ml,加入到反应器中,向反应器中通入1000ppm浓度h2s,进气流量为30ml/min。控制反应温度为40℃,在h2s脱除过程中,定时抽取50ml脱硫尾气,测定其h2s浓度,结果如图7所示。
图7表明,bmimfecl4体系在前160min对h2s的脱除率达到100%,之后脱除率逐渐下降,而bmimfecl4-dmac体系可以100%脱除h2s持续240min,bmimfecl4-dmac体系脱硫更具优势。
实验例4.2铁基离子液体与助溶剂比例对脱h2s的影响
本发明中,将实施例3中制得的4#~8#脱硫脱碳剂进行脱硫试验。分别取10ml不同复合比例的脱硫脱碳剂注入反应器中,反应温度为40℃,10000ppm浓度h2s进气量为30ml/min,复合比例对的脱硫率的影响如图8所示。
由图8可知,随着dmac比例的提高,脱硫性能先提高后降低。在提高dmac比例达到200:40时,脱硫性能有较大的提高;当dmac提高到200:50,脱硫性能有进一步的提高;当dmac提高到200:70时,由于fe3+浓度进一步降低,脱硫性能略下降。但在上述实验范围内时,脱硫曲线均平稳、高效,脱硫100min内,都能够达到100%。
实验例4.3温度对脱h2s的影响
将实施例3制备得到的6#脱硫脱碳剂注入反应器中,设置脱硫条件为10000ppmh2s,进气量为30ml/min,反应温度分别为20℃、40℃、60℃。分别测定在不同温度下,脱硫脱碳剂的脱硫率,结果如图9所示。
如图9显示,在20~60℃下,100min内脱硫率均可达到100%,200min内脱硫效率均可维持在95%以上,长时间脱硫情况下,脱硫效果在40℃最好。
实验例5水对脱硫脱碳剂的影响
虽然本发明中提出的是非水相脱硫,但是工业生产中,天然气采集中的气源水汽,石油炼制中酸性水汽提的过程都会将一定量的水带入反应体系中,所以需要探究水对脱硫性能的影响。
取10ml实施例3制备得到的6#脱硫脱碳剂,加入10%质量分数去离子水(加水后可以明显看到分层现象)后注入反应器中,反应温度为40℃,10000ppm浓度h2s,进气量为30ml·min-1,实验结果如图10所示。
由图10可知,bmimfecl4-dmac脱硫脱碳剂加入10%质量分数的去离子水后,脱硫效果基本不变。采用上述脱硫体系,水对脱硫率无负面影响。
实验例6再生性能测试
本发明中,将实施例3制备得到的6#脱硫脱碳剂进行脱硫实验,脱硫后的脱硫液经过离心分离硫磺后,在纯氧条件下进行再生,并补充分离硫磺损失的脱硫脱碳剂。上述脱硫试验进行4次,再生实验进行3次。脱硫实验条件为10000ppmh2s,进气量为40ml·min-1,反应温度为20℃。再生实验条件为再生气体为纯氧,进气量为40ml·min-1,反应温度为20℃。每隔20min检测吸收过后尾气中的h2s含量,脱硫效率如图11所示。
不同再生次数的脱硫脱碳剂在脱硫初期都能够实现100%高效脱硫,因此,图11截取了脱硫200min后的脱硫效率趋势线。如图11所示,新鲜脱硫液的脱硫性能最佳,随着再生次数的增加,脱硫性能有所下降,但是仍然可以保持高效稳定的脱硫。
实验例7热熔回收硫磺测试
将实施例1中脱硫脱碳剂进行脱硫,将脱硫后的体系进行初步过滤,除去滤液后转移至熔硫釜中,加热至125℃,并保持该温度10min,放出底部熔融态的硫磺,冷却结晶得到固态硫磺。
将实施例1中脱硫脱碳剂进行脱硫,并将所得硫磺与脱硫脱碳液的固液混合物置于抽滤漏斗中,采用去离子水反复抽滤洗涤至净,得到水洗生成硫磺。
将上述熔融生成硫磺、及水洗生成硫磺均采用gb/t2449-2006《工业硫磺》测定其纯度,检测其硫磺含量、水分含量、灰分含量、有机物含量、砷含量等参数。其中,硫的质量分数采用差减法,即w1=100-(w3+w4+w5+w6),w1为硫的质量分数,w3、w4、w5、w6分别为测得的灰分、酸度、有机物、砷的质量分数。结果如表7所示:
表7硫磺各组分含量:
由表7可以看出,从非水相脱硫脱碳体系中熔融分离的生成固态硫磺纯度≥99.0%,可达到合格品要求甚至一等品要求,而水洗生成硫磺的纯度则较差,含水分时仅为82.1%,不含水分时为98.3%。
实验例8bmimfecl4-dmac对低碳烃的吸收
分别取bmimfecl4、dmac、以及实施例1中的1#bmimfecl4-dmac脱硫脱碳剂30ml,在温度为70℃真空干燥24h,分别放入体积为200ml的高压反应器中,高压反应器置于温度为25℃的恒温水浴锅中,待系统恒温后,通入ch4气体,改变气体的压力,吸收结果如下表8所示。
表8不同压力下bmimfecl4-dmac对ch4的吸收(molch4/l)
由表8可以看出,dmac可以吸收一定量的ch4但是吸收量较少。而bmimfecl4不吸收ch4;同时,随着压力的升高,bmimfecl4、dmac、以及bmimfecl4-dmac对ch4的吸收能力有所增强,但总体上对ch4的吸收量均较少。
- 还没有人留言评论。精彩留言会获得点赞!