一种基于双水相的多液核水凝胶微囊芯片及其应用
本发明涉及微流控技术领域,尤其涉及一种基于双水相的多液核水凝胶微囊芯片。
背景技术:
水凝胶微囊因其具有良好的生物相容性、渗透性、高负载能力、可调响应性等优势,目前已经在生物学、药学、材料化学等领域引起了广泛关注。核壳状水凝胶微囊通常是采用聚乙二醇、海藻酸盐、明胶甲基丙烯酰胺等水凝胶材料通过悬滴法、涂层法和液滴微流体等方法制备而来。由于种微胶囊含液核和水凝胶壳,具有极好的生物相容性、渗透性,故在细胞负载、药物传递与释放、分子吸附等方面被广泛使用。但由于单液核的水凝胶微囊在结构上过于单一,只能实现物质的单一负载,对于多种物质的分区负载很难满足,目前,也有文献报道采用乳化聚合的方式可制备出含多个液核的水凝胶微囊,不足的是这种方式制备的微囊均一性和稳定性很差,且制备过程涉及溶剂挥发或温度聚合等操作,制备过程很极不温和。这就迫切需要提出一种简单、灵活、温和的方法制备出多液核水凝胶微囊。
微流控技术是一种在微米尺度下对流体进行精确操控为特征的技术。微流控液滴技术是其一个重要分支,因具有尺寸均一、体积小、使用灵活等优点,该技术已经在生物材料、组织工程、再生医学等领域得到了广泛的应用。能利用微流控技术实现多液核水凝胶微囊的制备仍是一个挑战。近年来,双水相体系引起了广大科研工作者的极大关注。双水相体系,是由两种浓度高于临界值的不同聚合物在水溶液组成的,当体系的相互作用能高于混合的吉布斯自由能时,从而产生自发的相分离。由于体系具有很好的生物相容性,这也拓宽了微流控技术在该领域中的应用。本发明提供了一种基于双水相的多液核水凝胶微囊芯片。
技术实现要素:
本发明的目的在于提供一种基于双水相的多液核水凝胶微囊芯片。
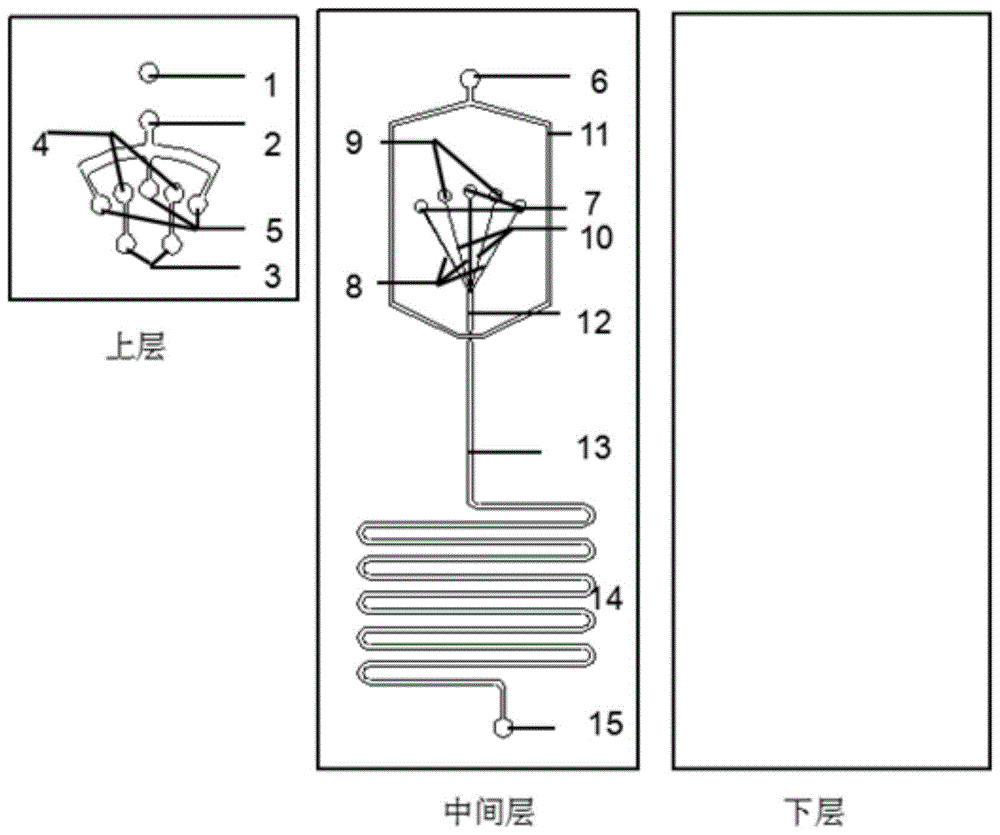
本发明提供的多液核水凝胶微囊制备芯片利用常规软光刻的方法而成的三层pdms芯片(上层、中间层、下层)键合而成的,上层采用了分流的设计,由简避繁,避免了多个泵装置同时使用的局限。
该芯片上层主要由核流体入口,壳流体入口,连续相入口,核流体分流口,壳流体分流口,中间层主要由连续相入口,连续相通道,核流体入口,壳流体入口,核通道,壳通道,层流通道,主通道和反应通道,流体出口组成,下层是没有结构的白板;
所述芯片上层的壳流体分流口与芯片中间层的壳流体入口相通;
壳流体入口的分支流体入口为壳流体分流口,核流体入口的分支流体入口为壳流体分流口。
核流体从核流体入口分别通过核流体分流口进入核流体入口,经过核通道流入层流通道;壳流体从壳流体入口分别通过壳流体分流口,经过芯片中间层的壳流体入口,通过壳通道流入层流通道;连续流从连续相入口通过中间层连续相入口经连续相通道流入主通道;核流体,壳流体,连续流体最终均通过通道和反应通道,制备的多液核水凝胶微囊从流体出口流出并收集。
本发明所述芯片层流通道宽度100-600μm,高100-500cm;主通道宽度100-500μm,高50-500cm,核、壳通道宽度20-200μm,高20-200μm,连续相通道宽度100-400μm,高50-300cm。
本发明所述芯片可根据增加核通道、壳通道的个数实现多种液核微囊的制备,其中微囊可含单液核、双液核、三液核、四液核等更多个数的液核。
所述核通道的个数≥1、壳通道(8)的个数≥1;实现多液核水凝胶微囊。
微囊的液核个数≥1。
本发明所述三层pdms层分别用等离子体处理25s进行封接,通道用1h,1h,2h,2h-全氟辛基三氯硅烷疏水处理;所述1h,1h,2h,2h-全氟辛基三氯硅烷浓度为0.5%-5%,处理时间为20-60min。
本发明所述的多液核水凝胶微囊的核均为水溶液,壳为水凝胶。
所述的多液核水凝胶微囊是基于双水相体系来制备的,选用的材料兼具生物相容性和稳定性,核为右旋糖酐(dex),壳为聚乙二醇(peg);所述peg分子量范围:8-20kda、浓度范围:10-30%;dex分子量范围:70k-500kda、浓度范围:10-40%;
为了产生多液核水凝胶微囊,在壳流体中可混入水凝胶预聚体,材料为海藻酸钠(naa)和乙二胺四乙酸钙二钠(ca-edta),naa使用的粘度范围:55-400cps、浓度范围:0.1-2%,ca-edta使用的浓度范围:0.1-2%,壳流体连续相中加入醋酸(hac),使用的浓度范围0.05-0.25%,在连续相中加入span80增大油水界面,利于形成稳定的液滴,所述span80浓度范围为1%-5%,收集池用氯化钙(cacl2)水溶液,浓度范围为0.5-4%;
所述核流体、壳流体、连续相流体分别从核流体入口、壳流体入口、连续相流体入口通入微流控芯片,通过改变核流速、壳流速和连续相流速来调节多液核水凝胶微囊的尺寸大小,包括液核的大小和微囊整体大小;核流速范围:0.01-2.0μl/min,壳流速范围:1-10μl/min,连续相流速范围:10-60μl/min。本发明与微流控技术相结合,实现了芯片设计的灵活性;为制备生物相容性极好的多液核水凝胶微提供了一种新的技术手段。囊过程简单、条件温和;通过调节核流体、壳流体、连续流的流速等可得到多液核水凝胶微囊尺寸均一、形貌可控,避免了现有文献报道的制备微囊均一性和稳定性差、制备条件极不温和的问题;此外,多液核水凝胶微囊的制备也为细胞分区化培养、药物共装载等生物学应用提供了一种技术手段。
附图说明
图1是制备双液核水凝胶微囊芯片示意图。
其中1为上层连续相入口,2壳流体入口,3核流体入口,4核流体分流口,5壳流体分流口,6中间层连续相入口,7中间层壳流体入口,8壳通道,9中间层核流体入口,10核通道,11连续相通道,12层流通道,13主通道,14反应通道,15流体出口。
图2是制备三液核水凝胶微囊芯片示意图。
其中1为上层连续相入口,2壳流体入口,3核流体入口,4核流体分流口,5壳流体分流口,6中间层连续相入口,7中间层壳流体入口,8壳通道,9中间层核流体入口,10核通道,11连续相通道,12层流通道,13主通道,14反应通道,15流体出口。
图3是制备四液核水凝胶微囊芯片示意图。
其中1为上层连续相入口,2壳流体入口,3核流体入口,4核流体分流口,5壳流体分流口,6中间层连续相入口,7中间层壳流体入口,8壳通道,9中间层核流体入口,10核通道,11连续相通道,12层流通道,13主通道,14反应通道,15流体出口。
图4是实施例4中制备双液核水凝胶微囊的明场图片(scalebar:100μm)。
图5是实施例5中制备三液核水凝胶微囊的明场图片(scalebar:200μm)。
具体实施方式
结合实际情况,首先设计含不同个液核的水凝胶微囊芯片,然后利用常规软光刻技术制备pdms芯片。下面结合附图和实施例对本发明作进一步说明。
实施例1
一种基于双水相的双液核水凝胶微囊芯片。
该芯片由三层pdms芯片(上层、中间层、下层)键合而成的,上层采用了分流的设计,由简避繁,避免了多个泵装置同时使用的局限。
主要由上层连续相入口1,壳流体入口2,核流体入口3,核流体分流口4,壳流体分流口5;中间层连续相入口6,中间层壳流体入口7,壳通道8,中间层核流体入口9,核通道10,连续相通道11,层流通道12,主通道13,反应通道14,流体出口15组成;
核流体从核流体入口3分别通过核流体分流口4进入核流体入口9,经过核通道10流入层流通道12;壳流体从壳流体入口2分别通过壳流体分流口5,经过壳通道8流入层流通道12;连续流从连续相入口1通过中间层连续相入口6经连续相通道11流入主通道13;核流体,壳流体,连续流体最终均通过通道13和反应通道14,制备的多液核水凝胶微囊从流体出口15流出并收集。
所述芯片层流通道宽度400μm,高360cm;主通道宽度400μm,高360cm,核、壳通道宽度50μm,高300μm,连续相通道宽度320μm,高360cm。如图1所示。
实施例2
一种基于双水相的三液核水凝胶微囊芯片。
该芯片由三层pdms芯片(上层、中间层、下层)键合而成的,上层采用了分流的设计,由简避繁,避免了多个泵装置同时使用的局限。
主要由上层连续相入口1,壳流体入口2,核流体入口3,核流体分流口4,壳流体分流口5;中间层连续相入口6,中间层壳流体入口7,壳通道8,中间层核流体入口9,核通道10,连续相通道11,层流通道12,主通道13,反应通道14,流体出口15组成;
核流体从核流体入口3分别通过核流体分流口4进入核流体入口9,经过核通道10流入层流通道12;壳流体从壳流体入口2分别通过壳流体分流口5,经过壳通道8流入层流通道12;连续流从连续相入口1通过中间层连续相入口6经连续相通道11流入主通道13;核流体,壳流体,连续流体最终均通过通道13和反应通道14,制备的多液核水凝胶微囊从流体出口15流出并收集。
芯片层流通道宽度300μm,高300cm;主通道宽度300μm,高300cm,核、壳通道宽度70μm,高100μm,连续相通道宽度300μm,高300cm,如图2所示。
实施例3
一种基于双水相的四液核水凝胶微囊芯片。
该芯片由三层pdms芯片(上层、中间层、下层)键合而成的,上层采用了分流的设计,由简避繁,避免了多个泵装置同时使用的局限。
主要由上层连续相入口1,壳流体入口2,核流体入口3,核流体分流口4,壳流体分流口5;中间层连续相入口6,中间层壳流体入口7,壳通道8,中间层核流体入口9,核通道10,连续相通道11,层流通道12,主通道13,反应通道14,流体出口15组成;
核流体从核流体入口3分别通过核流体分流口4进入核流体入口9,经过核通道10流入层流通道12;壳流体从壳流体入口2分别通过壳流体分流口5,经过壳通道8流入层流通道12;连续流从连续相入口1通过中间层连续相入口6经连续相通道11流入主通道13;核流体,壳流体,连续流体最终均通过通道13和反应通道14,制备的多液核水凝胶微囊从流体出口15流出并收集。
芯片层流通道宽度400μm,高400cm;主通道宽度300μm,高400cm,核、壳通道宽度70μm,高200μm,连续相通道宽度400μm,高300cm,如图3所示。
实施例4
一种基于双水相的双液核水凝胶微囊芯片应用。
利用实施例1中的一种基于双水相的双液核水凝胶微囊芯片来制备双液核水凝胶微囊,核流体成分为dex,壳流体为peg、海藻素钠(naa)和乙二胺四乙酸钙二钠(ca-edta)组成的混合物,连续相为矿物油、醋酸(hac)和span80组成的混合物。
所述peg分子量:20kda、浓度:17%;dex分子量:50kda、浓度:15%;naa浓度:1%,粘度为55cps,ca-edta的浓度:1%,hac的浓度0.15%,span80浓度2%。
将核、壳、连续相流体分别从核、壳、连续相流体入口通入微流控芯片,核流速:0.6μl/min,壳流速:4μl/min,连续相流速:30μl/min。基于以上条件制备的双液核水凝胶微囊明场图如图4所示。
实施例5
一种基于双水相的三液核水凝胶微囊芯片应用。
利用实施例2中的一种基于双水相的三液核水凝胶微囊芯片来制备双液核水凝胶微囊,核流体成分为dex,壳流体为peg、海藻素钠(naa)和乙二胺四乙酸钙二钠(ca-edta)组成的混合物,连续相为矿物油、醋酸(hac)和span80组成的混合物。
所述peg分子量:20kda、浓度:17%;dex分子量:50kda、浓度:15%;naa浓度:1%,粘度为55cps,ca-edta的浓度:1%,hac的浓度0.10%,span80浓度2%。
将核、壳、连续相流体分别从核、壳、连续相流体入口通入微流控芯片,核流速:0.3μl/min,壳流速:9μl/min,连续相流速:20μl/min。基于以上条件制备的三液核水凝胶微囊明场图如图5所示。
- 还没有人留言评论。精彩留言会获得点赞!