CD63在制备肝脏疾病诊断试剂盒或制备预防或治疗肝脏疾病药物中的应用的制作方法
本发明涉及医药生物工程技术领域,提供了肝干细胞的特异性表面分子标志物CD63及其应用,特别是CD63在制备肝脏疾病诊断试剂盒或制备预防或治疗肝脏疾病药物中的应用,并通过该表面标志物从肝脏中快速分离和培养扩增肝干细胞的方法。具体涉及应用肝干细胞的表面特异性标志物,通过流式分选的方法从肝脏细胞悬液中快速分离出肝干细胞,并实现肝干细胞在体外的扩增和双向分化,以及在肝脏疾病动物模型肝脏内的再植。
背景技术:
组织干细胞是指存在于个体已经分化的组织中的未分化细胞,这种细胞具有自我更新和特化形成该组织的细胞的能力。组织干细胞存在于机体的各种组织器官中,是组织器官稳态维持的结构和功能基础。成年个体组织中的组织干细胞在正常情况下大多处于休眠状态,只有在病理状态或在外界因素的作用下才能被激活增殖并向该组织的细胞类型分化。肝脏中的肝干细胞被认为存在于Hering’s管和胆管腺中,具有产生肝细胞和胆管上皮细胞的双向分化潜能。在正常肝组织中,肝干细胞的数量极少,只有当肝脏受损并且肝细胞的增殖受到抑制或是肝脏受到持续的大规模慢性损伤时,肝脏中的肝干细胞才能被激活,即所谓的“胆管反应”。在动物模型中常联合应用能够抑制肝细胞增殖的药物(如倒千里光碱、对乙酰氨基酚等)和三分之二肝切来诱导胆管反应,而在人类的慢性肝病中(如慢性病毒性肝炎、原发性胆汁性肝硬化等)常到观察到胆管反应的存在。
肝干细胞的分离培养及其深入研究对于肝脏发育,肝脏损伤后再生、肝脏肿瘤的发生的机理以及各种原因导致的终末期肝脏疾病的细胞治疗都具有十分重要的研究意义和应用价值。由于肝干细胞在肝脏中存在的数量极少,目前报道肝干细胞的分离的方法尚不完善。Li等通过千里光碱联合2/3肝切诱导胆管反应后,将肝脏制备成细胞悬液,经过分级离心去除肝实质细胞后,再通过差速贴壁的方法将肝干细胞纯化(Li WL,Su J,Yao YC,Tao XR,Yan YB,Yu HY,Wang XM,Li JX,Yang YJ,Lau JT,Hu YP,Isolation and characterization of bipotent liver progenitor cells from adult mouse,Stem Cells,24(2),322-332),该种分离纯化肝干细胞的方法比较繁琐,且不易从正常肝组织中分离出肝干细胞。近年来,通过Foxl1,CD133和Lgr5等肝干细胞的表面标志物结合流式或磁珠分选的方法从正常肝脏或诱导胆管反应的肝脏中分离出肝干细胞(Shin S,Walton G,Aoki R,Brondell K,Schug J,Fox A,Smirnova O,Dorrell C,Erker L,Chu AS,Wells RG,Grompe M,Greenbaum LE,Kaestner KH,Foxl1-Cre-marked adult hepatic progenitors have clonogenic and bilineage differentiation potential,Genes Dev.25(11):1185-1192;Dorrell C,Erker L,Schug J,Kopp JL,Canaday PS,Fox AJ,Smirnova O,Duncan AW,Finegold MJ,Sander M,Kaestner KH,Grompe M,Prospective isolation of a bipotentialclonogenic liver progenitor cell in adult mice.Genes Dev.25(11):1193-1203;Huch M,Dorrell C,Boj SF,van Es JH,Li VS,van de Wetering M,Sato T,Hamer K,Sasaki N,Finegold MJ,Haft A,Vries RG,Grompe M,Clevers H,In vitro expansion of single Lgr5+liver stem cells induced by Wnt-driven regeneration,Nature.494(7436):247-250.),但这些标志物并不能有效区分肝干细胞和胆管细胞。因此,现有的分离肝干细胞的方法操作繁复或是分离的肝干细胞纯度较低,目前尚没有能够快速从肝脏组织中特异分离纯化肝干细胞的方法。
CD63是包含有四个疏水结构域(hydrophobic domains)的膜蛋白,是四次跨膜蛋白家族(tetraspanin family)的主要成员之一。CD63主要与整合素(integrins)家族蛋白形成复合体,参与调节细胞的发育、生长、激活和迁移等功能。目前,CD63被发现主要表达于T细胞、巨噬细胞和激活的血小板。本发明发现CD63亦是肝干细胞的特异性表面分子标志物,并提供了从肝脏细胞悬液中快速、特异分离和纯化CD63+肝干细胞的方法,同时,实现了肝干细胞在体外的扩增和双向分化,以及在肝脏疾病动物模型肝脏内的再植。CD63+肝干细胞的获得为肝脏疾病的细胞治疗和肝脏疾病治疗药物筛选提供平台,也为开发以CD63为靶标的肝脏疾病诊断试剂盒和治疗方法等研究奠定基础。
技术实现要素:
本发明的目的在于提供一种肝干细胞的特异性表面分子标志物CD63。
本发明的另一目的在于提供肝干细胞的特异性表面分子标志物CD63在肝干细胞快速分离扩增和/或诱导分化的方法中的应用。
本发明的又一目的在于提供肝干细胞的特异性表面分子标志物CD63在制备肝脏疾病诊断试剂盒和/或治疗肝脏疾病的药物中的应用。
本发明的第一方面,提供了一种肝干细胞的特异性表面分子标志物,所述的肝干细胞的特异性表面分子标志物是CD63。
本发明的肝干细胞的特异性表面分子标志物,也称为肝干细胞的特异性表面标志物、肝干细胞的表面分子标记、肝干细胞的表面分子标志等。
本发明的第二方面,提供了CD63作为肝干细胞的特异性表面标志物的应用,该应用具体是CD63在肝干细胞快速分离扩增和/或诱导分化的方法中的应用。
CD63作为肝干细胞的特异性表面标志物,可以准确地、特异性地从正常肝脏中分离出肝干细胞,也可从DDC诱导胆管反应后的肝脏中分离出肝干细胞。
特异性表面分子标志物CD63在肝干细胞快速分离扩增和/或诱导分化的方法中的应用。本发明通过肝干细胞表面特异性标志物CD63,结合流式分选的方法快速特异的从小鼠肝脏中分离出CD63阳性肝干细胞。CD63阳性的肝干细胞具有强大的增殖能力和分化为肝细胞和胆管细胞的双向分化能力。其中所述肝脏是指正常肝脏或DDC诱导胆管反应后的肝脏。
所述的DDC诱导胆管反应后的肝脏,诱导方法可参见文献Preisegger KH,Factor VM,Fuchsbichler A,Stumptner C,Denk H,Thorgeirsson SS,Atypical ductular proliferation and its inhibition by transforming growth factor beta1in the 3,5-diethoxycarbonyl-1,4-dihydrocollidine mouse model for chronic alcoholic liver disease,Lab Invest.79(2):103-109。
特异性表面分子标志物CD63在肝干细胞快速分离扩增的方法中的应用,具体方法如下:
A、原位免疫荧光和免疫组化染色鉴定CD63阳性的肝干细胞在正常肝脏或DDC诱导胆管反应后肝脏中的定位。免疫荧光和免疫组化染色结果显示CD63阳性的肝干细胞在肝脏内分布于Hering’s管和胆管腺内。
B、通过流式细胞仪分选的方法,从正常肝脏或DDC诱导胆管反应后肝脏中分离出CD63阳性(CD63+)的肝干细胞,并实现了CD63阳性的肝干细胞在体外的扩增。首先将正常肝脏或DDC诱导胆管反应3周后的肝脏用两步法原位胶原酶灌注消化肝脏(Wang MJ1,Chen F,Li JX,Liu CC,Zhang HB,Xia Y,Yu B,You P,Xiang D,Lu L,Yao H,Borjigin U,Yang GS,Wangensteen KJ,He ZY,Wang X,Hu YP,Reversal of hepatocyte senescence after continuous in vivo cell proliferation,Hepatology.60(1):349-361.),消化混合物继续用0.25%胶原酶在37℃孵育30分钟,然后通过梯度离心法富集肝脏非实质细胞。再通过流式细胞仪分选出CD11b、CD31和CD45阴性,而CD63阳性的肝干细胞。最后将CD63阳性的肝干细胞在SCM-A培养基中大量扩增,SCM-A培养基:DMEM/F12、10%胎牛血清(Fetal bovine serum,FBS)、1×青链霉素、0.1mM2-巯基乙醇(2-Mercaptoethanol,2-Mer)、1×胰岛素-转铁蛋白-硒溶液(Insulin-Transferrin-Selenium Solution,ITS)、10ng/ml肝细胞生长因子(Hepatocyte Growth Factor,HGF)、10ng/ml表皮生长因子(Epidermal growth factor,EGF)、10ng/ml尼克酰胺(Nicotinamide)、10-7M地塞米松(dexamethasone,Dex)和50ug/ml庆大酶素(Gentamycin)。
所述的原位免疫荧光和免疫组化染色定位,可参见文献Yu B,He ZY,You P,Han QW,Xiang D,Chen F,Wang MJ,Liu CC,Lin XW,Borjigin U,Zi XY,Li JX,Zhu HY,Li WL,Han CS,Wangensteen KJ,Shi Y,Hui LJ,Wang X,Hu YP,Reprogramming fibroblasts into bipotential hepatic stem cells by defined factors,Cell Stem Cell.13(3):328-340。
所述的流式细胞仪分选的方法,可参见文献Wang MJ1,Chen F,Li JX,Liu CC,Zhang HB,Xia Y,Yu B,You P,Xiang D,Lu L,Yao H,Borjigin U,Yang GS,Wangensteen KJ,He ZY,Wang X,Hu YP,Reversal of hepatocyte senescence after continuous in vivo cell proliferation,Hepatology.60(1):349-361。;所用流式细胞仪型号为Becton Dickinson FACs Calibur。
较佳地,其中步骤A中原位免疫荧光和免疫组化染色鉴定CD63阳性的肝干细胞在正常肝脏或DDC诱导胆管反应后肝脏中的定位的具体步骤为:
A1、正常肝脏和DDC诱导胆管反应3周后的肝脏用OCT包埋剂包埋后,冰冻切片7um厚。4%多聚甲醛(PFA)室温固定10分钟,去除固定液,PBS洗三遍,4℃保存备用;
A2、免疫荧光染色:将经步骤A1处理后的肝脏切片用1%牛血清白蛋白(bovine serum album,BSA)室温封闭30分钟后,滴加用封闭液稀释的鼠抗CD63抗体和兔抗CK19抗体,4℃过夜。PBS-T洗涤三次,每次5分钟,滴加FITC标记的羊抗兔IgG(FITC-Goat anti Rabbit IgG)和TRITC标志的羊抗鼠IgG(TRITC-Goat anti Mouse IgG),37℃反应30分钟,用PBS-T洗涤3次,每次5分钟;DAPI复染细胞核1分钟,PBS-T洗2次。抗荧光衰减封片剂封片,荧光显微镜下观察。
A3、免疫组化染色:将经步骤A2处理后的肝脏切片用0.3%双氧水封闭30分钟,PBS-T洗三次,1%BSA室温封闭30分钟后,滴加用封闭液稀释的鼠抗CD63抗体,4℃过夜。PBS-T洗涤三次,每次5分钟。切片上滴加用PBS-T稀释的HRP标记二抗,37℃孵育30分钟,用PBS-T洗涤3次,每次5分钟。切片上滴加按说明书提供的方法新鲜配制的DAB染色液(货号:Kit-0014,福州迈新生物技术开发有限公司),镜下观察切片颜色变化,待颜色明显时,立即将片子放入自来水中冲洗,终止显色反应。DAB显色后,苏木精(货号:H3136,购自Sigma)复染,脱水后封片。
较佳地,其中步骤B的具体步骤为:
B1、两步法原位胶原酶灌注消化肝脏(Wang MJ1,Chen F,Li JX,Liu CC,Zhang HB,Xia Y,Yu B,You P,Xiang D,Lu L,Yao H,Borjigin U,Yang GS,Wangensteen KJ,He ZY,Wang X,Hu YP,Reversal of hepatocyte senescence after continuous in vivo cell proliferation,Hepatology.60(1):349-361.),消化混合物继续用0.25%胶原酶在37℃孵育30分钟。
B2、消化后的细胞悬液50g离心力低速离心30分钟两次,弃沉淀(大的肝细胞),收集上清液后,继续用300g离心力离心5分钟,用无血清培养基重悬细胞,计数,将细胞稀释至107/ml,使用密度梯度离心分层液(OptiPrepTM Density Gradient Medium)(货号:D1556,sigma公司)富集非实质细胞。
B3、收集富集到的非实质细胞后,PBS洗两遍,无血清培养基重悬。使用抗小鼠CD16/32抗体(每106细胞1ug抗体),4℃封闭10分钟。
B4、4℃避光孵育CD63-PE抗体(每106细胞0.5ug抗体),同时孵育CD11b,CD31,CD45-FITC抗体(每106细胞0.2ug抗体),20分钟。用含有2%FBS(质量百分比)的PBS清洗细胞三遍。
B5、使用流式仪分选,以获得CD63-PE阳性,CD11b,CD31,CD45-FITC阴性的细胞。
B6、接种500个流式细胞仪分选出的CD63+的肝干细胞至含SCM-A的培养基的96孔板中,37℃,5%CO2,95%湿度条件培养2周。
进一步,在上述步骤B之后,本发明还提供了CD63在肝干细胞诱导分化的方法中的应用,具体是分离出的CD63阳性的肝干细胞或扩增后的CD63阳性的肝干细胞在体外诱导分化为成熟肝细胞或胆管上皮细胞。
上述步骤B、通过流式细胞仪分选的方法,从正常肝脏或DDC诱导胆管反应后肝脏中分离出CD63阳性的肝干细胞,并实现了CD63阳性的肝干细胞在体外的扩增。
本发明提供了CD63阳性的肝干细胞在体外诱导分化为成熟肝细胞的方法。该方法具体为步骤C。
C、CD63阳性的肝干细胞在肝向诱导条件下(DMEM/F12、10%FBS、10ng/ml HGF、10ng/ml EGF、10-7MDex、1%二甲基亚砜(Dimethyl sulfoxide,DMSO)、10ng/ml抑瘤素(oncostatin M,OSM)、20%基质胶(Matrigel))诱导分化为成熟肝样细胞,CD63阳性的肝干细胞诱导分化形成的肝样细胞高表达肝细胞特异性功能基因(CYP7a1、G6PD、AAT等)且具有储存糖原的功能。
较佳地,具体诱导步骤为:
C1、按5×104细胞/cm2将CD63阳性的肝干细胞种于1型胶原(货号:354236,购自BD公司)包被的35mm培养皿,添加SCM-A培养基,于37℃、5%CO2培养箱中培养至细胞长满,其间隔天换液。
C2、细胞长满后,更换肝向诱导培养基(DMEM/F12、10%FBS、10ng/ml HGF、10ng/mlEGF、10-7MDex、1%DMSO、10ng/ml OSM、20%Matrigel)继续培养6天,其间隔天换液。
本发明还提供了CD63阳性的肝干细胞在体外诱导分化为胆管上皮细胞。该方法具体为步骤D。
D、CD63阳性的肝干细胞在Ⅰ型胶原三维培养条件下被诱导分化为分支样的管样结构,诱导形成的管样结构表达胆管细胞的标志物Krt19和EpCAM。
较佳地,具体诱导步骤为:
D1、所用的溶液均放置于4℃预冷30分钟;
D2、制备I型胶原凝胶溶液:I型胶原800ul,10×PBS 100ul,1N NaOH 20ul,ddH2O80ul混匀,置于冰上。
D3、将1ml胆管诱导培养液(DMEM、10%FBS、1x青链霉素、1x ITS、20ng/ml HGF、50ug/ml Gentamycin)重悬的5×104个CD63阳性的肝干细胞与上述配制的I型胶原凝胶溶液混匀,加入35mm培养皿内;
D4、将培养皿置于37℃、5%CO2培养箱中培养2小时,等含有细胞的凝胶凝固;
D5、向培养皿中加入1.5ml胆管诱导培养液,并将细胞持续培养9天(期间隔天换液)。
上述分离扩增方法得到的CD63阳性肝干细胞及其分化产生的功能性子代细胞。
上述分离扩增方法得到的CD63阳性肝干细胞及其分化产生的功能性子代细胞在制备组织化工程肝脏中的应用。
上述分离扩增方法得到的CD63阳性肝干细胞及其分化产生的功能性子代细胞在制备细胞治疗急性肝衰竭和各种终末期肝脏疾病的药物中的应用。
本发明的第三方面,提供了CD63作为肝干细胞的特异性表面标志物的另一应用,该应用具体是特异性表面分子标志物CD63在制备肝脏疾病诊断试剂盒和/或治疗肝脏疾病的药物中的应用。
本发明所述的CD63在制备肝脏疾病诊断试剂盒中的应用,所述的试剂盒中包含检测CD63表达量的试剂。
CD63作为肝干细胞的标志物,可以示踪并揭示肝干细胞在肝脏肿瘤发生、肝纤维化以及肝硬化的过程中肝干细胞所发挥的作用,CD63也可用作肝脏疾病的早期诊断标志物。
本发明所述的CD63在制备预防或治疗肝脏疾病药物中的应用,所述的药物为前述的CD63在肝干细胞快速分离扩增或诱导分化的方法中的应用中分离扩增方法得到的CD63阳性肝干细胞及其分化产生的功能性子代细胞。
CD63阳性肝干细胞可作为肝脏药物筛选、组织化工程肝脏和肝脏疾病细胞治疗的种子细胞,也为肝脏发育以及肝干细胞的细胞生物学特性的研究提供了理想的细胞模型。
CD63阳性的肝干细胞对肝细胞损伤模型小鼠(Fah基因敲除小鼠)和DDC诱导的胆管损伤模型小鼠具有肝脏再殖的能力,并显示出治疗作用。
CD63阳性的肝干细胞通过脾脏移植至肝脏损伤的模型小鼠体内可再植于损伤的肝脏,并缓解肝脏的损伤。CD63阳性的肝干细胞移植至肝细胞慢性损伤的小鼠模型体内后,CD63阳性的肝干细胞定植于肝脏内并分化为成熟肝细胞以缓解肝脏的损伤,具体表现为损伤模型小鼠肝功能的恢复。而CD63阳性的肝干细胞移植至DDC诱导的胆管损伤的模型小鼠后,则分化为胆管上皮细胞定植于胆管上。
CD63的表达量与肝脏疾病的相关性的检测,具体表现为:
收集不同类型肝脏疾病(如肝脏肿瘤、肝硬化、肝纤维化等)不同发展时期(早、中、晚期)标本(包括血液、尿液及其他分泌物,肝脏及其病灶等),检测CD63的表达量,具体的检测方法包括免疫组化和免疫荧光、蛋白质印迹法(Western Blot)、酶联免疫吸附试验(ELISA)和实时定量荧光PCR(Real-Time PCR)。
免疫组化和免疫荧光的检测方法可参见文献Yu B,He ZY,You P,Han QW,Xiang D,Chen F,Wang MJ,Liu CC,Lin XW,Borjigin U,Zi XY,Li JX,Zhu HY,Li WL,Han CS,Wangensteen KJ,Shi Y,Hui LJ,Wang X,Hu YP,Reprogramming fibroblasts into bipotential hepatic stem cells by defined factors,Cell Stem Cell.13(3):328-340。
蛋白质印迹法(Western Blot)的具体步骤为:
1、肝脏及其病灶的实体标本按蛋白裂解液(货号P0013B RIPA,碧云天生物技术研究所)说明书提供的方法裂解标本,收集蛋白裂解液。
2、检测蛋白裂解液中总蛋白的浓度,按微型BCA蛋白检测试剂盒(Micro BCA Protein Assay Kit,货号:23235,Thermo公司)说明书提供的检测方法测定标本的总蛋白浓度。
3、蛋白质印迹法(Western Blot)检测CD63的表达水平,具体方法参考Wang MJ1,Chen F,Li JX,Liu CC,Zhang HB,Xia Y,Yu B,You P,Xiang D,Lu L,Yao H,Borjigin U,Yang GS,Wangensteen KJ,He ZY,Wang X,Hu YP,Reversal of hepatocyte senescence after continuous in vivo cell proliferation,Hepatology.60(1):349-361.),蛋白质印迹法(Western Blot)中所用的CD63抗体为Santa Cruz公司的产品,货号为sc-15363。
酶联免疫吸附试验(ELISA)的具体检测方法参照人CD63酶联免疫吸附试验试剂盒(Human cluster of differentiation 63(CD63)ELISA Kit,货号:MBS702053,购自mybiosource公司)提供的说明书进行。
实时定量荧光PCR(Real-Time PCR)的具体操作方法参考Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T)method.Nat Protoc.3(6):1101-1108.
CD63可作为多种肝脏疾病(包括肝肝脏肿瘤、肝硬化、肝纤维化等)的早期诊断标志物。同时CD63也可作为肝脏疾病的预后的评价指标之一。因此,CD63可作为免疫组化和免疫荧光、蛋白质印迹法(Western Blot)、酶联免疫吸附试验(ELISA)和实时定量荧光PCR(Real-Time PCR)等检测试剂盒的靶标,用于肝脏疾病的早期诊断和的判断预后。CD63阳性的肝干细胞及其分化的子代细胞是肝脏疾病药物的筛选、药理、毒理及疗效试验的理想细胞平台。CD63阳性的肝干细胞及其分化的子代细胞可用于治疗肝脏疾病的药物的筛选,以及药物的药理、毒理及疗效的评价。
本发明的有益效果:
本发明提供了根据上述分离培养方法获得的CD63阳性的肝干细胞。CD63阳性的肝干细胞具备肝干细胞最本质的特征,即强大的增殖能力和在特定的诱导条件下可分化为成熟的肝细胞和胆管上皮细胞的双向分化能力。
本发明的创新点在于:1)CD63是肝干细胞的表面特异性标志物;2)结合CD63标志物和流式细胞仪可快速从正常肝脏和DDC诱导胆管反应的肝脏中分离纯化出具有增殖能力和双向分化能力的肝干细胞;3)CD63阳性的肝干细胞具有对损伤肝脏的再殖能力,并显示出治疗作用。
本发明所提供的肝干细胞的特异性表面标志物CD63具有广泛的用途,CD63作为肝干细胞的标志物,可以示踪并揭示肝干细胞在肝脏肿瘤发生、肝纤维化以及肝硬化的过程中肝干细胞所发挥的作用,CD63也可用作肝脏疾病的早期诊断和预后判断的标志物。
本发明所提供的CD63阳性肝干细胞及其分化产生的了代细胞也具有广泛的用途。可作为肝脏药物筛选、组织化工程肝脏和肝脏疾病细胞治疗的种子细胞,也为肝脏发育以及肝干细胞的细胞生物学特性的研究提供了理想的细胞模型。
附图说明
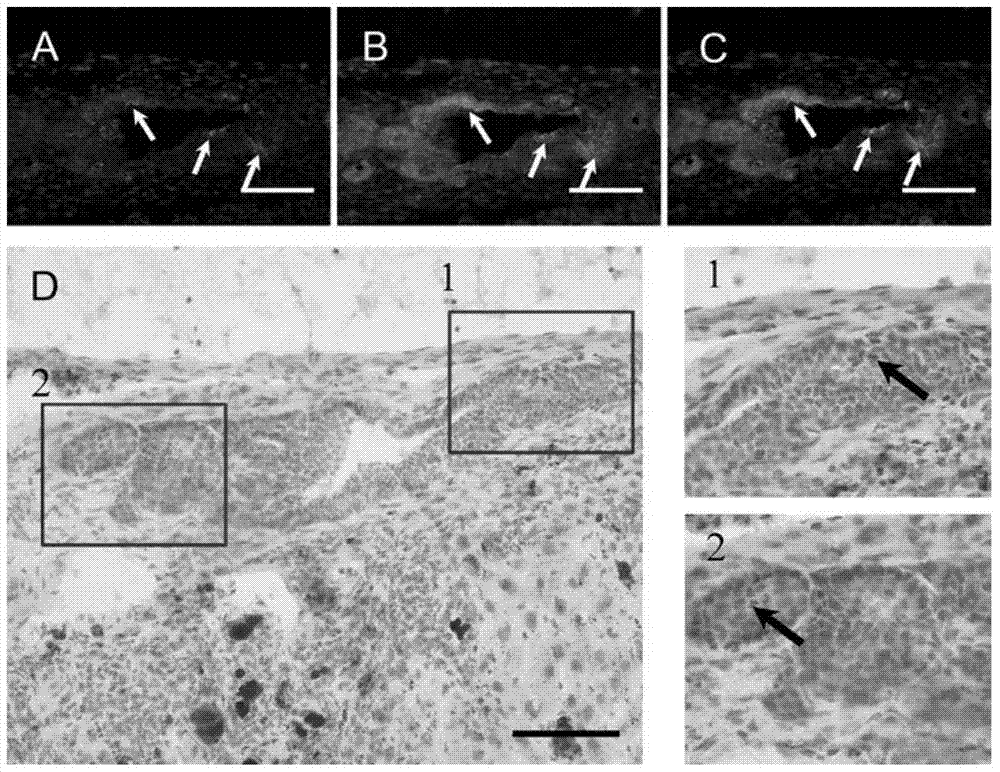
图1为野生型小鼠肝脏中CD63阳性肝干细胞的定位图。
其中A:CK19免疫荧光染色,白色箭头所示管道上的细胞为CK19阳性细胞,B:CD63免疫荧光染色,白色箭头所示管道上的细胞为CD63阳性细胞,C:A和B的叠加图,白色箭头所示管道上的细胞为CK19和CD63双阳性细胞;D:CD63的免疫组化染色,1和2为图D中方框内的局部放大图,黑色箭头所示细胞为CD63阳性细胞。标尺:100微米。
图2为DDC诱导胆管反应后肝脏中CD63阳性肝干细胞的定位图。
其中A:CK19免疫荧光染色,白色箭头所示细胞为CK19阳性细胞,B:CD63免疫荧光染色,白色箭头所示细胞为CD63阳性细胞,C:A和B的叠加图,白色箭头所示细胞为CK19和CD63双阳性细胞;D:CD63的免疫组化染色,1和2为图D中方框内的局部放大图,黑色箭头所示细胞为CD63阳性细胞。标尺:100微米。
图3为通过表面标志物CD63流式分选肝干细胞的散点图。
其中A:野生型小鼠肝脏中CD11b-CD31-CD45-CD63+肝干细胞比例为0.2%(Q4象限);B:DDC诱导胆管反应后肝脏中CD11b-CD31-CD45-CD63+肝干细胞比例为0.5%(Q4象限)。
图4为流式分选的CD63阳性的肝干细胞的形态图。
其中A:分选自野生型小鼠肝脏中CD63阳性的肝干细胞在倒置相差显微镜下的形态;B:分选自DDC诱导胆管反应后小鼠肝脏中CD63阳性的肝干细胞在倒置相差显微镜下的形态。
图5为CD63阳性的肝干细胞第10代(P10)和第30代(P30)的生长曲线图。图中显示p10和P30的CD63阳性的肝干细胞在增殖能力没有差异。
图6为CD63阳性的肝干细胞在肝向诱导和胆向诱导分化后相关基因表达变化情况图。胆向诱导后胆管特异性基因(CK19、Gja1、Ggt1)表达增强,而肝向诱导后肝细胞特异性基因(Alb、Hnf4a、Cps1、Aat、Cyp7a1、G6p)表达增强。
图7为CD63阳性的肝干细胞肝向诱导分化后糖原染色图。
其中A:CD63阳性的肝干细胞肝向诱导分化后糖原染色显示诱导后的细胞具有储存糖原的功能;B:为图A中白色方框内的局部放大图,图B中黑色虚线框内为糖原染色阳性的细胞。
图8为CD63阳性的肝干细胞胆向诱导分化后形成分支样的胆管结构图。
其中A:免疫荧光染色胆管标志物Krt19,箭头所示细胞为Krt19阳性细胞;B:免疫荧光染色胆管标志物EpCAM,箭头所示细胞为EpCAM阳性细胞;C:诱导后形成的分支样胆管结构在倒置相差显微镜下的形态。
图9为CD63阳性的肝干细胞在体外标志上绿色荧光后的形态和绿色荧光表达情况图。
其中A为标志上绿色荧光后的CD63阳性的肝干细胞在倒置相差显微镜下的形态,B为标志上绿色荧光后的CD63阳性的肝干细胞全部表达绿色荧光。
图10为标志上绿色荧光后的CD63阳性的肝干细胞再殖Fah基因敲除小鼠肝脏后,肝脏切片的免疫荧光染色图。
其中A为免疫荧光染色显示Fah基因敲除小鼠肝脏内来源于CD63阳性的肝干细胞的细胞表达Fah基因(白色虚线内);B为A的连续切片免疫荧光染色显示Fah基因敲除小鼠肝脏内来源于CD63阳性的肝干细胞的细胞表达GFP(白色虚线内);C为A的连续切片免疫荧光染色显示Fah基因敲除小鼠肝脏内来源于CD63阳性的肝干细胞的细胞表达肝细胞特异性基因Alb(白色虚线内)
图11为CD63阳性的肝干细胞再殖Fah基因敲除小鼠肝脏后的肝功能示意图。CD63阳性的肝干细胞再殖Fah基因敲除小鼠肝脏后,Fah基因敲除小鼠肝脏功能明显好转,肝脏损伤的指标ALT(A),AST(B)和Tbil(D)明显下降,而肝脏合成白蛋白ALB(C)的能力明显提升。。
图12为标志上绿色荧光后的CD63阳性的肝干细胞再殖DDC损伤的小鼠肝脏后,肝脏切片的免疫荧光染色图。
其中A为DDC损伤小鼠肝脏的胆管上有绿色荧光标志的CD63阳性的肝干细胞的定植(箭头所示);B为DDC损伤小鼠肝脏内胆管上来源于CD63阳性的肝干细胞表达胆管细胞的特异性标志CK19;C为A和B的融合图。
具体实施方法
现结合本发明的实施例和附图对本发明的实施作详细说明,以下实施例是在以本发明的技术方案为前提下进行实施,并给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1.CD63肝干细胞在肝脏中的定位
1、正常肝脏和DDC诱导胆管反应3周后的肝脏(Preisegger KH,Factor VM,Fuchsbichler A,Stumptner C,Denk H,Thorgeirsson SS,Atypical ductular proliferation and its inhibition by transforming growth factor beta1in the 3,5-diethoxycarbonyl-1,4-dihydrocollidine mouse model for chronic alcoholic liver disease,Lab Invest.79(2):103-109)用OCT包埋剂(货号:4583,购自SAKURA公司)包埋后,冰冻切片7um厚。4%多聚甲醛(PFA)(货号:P-6148,购自Sigma公司)室温固定10分钟,去除固定液,PBS(货号:BS7016,购自生工生物工程(上海)股份有限公司)洗三遍,4℃保存备用。
2、免疫荧光染色:将经步骤1处理后的肝脏切片用1%BSA(货号:A1933,购自sigma公司)室温封闭30分钟后,滴加用1%BSA稀释的鼠抗CD63抗体(货号:mab5417,购自R&D公司)和兔抗CK19抗体(货号:A3190,购自Abbomax公司),4℃过夜。PBS-T(货号:rbr01485,购自上海榕柏生物技术有限公司)洗涤三次,每次5分钟,滴加FITC-Goat anti Rabbit IgG(FITC标志的羊抗兔IgG,货号:111-095-003,购自Jackson公司)和TRITC-Goat anti Mouse IgG(TRITC标志的羊抗鼠IgG,货号:115-025-003,购自Jackson公司),37℃反应30分钟,用PBS-T洗涤3次,每次5分钟;DAPI(货号:D6584,购自生工生物工程(上海)股份有限公司)复染细胞核1分钟,PBS-T洗2次。抗荧光衰减封片剂(货号:C1210,购自北京普利莱基因技术有限公司)封片,荧光显微镜下观察。免疫荧光染色结果显示:在正常肝脏和DDC诱导胆管反应的肝脏中,CD63阳性的细胞共表达CK19(图1A-1C和图2A-2C)。
3、免疫组化染色:将经步骤1处理后的肝脏用0.3%双氧水(体积比)封闭30分钟,PBS-T洗三次,1%BSA室温封闭30分钟后,滴加用1%BSA稀释的鼠抗CD63抗体,4℃过夜。PBS-T洗涤三次,每次5分钟。切片上滴加用PBS-T稀释的HRP标记二抗(货号:sc-2005,购自Santa Cruz公司),37℃孵育30分钟,用PBS-T洗涤3次,每次5分钟。切片上滴加按说明书提供的方法新鲜配制的DAB染色液(货号:Kit-0014,福州迈新生物技术开发有限公司),镜下观察切片颜色变化,待颜色明显时,立即将片子放入自来水中冲洗,终止显色反应DAB显色后,苏木精(货号:H3136,购自Sigma)复染,脱水后封片。
结果显示CD63阳性的肝干细胞在肝脏中位于Hering’s管(图1D和图2D-1)和胆管腺(图2D-2)。
实施例2.CD63阳性肝干细胞的快速分离与扩增培养
1、两步法原位胶原酶灌注消化肝脏(Wang MJ1,Chen F,Li JX,Liu CC,Zhang HB,Xia Y,Yu B,You P,Xiang D,Lu L,Yao H,Borjigin U,Yang GS,Wangensteen KJ,He ZY,Wang X,Hu YP,Reversal of hepatocyte senescence after continuous in vivo cell proliferation,Hepatology.60(1):349-361.),消化混合物继续用0.25%胶原酶(货号:11088858001,购自Roche)在37℃孵育30分钟。
2、消化后的细胞悬液50g离心力低速离心30分钟两次,弃沉淀(大的肝细胞),收集上清液继续用300g离心力离心5分钟,用无血清DMEM培养基(货号:SH30022.01,购自Hyclone公司)重悬细胞,计数,将细胞稀释至107/ml,使用OptiPrepTM Density Gradient Medium(货号:D1556,sigma公司)分层液富集非实质细胞。
3、收集富集到的非实质细胞后,PBS洗两遍,无血清培养基重悬。使用抗小鼠CD16/32抗体(货号:101309,购自Biolegend公司)(每106细胞1ug抗体),4℃封闭10分钟。
4、4℃避光孵育CD63-PE抗体(货号:143904,购自Biolegend公司)(每106细胞0.5ug抗体),同时孵育CD11b-FITC(货号:11-0112,购自eBioscience公司),CD31(货号:CYT-31F2,购自Cytognos公司),CD45-FITC抗体(货号:553079,购自BD公司)(每106细胞0.2ug抗体),20分钟。用含有2%FBS的PBS清洗细胞三遍。
5、使用流式仪(流式细胞仪型号为Becton Dickinson FACs Calibur)分选,以获得PE阳性,FITC阴性的细胞。正常小鼠肝脏中CD63阳性的肝干细胞约为0.2%,DDC诱导胆管反应的肝脏中CD63阳性的肝干细胞约为0.5%(图3)。
6、接种500个流式细胞仪分选出的CD63+的肝干细胞至含SCM-A的培养基的96孔板中,37℃,5%CO2,95%湿度条件培养2周后,无论正常肝脏还是DDC诱导胆管反应的肝脏中的CD63阳性的肝干细胞均形成典型的上皮样克隆(图4)。
7、CD63阳性的肝干细胞在SCM-A的培养基的培养条件下显示出较强的增殖能力,其第30代细胞(P30)的增殖能力和第10代细胞(P10)的增殖能力无明显差异(图5)。
实施例3.CD63阳性肝干细胞分化为成熟肝细胞
1、按5×104细胞/cm2将CD63阳性的肝干细胞种于1型胶原包被的35mm培养皿,添加SCM-A培养基,于37℃、5%CO2培养箱中培养至细胞长满,其间隔天换液。
2、细胞长满后,更换肝向诱导培养基(DMEM/F12、10%FBS、10ng/ml HGF、10ng/ml EGF、10-7MDex、1%DMSO、10ng/ml OSM、20%Matrigel)继续培养6天,其间隔天换液。
3、CD63阳性肝干细胞诱导分化形成的成熟肝细胞的检测:收集诱导后形成的细胞提取RNA,Real-Time检测显示,干细胞和胆管细胞的标志物(Abcg2、CK19、Gja1、Ggt1)的表达量较诱导前显著下调,而肝细胞的标志物(Alb、Hnf4a、Cps1、Aat、Cyp7a1、G6P)的表达量较诱导前显著上升(图6)。PAS染色显示诱导后的细胞具有糖原储备的功能(图7),以上结果表明,在该诱导体系下,CD63阳性的细胞可被诱导分化为成熟肝细胞。
实施例4.CD63阳性肝干细胞分化为胆管上皮细胞
1、所用的溶液均放置于4℃预冷30分钟;
2、制备I型胶原凝胶溶液:I型胶原800ul,10×PBS 100ul,1N NaOH 20ul,ddH2O 80ul混匀,置于冰上。
3、将1ml胆管诱导培养液(DMEM、10%FBS、1x青链霉素、1x ITS、20ng/ml HGF、50ug/ml Gentamycin)重悬的5×104个CD63阳性的肝干细胞与上述配制的I型胶原凝胶溶液混匀,加入35mm培养皿内;
4、将培养皿置于37℃、5%CO2培养箱中培养2小时,等含有细胞的凝胶凝固;
5、向培养皿中加入1.5ml胆管诱导培养液,并将细胞持续培养9天(期间隔天换液)后细胞形成典型的分支样管样结构(图8)。分支样结构免疫荧光染色显示,诱导形成的分支样结构表达胆管细胞的标志物CK19和EpCAM(图8A和8B)。这些结果表明在胆向诱导条件下,CD63阳性的肝干细胞可被诱导分化为胆管上皮细胞。
实施例5.CD63阳性的肝干细胞治疗慢性肝细胞损伤模型小鼠
1、用绿色荧光标志CD63阳性的肝干细胞,将106个表达GFP基因的慢病毒颗粒(货号:12255,购自Addgene公司)加入至105个CD63阳性的肝干细胞培养皿中,病毒感染72小时后加入2ug/ml的嘌呤霉素(PURO)(货号:J593,购自Amresco公司)筛选一周,PURO筛选后的CD63阳性的肝干细胞全部表达GFP(图9)。
2、取8-10周龄体重正常的Fah基因敲除小鼠(Wang MJ1,Chen F,Li JX,Liu CC,Zhang HB,Xia Y,Yu B,You P,Xiang D,Lu L,Yao H,Borjigin U,Yang GS,Wangensteen KJ,He ZY,Wang X,Hu YP,Reversal of hepatocyte senescence after continuous in vivo cell proliferation,Hepatology.60(1):349-361.),超净台中麻醉,酒精消毒;
3、于腹腔左侧肋下打开腹腔,暴露脾脏;
4、将约106个标志GFP的CD63阳性的肝干细胞悬于100ul PBS中,用1ml微量注射器将细胞悬液进行脾脏注射;
5、小鼠缝合伤口后放回SPF级动物房继续饲养,其饮用水中撤去NTBC(2-硝基-4-三氟甲笨-1,3环乙烷碘,上述步骤2中Fah基因敲除小鼠出后,在其饮水中添加NTBC,用以抵制Fah基因缺失后引起的代谢毒物的堆积,免于小鼠发生肝损伤)。
6、细胞移植后第8周,收集小鼠肝脏及静脉血,并分析标志GFP的CD63阳性的肝干细胞在肝脏内的再殖情况和对肝脏损伤的治疗作用(具体实验方法见Wang MJ1,Chen F,Li JX,Liu CC,Zhang HB,Xia Y,Yu B,You P,Xiang D,Lu L,Yao H,Borjigin U,Yang GS,Wangensteen KJ,He ZY,Wang X,Hu YP,Reversal of hepatocyte senescence after continuous in vivo cell proliferation,Hepatology.60(1):349-361.)。肝脏切片的免疫荧光染色显示Fah基因敲除小鼠的肝脏肝板有来源于GFP阳性的肝干细胞的再殖(图10B),且这些再殖的细胞表达肝细胞的特异性基因Fah(图10A)和Alb(图10C)。同时小鼠静脉血的肝功能检测结果显示肝脏损伤的指标ALT、AST和Tbil较未进行细胞移植的Fah基因敲除小鼠明显下降,而肝脏合成Alb的能力有显著提升(图11)。以上结果表明CD63阳性的肝干细胞能够再殖于慢性肝细胞损伤的肝脏内分化为成熟肝细胞,并显示出治疗作用。
实施例6.CD63阳性的肝干细胞再植DDC诱导胆管损伤模型小鼠
1、DDC喂饲8-10周龄体重正常的野生型小鼠3天。
2、将106个表达GFP的CD63阳性的肝干细胞通过脾脏移植至DDC喂饲3天后的小鼠肝脏内,移植方法同实施例5。
3、移植后的小鼠继续喂饲DDC,3周后收集小鼠肝脏。
4、通过免疫荧光染色检测移植的表达GFP的CD63阳性肝干细胞在DDC诱导胆管损伤的小鼠肝脏内的再植情况(具体实验方法见Yu B,He ZY,You P,Han QW,Xiang D,Chen F,Wang MJ,Liu CC,Lin XW,Borjigin U,Zi XY,Li JX,Zhu HY,Li WL,Han CS,Wangensteen KJ,Shi Y,Hui LJ,Wang X,Hu YP,Reprogramming fibroblasts into bipotential hepatic stem cells by defined factors,Cell Stem Cell.13(3):328-340)。
染色结果显示在DDC诱导胆管损伤的小鼠肝脏内的胆管上有外源GFP阳性细胞的植入(图12A),且这些外源的GFP阳性的细胞表达胆管细胞特异性标志物CK19(图12B和图12C),以上结果表明CD63阳性的肝干细胞能够再植入DDC诱导胆管损伤的小鼠肝脏的胆管内并分化为成熟的胆管上皮细胞。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!