固定位置控制装置以及方法与流程
本发明涉及使用拉曼显微镜的生物分子检测中的固定位置控制技术。
背景技术:
作为本技术领域的背景技术,有与纳米细孔拉曼dna序列相关的专利文献1,在该公报中公开了以下技术:使生物聚合物进入到内径约10nm的纳米细孔中,通过向纳米细孔照射的激励光和存在于纳米细孔近旁的导电性薄膜而使通过纳米细孔的生物聚合物的拉曼散射光增大后,进行检测,由此对生物聚合物进行测定。因此,虽然也受激励光的照射光斑直径影响,但是需要将作为观察对象的部位以几十至几百纳米的精度连续保持于固定位置。
作为与这样的固定位置控制相关的技术,有专利文献2。此外,作为对温度变化所引起的位置偏离进行探测校正的技术,有专利文献3。
在先技术文献
专利文献
专利文献1:国际公开wo2012/043028a1
专利文献2:jp特开昭62-43050号公报
专利文献3:jp特开2003-172684号公报
技术实现要素:
发明要解决的课题
在专利文献1记载的技术中,激励光的照射光斑直径越大,激励光本身的漂移(drift)、作为测定部位的纳米细孔本身的漂移的影响就越轻微。但是,若照射光斑直径大则会有几个缺点。第一,由于也照射到测定部位以外的部位,所以噪声以及背景的信号会变大。第二,由于照射光斑大,所以会向导电性薄膜供给大量热,使导电性薄膜的寿命缩短,不能进行长时间测定,与此相对,若照射光斑小,则热容易向外部扩散。第三,在向多个纳米细孔进行照射的情况下,照射光斑越大则对激励光源需要越高的输出,就会需要大型且昂贵的设备。也就是说,照射光斑优选接近于生物聚合物所进入的纳米细孔的尺寸或者检测生物聚合物的尺寸。因此,需要高精度地将激励光、纳米细孔控制在固定位置。漂移的主要因素被认为是装置设置环境温度的变化。虽然受装置的构成、温度变化的影响,但是几μ米或者几纳米的漂移是在通常的生活环境的范围内进行漂移这一情况,能够很容易根据构成装置的材质的线膨胀系数来想象。因此,期望有避免这些漂移的功能。
在专利文献2记载的技术中,通过反复进行包含特定图案的一定区域的图案检测和测定,从而即使发生了漂移也能够通过校正功能再次进行最佳的位置处的测定,但是由于在进行一定区域的图案检测的期间不进行测定,所以图案检测时间中的样品测定数据会丢失。例如,在纳米细孔拉曼dna序列中,若在进行图案检测的期间有dna通过则该部分的数据就会丢失。结果,每单位时间得到的dna序列数据量减少,需要延长相应测定时间。进一步地,在dna通过过程中发生漂移并且为了校正进行图案检测的情况下,通过过程中的dna的数据仅能部分地解析,会丢失能够解析单分子的纳米细孔拉曼dna序列的特征。例如若在10,000碱基的dna序列测定过程中,在测定至5,000碱基时进行校正动作,则在该校正过程中剩余的5,000碱基会通过纳米细孔而无法测定。即使假定在校正前觉察到漂移而使dna的移动停止,由于惯性动作也不会突然停止,会产生不能测定的区域。
近年来,在单细胞水平,基因组序列决定、rna解析、表观基因组解析等的研究很活跃,对各细胞的差异、同一细胞的时间变化伴随的各种变化进行解析。已知各人的基因组序列有时按每个细胞而不同。特别地,若取出癌组织来解析基因组序列,则通常会得到正常细胞和癌细胞的混合物的数据。由于癌细胞本身也随时间逐渐发生变化,所以根据情况不同会得到多种混合排列数据。考虑若能按每一个细胞来决定癌组织的基因组序列,则针对癌的发生和增殖应该会得到更准确的理解,不断在进行研究。从这些目的出发,对于解析1细胞内的单分子的dna,拉曼纳米细孔dna测序仪是有价值的。
此外,专利文献3记载的技术由于需要位移检测单元、振动单元、加热冷却单元等与本来的测定目的不同的各种单元,所以装置变得复杂,成为高度控制、昂贵的装置。虽然为了减小作为漂移的主要因素的热所带来的影响,也存在对装置整体使用线膨胀系数小的不胀钢、金刚石作为选项,但是从价格、加工性来看并不现实。此外,虽然还存在增大热容量而使得难以受到环境温度的影响的方法作为选项,但会变大并且重量增加,这会导致为了架设装置而需要较大用地或者需要准备用于架设装置的高强度设备等,缺乏便利性。
本申请发明的目的在于,解决上述课题,提供一种能够在样品的观察的同时执行固定位置控制的固定位置控制装置及其方法。
用于解决课题的手段
为了达成上述目的,在本发明中,提供一种如下构成的固定位置控制装置,该固定位置控制装置具备:照射光学系统,能同时进行至少一个以上的激励光的照射;检测器,进行通过激励光照射而从照射位置产生的信号的检测;基板,设置至少一个纳米细孔和基准对象;以及位置控制部,向位于纳米细孔的测定样品和基准对象同时照射激励光,根据从基准对象得到的检测信号,运算激励光照射向测定样品的位置,并基于运算结果,将针对测定样品的激励光照射控制在固定位置,在进行激励光照射的位置控制的同时进行针对测定样品的测定。
此外,为了达成上述目的,在本发明中,提供一种固定位置控制方法,在该固定位置控制方法中,针对基板上的至少一个纳米细孔和至少一个基准对象,同时进行激励光的照射,基于从基准对象产生的信号,运算激励光照射向测定样品的位置,基于该运算结果来控制针对测定样品的激励光照射的位置,同时进行测定对象的测定。
发明的效果
根据本发明,通过同时进行测定和固定位置控制,能够短时间地进行解析。
附图说明
图1是表示实施例1涉及的纳米细孔拉曼dna测序仪装置的构成例的图。
图2是表示实施例1涉及的纳米细孔拉曼dna测序仪装置的检测部和观察容器的剖面构成的一例的图。
图3是表示纳米细孔拉曼dna测序仪装置的多纳米细孔基板的一例的图。
图4a是表示实施例1涉及的多纳米细孔基板的一例的图。
图4b是表示实施例1涉及的向多纳米细孔基板进行激励光照射的构成例的示意图。
图5是表示实施例1涉及的为了固定位置控制而扫描激励光后得到的结果的曲线图。
图6是表示实施例1涉及的反复进行固定位置控制的校正而得到的信号强度的曲线图。
图7是表示实施例2涉及的多纳米细孔基板的其他例的图。
图8是表示实施例2涉及的在x轴方向上扫描作为基准对象的硅单晶的结果的曲线图。
图9是表示实施例3涉及的多纳米细孔基板的其他例的图。
图10是表示实施例3涉及的在多纳米细孔基板配置高度不同的基准对象的例子的图。
图11是表示实施例4涉及的多纳米细孔基板的其他例的图。
图12是表示实施例5涉及的固定位置控制流程图的一例的图。
图13是表示实施例5涉及的固定位置控制事先设定用的画面显示例的图。
具体实施方式
以下,根据附图依次说明本发明的各种实施例。
实施例1
作为实施例1,说明以下结构的固定位置控制装置及其方法的实施例,该固定位置控制装置具备:照射光学系统,能同时进行至少一个以上的激励光的照射;检测器,进行通过激励光照射而从照射位置产生的信号的检测;基板,设置至少一个纳米细孔和基准对象;以及位置控制部,同时向位于纳米细孔的测定样品和基准对象照射激励光,根据从基准对象得到的检测信号,运算对测定样品照射激励光的位置,并基于运算结果,将针对测定样品的激励光照射控制在固定位置。
在本实施例中,例示使作为测定样品的生物聚合物进入到纳米细孔并检测拉曼光谱的纳米细孔拉曼dna测序仪装置的固定位置控制装置,进行以下的说明。即,是如下装置100的实施例:使生物聚合物进入到内径约10nm的纳米细孔中,通过向纳米细孔照射的激励光和存在于纳米细孔附近的导电性薄膜而使通过纳米细孔的生物聚合物的拉曼散射光增大后,检测拉曼光谱。
图1示出本实施例的纳米细孔拉曼dna测序仪装置的构成例。这里,以正立型显微镜为基本构成,以适于拉曼光的观察的情况为一例,来说明装置的构成和动作。另外,该装置构成并不限定于正立型显微镜的基本构成,例如在以倒立型显微镜为基本构成的情况等下,只要是能够进行基于照射光的样品的信号检测的构成即可。
在图1中,光源101照射能够产生荧光或者拉曼散射光的波长的外部光作为激励光。能够使用本技术领域中公知的光源101,例如半导体激光器、氪(kr)离子激光器、钕(nd)激光器、氩(ar)离子激光器、yag激光器、氮激光器、蓝宝石激光器等。在向多个纳米细孔照射来自该光源101的外部光作为激励光的情况下,使用多重照射机构113。作为该多重照射机构113,并不限定,但能够使用微透镜阵列、衍射光栅型分束器或者lcos(liquidcrystalonsilicon,硅基液晶)。在本实施例的装置中,如后面所说明的那样,使用这些构成,向纳米细孔以及基准对象照射多个外部光作为激励光。此外,为了从光源向显微镜观察容器照射外部光并使其收敛,优选与光源组合使用共焦透镜以及物镜102。将以上的光源101到物镜102的光学系统总称为照射光学系统。
显微镜观察容器103架设在xy台座104上,能够通过作为定位单元的xy台座104来调整水平面上的位置。关于垂直方向位置,通过z轴调整机构105来进行调整使得测定对象的样品位于由物镜102聚光的区域。z轴调整机构105也可以由xy台座104具有。作为定位单元,除了这些台座以外,也可以利用θ轴台座、测角台座来精密地调整。这些定位单元由驱动控制部115控制,驱动控制部115能够由使用者使用计算机116进行操作。
此外,如图1所示,作为装置构成,也可以组合与测定波长区域等测定目的相应的陷波滤波器、短通滤波器、长通滤波器等滤波器106、分束器107、衍射光栅108等。此外,还可以根据光学部品配置的需要而使用反射镜112、针孔、透镜114、nir(近红外)反射镜117。为了进行这样的荧光或者拉曼散射光的检测,能够适当选择优选的构成要素。
另一方面,进行通过激励光照射而从照射位置产生的信号的检测的检测器只要是能检测荧光或者拉曼散射光的检测器就能够使用任意的分光检测器。此外,为了防止伴随检测的高速化的灵敏度降低,检测器109优选具有光电子倍增机构,例如具有图像增强器。进一步地,检测器109优选具备能够直接记录拉曼散射光等的图像信息的大容量存储器,由此能够不经由电缆、电路板、计算机等,装置100内的解析装置118能够高速地进行解析。另外,解析装置118也可以还具备记录来自检测器109等的测量值的帧缓冲存储器。此外,解析装置118也可以构成为与用于对来自检测器109等的测量值进行数字化、运算处理并输出的计算机116连接。
进一步地,本实施例的纳米细孔拉曼dna测序仪装置100也可以具有能够进行明视场观察的功能。为此,如图1所示,使用led110作为明视场的照射光源,使用二维检测器111作为明视场摄像元件。能够根据所使用的显微镜观察容器中的样品的数目以及配置,使用一个或者多个一维或二维检测器111。作为那样的分光检测器,可以列举ccd(电荷耦合元件)图像传感器、cmos(互补性金属氧化膜半导体)图像传感器、其他高灵敏度元件(雪崩光电二极管等)的图像传感器等。
<观察容器的说明>
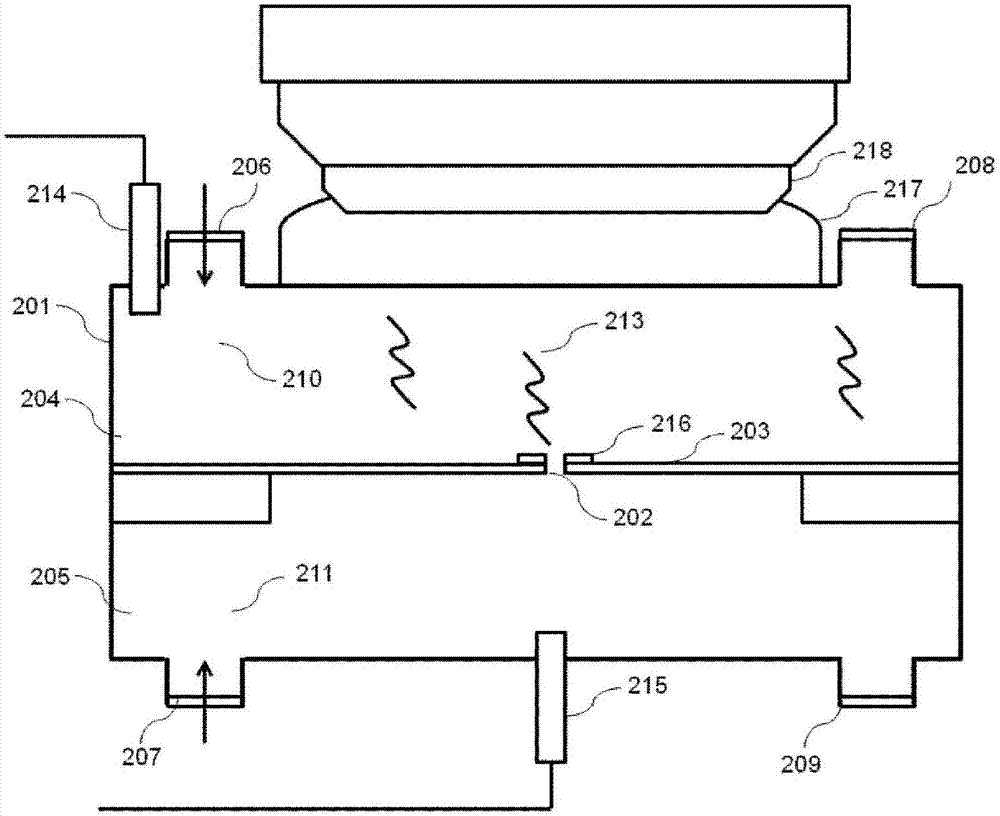
本实施例的装置100中使用的显微镜观察容器103如图2中示出一例剖面构成那样,由在其内部配置有基板203的观察容器201构成,基板203设置了至少一个纳米细孔203和在后面说明的基准对象。观察容器201隔着具有纳米细孔202的基板203由2个闭合的空间即样品导入分区204和样品流出分区205构成。其中,样品导入分区204和样品流出分区205由纳米细孔202连通。样品导入分区204以及样品流出分区205被经由分别与两分区连结的流入路径206、207导入的液体210、211充满。液体210、211从分别与样品导入分区204以及样品流出分区205连结的流出路径208、209流出。流入路径206和流入路径207可以设置在隔着基板203对置的位置,但并不限定于此。流出路径208和流出路径209也可以设置在隔着基板203对置的位置,但并不限定于此。
基板203具有基材、面向基材形成的导电性薄膜216、和设置于导电性薄膜216的将样品导入分区204和样品流出分区205连通的纳米细孔202,且配置在观察容器201的样品导入分区204与样品流出分区205之间。在本图中,在基板203省略了本实施例涉及的基准对象的图示。
图2中的213示出被观察的样品,214、215示出第1、第2电极。利用省略了图示的电压施加单元,在设置于样品导入分区204的第1电极214、设置于样品流出分区205的第2电极115之间施加电压。此外,也可以在这些电极间配置电流计。第1电极214与第2电极215之间的电流只要在决定样品的纳米细孔通过速度方面适当设定即可,例如,在使用不包含样品的离子液体的情况下,若是dna则优选100mv~300mv程度,但是并不限定于此。这些电极能够由金属例如铂、钯、铑、钌等铂族、金、银、铜、铝、镍等、石墨例如石墨烯(单层或者多层均可)、钨、钽等来制作。
作为因电极间施加电压而通过纳米细孔202的测定样品,生物分子聚合物因激励光会发出拉曼光,而在纳米细孔202近旁准备导电性薄膜216来产生近场,能够增强拉曼光。设置于纳米细孔近旁的导电性薄膜216如根据薄膜的定义而明确的那样,形成为平面状。导电性薄膜216的厚度根据所采用的材料,设为0.1nm~10nm,优选设为0.1nm~7nm。导电性薄膜的厚度越小,则越能够限定所产生的近场,越能够进行高分辨率且高灵敏度的解析。此外,导电性薄膜的大小并不特别限定,能够根据所使用的基板以及纳米细孔的大小、所使用的激励光的波长等来适当选择。
在本实施例的装置中,基板203能够由电绝缘体的材料例如无机材料以及有机材料(包含高分子材料)来形成。作为构成基板的电绝缘体材料的例子,可以列举硅(硅元素)、硅化合物、玻璃、石英、聚二甲基硅氧烷(pdms)、聚四氟乙烯(ptfe)、聚苯乙烯、聚丙烯等。作为硅化合物,可以列举氮化硅、氧化硅、碳化硅等氮氧化硅。特别地,构成基板的支撑部的基底(基材)虽然能够由这些任意的材料来制作,但是例如也可以是硅或者硅化合物。
基板203的尺寸以及厚度只要能够设置纳米细孔202则并不特别限定。基板可以利用本技术领域中公知的方法来制作,或者也可以作为市售品而得到。例如,基板能够使用光刻法或者电子束平板印刷术、以及蚀刻、激光器烧蚀、注射成型、铸造、分子束外延、化学蒸镀(cvd)、感应电破坏、电子束或者收敛离子束等技术来制作。基板为了避免目标外的分子吸附到表面,也可以进行涂敷。
<纳米细孔的说明>
在本实施例中,所谓“纳米细孔”以及“细孔”,是指纳米(nm)尺寸(即,1nm以上且不足1μm的直径)的孔(开口部),意思是贯通基板将样品导入分区与样品流出分区连通的孔。所谓纳米细孔或者细孔的孔,是指纳米细孔或者细孔与样品溶液相接的部分的纳米细孔或者细孔的开口圆。在生物高分子的分析时,样品溶液中的生物高分子、离子等从一个开口部进入到纳米细孔,从相同或者相反侧的开口部出去到纳米细孔外。本实施例的装置中使用的基板203通常具有至少1个纳米细孔202。纳米细孔具体来说设置于导电性薄膜216,但也可以根据情况,同时设置于作为基材的绝缘体。
通过在基板203上形成适于形成纳米尺寸的孔的材料以及厚度的导电性薄膜216,从而能够简便且高效地将纳米细孔202设置于基板。从形成纳米细孔的方面出发,导电性薄膜216的材料例如优选氧化硅(sio2)、氮化硅(sin)、氮氧化硅(sion)、金属氧化物、金属硅酸盐等。此外,根据导电性薄膜以及情况的不同,基板整体可以是实质上透明的。这里,所谓“实质上透明”,意味着能够透过大致50%以上的外部光,优选能够透过80%以上的外部光。此外,导电性薄膜216可以是单层,也可以是多层。导电性薄膜216的厚度是1nm~200nm,优选是1nm~50nm,更优选是1nm~20nm。导电性薄膜216能够通过本技术领域中公知的技术,例如通过低压化学气相沉积(lpcvd)而形成在基板203上。
进一步地,在导电性薄膜216上,还优选设置绝缘层。绝缘层的厚度优选是5nm~50nm。绝缘层能够使用任意的绝缘体材料,但例如优选使用硅或者硅化合物(氮化硅、氧化硅等)。
如上所述,纳米细孔的孔尺寸能够根据分析对象的生物高分子的种类来选择适当的尺寸。纳米细孔可以具有相等的直径,但是也可以根据部位而具有不同的直径。纳米细孔也可以与具有1μm以上的直径的细孔连结。设置于基板的导电性薄膜216的纳米细孔的最小直径部即该纳米细孔所具有的最小的直径是直径100nm以下,例如是1nm~100nm,优选是1nm~50nm,例如是1nm~10nm,具体来说是1nm以上且5nm以下,优选是3nm以上且5nm以下等。
作为测定样品213的一例的ssdna(单链dna)的直径是约1.5nm,用于分析ssdna的纳米细孔直径的适当范围是1.5nm~10nm程度,优选是1.5nm~2.5nm程度。作为其他例的dsdna(双链dna)的直径是约2.6nm,用于分析dsdna的纳米细孔直径的适当范围是3nm~10nm程度,优选是3nm~5nm程度。在将其他的生物高分子例如蛋白、多肽、糖链等作为样品而设为分析对象的情况下也同样地,能够选择与生物高分子的外径尺寸相应的纳米细孔直径。
纳米细孔的深度(长度)能够通过调整基板203或者导电性薄膜216的厚度来调整。纳米细孔的深度优选设为构成分析对象样品的生物高分子的单体单元。例如在选择核酸作为生物高分子的情况下,纳米细孔的深度优选设为碱基3个以上的大小,例如约1nm以上。纳米细孔的形状基本上是圆形,但也可以设为椭圆形、多边形。
纳米细孔能够在基板设置至少1个,在设置多个纳米细孔的情况下,可以按规则地排列。纳米细孔能够通过本技术领域中公知的方法,例如通过照射透射型电子显微镜(tem)的电子束,使用纳米光刻技术或者离子束光刻技术等来形成。
<导电性薄膜的说明>
若导电性薄膜216不是平面状而是存在弯曲等,则在该弯曲部感应近场致使光能漏出,在目标外的场所产生拉曼散射光。即,背景光增大,s/n降低。因此,导电性薄膜216优选是平面状,换言之,优选剖面形状是没有弯曲的直线状。将导电性薄膜形成为平面状不仅具有减轻背景光、增大s/n比的效果,从薄膜的均匀性、制作上的重现性等观点来看也优选。
导电性薄膜的形状只要是能够通过照射外部光而产生近场并进行增强的形状,则能够设为任意的形状。产生这样的近场的探头在本技术领域中是公知的,例如,已知能够通过针尖增强拉曼散射(ters)来产生近场并使其增强而成为增强场的具有锐角的端部的形状、金属领结构造等。作为导电性薄膜的优选的平面形状的一例,可以列举具有锐角的端部的形状,特别优选面向纳米细孔来设置该端部。在该情况下,该端部的角度设为10~80度,优选设为20~60度,更优选设为20~40度。关于用于形成这样的近场光的导电性薄膜(光散射体)的优选的形状,例如请参照jp特开2009-150899号公报。另外,导电性薄膜的端部的顶点部分可以不是严格意义上的点,也可以是具有一定以下优选是10nm以下的曲率半径的带有圆形的形状等。作为锐角的端部以外的导电性薄膜的形状,能够采用比端部的顶点的角度更钝的角。但是由于在角的部分感应近场而导致光能漏出,所以对于面向纳米细孔的锐角的端部以外的部分,优选极力避免复杂的形状,采用无角的圆形、直线状等。此外,导电性薄膜的整体的形状只要具有锐角的端部,则能够设为任意的形状,可以设为三角形、四边形以及五边形等多边形、扇形、圆形和三角形的合成形等。
另一方面,作为导电性薄膜的形状,还可以采用金属领结(bow-tie)构造。即,配置圆形、椭圆形或者多边形的2个导电性薄膜使得该形状的凸部彼此对置。关于这样的金属领结构造,例如请参照美国专利第6,649,894号。金属领结构造还可以视为在形成近场的区域插入间隙(开口)的构造。通过间隙的插入而导入各向异性,从而改善检测灵敏度。针对这样的技术的说明例如请参照美国专利第6,768,556号以及美国专利第6,949,732号。
将导电性薄膜的至少一部分,特别优选将导电性薄膜的产生近场的端部等构造面向纳米细孔来设置。对于导电性薄膜来说,只要将其至少一部分,特别优选将其端部面向纳米细孔来设置,则既可以配置在固体基板的表面上,或者也可以配置在固体基板之间。例如,能够在固体基板的表面上面向纳米细孔的开口部来配置。或者,能够在固体基板上的纳米细孔的中心轴方向上的大致中间的位置(深度)配置导电性薄膜。在该情况下,导电性薄膜优选成为由固体基板的薄膜部分相夹的构造。由此,由于近场形成在纳米细孔的中心轴方向(深度方向)的中间附近,所以能够在对生物聚合物的形状和移动速度进行控制的同时在纳米细孔内产生生物聚合物的拉曼散射光,从而能够高精度且高灵敏度地进行解析。另外,在将导电性薄膜配置在固体基板的情况下,优选考虑所照射的外部光的偏振方向来配置。
此外,导电性薄膜只要针对各纳米细孔至少配置1个即可,可以是奇数,也可以是偶数。例如,导电性薄膜可以针对各纳米细孔配置1个、2个、3个、4个或者更多。如后述的实施例所记载的那样,若导电性薄膜存在多个,则会形成强的光的场,故优选针对各纳米细孔配置2个以上的导电性薄膜。或者,导电性薄膜也可以将上述的形状作为1个单位,设为具有多个单位的一个薄膜。
导电性薄膜能够由具有导电性或者光散射特性的材料来形成。作为那样的材料,可以列举金属例如铂、钯、铑、钌等铂族、金、银、铜、铝、镍等和石墨例如石墨烯(单层或者多层均可)等。
在此,讲述配置多个导电性薄膜尤其是连结配置的情况下的注意点。在将多个导电性薄膜连结来配置的情况下,在作为连结的结果的导电性薄膜的整体的形状方面,需要其至少一部分,特别优选是需要其面向纳米细孔的部分的形状具有锐角的端部。若在纳米细孔附近连结多个导电性薄膜,则该锐角的端部有可能消失,但是由于端部对于近场的有效的形成来说是必要的,因此不得不避免该消失。相关联地,在使用1个导电性薄膜的情况下,若将其以包围纳米细孔的整周的方式来配置,则有可能会发生同样的不良状况。也就是说,因激励光而在导电性薄膜上感应的电荷会在通过环绕纳米细孔的整周的导电性薄膜而迂回,有可能会产生无法在纳米细孔部分形成偶极子这样的不良状况。因此,生物聚合物的特性解析芯片中的至少1个导电性薄膜仅配置于固体基板的形成纳米细孔的一部分而并非配置于纳米细孔的整周为宜。
导电性薄膜216优选其端部面向纳米细孔的开口部来配置。更具体来说,将导电性薄膜在与纳米细孔中心轴正交的面内且使薄膜的端部面向纳米细孔的开口部来配置。此外,在配置至少2个导电性薄膜的情况下,优选这些导电性薄膜隔着纳米细孔的开口部彼此对置配置。在这样的情况下,通过向导电性薄膜照射外部光,从而在导电性薄膜面向纳米细孔的端部产生近场,产生进入纳米细孔的生物聚合物的拉曼散射光。
导电性薄膜能够通过本技术领域中公知的方法来制作,并配置于固体基板。例如,在由银来形成导电性薄膜的情况下,能够在通过溅射在基板形成了期望的厚度的银薄膜后,通过电子束来形成期望的形状。此外,在由单层的石墨烯来形成导电性薄膜的情况下,能够将由石墨制作的石墨烯载置于支持基板,照射电子束来形成期望的形状的石墨烯。
通过向本实施例的装置中的解析芯片照射外部光,从而能够激励进入到纳米细孔中的生物聚合物而产生拉曼散射光,基于该拉曼散射光的光谱能够解析生物聚合物的特性。由于所形成的近场的厚度基本上与导电性薄膜的厚度是相等的,即导电性薄膜与纳米细孔的中心轴正交,所以所形成的近场的中心轴方向的厚度与导电性薄膜的厚度是相同程度。因此,通过使用本实施例的解析芯片,能够以高空间分辨率且高灵敏度地解析生物聚合物。
<测定动作的说明>
图2所示的液体210是包含成为分析对象的样品213的样品溶液。除样品213以外,液体210优选仅包含最好含有大量成为电荷的载体的离子的离子液体。作为离子液体,优选溶解了电离度高的电解质的水溶液,能够适宜使用盐类溶液,例如氯化钾水溶液等。样品213优选在离子液体中具有电荷。样品213典型而言是生物高分子。
由于针对电极214、215的电压施加,具有电荷的样品213从样品导入分区204通过纳米细孔202而移动到样品流出分区205。在样品213通过由激励光照射的纳米细孔202时,对于由导电性薄膜216增强的拉曼散射光谱而由液浸介质217有效地将拉曼光聚光,在通过与图1的物镜102对应的物镜218后到达检测器109而被解析。
图3示出一般使用的多纳米细孔基板的一构成例。如图3所示,在基板301上设置有多个纳米细孔302和导电性薄膜303。这些与图2的纳米细孔202、导电性薄膜216对应。纳米细孔302以及导电性薄膜302虽然呈格子状设置有20个,但并不限定于此。对于多纳米细孔基板301也通过多重照射机构113对纳米细孔302照射激励光,并由图2中说明的探测器109来检测。
<使用基准对象的测定的说明>
由于一般的装置设置环境的温度变化、构成台座驱动的电动机的热所引起的温度变化等,有时会发生上述的激励光的漂移、观察容器的漂移,导致照射光不正确地向纳米细孔照射,从而得不到期望的信号。因此,在本实施例的纳米细孔拉曼dna测序仪装置中,使用图4a所示的具备基准对象的基板。图4a的多纳米细孔基板401除了具有多个纳米细孔402和导电性薄膜403以外,还具备作为基准对象的基准物质404、405、406,通过使用该多纳米细孔基板401,从而能够不受观察时的环境变化影响地得到期望的信号。纳米细孔402、导电性薄膜403分别与图2的纳米细孔202、导电性薄膜216对应。这里,所谓的多纳米细孔基板上的基准对象,意味着成为用于排除上述的温度变化等所引起的漂移的影响的基准的对象。
在本实施例的装置中,首先将包含多纳米细孔基板401的观察容器201架设于装置100。如图4b中示意性示出的那样,在架设后利用多重照射机构113、物镜218等照射光学系统,使多个激励光照射到多纳米细孔基板401的位置与纳米细孔402的位置一致。作为该初始阶段中的对准位置的方法之一,在照射激励光的同时驱动xy台座104等各种台座,检测从作为基准对象而例示的基准物质405、406、纳米细孔402发出的拉曼散射光。为此,需要事先进行设计或者位置调整,以使得多纳米细孔基板401上的纳米细孔402、基准物质404-406的配置与多个激励光的照射配置一致。检测并不限定于拉曼散射光,也可以将荧光物质设为基准物质404-406来检测荧光。优选为能得到对于检测来说充分的信号的物质。例如也可以将能够作为市售品而得到的、发出荧光的微珠固定于多纳米细孔基板401来进行处理。
另外,在初始阶段中用于位置对准的信号检测也可以检测从多纳米细孔以及导电性薄膜得到的信号而并非作为基准对象的基准物质404-406。在该初始阶段中,作为观察对象的样品未被混合在溶液中,充满了观察容器201溶液也具有拉曼散射光,能够与样品同样地得到由导电性薄膜增强的信号,因此也可以利用该信号来进行高精度的初始阶段中的位置对准。
此外,也可以使用光刻技术以及微细加工技术,在基板上形成作为基准对象的硅单晶的构造体,检测该硅单晶的拉曼散射光。粘贴了平坦的单晶薄膜的基板也一般会有市售,也能够制造规定了厚度(即构造体的高度)的基板。此外,并不限于硅而将单晶这样的规定了晶体取向面的材料或不限于单晶而将能够重现性良好地得到拉曼散射强度的绝对值的平坦且均质的材料进行成膜或者粘贴之后,从其上,使用光刻技术进行图案形成,并通过微细加工技术将这些材料加工成作为基准对象的构造体,则不仅可以用于位置调整,还可以作为拉曼散射光的强度基准来使用。用于将这样的规定了位置和拉曼散射强度的构造体配置为基准对象的布局图案,可以使用与在形成纳米细孔时所使用的相同的相对定位单元,例如构造体形成用的对准标记等,或者使用不需要多个布局的对准的一并形成法来形成,所以能够高精度地将纳米细孔和基准对象配置在多纳米细孔基板上。
进一步地,即使在纳米细孔402的形成位置和作为基准对象的基准物质404-406的材料不同的情况下,只要预先在多纳米细孔基板401上设置不同材料的表面区域,在上面利用光刻技术来形成微细加工用的掩模并对其进行加工,则也可以制造高精度地配置了与纳米细孔的功能相关的构造体、和规定位置以及拉曼散射强度的其他材料的构造体即基准对象的基板。这里,虽然以硅单晶为例来说明,但是并不限定于此。只要是能给出在想要检测的波数范围内具有峰值的光谱的材料即可。例如也可以选择氧化钼、氧化钨、氧化铝、氧化锌、氧化锡、氧化钛、碳化硅等能够在基板上进行成膜以及加工的材质等。
以上,记载了使用光刻技术以及微细加工技术来准备基准对象的手段,但是并不限定于此。还设想了根据材料的不同而加工困难的情况。例如,也可以在基板上整体对基准物质的材料进行成膜,之后,用容易加工的材料覆盖基准物质,通过修边等使仅覆盖了想要得到信号的大小、范围的部位露出,从露出的部位检测荧光、拉曼光。
图5示出在本实施例的构成中使用硅单晶作为位置对准的基准对象的一例、使用作为位置控制部的一部分而发挥作用的驱动控制部115对基准对象进行xy轴方向扫描的结果。此时,扫描的轴不限定于利用xy台座104的xy方向,也可以实施利用了z轴调整机构105的z轴方向的扫描,还可以实施θ轴方向的扫描或利用测角台座来实施倾斜方向的扫描。并不仅是对xy轴进行整体扫描,扫描的方法也并不限定。根据通过各轴的移动和照射来检测信号的动作的结果,能够移动到得到最强信号的坐标位置,从而能够从得到最强信号的坐标轴开始测定。
虽然较为理想的是在扫描后的位置开始测定,到测定完成为止想要在相同的坐标轴得到期望的信号,但是如前所述,由于构成装置的xy台座104等的台座电动机、检测器的排热、环境的温度变化而在测微计或者纳米仪的范围内会发生漂移。因此,在本实施例的装置中,与开始混合了样品的液体210的测定一起检测来自纳米细孔402的信号,同时也由作为位置控制部的一部分而发挥作用的驱动控制部115进行作为基准对象的基准物质404-406的扫描动作,并使用检测器109的检测信号,通过作为位置控制部的一部分而发挥作用的计算机116或者解析装置118,来运算扫描后信号最强的坐标轴。以释放该最大信号强度的坐标轴为中心,在作为位置控制部的一部分而发挥作用的驱动控制部115的控制下,再次进行扫描。此时,进行扫描的范围根据初始的定位时得到的图5所示的坐标轴和信号的结果,控制为在得到最低限度所需的信号的范围之中进行扫描。通过该操作,从而能够始终进行固定位置控制使得持续得到最低限度所需的检测信号。
换言之,包含驱动控制部115、计算机116等的位置控制部针对测定样品以及基准对象的位置,对激励光的光斑位置进行扫描,根据从基准对象得到的信号,运算测定样品被强烈照射激励光的位置,并根据运算结果将针对测定样品的光斑位置控制在期望的位置。
另外,作为使用混入了样品的液体的样品测定中的位置控制用的信号,若假定为利用来自纳米细孔的信号,则作为该信号,会检测出作为溶媒的液体本身的信号与作为时而通过纳米细孔的观察对象的样品即生物聚合物的信号混合的信号,从而成为误差的原因,所以在本实施例的装置中,在样品的测定的执行中,仅使用来自作为基准对象的基准物质的检测信号,实施基于位置控制部的固定位置控制的扫描。
样品测定中的固定位置控制用的扫描范围也可以使用扫描了在产品出厂前等事先试验过的基准物质或者纳米细孔的坐标轴和信号的结果来决定。优选是,利用从在测定即将开始之前的初始阶段进行该基板的位置对准时使用的基准物质得到的信息,但更优选是利用在初始阶段中的位置对准时从纳米细孔位置得到的信息,来决定得到最低限度所需的信号的范围。
作为使用位置控制部来进行样品的测定中的扫描的时间间隔,可以始终反复进行扫描,但也可以以一定间隔来实施。图6示出使用本实施例的装置,以2分钟间隔扫描直径700nm、高度220nm的作为基准对象的圆柱型硅单晶,同时进行拉曼光测定,并基于扫描结果来反复进行校正而得到的样品的信号强度的一例。这是在装置刚刚启动之后的电动机等产生热而容易发生温度漂移的条件下进行了测定。同时也测定了装置内的温度,确认了即使发生图中所示的温度变化,相对于将测定开始时的信号设为100%时,也始终保持80%以上的信号。另一方面,不进行本实施例的固定位置控制的校正动作而进行了装置刚刚启动之后的拉曼光的测定,结果如图6所示,约5分钟后成为80%以下的信号强度,之后随时间经过而观测到信号的减少。
此外,驱动控制部115等的位置控制部的固定位置控制用的扫描的间隔并不限制为以一定的时间间隔来进行。例如,可以在装置100内、装置外或者排热部位等设置温度传感器,在温度传感器示出某一定范围外的温度时或发生了平均每小时的温度变化时,进行上述的位置控制部所进行的固定位置控制用的扫描动作。即,位置控制部通过规定的温度变化的检测,开始固定位置控制用的激励光的光斑位置的扫描,将前述光斑位置控制为期望的位置。
此外,作为进行上述的位置控制部的扫描的台座驱动的方法,可以对xy轴均匀地进行整体扫描,但也可以仅对测定开始点的x轴在上述的必要范围内进行扫描,并移动到得到最大信号强度的x坐标轴,接着仅对y轴在上述的必要范围内进行扫描,通过反复进行这样的操作,从而缩短扫描时间。此时,与位置对准同样地,扫描的台座驱动轴并不限定于xy,可以实施z轴方向的扫描、θ轴方向的扫描或利用测角台座实施倾斜方向的扫描。
通过上述的本实施例的固定位置控制的动作,从而能够控制多个激励光照射于基板的位置和多纳米细孔的位置,能够始终从多纳米细孔得到最低限度所需的信号。
另外,这里得到的信号由于是拉曼光或荧光,所以具有物质固有的光谱。例如,若是硅单晶,则可得到在520cm-1具有峰值的光谱。因此,也可以使用该物质固有的光谱来校正检测器本身的漂移(位置偏离)。即,能够使用作为基准对象的基准物质的光谱,来校正检测器的位置或者检测器的图像元件的信息。例如在检测器109发生了漂移的情况下,作为基准对象的硅单晶的拉曼光不是由表示520cm-1的位置例如二维的检测面上的规定的图像元件检测到,而是由漂移后的位置例如表示540cm-1的位置的图像元件检测到。也就是说,样品不是在本来可获得的波数位置得到峰值,而是在不同的波数位置检测出峰值或者探测为弱的峰值。
但是,由于使用硅单晶作为基准物质是显而易见的,因此能够使用检测器的各图像元件的检测信号,基于发生漂移得到的基准物质的峰值来校正上述的漂移。也可以在测定开始时将检测器得到基准物质的信号的位置作为规定的图像元件的信息预先进行存储,根据得到了从漂移后的位置的图像元件得到的基准物质的信号的位置来计算漂移量,并使用省略了图示的检测器109本身所具备的驱动机构来校正漂移的距离。校正单元并不限定于驱动机构,可以使用其他单元。
如图4所示,在本实施例的装置中,在阵列化的纳米细孔402的端部准备多个基准物质404-406。结果,利用在检测器109得到各基准物质的峰值作为多个点的情况,再次计算并校正捕捉到峰值的各图像元件的位置的信息和波数信息。因此,若使用得到多个峰值的物质,则能够进行更高精度的校正,所以也可以将这样的物质用作基准物质。这里,示出了使用硅单晶的拉曼光的例子,但是并不限定于此,也可以使用发出拉曼光的其他材料、荧光物质的荧光。
通过以上所示的本实施例的构成,无需新准备高精度地控制环境温度、装置内的温度的机构,便能够将激励光的照射位置控制在固定位置。此外,也无需新准备检测位置的位移的机构就能够控制在固定位置。进一步地,通过使用至少一个以上的基准物质,从而无需对检测器准备新的驱动机构,就能够将检测器本身控制在固定位置。也就是说,根据本实施例,通过在形成了纳米细孔的基板配备作为基准对象的基准物质,从而能够将纳米细孔拉曼dna测序仪装置的激励光的照射位置控制在固定位置,进行高精度的信号检测。
实施例2
实施例2是能够进一步抑制信号的衰减来执行固定位置控制的扫描的装置的实施例。图7是表示在本实施例中具备进一步抑制信号的衰减的基准物质704、705、706的多纳米细孔基板701的构成图的例。本实施例的多纳米细孔基板701也与实施例1同样地使用图1所示的纳米细孔拉曼dna测序仪装置,使作为样品的生物聚合物通过纳米细孔,来检测生物聚合物。此时,在本实施例中,在使用图4b所示的照射光学系统向纳米细孔702以及导电性薄膜703照射的激励光的光斑直径与同时向基准对象照射的光斑直径相等时,配置相对于纳米细孔位置处的样品的直径而言较小直径的基准物质704-706。由此,能够有效地抑制信号的衰减来执行固定位置控制用的激励光的扫描。此外,在激励光的光斑直径小于样品以及基准物质的直径时,使向基准物质照射的激励光光斑直径比向测定样品照射的激励光光斑直径大。
图8中作为一例而示出在包含直径700nm和直径150nm且高度220nm的两种圆柱型硅单晶的中心位置的x轴方向上扫描的信号的检测结果。如图8所示,直径小的圆柱型硅单晶,从中心位置偏离时的信号的衰减大而显著。例如,在纳米细孔位置被照射激励光的样品的直径即增强场的直径设为直径700nm时,若使用直径150nm的硅单晶作为基准物质,则来自基准物质侧的信号的衰减显著,因此能够抑制样品的信号的衰减来扫描。若扫描的范围取得过广,则会较大丢失样品的信号,与此相对,来自直径小的基准物质侧的信号的衰减显著,所以利用即使激励光的扫描的范围较窄也能够检测到期望的位置的情况,能够不丢失样品的信号地检测基准物质的信号的衰减,从而能够准确地检测出期望的位置。作为一例,虽然列举硅单晶,但是并不限定于此,只要是能给出在想要检测的波数范围内具有峰值的光谱的材料即可。例如也可以选择氧化钼、氧化钨、氧化铝、氧化锌、氧化锡、氧化钛、碳化硅等能够在基板上进行成膜以及加工的材质等。或者使用荧光物质也是同样。
说明了通过使基准物质的直径相对于测定样品较小来抑制信号的衰减,但是并不限定于此。激励光所照射的光斑直径也优选向基准物质照射的光斑直径小于向样品照射的光斑直径。即,也可以向基准物质照射光斑直径比向测定样品照射的激励光的光斑直径小的激励光。一般使用透镜等来缩小激励光的照射光斑,但是由于原理上无法将照射光斑缩成波长以下的大小,所以能够将图4b中示出其一例的照射光学系统的一部分进行变更,设为以下构成:通过向基准物质照射波长比向样品照射的波长短的激励光,从而减小照射光斑,使来自发生了漂移时的基准物质的信号的增减变得显著来高灵敏度地检测漂移。即,能够使用波长比针对测定样品的激励光的波长短的激励光,来向基准物质照射比样品小的激励光光斑直径。
此外,一般,设置于光轴上的针孔、或者孔径变大的被摄景深度会变深。若利用该现象,相对于设置于样品的光轴上的针孔,缩小设置于基准物质的光轴上的针孔,则对于与基准物质的光轴垂直的方向(图1、图4中的z轴方向)上的漂移,信号的增减变显著,所以能够高灵敏度地进行漂移检测。
通过以上所说明的使本实施例的基准对象的直径小于纳米细孔位置处的样品的直径等的构成,能够更高灵敏度地检测漂移,从而高精度地进行固定位置控制。
实施例3
实施例3是能够进一步抑制信号的衰减来高精度地进行固定位置控制的装置的实施例。在实施例1以及2中,示出了如下构成,即,即使由于例如装置内的温度变化等而发生了漂移,也通过固定位置控制用的激励光扫描来探测漂移的方向,并通过在漂移方向上进行校正来抑制信号的衰减。在本实施例中,不是通过扫描来探测漂移的方向,而是根据多个激励光的照射位置和纳米细孔以及基准对象的位置偏离时的信号变化来运算漂移方向和漂移量并进行校正。
图9是表示本实施例中的具备作为基准对象的基准物质902、905的多纳米细孔基板900的一例的俯视图。配备了多个的纳米细孔904与实施例1以及2同样地,使用图1所示的纳米细孔拉曼dna测序仪装置100,使作为样品的生物聚合物通过纳米细孔904,来检测生物聚合物。本实施例也与实施例1同样地,首先将包含多纳米细孔基板900的观察容器201架设于装置。在架设后使用图4b中示出其一例的照射光学系统等,使多个激励光同时照射于多纳米基板900的位置901与多纳米细孔904的位置对准。作为对准位置的手段之一,在向多纳米细孔基板900照射激励光的同时,驱动各轴各种台座104等,检测从基准物质902发出的拉曼散射光,将拉曼散射光的信号强度和台座位置信息存储在计算机116或解析装置118的存储介质等中。因此,在本实施例中,也需要事先进行设计或者位置调整,以使得多纳米细孔基板900上的纳米细孔的配置与多个激励光的照射配置匹配。检测并不限定于拉曼散射光,也可以将荧光物质设为基准物质来检测荧光。
在本实施例中,在多纳米细孔基板900中,照射光斑901对准从各纳米细孔904得到的信号成为最大的位置,将基准物质902配置在从发出最大信号的位置错开的位置。基准物质902也可以事先配置在从照射光斑错开的位置处。或者,也可以将照射向基准物质902的照射光斑的位置错开。图9所示的4个基准物质中,基准物质902配置于在y轴方向上错开的位置处,根据在y轴方向上错开的情况下信号增加的情况以及所检测出的检测器109的图像元件的位置信息来识别漂移的方向。进一步地,根据在初始的位置对准时实施的扫描动作的结果的台座位置信息与信号强度的关系、和基准物质902在漂移时产生的信号强度的增加,来计算漂移量。能够基于所计算出的漂移方向和漂移量通过台座驱动来进行向从纳米细孔得到最强信号的位置的校正动作。此时,通过将其他3个基准物质配置在与基准物质902不同的位置(向量),能够高精度地校正各方位的漂移。
在图9的配置构成中,将基准物质的位置错开的幅度根据想要检测的漂移量来决定。在想要高灵敏度地进行检测的情况下,例如若以图8所示的扫描结果作为参考则使用硅的单晶作为基准物质,若将直径150nm的硅的单晶配置在从中心位置错开例如200nm的位置处,则能够通过信号的增减来估算漂移量。
图10是表示在本实施例的装置中为了检测z轴方向的漂移而将作为基准对象的基准物质1001、1002配置于多纳米细孔基板1000的一例的图。该基准物质1001、1002与图9的俯视图所示的2个基准物质905对应。例如,将基准物质1001的高度准备为与多纳米细孔904成为信号最强的位置相同的高度时,将基准物质1002配置在比基准物质1001高的位置,即提高高度来配置。结果,在所检测的样品在z轴方向上向上升的方向漂移了的情况下,基准物质1001的信号下降,基准物质1002的信号上升。另一方面,在样品向下降的方向漂移了的情况下,基准物质1001、1002双方的信号下降。这里,基准物质1001、1002优选设为大至即使在xy轴方向上发生了漂移也不会使信号强度受到影响的程度的尺寸的直径。由此,能够通过各基准物质的信号的增减来识别并校正z轴的漂移方向。
配置基准物质的位置并不限定于如上述那样配置。例如,也可以将基准物质1002配置在比基准物质1001低的位置。或者,也可以双方基准物质都不准备成与多纳米细孔904成为信号最强的位置相同的高度,一个基准物质配置于比多纳米细孔904成为信号最强的位置低的位置,另一个基准物质配置于比多纳米细孔904成为信号最强的位置高的位置。也就是说,在各轴方向上错开配置的基准物质1001、1002至少配置在能够检测出想要检测的z轴的漂移量的位置。
作为一例,列举了硅单晶作为基准对象,但并不限定于此,只要是能给出在想要检测的波数范围内具有峰值的光谱的材料即可。例如也可以选择氧化钼、氧化钨、氧化铝、氧化锌、氧化锡、氧化钛、碳化硅等能够在基板上进行成膜以及加工的材质等。或者使用荧光物质也是同样。
实施例4
实施例4是根据激励光的照射位置和纳米细孔的位置偏离时的信号变化来运算漂移方向和漂移量并进行校正的其他构成的实施例。作为运算漂移方向和漂移量并进行校正的其他构成,在本实施例中,与图9所示的多纳米细孔基板900的构成不同,如图11所示那样,具备如下构成,即,相对于照射光斑位置,基准物质被配备在想要检测的漂移方向上的偏离的位置并且其信号根据漂移而变化。
在本实施例中,使用图11所示的多纳米细孔基板1100的构成。配备了多个的多个纳米细孔1102与实施例1-3同样地,使用图1所示的纳米细孔拉曼dna测序仪装置,使作为样品的生物聚合物通过纳米细孔1102,并检测生物聚合物。在本实施例中,也首先将包含多纳米细孔基板1100的观察容器201架设于装置100。在架设后使多个激励光照射于基板1100的位置1101与多纳米细孔1102的位置对准。作为对准位置的手段之一,在向多纳米细孔基板1100照射激励光的同时驱动各轴各种台座,检测从基准物质发出的拉曼散射光,由计算机116、解析装置118等存储拉曼散射光的信号强度和台座位置信息。因此,需要事先进行设计或者位置调整,以使得多纳米细孔基板1100上的纳米细孔1102的配置与多个激励光的照射配置匹配。检测并不限定于拉曼散射光,也可以将荧光物质设为基准物质来检测荧光。
在图11的多纳米细孔基板1100中,照射光斑1101对准从各纳米细孔1102得到的信号成为最大的位置。长方体基准物质1104、1105配置在从发出最大信号的位置例如从照射光斑的中心错开的位置。例如,长方体基准物质1104的中心相对于照射光斑的中心在x轴方向上偏离,在y轴方向上具有长边。长方体基准物质1105是中心相对于照射光斑在y轴方向上偏离且在x轴方向上具有长边的长方体。若是基准物质1104,则配置于在y轴方向上错开的位置,根据在x轴方向上偏离的情况下信号增减的情况和检测到信号的检测器109的图像元件的位置信息来识别漂移的方向,若是基准物质1105,则配置于在x轴方向上错开的位置,根据在y轴方向上偏离的情况下信号增减的情况和检测到信号的检测器109的图像元件的位置信息来识别漂移的方向。进一步地,期望将在y以及x轴方向上具有长边的长方体基准物质1104、1105分别架设至少2个以上。更优选的是,若配置于比成为检测部位的纳米细孔1103更靠外侧,则在发生了旋转方向的漂移时,相比于内侧的纳米细孔而外侧的基准物质会较大地发生漂移,因而能够通过进行外侧的基准物质1104、1105的校正从而更准确地校正向位于内侧的纳米细孔1102的照射。
基准物质1106的高度或者厚度,与在z轴方向上设计为不同高度的实施例3中所示的基准物质905同样地配备。这些基准物质事先配置在铅垂方向上从照射光斑错开的位置,基于信号的增减来检测z轴方向的漂移。也可以使用多个这些基准物质1106,来检测所进行测定的基板1100的倾斜度。例如也可以如图11所示在四角配置基准物质1106,基于四个信号的增减来检测倾斜度的朝向,通过倾斜度调整用的台座或者驱动机构来进行校正以保持平面。
根据本实施例,不仅能够检测这样的xyz轴方向的漂移,还能够检测旋转方向。例如,如图11所示,在基板的两端配置长方体基准物质1105。通过配置为长方体基准物质1105的中心相对于照射光斑的中心在y轴方向上偏离,并在x轴方向上具有长边,从而能够检测旋转方向的漂移。在基板顺时针漂移的情况下,从两个长方体基准物质1105得到的信号同时衰减。根据该现象,探测到基板顺时针发生了漂移,使台座逆时针旋转来进行校正。另一方面,在基板逆时针发生了漂移的情况下,从两个长方体基准物质1105得到的信号同时增加。根据该现象,探测到基板逆时针地发生了漂移,使台座顺时针旋转来进行校正。
根据本实施例,不仅能够与实施例3的构成同样,运算漂移方向和漂移量并进行校正,还能够检测旋转方向的漂移并进行校正。
实施例5
在以上说明的实施例1-4中,说明了针对各轴上的漂移的校正动作,但是在校正中使用的θ台座的旋转轴与发生了漂移时的旋转轴的旋转中心不同、并且旋转方向的漂移和xyz轴方向的漂移合成的情况下,由计算机116或者解析装置118执行的、基于从基准物质得到的信号的信息的各种漂移校正需要按顺序进行。因此,作为实施例5,示出能够进行这样的情况下的适宜的漂移校正的装置的实施例。
图12表示本实施例中的漂移校正的一例的流程图。首先,例如将具有图11所示的基板1100的观察容器201架设于装置100。在架设后向观察容器201照射激励光,进行搜寻来自各纳米细孔1102的信号强度成为最强的位置的扫描动作来决定测定位置(1200)。同时,也取得来自各基准物质1104、1105、1106的信号强度和位置信息并保存在计算机116、解析装置118等的存储介质中(1201)。
在扫描结束后,移动到纳米细孔发出最强信号强度的位置,检测通过纳米细孔的生物分子的信号,同时开始来自基准物质的信号测定。测定开始时的来自基准物质的信号被依次存储,在之后的漂移校正时使用。
在测定开始后因温度变化等而发生了漂移的情况下,由于在基准值的信号中可看到变化,所以通过基准值的变化来探测漂移。虽然可以始终进行探测以及运算,但是为了减轻运算处理,也可以如前面说明的那样,例如以10分钟间隔取得数据等,以定期的方式取得基准值的信号来检测漂移。另外,也可以事先设定探测漂移的信号强度。
图13中示出本实施例的装置中的漂移探测以及校正的条件设定的一构成例。显示画面1300例如是显示于计算机116、解析装置118的显示器等的画面。在显示画面1300中的漂移校正窗口1301中示出为“漂移探测点”的项目是设定在从起始时的来自基准物质的信号值例如低于90%时识别为漂移的值的项目。在探测到漂移时,首先,检测用于探测z轴的漂移的基准物质1106的信号,并基于事先扫描信息进行校正,使得成为与起始时相同的信号强度的高度、倾斜度(1202)。这是简单确认是否因z轴发生漂移且焦点发生了偏离从而来自其他基准值的信号值发生变化而没有识别为漂移的工序。因此,可以将针对来自z轴基准物质的信号强度的识别为漂移的值如图13所示作为“z漂移探测点”而设定为比其他项目更严格的例如95%。另外,显示画面1300中的“保存”等各种按钮1302由操作者在各种操作中使用。
对z轴进行监视的基准物质1106的信号恢复为起始时,在基准物质1104、1105的信号值超出“漂移探测点”的值的范围的情况下,进行进一步的校正动作。此时,在基准物质1104、1105的信号强度全部增加或者衰减的情况下(1203),依次根据在测定前进行扫描得到的信息以最少的移动量使θ移动到构成至少一个对角对的基准物质成为起始时的信号强度的位置。但是,在成为起始时的信号强度的位置找不到的情况下,移动θ并以最少的移动量移动到构成至少一个对角对的基准物质相等的位置处。此时,也可以将以一次校正动作挪动的移动量设定为图13的“θ轴校正范围”。这是为了减少由于针对仅1轴过大移动而使其他轴的校正变得困难的情况。
在θ轴的校正动作完成后,使用构成对角对的基准物质的信号最背离起始时的信号强度的对的信号,按照实施例4的步骤来进行x轴或者y轴方向的漂移校正。xy轴也可以与θ轴同样地设定由一次校正动作能够移动的移动量。在漂移量少的情况下,在该时间点来自所有的基准物质的信号强度恢复成起始时的强度,结果,能够在来自通过纳米细孔的生物样品的信号被始终限制的范围内得到较强的信号。此时,在从基准物质得到的拉曼光谱的峰值不在与起始时相同的检测器的元件的情况下,移动检测器并进行波数校正使得由相同的元件照射。或者,也可以根据起始时的从基准物质得到的拉曼光谱的峰值的检测器内的元件信息和校正后的位置信息,来进行运算并进行波数校正。用于波数校正的光谱信息也可以作为测定前的设定条件而设定为选择基准物质的材质。作为材质的例子,存在硅单晶、氧化钼、氧化钨、氧化铝、氧化锌、氧化锡、氧化钛、碳化硅等。
在漂移量大而来自所有的基准物质的信号强度没有恢复成起始时的强度的情况下,再一次反复θ轴的校正和xy轴的校正。此时,也可以指定反复的次数。在所指定的次数以内不满足起始时的信号强度或者识别为漂移探测的信号强度的情况下,也可以发出警告,促使重新测定。或者也可以简单地在来自基准物质的信号低于一定值的情况下发出警告,促使重新测定。这些警告在受到对装置等出现了设想外的冲撞时的影响而发生了较大偏离的情况下的检测中很有效。
另一方面,装置架设后的扫描结束,开始测定,进行z轴校正从而基准物质1106的信号恢复成起始时,在基准物质1104、1105的信号值超出“漂移探测点”的值的范围的情况下进行进一步的校正动作(1202)。此时,对于基准物质1104、1105的信号强度来说,在构成对角对的两个基准物质1104或者两个基准物质1105彼此增减不同的情况下(1204),基于测定前的扫描结果对xy轴方向的漂移量进行估算并移动使得成为起始时的信号强度。估算的结果,在构成对角对的基准物质彼此间漂移量不同的情况下设想θ轴方向的漂移,所以进行xy轴校正到构成对角对的基准物质彼此的信号量相等的位置。在xy轴校正后,以最少的移动量将θ移动到至少一个对角对彼此的基准物质成为起始时的信号强度的位置。
在漂移量少的情况下,在该时间点来自所有的基准物质的信号强度恢复成起始时的强度(1205),结果,能够在来自通过纳米细孔的生物样品的信号被始终限制的范围内得到强信号,从而恢复成起始时。此时,在从基准物质得到的拉曼光谱的峰值不在与起始时相同的检测器的元件的情况下,移动检测器并进行波数校正使得由相同的元件照射。或者,也可以根据起始时的从基准物质得到的拉曼光谱的峰值的检测器内的元件信息和校正后的位置信息,来进行运算并进行波数校正(1206)。然后,完成漂移校正(1207)。
在漂移量大而来自所有的基准物质的信号强度没有恢复成起始时的强度的情况下,再一次反复θ轴的校正和xy轴的校正。此时,也可以指定反复的次数。在所指定的次数以内不满足起始时的信号强度或者识别为漂移探测的信号强度的情况下,发出警报(1208、1209),促使重新扫描、重新测定。或者也可以简单地在来自基准物质的信号低于某一定的值的情况下发出警告,促使重新测定。这些警告在受到对装置等出现了设想外的冲撞时的影响而发生了较大偏离的情况下的检测中很有效。
另外,本发明并不限定于上述的实施例,而包含各种变形例。例如,上述的实施例是为了更好地理解本发明而详细说明的,并不限定为必须具备说明的所有构成。此外,可以将某实施例的构成的一部分置换成其他实施例的构成,还可以在某实施例的构成中添加其他实施例的构成。此外,针对各实施例的构成的一部分,可以进行其他构成的追加、删除、置换。
进一步地,上述的各构成、功能、解析装置等以通过作成实现它们的一部分或者全部的程序而由软件来实现的情况为例进行了说明,但是也可以通过例如以集成电路来设计等而由硬件来实现它们的一部分或者全部。
以上,在本说明书中,基于各种实施例,说明了本发明的实施方式,但是在以上的说明中,不仅是权利要求书中记载的发明,还公开了很多的发明。如以下所示来例示它们的一部分。
[例示1]
一种位置控制方法以及装置,具备:
能进行至少一个以上的激励光照射的光学系统;
能进行通过至少一个以上的激励光照射而发出的信号检测的单元;以及
与测定样品的检测一起还同时进行基准物质的检测,根据从基准物质得到的信号,运算测定样品被强烈照射激励光的位置的位置运算单元,
根据运算结果将测定样品的位置或者光学系统位置校正为期望的位置。
[例示2]
在例示1的位置控制方法以及装置中,通过激励光照射而发出的信号是拉曼散射光或者荧光。
[例示3]
在例示1的位置控制方法以及装置中,检测来自至少一个以上的基准物质的信号。
[例示4]
在例示1的位置控制方法以及装置中,使用通过激励光照射而发出的至少一个以上的基准物质的光谱来校正检测器的位置或者图像元件信息。
[例示5]
在例示1的位置控制方法以及装置中,检测来自比样品小的基准物质的信号。
[例示6]
在例示1的位置控制方法以及装置中,向基准物质照射比样品小的激励光光斑直径,检测来自基准物质的信号。
[例示7]
在例示1的位置控制方法以及装置中,使用比样品短的波长的激励光,向基准物质照射比样品小的激励光光斑直径,检测来自基准物质的信号。
[例示8]
在例示1的位置控制方法以及装置中,在激励光光斑直径比样品以及基准物质小时,向基准物质照射的激励光光斑直径大于向样品照射的激励光光斑直径,并检测来自基准物质的信号。
[例示9]
在例示1的位置控制方法以及装置中,检测来自作为硅单晶、氧化钼、氧化钨、氧化铝、氧化锌、氧化锡、氧化钛、碳化硅的基准物质的信号。
[例示10]
在例示1的位置控制方法以及装置中,作为样品,解析生物分子。
[例示11]
在例示1的控制方法以及装置中,具备驱动单元,
使用驱动单元对样品以及基准物质的位置和激励光斑位置进行扫描,并根据位置运算单元的运算结果将测定样品的位置或者光学系统位置校正为期望的位置。
[例示12]
在例示11的控制方法以及装置中,在检测温度变化的同时,利用驱动单元对样品以及基准物质的位置和激励光斑位置进行扫描,基于温度变化的检测来将样品的位置或者光学系统位置校正为期望的位置。
[例示13]
在例示1的控制方法以及装置中,根据基准物质的信号的增减来运算漂移量以及漂移方向,将测定样品的位置或者光学系统位置校正为期望的位置。
[例示14]
在例示13的控制方法以及装置中,根据事先取得的基准物质的位置和信号强度的信息以及基准物质的信号的增减来运算漂移量以及漂移方向,将测定样品的位置或者光学系统位置校正为期望的位置。
[例示15]
在例示1的控制方法以及装置中,使用配置在从位置与样品一致的激励光斑位置偏离的位置处的基准物质,校正为期望的位置。
[例示16]
在例示1的位置控制方法以及装置中,使用焦点位置与样品不同的基准物质,校正为期望的位置。
[例示17]
在例示1的装置中,使设置在基准物质测定光轴上的针孔比设置在样品测定光轴上的针孔小。
[例示18]
在例示1的控制方法以及装置中,基准物质为长方体,并且校正为期望的位置。
[例示19]
在例示1的控制方法以及装置中,至少2个长方体基准物质的长边以正交的直线状存在,校正为期望的位置。
[例示20]
在例示1的方法以及装置中,基准物质是等离子体激元共振。
符号说明
100纳米细孔拉曼dna测序仪装置
101光源
102、218物镜
103显微镜观察容器
104xy台座
105z轴调整机构
106滤波器
107分束器
108衍射光栅
109检测器
110led
111二维检测器
112反射镜
113多重照射机构
114透镜
115驱动控制部
116计算机
117nir(近红外)反射镜
118解析装置
201观察容器
202、302、402、702、904、1102纳米细孔
203、301基板
204样品导入分区
205样品流入分区
206、207流入路径
208、209流出路径
210、211液体
213样品
214、215电极
216导电性薄膜
217液浸介质
302纳米细孔
303、403、703、903、1103导电性薄膜
401、701、901、1000、1100多纳米细孔基板
404、405、406、704、705、706、902、903、1001、1002、1004-1006基准物质
901激励光照射于基板的位置
1003、1101激励光照射于基板的位置
1300显示画面
1300漂移校正窗口
- 还没有人留言评论。精彩留言会获得点赞!