同时测定组织中两种马兜铃酸-DNA加合物的HPLC-FLD-DAD分析方法与流程
本发明属于生物技术分析领域,具体为涉及一种检测马兜铃酸肾病生物标记物(即马兜铃酸-DNA加合物)的HPLC-FLD-DAD法,可用于马兜铃酸肾病相关研究工作。
[
背景技术:
]
马兜铃酸肾病(AAN)是摄入含有马兜铃酸(AAs)类成分中草药(例如关木通、广防己、青木香等)导致的肾小管间质疾病。目前文献报道约50%的AAN患者同时患有上尿路上皮细胞癌(UTUC)[1],70%UTUC患者体内有AA-DNA加合物[2]。AA-DNA加合物通过引起基因位点AT→TA的突变,阻止转录或DNA复制,促进细胞周期受阻或导致细胞凋亡[3],引起肿瘤。AA-DNA加合物作为AA暴露的生物标志物[2,4],其检测具有重要意义[5]。
目前文献报道在动物及患者体内可检测到的AA-DNA加合物有脱氧腺苷-马兜铃酸I加合物(dA-AA-I)、脱氧腺苷-马兜铃酸II加合物(dA-AA-II)、脱氧鸟苷-马兜铃酸I加合物(dG-AA-I)、脱氧鸟苷-马兜铃酸II加合物(dG-AA-II)、脱氧胞苷-马兜铃酸I加合物(dC-AA-I)、脱氧胞苷-马兜铃酸II加合物(dC-AA-II),其中dA形成的加合物基因诱导作用最强[1],即dA-AA-I、dA-AA-II为AAN主要的加合物,这其中又以dA-AA-I在AAN患者中最为常见[6]。AA-DNA加合物的检测步骤包括DNA提取、酶消化、加合物的富集及检测分析,主要的检测方法包括32P-后标记法[7-10]、高效液相(HPLC)-质谱(MS)联用法[11-14]等,但32P-后标记法有放射性操作有一定风险,而HPLC-MS联用法花费昂贵。针对此现状,本课题组根据AA-DNA加合物由于具有马兜铃内酰胺环状结构,受激发时会产生荧光信号,认为荧光法(FLD)是检测AA-DNA加合物一种很好的可选择的方法。本课题组[15,16]前期用AA-I刺激肾小管上皮细胞,证明了细胞核的荧光物质为AA-DNA加合物,并用激光共聚焦测定了其荧光强度,该法可原位观察。Chan[17]等曾单次给予大鼠AA-I、AA-II(1∶1)混合品并用HPLC-FLD方法进行分析,但仅检测了肾脏,且在肾脏中只检测到dA-AA-II这一种加合物。
因此本发明致力于建立一种HPLC-FLD-DAD法用于检测dA-AA-I、dA-AA-II这两种最主要的AA-DNA加合物。
[
技术实现要素:
]
本发明的目的是针对上述不是提供一种采用HPLC-FLD-DAD法同时测定两种最主要的 AA-DNA加合物(dA-AA-I、dA-AA-II)的分析方法,并应用该法测定给予关木通等含有AAs的药物或食物后的动物的组织(如大鼠肝、肾组织等)中AA-DNA加合物含量。本发明主要通过以下步骤实现:
(1)组织中DNA的提取;
(2)DNA的消化及加合物的富集;
(3)HPLC-FLD测定AA-DNA加合物;
(4)HPLC-DAD测定脱氧腺苷;
(5)AA-DNA加合物含量的计算。
具体操作步骤如下所示:
(1)DNA的提取:苯酚氯仿法提取组织中DNA。
(2)DNA的消化及加合物的富集:取200μg DNA,加入DNase I 30μL(20mg·mL-1),70μL 0.01M MgCl2-0.01M Tris缓冲液(pH 7.0),用0.01M Tris-5mM NaCl缓冲液(pH 7.5)补体积至400μL,37℃孵育2h。再向其中加入392μL 0.2M Tris缓冲液(pH 8.0~9.0)和4μL磷酸二酯酶I(100mU·μL-1),孵育24h后加入4μL碱性磷酸酶(1.25U·μL-1)。
继续孵育24h后混匀,取10μL加入90μLH2O,HPLC-DAD检测脱氧腺苷含量。剩余溶液用等体积乙酸乙酯萃取3次合并,氮气吹干,加入50μL甲醇溶解,HPLC-FLD检测AA-DNA加合物。
(3)HPLC-FLD测定AA-DNA加合物:流动相为0.2%乙酸-水(A)、乙腈(B),B相0~20min在25%~40%范围内梯度变化,20~45min在40%~80%范围内梯度变化。进样量20μL,流速0.8mL·min-1,柱温25℃。FLD激发波长在280~430nm,发射波长在450~600nm。
(4)HPLC-DAD测定脱氧腺苷:流动相为水(A)、乙腈(B),B相0~35min在5%~80%范围内梯度变化。进样量20μL,流速1mL·min-1,柱温25℃。DAD检测波长在250~260nm。
(5)AA-DNA加合物含量的计算:AA-DNA加合物浓度以每105正常脱氧核苷中的加合物数量表示,即[AA-DNA]=NdA-AA/NdA·10-5。
其中,步骤(3)中FLD激发波长为304nm,发射波长为480nm。流动相为0.2%乙酸-水(A)、乙腈(B),B相0~10min在25~30%范围内梯度变化,10~20min在30~40%范围内梯度变化,20~35min在40~80%范围内梯度变化,35~45min为80%。
其中,步骤(4)中DAD检测波长为254nm。流动相为水(A)、乙腈(B),B相梯度变化,0~10min为5%,10~30min为5~80%,30~35min为80%。
本发明的有益效果在于:①优化分离加合物的条件,使其可以同时定量dA-AA-I、dA-AA-II,引起AAN的两种最主要加合物;②利用HPLC-FLD检测AA-DNA加合物、 HPLC-DAD检测脱氧核苷,从而测定加合物含量;③所建方法AA-DNA加合物及脱氧腺苷均与内源性成分分离良好,线性良好(r2>0.999);加合物的检测限为0.5ng/ml(0.30pmol)、定量限为1ng/ml(0.59pmol),显示了较高的灵敏度;④所建方法与32P后标记法相比无放射性,与质谱法相比价廉;⑤应用该方法可用于检测组织中(例如大鼠肝、肾)中的AA-DNA加合物。
[附图说明]
图1马兜铃酸-DNA加合物(dA-AA-I、dA-AA-II)的化学结构
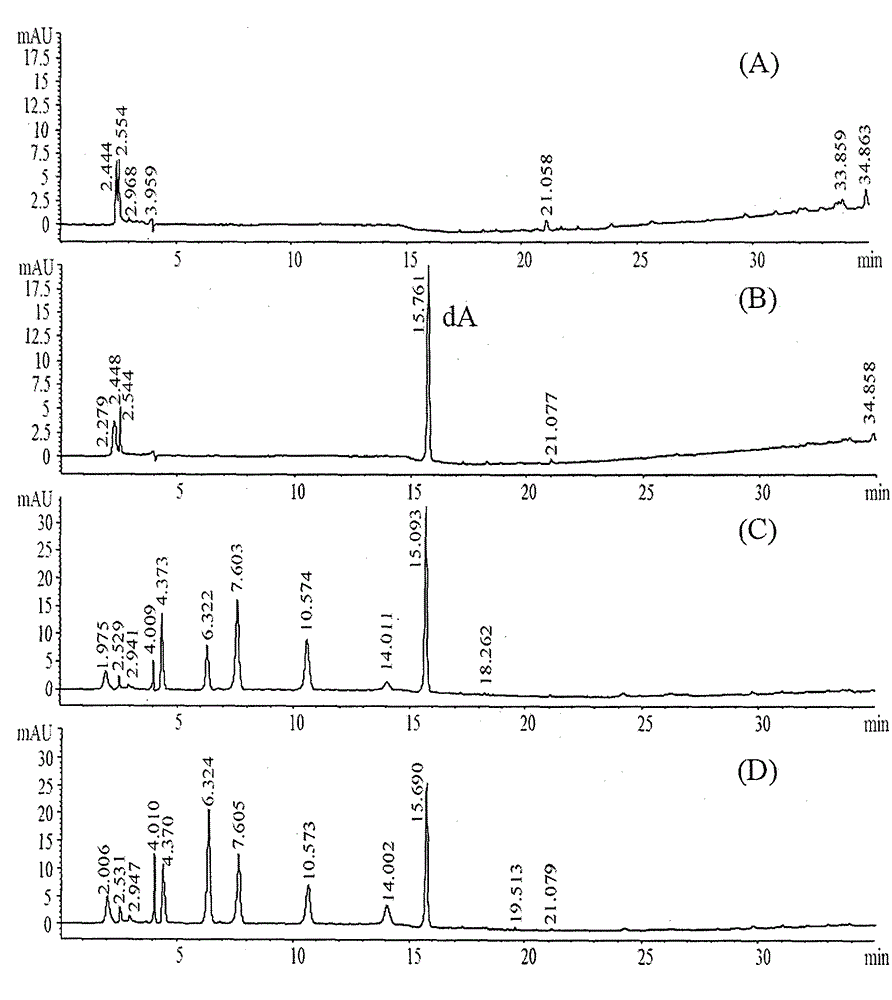
图2HPLC-FLD检测AA-DNA加合物的专属性考察:(A)空白基质(CT-DNA消化液)色谱图;(B)空白基质加dA-AA-I对照品色谱图;(C)关木通给药5天大鼠肾色谱图;(D)关木通给药5天大鼠肝色谱图。
图3HPLC-DAD检测脱氧核苷的专属性考察:(A)空白基质(不含DNA的消化液)色谱图;(B)空白基质加dA对照品色谱图;(C)关木通给药5天大鼠肾色谱图;(D)关木通给药5天大鼠肝色谱图。
[具体实施方式]
下面结合实施例、验证例及附图对本发明作进一步的描述。但不应将其理解为本发明的范围仅限于以下实施例,凡基于本发明的内容所实现的技术方案均属于本发明的范围。
实施例1 关木通给药大鼠的肾组织中AA-DNA加合物的检测
1.材料
1.1 试剂和仪器
2-脱氧腺苷(dA)、小牛胸腺DNA(CT-DNA)均购自Sigma公司。脱氧核糖核酸酶I(DNase I)、磷酸二酯酶I均购自Worthington公司。碱性磷酸酶购自上海生工生物有限公司。乙腈、甲醇均为HPLC级,Thermo Fisher公司。乙酸、乙酸乙酯、锌粉、氯化钠、氯化镁均为分析纯,北京化工厂。三羟甲基氨基甲烷(Tris)购自北京东胜泰博科技有限公司。AA-DNA加合物(dA-AA-I、dA-AA-II),本课题组前期合成经质谱确证结构。
Agilent 1200液相色谱仪(DAD检测器、FLD检测器、柱温箱、二元泵、自动进样器、脱气机)。Phenomenex Luna C18(250mm×4.6mm,5μm)色谱柱。
1.2 药材和水煎液
关木通干燥茎,采自辽宁,经鉴定为马兜铃科植物东北马兜铃Aristolochia manshuriensis Kom.的藤茎。称取关木通饮片适量,加水浸泡45min,大火煮沸后,文火煮沸30min,过滤,留待浓缩;残渣再加水,大火煮沸后,文火煮沸45min,过滤,留待浓缩。合并两次煎液,旋转蒸发浓缩得到浓缩液,AA-I浓度为2.54mg·mL-1。
1.3 实验动物
雄性Wistar大鼠,体重150~180g,购自北京维通利华实验动物技术有限公司,均为II级清洁级动物,动物合格证号为SCXK(京)2011-0012。实验前进行适应性喂养4天,自由饮食。
2.方法
2.1 动物实验
雄性Wistar大鼠(n=5),灌胃给予关木通水煎液,剂量按AA-I计20mg/kg/d,连续给药5天,在最后一次给药后2h,经腹腔注射10%水合氯醛麻醉,行全身生理盐水灌流,取肾组织,立即放入液氮中,样品检测前保存于-80℃。
2.2 HPLC-FLD-DAD检测组织中AA-DNA加合物
(1)DNA的提取:苯酚氯仿法提取大鼠肾组织中DNA。
(2)DNA的消化及加合物的富集:取200μg DNA,加入DNase I 30μL(20mg·mL-1),70μL 0.01M MgCl2-0.01M Tris缓冲液(pH 7.0),用0.01M Tris-5mM NaCl缓冲液(pH 7.5)补体积至400μL,37℃孵育2h。再向其中加入392μL 0.2M Tris缓冲液(pH 8.0~9.0)和4μL磷酸二酯酶I(100mU·μL-1),孵育24h后加入4μL碱性磷酸酶(1.25U·μL-1)。
继续孵育24h后混匀,取10μL加入90μLH2O,HPLC-DAD检测脱氧腺苷含量。剩余溶液用等体积乙酸乙酯萃取3次合并,氮气吹干,加入50μL甲醇溶解,HPLC-FLD检测AA-DNA加合物。
(3)HPLC-FLD测定AA-DNA加合物:流动相为0.2%乙酸-水(A)、乙腈(B),B相0~10min在25~30%范围内梯度变化,10~20min在30~40%范围内梯度变化,20~35min在40~80%范围内梯度变化,35~45min为80%。进样量20μL,流速0.8mL·min-1,柱温25℃。FLD激发波长304nm,发射波长480nm。
(4)HPLC-DAD测定脱氧腺苷:流动相为水(A)、乙腈(B),B相梯度变化,0~10min为5%,10~30min为5~80%,30~35min为80%。进样量20μL,流速1mL·min-1,柱温25℃。DAD检测波长254nm。
(5)AA-DNA加合物含量的计算:AA-DNA加合物浓度以每105正常脱氧核苷中的加合物数量表示,即[AA-DNA]=NdA-AA/NdA·10-5。
3.结果
在给药5天大鼠肾脏中能检测到dA-AA-I、dA-AA-II,如图2C,其含量分别为16.90±4.31×10-5、1.21±0.61×10-5。
实施例2 关木通给药大鼠的肝组织中AA-DNA加合物的检测
1.材料
1.1 试剂和仪器
同实施例1。
1.2 药材和水煎液
同实施例1。
1.3 实验动物
同实施例1。
2.方法
2.1 动物实验
操作同实施例1,所取组织为大鼠肝组织。
2.2 HPLC-FLD-DAD检测组织中AA-DNA加合物
操作同实施例1
3.结果
在给药5天大鼠肝脏中能检测到dA-AA-I,未检测到dA-AA-II,如图2D,其含量为7.24±2.24×10-5。
验证例 HPLC-FLD-DAD检测AA-DNA加合物及脱氧腺苷的方法学验证
1.HPLC-FLD测定AA-DNA加合物的方法学验证
分别制备空白基质(CT-DNA的消化液)、空白基质加dA-AA-I对照品及关术通给药大鼠肝、肾组织样品,同法处理测定并进行色谱图比较,考察专属性。将不同浓度的dA-AA-I对照品加入空白基质中,按样品同法处理测定,选取6个浓度点建立标准曲线,即1、2.5、5、10、25、50ng·mL-1。标准曲线最低浓度点为LOQ,且S/N>10,继续稀释至S/N>3的最低浓度为LOD。分别在日内、日间(1~3天)选取高浓度(40ng·mL-1)、中浓度(10ng·mL-1)、低浓度(2.5ng·mL-1)样品,每个浓度平行制备5份,进行日内、日间精密度准确度考察。对比空白基质同法处理后,加入相当于高浓度(40ng·mL-1)、中浓度(10ng·mL-1)、低浓度(2.5ng·mL-1)样品的等量dA-AA-I甲醇溶液,考察dA-AA-I的提取回收率。高浓度(40ng·mL-1)、低浓度(2.5ng·mL-1)样品室温放置24h,同法处理测定,并与0h测得的结果进
行比较,考察样品稳定性。
2.HPLC-DAD测定脱氧腺苷的方法学验证
分别制备空白基质(不含DNA的消化液)、空白基质加dA对照品及关木通给药大鼠肝、肾组织DNA的消化液,同法处理测定并进行色谱图比较,考察专属性。将不同浓度的dA对照品加入空白基质中,按样品同法处理测定,选取7个浓度点建立标准曲线,即0.10、0.25、0.50、1.0、2.5、5.0、10μg·mL-1。标准曲线最低浓度点为LOQ,且S/N>10,继续稀释至S/N>3的最低浓度为LOD。分别在日内、日间(1-3天)选取高浓度(5.0μg·mL-1)、中浓度(1.0μg·mL-1)、低浓度(0.25μg·mL-1)样品,每个浓度平行制备5份,进行日内、日间精密度准确度考察。高浓度(5.0μg·mL-1)、低浓度(0.25μg·mL-1)样品室温放置24h,同法处理测定,并与0h测得的结果进行比较,考察样品稳定性。
3.方法学验证结果
3.1 专属性
如图2、3,dA-AA-I和dA均与内源性成分分离良好,分离度>1.5。
3.2 标准曲线、线性范围
dA-AA-I的标准曲线为y=0.8377x-0.3753(r2=0.9998)、线性范围为1~50ng·mL-1,dA的标准曲线为y=57.13x-1.5175(r2=0.9999)、线性范围为0.10~10μg·mL-1。
3.3 检测限、定量限
dA-AA-I的检测限为0.5ng·mL-1(0.30pmol),定量限为1ng·mL-1(0.59pmol),显示了较高的灵敏度。dA的检测限为0.05μg·mL-1,定量限为0.10μg·mL-1。
3.4 日内日间精密度、准确度
表1所示,dA-AA-I及dA在高中低三个浓度的日内、日间精密度均小于15%,准确度在85%~115%。
3.5 提取回收率、稳定性
表1所示,dA-AA-I的提取回收率为82.6%~84.5%。dA-AA-I及dA在室温放置24h,稳定性在85%~115%。符合生物样品方法学考察要求。
表1 dA-AA-I、dA的日内日间精密度、准确度、回收率
注:Ca为加入浓度(added concentration),Cc为计算浓度(calculated concentration),A基质/A溶剂以dA-AA-I加入基质同法处理测定的峰面积(A基质)与dA-AA-I甲醇溶液峰面积(A溶剂)的比值
本发明建立的HPLC-FLD-DAD法利用AA-DNA加合物的荧光特性,具有专属性强,背景干扰少的特点;有着较高的灵敏度,检测限为0.5ng/mL(0.30pmol),定量限为1ng/mL(0.59pmol)。两种AA-DNA加合物由于结构相似,液相分离困难,本发明优化了HPLC-FLD检测加合物的液相条件,并成功在大鼠肾脏中检测到了dA-AA-I、dA-AA-II,AA引起癌症的两种最主要加合物。本发明是一种很好的检测AAN生物标记物的方法,可用于AAN相关研究。
参考文献
[1]Attaluri S,Bonala R R,Yang I Y,et al.DNA adducts of aristolochic acid II:total synthesis and site-specific mutagenesis studies in mammalian cells[J].Nucleic Acids Res,2010,38(1):339-352.
[2]Jelakovic B,Karanovic S,Vukovic-Lela I.et al.Aristolactam-DNA adducts are a biomarker of environmental exposure to aristolochic acid[J].Kidney Int,2012,81(6):559-567.
[3]Romanov V,Whyard T C,Waltzer W C,et al.Aristolochic acid-induced apoptosis and G2 cell cycle arrest depends on ROS generation and MAP kinases activation[J].Arch Toxicol,2014.
[4]Poon S L,Pang S T,Mcpherson J R,et al.Genome-wide mutational signatures of aristolochic acid and its application as a screening tool[J].Sci Transl Med,2013,5(197):101r-197r.
[5]Grollman A P.Aristolochic acid nephropathy:Harbinger of a global iatrogenic disease[J].Environ Mol Mutagen,2013,54(1):1-7.
[6]Schmeiser H H,Nortier J L,Singh R,et al.Exceptionally long-term persistence of DNA adducts formed by carcinogenic aristolochic acid I in renal tissue from patients with aristolochic acid nephropathy[J].Int J Cancer,2014,135(2):502-507.
[7]Wang Y,Arlt V M,Roufosse C A,et al.ACB-PCR measurement of H-ras codon 61 CAA-->CTA mutation provides an early indication of aristolochic acid I carcinogenic effect in tumor target tissues[J].Environ Mol Mutagen,2012,53(7):495-504.
[8]Mcdaniel L P,Elander E R,Guo X,et al.Mutagenicity and DNA adduct formation by aristolochic acid in the spleen of Big Blue(R)rats[J].Environ Mol Mutagen,2012,53(5):358-368.
[9]Stiborova M,Levova K,Barta F,et al.Bioactivation versus detoxication of the urothelial carcinogen aristolochic acid I by human cytochrome P450 IA1 and IA2[J].Toxicol Sci,2012,125(2):345-358.
[10]Dong H,Suzuki N,Torres M C,et al.Quantitative determination of aristolochic acid-derived DNA adducts in rats using 32P-postlabeling/polyacrylamide gel electrophoresis analysis[J].Drug Metab Dispos,2006,34(7):1122-1127.
[11]Xing G,Qi X,Chen M,et al.Comparison of the mutagenicity of aristolochic acid I and aristolochic acid II in the gpt delta transgenic mouse kidney[J].Mutat Res,2012,743(1-2):52-58.
[12]Guo L,Wu H,Yue H,et al.A novel and specific method for the determination of aristolochic acid-derived DNA adducts in exfoliated urothelial cells by using ultra performance liquid chromatography-triple quadrupole mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2011,879(2):153-158.
[13]Chan W,Yue H,Pooh W T,et al.Quantification of aristolochic acid-derived DNA adducts in rat kidney and liver by using liquid chromatography-electrospray ionization mass spectrometry[J].Murat Res,2008,646(1-2):17-24.
[14]Yun B H,Rosenquist T A,Sidorenko V,et al.Biomonitoring of Aristolactam-DNA Adducts in Human Tissues Using Ultra-Performance Liquid Chromatography/Ion-Trap Mass Spectrometry[J].Chemical Research in Toxicology,2012,25(5):1119-1131.
[15]商朴,王璇,李晓玫,等.马兜铃内酰胺-1进入人肾小管上皮细胞及细胞内分布和蓄积的观察[J].中国中药杂志,2008(07):793-797.
[16]王璇,高志,李晓玫,等.一种分析马兜铃酸肾病生物标记物的激光共聚焦显微镜法201210144885.3[P].2013.11.13.
[17]Chan W,Poon W T,Chan Y W,et al.A new approach for the sensitive determination of DNA adduct of aristolochic acid II by using high-performance liquid chromatography with fluorescence detection[J].J Chromatogr B Analyt Technol Biomed Life Sci,2009,877(10):848-852.
- 还没有人留言评论。精彩留言会获得点赞!