乙酰化热休克蛋白90抑制剂的筛选方法与流程
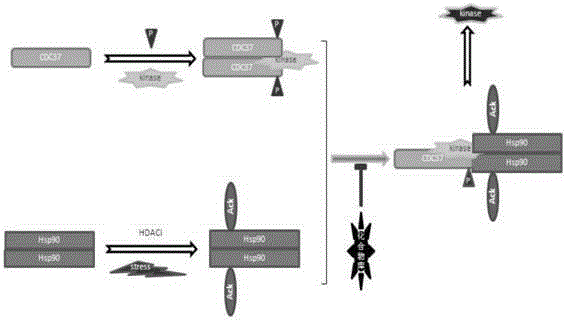
本发明属于生物制药领域,涉及乙酰化热休克蛋白hsp90,尤其涉及乙酰化热休克蛋白hsp90抑制剂的筛选方法。
背景技术:
:现有技术公平开了目前发现的肿瘤的种类繁多,其特性,重要信号分子及信号途径不尽相同,所述相关的重要分子或其组合等均可能成为治疗靶标,如,肿瘤中CyclinD1、CDK4、AKT或MYC等表达失控,或,ZAP-70、p-AKT、CyclinD1的短小变体、CyclinD2、CyclinD3等的表达与肿瘤恶化的相关性等,研究显示,该些分子本身的活性、稳定性及其下游信号均依赖于热休克蛋白Hsp90的分子伴侣功能。研究表明,Hsp90是高度保守、以二聚体存在的ATP依赖型分子伴侣,在肿瘤细胞中大量表达,其主要功能是帮助细胞的蛋白质折叠,保持蛋白正确的空间结构而发挥正常的生理活性,这些需要Hsp90来维持功能的蛋白分子通常被称为Hsp90的分子伴侣底物,其稳定性因蛋白Hsp90正常的分子伴侣功能而改变。有研究显示,肿瘤中诱导表达的Hsp90对维持肿瘤相关蛋白的空间结构及活性是不可或缺的,如肿瘤相关的蛋白激酶、核内激素转录因子的组装和拆分等;越来越多的肿瘤相关蛋白被发现是Hsp90的分子伴侣底物,尤其是与肿瘤转移相关的信号分子,如c-Raf、AKT、ZAP-70、IKKα;ER(endoplasmicreticulum)的转膜激酶,如IRE1(inositolrequiringenzyme1)和PERK(double-strandedRNA-activatedproteinkinase-likeERkinase);cellcycle调控蛋白,如cdk4、cyclinD、p21、chk1及wee1等,它们与许多肿瘤的发生、转移有直接的关系,因此,肿瘤中Hsp90和所述肿瘤相关蛋白形成复合物并主导它们的功能,这已成为抗肿瘤研究的热门靶标分子。研究还表明,含Hsp90的分子伴侣复合物经ATP结合、水解循环,Hsp90在ATP和ADP之间实现空间转换,完成hsp90与分子伴侣底物的结合与分离,最终导致分子伴侣底物以高活性状态存在;其中ATP结合部位在Hsp90的N-端的疏水区域,ATP和N-端的结合引起Hsp90空间结构的变化,影响Hsp90和辅助伴侣分子如p23和p50cdc37(如果底物是信号蛋白激酶分子的话)形成伴侣机器(chaperonemachine),直接影响与肿瘤转移相关信号分子的活性和稳定性;已知Hsp90本身具有ATPase的功能,ATP与Hsp90结合的复合物在ATPase活性作用下,水解成ADP结合的Hsp90复合物,该种复合物没有分子伴侣的功能,底物分子在泛素化E3连结酶的帮助下被26S蛋白酶体降解;对肿瘤细胞而言,维持肿瘤细胞生存的重要蛋白及蛋白激酶多数需要Hsp90分子伴侣功能的帮助,因此,Hsp90对肿瘤细胞至关重要。还有研究基于Hsp90的N-端含有ATP的结合部位,影响ATP与Hsp90结合的小分子化合物可以抑制Hsp90的分子伴侣功能,ATP的结合部位成为目前筛选Hsp90抑制剂的主要筛选模型;其中,中间段是分子伴侣底物和Hsp90相互作用的部位,许多肿瘤相关蛋白激酶,如AKT、c-Raf、c-Src等都和Hsp90的中端部位作用;C-端的末尾含有一个MEEVD片段,这一片段对Hsp90和含有TPR结构蛋白的相互作用至关重要,除去该片段将抑制Hsp90的ATPase活性,研究显示,Hsp90结构的任何变化均可能影响Hsp90的功能,甚至干扰Hsp90和分子伴侣底物的结合,最终引起分子伴侣底物的降解。此外,正常生理条件下的肿瘤细胞Hsp90表达水平高达总蛋白的4%,明显地比正常细胞的1-2%高得多,这种表达水平的差异也使Hsp90成为一个很好的抗肿瘤药物的筛选靶标。格尔德霉素(Geldanamycin,GA)是一种天然的Hsp90抑制剂,特异性地干扰糖皮质激素受体(GR)/HSP复合物的形成,有研究公开了GA的衍生物17-AAG和17-DMAG与hsp90有很强的亲和力,它们和hsp90的ATP/ADP结合部位结合,从而阻止hsp90和底物相结合,使底物被蛋白酶体降解,Hsp90的ATP结合部位理所当然地成为筛选Hsp90抑制剂的模型,以Hsp90的ATP结合部位为筛选模型,已筛选到一些Hsp90抑制剂,如17-AAG、17-DMAG和AUY922都促使肿瘤蛋白迅速被蛋白酶体途径降解,达到已知肿瘤细胞的目的,其中有些已进入临床试验, 但迄今,尚未见成功地开发为临床用药的Hsp90抑制剂。‘蛋白乙酰化’是一种蛋白翻译后修饰,一般指蛋白质链上的Lys(K)的氨基接上一个乙酰基基团,而不是指蛋白链末端其他氨基;有研究显示,HATs(组蛋白乙酰化转移酶)和HDACs(组蛋白去乙酰化酶)是分别控制组蛋白N-端Lys乙酰化和去乙酰化的、功能相反的两类酶;乙酰化修饰是由HDACs和HATs调控的可逆过程,受环境、营养、药物等多种因素影响,乙酰化直接导致蛋白质功能的变化,通常乙酰化促进转录因子的转录活性,如p53、E2F1、FATA1、RelA、YY1、Bcl-6等;蛋白乙酰化的研究历史显示了,首先在组蛋白中发现乙酰化修饰,后来在非组蛋白中同样发现乙酰化修饰,由此乙酰化对非组蛋白P53和FoxO1的功能影响研究使蛋白乙酰化成为研究的热点之一,即在细胞中,蛋白质是主要的信息调控和传递的分子,任何修饰都会对蛋白的功能产生或正或负面的影响,合理利用这些负面影响对肿瘤细胞可能是致命的;HDAC分为HDAC-I、II、III三类,目前发现的18个不同的HDAC蛋白中,有多个可以抑制HDAC-I/II/III的抑制剂,其中HDAC-I/II抑制剂显现出较突出的肿瘤防治价值。还有研究报道了HDAC抑制剂,如SAHA(Vorinostat)、LAQ824、LBH589增加p21、p27的表达,和诱导促凋亡蛋白如Bax、Bak和Bim的表达,同时影响抗凋亡蛋白如Bcl-xl、XIAP、AKT、c-Raf和Survivin的水平;具有抑制肿瘤细胞增殖、细胞周期阻滞、诱导细胞分化及促进细胞凋亡的作用的组蛋白去乙酰化酶抑制剂,其中SAHA、LBH589和FK228已上市,MS-275、Trichostatin(TSA)及西达苯胺等多种组蛋白去乙酰化酶抑制剂已进入临床研究。目前,Hsp90抑制剂的筛选通常基于大肠杆菌表达的Hsp90的ATP结合片段为模型筛选,筛选的小分子化合物对肿瘤Hsp90抑制效果有限,还诱导hsp70的表达而使肿瘤细胞产生抗药性;以hsp90-CDC37复合物为靶标筛选的hsp90抑制剂,可以破坏hsp90-CDC37复合物的形成,hsp90抑制剂一般不诱导hsp70的表达,因此比以ATP结合部位为靶标的筛选更具优势,尽管CDC37对激酶的稳定性及活性必不可少,但CDC37必须是经磷酸化激活的形式才能与未成熟的激酶结合,然后在hsp90-CDC37复合物作用下使激酶成熟活化。本申请前期研究显示,hsp90中7个位点可被HDAC抑制剂LBH589诱导产生 乙酰化,分别是K69、K100、K292、K327、K478、K546和K558。经过乙酰化模拟突变K/Q分析发现,在C-端的乙酰化都破坏hsp90的功能;但在中间段乙酰化则显示,K292位于hsp90中端起始部位的链接(hinge)区域在各种物种中是高度保守的,K292位点的乙酰化极大地增强了hsp90与ATP、激酶伴侣分子p50cdc37及泛素化E3连结酶CHIP的结合,这意味着hsp90如果在K292位点上乙酰化的话,将使失活的蛋白激酶更快地降解,hsp90发挥分子伴侣功能时对ATP的浓度要求降低,其分子伴侣功能更强大,这将显著增强肿瘤细胞的抗药性和蛋白激酶的信号,更有利于肿瘤细胞的生长,促使肿瘤细胞的转移扩散。另一个事实是,hsp90的K292位点的乙酰化和肿瘤大小及肿瘤的恶化程度有着紧密的相关性,实验结果显示,肿瘤组织细胞而非正常组织细胞中Hsp90的K292位点是以乙酰化修饰形式存在,hsp90中K292的乙酰化和肿瘤大小相对应,也与肿瘤恶化程度相对应;一般认为Hsp90乙酰化使肿瘤细胞死亡,不同意见则认为不同部位的乙酰化对hsp90的功能影响是不同的,不一定导致肿瘤细胞的死亡。基于现有技术研究现状,本申请的发明人拟提出“乙酰化Hsp90-磷酸化CDC37复合物是肿瘤治疗新靶标”的概念,以此建立破坏乙酰化hsp90-磷酸化CDC37复合物形成的乙酰化Hsp90抑制剂筛选模型。技术实现要素:本发明的目的是,基于现有技术研究现状,提供乙酰化热休克蛋白hsp90抑制剂的筛选方法。该筛选方法围绕hsp90分子中K292位点的乙酰化可增强hsp90和CDC37的结合及其分子伴侣功能的特点,破坏它们形成复合物的抑制剂就是乙酰化hsp90抑制剂;本发明的核心是hsp90的K292乙酰化,K292位点是真实的乙酰化修饰还是K292Q模拟乙酰化修饰同等重要。本发明基于乙酰化热休克蛋白90(hsp90)与磷酸化CDC37形成保护肿瘤相关蛋白激酶稳定性和活性的复合物,破坏该复合物形成的化合物即乙酰化hsp90抑制剂依据,采用特异性识别K292位点乙酰化的hsp90抗体,以及利用K292乙酰化hs90(或K292Q模拟乙酰化hsp90)与CDC37磷酸化(或S13D模 拟磷酸化CDC37)复合物的解离筛选乙酰化hsp90抑制剂。具体而言,本发明提供了一种抑制乙酰化hsp90-磷酸化CDC37复合物形成的hsp90小分子抑制剂筛选模型,该活性小分子化合物阻止磷酸化的CDC37与乙酰化的hsp90形成复合物,阻断了蛋白激酶成熟的路径,其原理如图1所示。本发明中,乙酰化hsp90可以是细胞体内或体外经HDAC抑制剂等诱导产生,也可以是肿瘤组织中天然存在的含K292位点乙酰化的hsp90,还包括模拟K292位点乙酰化的K292Q-hsp90;本发明中,磷酸化的CDC37可以是细胞体内或体外含Ser13位点磷酸化修饰的CDC37,也可以是模拟Ser13磷酸化的S13D-CDC37;本发明中,采用的测试的指标是乙酰化hsp90-磷酸化CDC37复合物形成的多少,但该复合物中乙酰化hsp90及磷酸化CDC37的标记可以是多种多样的,但本发明的目的即目标是建立阻止乙酰化hsp90-磷酸化CDC37形成复合物的小分子化合物的筛选方法。更具体的,本发明的乙酰化热休克蛋白90抑制剂的筛选方法,其通过下述技术方案实现:(1)以肿瘤细胞为对象,建立稳定表达Renilla荧光素酶N-端融合K292Q-hsp90及荧光素酶C-端融合S13D-CDC37的细胞株,两种融合蛋白相互作用时产生荧光素酶活性;各单一化合物处理96孔板中稳定细胞裂解液,依据荧光素酶活性变化程度,筛选出阻止hsp90-CDC37复合物形成的乙酰化hsp90抑制剂;(2)建立稳定表达含K292Q突变的Flag-hsp90及含S13D突变的HA-CDC37的细胞株,用PerkinElmer的AlphaTechnology技术检测各单一化合物处理96孔板中培养的稳定细胞中hsp90-CDC37复合物形成产生的荧光强度变化,由此筛选出阻止hsp90-CDC37复合物形成的乙酰化hsp90抑制剂;(3)以肿瘤组织裂解液为对象,联合特异性识别K292位点乙酰化的hsp90抗体及特异性识别S13位点磷酸化的CDC37抗体,用ELISA技术检测各单一化合物处理96孔板中的乙酰化hsp90-磷酸化CDC37复合物形成产生的信号强度变化,由此筛选出阻止hsp90-CDC37复合物形成的乙酰化hsp90抑制剂。本发明的乙酰化热休克蛋白hsp90抑制剂的筛选方法基于hsp90分子中K292位点的乙酰化可增强hsp90和CDC37的结合及其分子伴侣功能的特点,破坏它们形成复合物的抑制剂即乙酰化hsp90抑制剂,提出“乙酰化Hsp90-磷酸化CDC37复合物是肿瘤治疗新靶标”的概念,并建立了破坏乙酰化hsp90-磷酸化CDC37复合物形成的乙酰化Hsp90抑制剂筛选模型,有助于抗肿瘤中有关热门靶标分子的研究。附图说明图1.筛选原理示意图,其中,P-表示磷酸化修饰基团,Ack表示乙酰化修饰基团。图2.ack292-hsp90抗体专一性,其中,ack表示C-QEELNK(Ac)TKPIW乙酰化多肽,non-ack表示C-QEELNKTKPIW非乙酰化多肽。图3.K292乙酰化hsp90在乳腺癌组织中的表达。图4.K292乙酰化hsp90在乳腺癌发展过程中的表达。图5.K292乙酰化增强hsp90与辅助分子伴侣的结合。图6.荧光素酶法筛选乙酰化hsp90抑制剂示意图。具体实施方式下面结合实验例对本发明进一步详细描述,但不限制本发明。实施例1.制备特异性识别K292乙酰化hsp90抗体分别合成15mg的乙酰化多肽C-QEELNK(Ac)TKPIW和非乙酰化多肽C-QEELNKTKPIW,每条多肽纯度大于85%;乙酰化多肽与KLH偶联作为免疫抗原,乙酰化多肽及非乙酰化多肽分别与BSA偶联作为检测抗原;使用免疫抗原免疫4只新西兰白兔,每只兔子免疫4-5次后处死,分离血清,然后用乙酰化多肽及非乙酰化多肽分别制备亲和纯化柱,亲和纯化乙酰化特异性抗体ack292-hsp90。为了检测ack292-hsp90抗体的专一性,将乙酰化多肽(ack)和非乙酰化多肽(Non-ack)依下图剂量点在硝酸纤维素(NC)膜上,晾干后用5%脱脂牛奶封闭,经Western检测ack292-hsp90抗体的专一性发现,该抗体只 识别乙酰化多肽而不识别非乙酰化多肽;图2显示了ack292-hsp90是特异性识别K292乙酰化多肽的专一性抗体。实施例2.热休克蛋白hsp90的K292位点乙酰化与肿瘤发展的相关性实验本实施例中进行了乳腺癌患者临床样本的检测,结果显示,癌症患者组织中K292位点乙酰化的hsp90明显比正常组织中hsp90乙酰化水平高(如图3所示),同样,用ack292-hsp90抗体检测小鼠中肿瘤发展过程中的hsp90乙酰化情况,用10%的FBS培养基培养过夜的MDA-MB-231乳腺癌细胞经消化后稀释成含2x107个/ml的细胞悬浮液,Balb/c裸鼠接种2x106个MDA-MB-231细胞,接种肿瘤细胞两周后(肿瘤约长至100mm3)收集小鼠肿瘤样本,用ack292-hsp90抗体检测小鼠肿瘤样本中hsp90中K292位点的乙酰化水平,结果显示,CDC37及活性CDC37在乳腺癌发展过程中的表达水平不随肿瘤的发展而变化;同样,hsp90的表达水平无明显变化,但肿瘤组织中K292位点乙酰化的hsp90随着肿瘤的不断发展,其表达水平不断升高,结果表明,K292乙酰化的hsp90和肿瘤的发展呈现正相关(如图4所示)。实施例3K292乙酰化修饰增强hsp90与辅助伴侣分子形成复合物构建含flag-标签的hsp90表达质粒,在此基础上再用PCR-定点突变的方法构建含K292Q突变和K292R突变的flag-hsp90表达质粒,其中K292Q用来模拟乙酰化修饰;乳腺肿瘤细胞MDA-MB-231于37℃、5%的CO2培养条件下,分别转染flag-hsp90表达质粒,继续培养24小时,细胞裂解液用M2-beads免疫沉淀后,检测hsp90和辅助分子伴侣形成复合物的能力,结果显示,K292位点的乙酰化促进Hsp90与辅助分子伴侣的结合,但并不影响各种辅助分子伴侣在肿瘤细胞中的表达(如图5所示)。实施例4.Renilla荧光素酶法筛选乙酰化hsp90抑制剂构建Renilla荧光素酶的N-端(1-229,NRL)和含K292Q突变hsp90的N-端融合表达质粒(NRL-hsp90-K292Q)及Renilla荧光素酶的C-端(230-311,CRL)和含S13D突变CDC37的C-端融合表达质粒(CDC37-S13D-CRL),建立稳定表达 NRL-hsp90-K292Q及CDC37-S13D-CRL的肿瘤细胞株,两种融合蛋白相互作用时会使荧光素酶活性恢复,因此,稳定细胞株以荧光素酶活性强度为选择依据,选取荧光素酶活性强度最高的用于后面的实验;稳定细胞于37℃和5%的CO2条件下培养24小时后裂解,将裂解液置于96孔板中,用各单一化合物处理96孔板中稳定细胞裂解液,4℃孵育1小时后检测荧光强度变化,依据荧光强度变化程度,筛选出阻止hsp90-CDC37复合物形成的乙酰化hsp90抑制剂;本实施例中用上述方法筛选含1080个FDA批准的药品化合物库,筛选结果显示抑制率大于50%的药物如表1所示:表1荧光素酶筛选结果抑制率(%)化合物库编号化合物54S1014Bosutinib97S1166Cisplatin80S1289Carmofur97S1680Disulfiram58S1748Nisoldipine62S1786Verteporfin78S1917Crystalviolet97S1949Menadione89S2499PhenoxybenzamineHCl54S4352Rolitetracycline实施例5用PerkinElmer的AlphaTechnology技术检测乙酰化hsp90抑制剂构建含K292Q突变的Flag-hsp90及含S13D突变的HA-CDC37表达质粒,建立稳定表达Flag-hsp90-K292Q及HA-CDC37-S13D的肿瘤细胞株;稳定细胞于37℃和5%的CO2条件下培养24小时后裂解,将裂解液置于96孔板中,用各单一化合物处理96孔板中稳定细胞裂解液,4℃孵育1小时后,用PerkinElmer的Alpha Technology技术检测各单一化合物处理96孔板中K292Q-hsp90-CDC37-S13D复合物形成产生的荧光强度变化,由此筛选出阻止hsp90-CDC37复合物形成的乙酰化hsp90抑制剂。实施例6用ELISA技术检测乙酰化hsp90抑制剂基于肿瘤组织中hsp90的K292位点乙酰化修饰程度高的依据,本实施例以肿瘤组织裂解液为对象,联合特异性识别K292位点乙酰化的hsp90抗体及特异性识别S13位点磷酸化的CDC37抗体,采用ELISA技术筛选乙酰化hsp90抑制剂;用小鼠移植瘤或离体的肿瘤患者的肿瘤组织为乙酰化hsp90的来源,将肿瘤组织裂解液置于96孔板中,各单一化合物处理96孔板中的乙酰化hsp90-磷酸化CDC37复合物形成,4℃孵育1小时;将96孔板中样品同体积地转移到用S13位点磷酸化CDC37抗体包被的ELISA板中,37℃孵育1小时,再用酶标记的特异性识别K292位点乙酰化的hsp90抗体37℃孵育1小时后,加入TMB底物溶液,37℃继续孵育10~30分钟,检测各单一化合物处理96孔板中的乙酰化hsp90-磷酸化CDC37复合物形成产生的信号强度变化,筛选出阻止hsp90-CDC37复合物形成的乙酰化hsp90抑制剂;本实施例中筛选出的能有效抑制乙酰化hsp90和CDC37复合物的形成的乙酰化hsp90抑制剂如表1所示;还包括辛伐他丁及美伐他汀药物。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1