用于执行多重分析方法的对照与流程
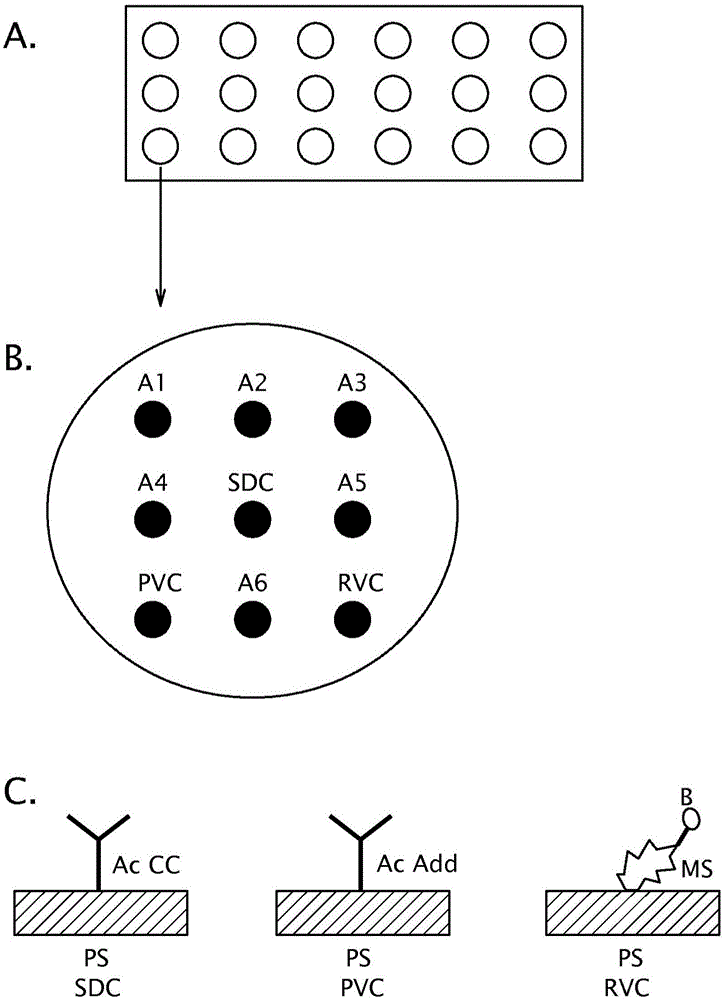
本发明涉及能够用于确保包括一个或若干个步骤的多重分析方法的结果的对照。发明背景多重分析方法允许同时检测在同一样品中的若干种被分析物的潜在存在。多重分析具有若干优点,如:通过使得可以同时分析若干种被分析物而节省时间,试剂和消费品的较低消耗,以及较低量的为检测被分析物所需的样品。通常,使用一种或若干种对照,以验证在寻求检测一种或若干种被分析物的存在的分析方法的结束时获得的结果。由分析装置提供的结果的可靠性实际上是一个主要问题,尤其是当涉及意在用于医学诊断和/或献血(transfusiondonation)资格的分析的时候。一种传统上使用的阳性对照由校验对已知化合物的检测来构成,所述已知化合物以已知的量使用并且对应于在给定样品中寻求其潜在存在的被分析物。然而,此类型的对照仅使得可以验证分析方法的总体的执行,并且没有使得可以验证方法的每个步骤。此外,可以使用其他类型的对照。例如,文献WO2004/046685使用对照以校验在免疫组织化学试验中使用的试剂的品质。对于那种目标,使用对照载片,其包含不同的对照化合物的一系列溶液。在对照化合物处的对照侧的阳性着色必须仅在如果在免疫标记方法期间使用了所述对照化合物的专门抗体或所述对照化合物的报道物(reporter)或底物的情况下才被观察到。这一用于校验试剂的品质的方法需要在对照载片上使用大数量的对照化合物。事实上,目前没有使得可以在多重分析方法的情况下对全部步骤(尤其是,样品的沉积、试剂的沉积、不同的水和温育循环)进行对照的简单手段。然而,在输血和医疗诊断的领域中,获得高水平的安全性和追踪能力是至关重要的。因此,对于提供使得可以保证在执行多重分析方法期间获得的结果的可靠性并且尤其使得可以验证方法的每个步骤的方案,存在着实际需要。发明详述本发明基于由发明人发现的对照手段,其通过校验多重分析方法的每个步骤已经正确进行(且不是通过仅仅校验方法的总体的执行),使得可以保证获得的结果的可靠性。因此,发明人首次提供了使得可以验证样品本身的沉积以及更一般地验证方法的不同步骤的对照。这样,通过仅将根据本发明的两或三种对照组合,可以验证样品的沉积步骤、在样品中待检测的被分析物的专门检测配体的一个或多个沉积步骤、不同的洗涤和温育步骤,以及如果可能,检测标记物的报道物的沉积步骤和/或偶联到所述报道物的标记物的底物的沉积步骤。在根据本发明的多重分析方法中,为了验证整个多重方法的每个步骤,仅需要两或三种对照。除了验证结果以外,使用根据本发明的对照也使得可以鉴别在执行多重分析方法期间存在的潜在错误,以及例如修改相应的一个或多个步骤以对分析方法的执行进行改进。本发明也具有容易执行、仅需要有限数量的对照、不对分析方法添加附加步骤以及不需要使用附加器材(例如,不需要使用分光光度计)的优点。事实上,在单一位置(例如,具有其中安放样品的孔的管)完成分析方法的多个步骤,并且同时加工对照(例如以斑点(spot)或珠的形式)作为用于检测被分析物的斑点或珠。第一类根据本发明的对照是样品的沉积的对照,使得可以校验样品的沉积。在下文概述某些实施方案中,样品的沉积的对照也使得可以校验一种或若干种被分析物检测配体的沉积。“样品或添加剂的沉积”或者“样品或添加剂的添加”指的是,样品或至少一种添加剂在固定在固体支持体上的感兴趣的化合物的存在下的安放。“至少一”在本申请的含义内指的是一或若干,若干尤其意味着二、三、四、五、六、七、八、九、十、十一、十二、十三、十四、十五、十六或多于十六。“检测配体、报道物或底物的沉积”或“检测配体、报道物或底物的添加”指的是检测配体、报道物或底物在固定在固体支持体上的感兴趣的化合物或任何固定在所述感兴趣的化合物上的化合物的存在下的安放。第二类对照是被分析物的检测配体的沉积的对照,使得可以校验在样品中待检测的被分析物的一种以上专门检测配体(检测配体的混合物)的沉积。此对照也使得可以验证温育和洗涤步骤。第三类对照是报道物的沉积的对照,使得可以校验一个或多个显影步骤已经正确进行。报道物的沉积的对照在检测配体的间接标记的情况下是有用的。最后,根据本发明的对照特别适合用于在微列阵中(例如在微量培养板(microplate)型的固体支持体上)或者在液相芯片中(例如在珠型的固体支持体上)进行多重分析方法。样品待分析的样品优选是生物样品。生物样品可以是生物流体,如血液、血液衍生物(如血浆或血清)、尿液、脑脊髓液、唾液,或组织样品,如由活组织检查获得的组织、细胞或细胞组、植物提取物,或它们的组合。血液衍生物指的是任何从血液样品获得的产物,尤其是流体。待分析的样品也可以是培养基和/或培养物上清液。在被分析之前,样品可以经历一个或若干个前处理步骤,如稀释、离心、热和/或化学处理、细胞溶解(例如通过一种或若干种离液剂、一种或若干种还原剂和/或通过加热)、萃取、PCR(聚合酶链反应)、添加未被标记的检测配体、或它们的组合。对于执行中和试验来说,添加未被标记的检测配体尤其有用,中和试验本身是本领域技术人员已知的试验。样品也可以是至少两种样品的混合物,所述样品可以是相同性质或不同性质的。不同性质的样品的混合物的实例是血浆和血清的混合物、血液和血浆的混合物、血清和血浆的混合物、或血液、血清和血浆的混合物。一种优选的根据本发明的样品是血液和/或血液衍生物的样品或样品混合物。被分析物在样品中待检测的被分析物可以是人们希望在样品中检测和/或量化任何类型的天然的或合成的化合物。被分析物可以是例如蛋白、肽、糖蛋白、碳水化合物、脂质、细胞、细胞器、病毒或核酸。细胞可以是动物细胞、植物细胞、细菌细胞、原生动物、后生动物细胞、酵母细胞、真菌细胞或原生动物。核酸指代通过磷酸二酯键连接的核苷的聚合物,如脱氧核糖核酸(DNA)、核糖核酸(RNA)或它们的类似物,如硫代膦酸酯或硫代酯,以单链或双链的形式。被分析物或多种被分析物的至少一种或多种被分析物例如选自由以下各项组成的组:抗原、抗体、抗体片段、半抗原、激素、激素受体、酶或核酸。在一个优选的实施方案中,一种或多种被分析物不是核酸。一种或多种被分析物例如选自由以下各项组成的组:抗原、抗体、抗体片段、半抗原、激素、激素受体和酶。在此,“抗原”指的是天然的、重组的或合成的分子,其被免疫系统的抗体或细胞所识别并且当它在对宿主的免疫系统合适的条件下存在时能够引起免疫应答。这可以是分子,尤其是多肽,包括或由以下构成:至少一个可以是线性或构象的表位。术语“线性表位”指的是能够结合至针对所述抗原的抗体分子的多肽,尤其是包含或由以下构成的肽:3至15个、更通常5至15个氨基酸,优选至少6、8、10或12个氨基酸。术语“构象表位”指的是被抗体所识别并且由空间中的若干氨基酸的并列所决定的三维结构,所述若干氨基酸在此抗体所针对的蛋白质的肽序列(或多肽)中可以是不连续的,但是所述若干氨基酸由于多肽链的折叠而使它们自己在空间中相互靠近,并且因此可以形成可以被抗体识别的图案。抗原是例如蛋白质(尤其是天然的或重组的蛋白质)、肽(例如,合成肽)、糖蛋白、碳水化合物或脂质,所述肽能够与载体分子例如BSA(牛血清白蛋白)有关联或没有关联。在本申请中,“载体分子”尤其指的是蛋白质或碳水化合物载体分子。载体分子可以是多肽(尤其是蛋白质或肽),其可以是或可以不是天然的(例如,重组的蛋白质或合成的肽),官能化的聚合物(如葡聚糖、多糖或聚赖氨酸)或混合的共聚物(尤其是不同氨基酸的共聚物,例如赖氨酸-酪氨酸共聚物)。载体分子可以是抗体(尤其是单克隆抗体或多克隆抗体),例如免疫球蛋白。一种实例载体分子是BSA。在一个具体实施方案中,载体分子不是抗体。“半抗原”在此指的是能够被免疫系统所识别的具有低分子量的分子,但是其仅当它偶联到载体分子时才是免疫原性的。被分析物或多种被分析物中的至少一种优选是使得可以诊断受试者中可以是或可以不是病理性的病况或者诊断发展可以是或可以不是病理性的病况的风险的化合物。非病理性的病况的实例是妊娠。受试者可以是人类、非人类动物或植物。非人类动物优选是哺乳动物,如猫、狗、猴、兔、小鼠或大鼠。术语“人类”被广泛使用,并且尤其指代任何年龄的男人或女人,如婴儿、儿童、青少年、成人或老人。当被分析物或多种被分析物中的至少一种是抗原时,它优选是使得可以诊断传染的抗原,例如由病毒、细菌、真菌或寄生虫引起的传染。当被分析物或多种被分析物中的至少一种是抗体时,它优选是使得可以诊断传染的抗体,例如由病毒、细菌、真菌或寄生虫引起的传染。典型地,这可以包括以下各项的一种或若干种抗原和/或一种或若干种抗体:-病毒,如HIV(人类免疫缺损病毒),尤其是HIV-1或HIV-2,HBV(乙型肝炎病毒),HCV(丙型肝炎病毒),HPV(人乳头瘤病毒),HTLV(人类嗜T淋巴细胞病毒),尤其HTLV-I或HTLV-II,-寄生虫,如可以在人类或非人类动物内引起以下各项的寄生虫:弓形体病(尤其是弓形虫(Toxoplasmagondii)),疟疾(尤其是疟原虫属(Plasmodiumgenus)的寄生虫,例如恶性疟原虫(Plasmodiumfalciparum),间日疟原虫(Plasmodiumvivax),卵形疟原虫(Plasmodiumovale),三日疟原虫(Plasmodiummalariae)或诺氏疟原虫(Plasmodiumknowlesi))或查加斯(Chagas)病(尤其是克鲁斯锥虫(Trypanosomacruzi)),或-细菌,如能够在人类或非人类动物内引起以下各项的细菌:梅毒(苍白密螺旋体(Treponemapallidum))或莱姆(Lyme)病(尤其是来自包柔氏螺旋体属(Borreliagenus)的细菌)。“寄生虫”在此指的是充当相对于身体的寄生虫的并且引起寄生虫病的后生动物或原生动物。在本发明的含义内的寄生虫因此不是病毒、细菌或真菌。被分析物或多种被分析物中的至少一种也可以是用于疾病的标记物,如心血管病的标记物或糖尿病标记物,疾病如肝炎的进展的标记物,由病毒、细菌、真菌或寄生虫引起的传染的进展的标记物,对治疗例如对抗病毒治疗、抗生素治疗或癌症治疗的耐性的标记物。可以在多重分析方法期间,在样品中同时检测若干种(例如,二、三、四、五、六、七、八、九、十、十一、十二、十三、十四、十五或多于十五种)本申请中所述的被分析物。这可以使得可以在相同的样品中诊断受试者中一种或若干种传染或疾病、传染或疾病的进展、病况(病理性的或不是病理性的)、发展病况(病理性的或不是病理性的)的风险或对治疗的耐性的标记物。在多重分析方法期间检测的被分析物可以是相同性质的(例如仅为抗体或仅为抗原)或不同性质的(例如,至少一种抗原和至少一种抗体)。优选地,不用检测标记物标记待分析的一种或多种被分析物。在一个优选的实施方案中,待分析的一种或多种被分析物选自抗体和/或抗原。对照化合物在此,“对照化合物”指的是在待分析的样品中天然存在的化合物,优选是在所有相同性质的样品中可探测的浓度。在待分析的样品中天然存在的化合物可以是在样品中初始存在的化合物或在样品中初始存在的化合物的衍生物。可以在分析方法之前的一个或若干个样品处理步骤的结束时获得在样品中初始存在的化合物的衍生物。这些步骤尤其是如上文定义的,例如热和/或化学处理、细胞溶解、萃取、PCR(聚合酶链反应)、添加未被标记的检测配体、或它们的组合。在样品中初始存在的化合物的衍生物是例如PCR产物和/或通过热和/或化学处理、细胞溶解、添加未被标记的检测配体或它们的组合改性的化合物。优选地,在待分析的样品中天然存在的化合物是在样品中初始存在的化合物。在这种情况下,如果在分析方法之前进行了一个或若干个样品处理步骤,化合物因此在样品的任何在前处理步骤之前存在。在待分析的样品中天然存在的化合物不包括这样的化合物:其在分析的时候在样品中存在但却是在样品的一个或若干个在前处理步骤期间加入的或是源自在该期间加入至样品的化合物的。当样品是至少两种样品的混合物时,对照化合物是在所述多种样品的至少一种中、优选在混合物的每种样品中天然存在的化合物。“相同性质的样品”指的是在不同的受试者中以基本上相同的方式提取的或在相同的受试者中在不同的时间段提取的相同起源的样品,如果适用的话,已经经历了相同的一种或多种处理。“可检测的浓度”是使得可以在试验期间检测对照化合物的存在的浓度,尤其是在三明治(sandwich)型的免疫学试验期间,其中对照化合物结合到固定在固体支持体上的捕捉抗体,并且通过被标记的检测抗体被检测。优选地,对照化合物的浓度在相同性质的样品中变化很小。表述“对照化合物的浓度在相同性质的样品中变化很小”在此意味着从一个样品到另一个变化小于60%、优选小于40%、更优选小于20%的浓度,浓度以μg/mL给出。在一个有利的实施方案中,当待检测的一种或多种被分析物存在时,对照化合物在样品中以与这些被分析物的浓度相同的大小等级的浓度存在。优选地,对照化合物在样品中以与待检测的被分析物的每种的浓度的相同大小等级的浓度存在。对照化合物的浓度是与待测量的被分析物的每种的浓度相同大小等级的。优选地,对照化合物的浓度比待化验的所述被分析物(当它在样品中存在时)的浓度低或高多于5个十进制量级(decade),优选至少4个十进制量级,更优选至少3个十进制量级。例如,对于1ng/mL的待化验的被分析物的浓度来说,对照化合物浓度不大于100μg/mL,优选不大于10μg/mL,更优选不大于1μg/mL。优选地,当在含有被分析物的待分析的样品中的此被分析物的浓度与对照化合物的浓度之间的偏差不大于5个十进制量级、优选不大于4个十进制量级、更优选不大于3个十进制量级时,对照化合物的浓度是与被分析物的浓度相同大小等级的。在人类或动物起源的样品的情况下,对照化合物优选具有在被讨论用于分析的人类或动物种群中保留的结构。在一个优选的实施方案中,对照化合物在考虑的种群中不具有多态性。对照化合物优选不是疾病的标记物。当通过抗体检测至少一个被分析物时,对照化合物优选是可以通过抗体检测的化合物。对照化合物优选不被样品的任何可能的一个或多个在前处理步骤改变从而可以通过抗体检测。对照化合物可以是分子,或是至少两个可以同样的或不同的分子的配合物。作为实例,当待分析的样品是血液或血浆样品尤其是人类血液或人类血浆时,对照化合物可以是:配合到运铁蛋白的运铁蛋白的可溶性受体,激素,例如类固醇,凝血因子,例如选自因子VIII、IX、X、XI、XII或XIII的凝血因子。在一个具体实施方案中,对照化合物不是因子XIII。在一个特别的实施方案中,对照化合物不是G(IgG)尤其是人类IgG型的免疫球蛋白,和/或不是M(IgM)尤其是人类IgM型的免疫球蛋白,或更通常地,不是免疫球蛋白尤其是人类免疫球蛋白。配合到运铁蛋白的运铁蛋白的可溶性受体是包含两个运铁蛋白的可溶性受体的分子和两个运铁蛋白分子的配合物。例如,配合到运铁蛋白的运铁蛋白的可溶性受体通常以以下浓度存在:在来自人类受试者的待分析的样品中占0.8μg/mL至4μg/mL的浓度,与受试者的病况无关。当对照化合物的浓度可以变化时,例如基于样品的性质和/或从其取得样品的受试者的病况变化时,使用至少两种不同的对照化合物可以是有利的。添加剂添加剂是不存在于样品中的化合物或化合物组,即,并不初始存在于样品中,或并不源自初始存在于样品中的化合物。添加剂尤其可以是抗原或半抗原,所述抗原或所述半抗原能够偶联或能够不偶联到载体分子。作为实例,对于人类或动物生物样品来说,不存在于待分析的样品中的化合物或多种化合物中的一种例如选自由以下各项组成的组:地高辛配基(digoxigenin)、植物激素、生物碱、植物类固醇、核酸和杀虫剂。在一个优选的实施方案中,添加剂不是核酸。地高辛配基是从某些植物中提取的类固醇。杀虫剂是例如杀昆虫剂,如有机磷酸酯或有机氯,以及除草剂,如三嗪或苯基脲,或它们的组合。一种优选的根据本发明的添加剂是偶联到载体分子的地高辛配基、偶联到载体分子的茁长素、偶联到载体分子的三嗪,所述载体分子例如是BSA。一种优选的根据本发明的添加剂是偶联到BSA的地高辛配基。此外,在执行多重分析方法期间,添加剂不干扰对被分析物的检测。尤其是,添加剂不干扰待检测的被分析物、所用的一种或多种捕捉配体、所用的一种或多种检测配体、一种或多种对照化合物、如果可用的话一种或多种报道物、如果可用的话一种或多种底物、以及信号的检测。在一个特别的实施方案中,添加剂不包含或由以下组成:生物素或生物素的类似物和/或抗生物素蛋白或抗生物素蛋白的类似物(尤其是链霉抗生物素蛋白或中性抗生物素蛋白(neutravidin)),所述生物素、抗生物素蛋白或它们的类似物中的一种是接枝在载体分子上的或不是接枝在载体分子上的。捕捉配体捕捉配体是固定在固体支持体上尤其是在斑点处或在珠的表面处的化合物。捕捉配体优选是固定在固体支持体上尤其是在斑点处或在珠的表面处的抗体或抗原。捕捉配体可以对于在样品中的待检测的被分析物、对照化合物或添加剂来说是专门的。捕捉配体可以是抗体、抗原、肽、碳水化合物、脂质或核酸。在一个优选的实施方案中,捕捉配体不是核酸。在一个优选的实施方案中,捕捉配体选自由以下各项组成的组:抗体、抗原、肽、碳水化合物和脂质。捕捉配体优选是抗体或抗原。当捕捉配体是抗体时,它例如包括单克隆抗体或多克隆抗体。检测配体检测配体意在揭示它专门针对的化合物的存在。检测配体可以是抗体、抗原、肽、碳水化合物、脂质或核酸。在一个优选的实施方案中,检测配体不是核酸。在一个优选的实施方案中,检测配体选自由以下各项组成的组:抗体、抗原、肽、碳水化合物和脂质。检测配体优选是抗体或抗原。当检测配体是抗体时,它例如包括单克隆抗体或多克隆抗体。检测配体优选是被标记的检测配体,即,向其共价或非共价附接了检测标记物(其可以例如是生物素或过氧物酶)的检测配体。当检测配体是未被标记的时,可以通过使用所述检测配体的专门的被标记的抗体,获得它的检测。检测配体可以专门针对在样品中的待检测的被分析物、对照化合物或添加剂。检测配体与所用的捕捉配体或所用的多种捕捉配体中的一种可以是同样的,区别在于检测标记物的任何存在,并且/或者在与被捕捉配体或多种捕捉配体中的一种结合的区域相同的区域连结到它专门针对的化合物。在这种情况下,如果捕捉配体和所述检测配体是抗体,则其涉及“同种型三明治”。捕捉配体和检测配体或多种检测配体中的一种可以针对它们所专门针对的化合物处的分开的区域,以避免捕捉配体和检测配体关于它们所专门针对的化合物由于位阻导致的竞争。在这种情况下,如果所述检测配体和所述捕捉配体是抗体,那么它涉及“异种型三明治”。在一个优选的实施方案中,专门针对同一化合物的检测配体和捕捉配体不结合到所述化合物上的同一位置。更优选地,所述检测配体结合到远离与所述捕捉配体的连结区域的所述化合物的区域。在另一个优选实施方案中,检测配体与捕捉配体是同样的,区别在于检测标记物的任何存在,并且/或者在与被所述捕捉配体结合的区域相同的区域结合到它专门针对的化合物,尤其是当它专门针对的化合物是具有至少两个同样的结合区域的配合物的形式时。检测标记物检测标记物可以是直接标记物或间接标记物。直接标记物是其信号可以被直接检测(即不需要在前添加报道物)的标记物。直接标记物例如选自由以下各项组成的组:放射性同位素、荧色物、和来自周期表的重元素如镧系元素、发光化合物、过渡金属如钌、显色剂、以及有色的、荧光的或发光的纳米粒子。在本申请中,“发光化合物”尤其指代电致发光的、热致发光或(优选)化学发光的化合物。可以用作直接标记物的一种实例发光化合物(更具体地,热致发光化合物)由二氧化硅纳米粒子组成,所述二氧化硅纳米粒子包含(例如掺杂有)二氧杂环丁烷化合物的分子,尤其是1,2-二氧杂环丁烷化合物,或二氧杂环丁烷化合物的衍生物,例如,1,2-二氧杂环丁烷的衍生物。间接标记物是这样的标记物:对于其来说,信号的检测需要在前添加报道物,并且如果可用,添加偶联到所述报道物的标记物的底物。报道物是间接标记物的底物或是专门结合到间接标记物的分子,所述分子它自己是直接或间接标记物或它自己偶联到直接或间接标记物。间接标记物可以例如是酶(尤其是,从底物产生发光化合物的酶)、生物素、抗生物素蛋白、链霉抗生物素蛋白、中性抗生物素蛋白、半抗原、抗原或抗体。酶的报道物是例如所述酶的底物。发光化合物的报道物是例如酶或催化剂。生物素的报道物是,例如,抗生物素蛋白、链霉抗生物素蛋白或中性抗生物素蛋白,优选与直接标记物或间接标记物如酶或催化剂偶联。实例酶是过氧物酶,例如辣根过氧物酶(HRP)。一种优选的根据本发明的生物素报道物是与过氧物酶、优选辣根过氧物酶偶联的链霉抗生物素蛋白。在本发明的一个特别的实施方案中,所用的检测标记物或多种检测标记物中的一种是或者具有作为底物的:鲁米诺(3-氨基苯二甲酰肼,也称作5-氨基-2,3-二氢-酞嗪-1,4-二酮,分子式C8H7N3O2)、异鲁米诺(也称作4-氨基苯二甲酰肼)、吖啶、腔肠荧光素(coelenterazine)、二氧杂环丁烷或过氧草酸化合物,或它们的衍射物的一种,且尤其是在出版物DodeigneC.等人(2000),Talanta51,415-439,“作为诊断工具的化学发光.回顾(Chemiluminescenceasdiagnostictool.Areview)”中描述的化合物。根据一个优选的本发明的实施方案,所用的检测标记物或多种检测标记物中的一种具有作为底物的鲁米诺、异鲁米诺、或它们的衍生物的一种。鲁米诺或异鲁米诺的衍生物优选分别是通过所有可能的一种或多种修改(例如,化学的和/或酶的)从鲁米诺或异鲁米诺获得的分子。鲁米诺或异鲁米诺的衍生物例如是过氧物酶的底物,所述过氧物酶与鲁米诺或异鲁米诺的所述衍生物的反应使得可以产生化学发光化合物。异鲁米诺的衍生物可以是例如氨基乙基异鲁米诺(或AEI)、氨基乙基乙基异鲁米诺(或AEEI)、氨基丁基异鲁米诺(或ABI)、氨基丁基乙基异鲁米诺(或ABEI)、氨基戊基乙基异鲁米诺(或APEI)、氨基己基异鲁米诺(或AHI)、氨基己基乙基异鲁米诺(或AHEI)、氨基辛基甲基异鲁米诺(或AOMI)或氨基辛基乙基异鲁米诺(或AOEI),如在出版物DodeigneC.etal(2000),Talanta51,415-439,“作为诊断工具的化学发光.回顾(Chemiluminescenceasdiagnostictool.Areview)”中所述。显影一个或多个显影步骤对应于由一种或多种检测标记物产生的信号的检测。当被检测的信号是荧光发光信号时,“产生的信号”尤其是“发射的信号”。一个或多个显影步骤取决于所用的标记物的类型。由荧光团型的直接标记物产生或发射的信号可以通过荧光直接被读取。酶型、发光化合物型或生物素型的间接标记物需要添加报道物。如上文指出的,生物素型的间接标记物需要添加报道物,优选偶联到标记物的报道物。如果报道物偶联到间接标记物,例如酶,则必须在后面的步骤中添加那种间接标记物的底物,例如那种酶的底物。作为实例,如果报道物偶联到过氧物酶,则必须在后面的步骤中添加那种酶的底物,如鲁米诺。在一个优选的实施方案中,通过化学发光检测信号,所述信号是通过化学发光化合物产生的,所述化学发光化合物是通过过氧物酶与它的底物例如鲁米诺、异鲁米诺和/或鲁米诺或异鲁米诺的衍生物的反应产生的。过氧物酶与它的底物的这一反应通常也需要氧化剂的存在,并且如果可用,需要电子中介体的存在。通常,使用包含至少两个溶液的试剂盒完成化学发光反应。第一溶液包含用于过氧物酶的底物,例如鲁米诺、异鲁米诺和/或鲁米诺或异鲁米诺的衍生物,和电子中介体;第二溶液包含氧化剂。作为实例,可以使用以下试剂盒:″Immun-starwesternC″(Bio-Rad,UnitedStates),″ELISTARETACUltraELISA″(Cyanagen,Italy),″SupersignalWestPico″(ThermoScientific,UnitedStates),″ChemiluminescentSensitivePlusHRP″(Surmodics,UnitedStates)。适合用于安全的多重分析的固体支持体用于进行根据本发明的分析方法的一种或多种支持体是固体支持体。固体支持体可以由任何适合于进行分析方法的材料制成。固体支持体是例如具有聚合物的或聚合物的混合物的基底的支持体。适合的根据本发明的固体支持体是例如由聚苯乙烯、聚丙烯、聚(甲基)丙烯酸酯、聚丁二烯或它们的组合制成的支持体。另一类型的适合的根据本发明的固体支持体是例如无机支持体,如玻璃和/或金属支持体。支持体可以是板、微量培养板、载片、珠或膜形式的。适合的固体支持体的另一个实例是膜,例如由硝基纤维素、PVDF(聚亚乙烯氟化物)、尼龙或它们的组合制成的膜。一种优选的固体支持体是由聚苯乙烯或聚丙烯制成的。取决于所用的技术,可以使用单一的固体支持体(例如包含至少一个区划(compartment)的固体支持体,所述区划包含至少两个斑点)或在一套固体支持体(例如一套珠)上进行多重分析方法。根据本发明的对照可换位用在单一的固体支持体上或一套固体支持体上。在第一种情况下,对照以及被分析物的检测手段是斑点形式的,并且在第二种情况下,对照以及被分析物的检测手段是珠形式的。珠(其也可以称为“粒子”、“微珠”或“微粒”)可以在溶液或悬浮液中或固定在另一种固体支持体例如板、微量培养板、载片或膜上,并且尤其是固定到固体支持体(例如微量培养板)的一个或若干个孔的底部。取决于所用的一种或多种固体支持体,样品的沉积的对照称为对样品的沉积进行对照的斑点或对样品的沉积进行对照的珠;被分析物的一种或若干种检测配体的对照称为对被分析物的检测配体的沉积进行对照的斑点或对被分析物的检测配体的沉积进行对照的珠;并且报道物的沉积的对照称为对报道物的沉积进行对照的斑点或对报道物的沉积进行对照的珠。在一个优选的实施方案中,一种或多种固体支持体适合用于执行三明治型的免疫学试验的形式的多重分析。根据本发明的固体支持体还具有以下优点:能够独立地从样品的母体检测被分析物。例如,可以使用根据本发明的固体支持体,从血液样品或血液衍生物(如血浆或血清)或血液和/或血液衍生物样品的混合物中,进行存在于血液中的被分析物的检测。适合用于在斑点上安全的多重分析的固体支持体本发明特别地涉及适合用于至少一个样品的多重分析的固体支持体,其包含至少一个区划,所述区划包含至少一个对照斑点和至少两个用于被分析物的检测斑点,其特征在于所述对照斑点选自由以下各项组成的组:用于对样品的沉积进行对照的斑点、用于对被分析物的检测配体的沉积进行对照的斑点和用于对报道物的沉积进行对照的斑点。固体支持体包含至少一个区划(也称作分析区域),优选至少两个区划。根据本发明的一个特别的实施方案,固体支持体包含单一的区划。所述单一的区划可以是包含一个或若干个壁的区划。备选地,所述单一的区划可以不具有壁并且那么与固体支持体它自己是可比的。那么区划的底部可以由固体支持体的上面构成。这样的包含可以包括或可以不包括一个或若干个壁的单一区划的固体支持体的一个实例是载片或膜。在其中固体支持体(例如载片或膜)包含单一区划的本发明的一个特别的实施方案中,典型地,每个分析的样品使用至少一个(例如一个或两个)固体支持体。当固体支持体包含至少两个区划时,它们是相互隔离的,使得它们不相互沟通,即,使得在分析期间用于分析的各种组合物或溶液不能从一个区划流通到另一个。因此,添加到一个区划中的溶液将不进入其他的区划。例如,一个或多个区划包含或由以下组成:底部和一个或若干个壁,所述一个或多个壁将一个或多个区划相互隔离开,使得它们不相互沟通。每个待分析样品使用固体支持体的一个区划。一个实例区划是孔。固体支持体是例如微量培养板。微量培养板典型地是具有96个孔或386个孔的微量培养板。用于分析样品的固体支持体的区划包含至少三个斑点,例如三个斑点、四个斑点或五个斑点,或至少六个斑点,优选六个斑点、七个斑点、八个斑点,更优选至少九个斑点,例如九个斑点、十个斑点、十一个斑点、十二个斑点、十三个斑点、十四个斑点、十五个斑点、十六个斑点或多于十六个斑点。在此,“斑点”指的是固体支持体的区划的区域,该区域包含至少一种通过非共价物理化学相互作用(尤其是弱键类型,例如,离子的、范德华、氢和/或疏水的)或通过共价键结合到所述区划的表面的感兴趣的化合物。斑点除了一种或多种感兴趣的化合物之外可以含有至少一种聚合物,尤其是至少一种包括亲水基团的聚合物,例如至少一种水凝胶。在本申请的含义内,“至少”指的是一或若干,若干尤其意味着二、三、四、五、六、七、八、九、十、十一、十二、十三、十四、十六或多于十六。斑点对应于孔限定的区域,通常是球形的或卵形的并且是小的,例如包含0.0078mm2至5.309mm2之间、优选0.196mm2至3.142mm2、更优选包含0.503mm2至2.011mm2。斑点具有平圆形的、圆柱形的或大约平圆形的或圆柱形的(例如卵形的)形状,尤其是当固体支持体是微量培养板或载片时。备选地,斑点可以具有正方或矩形的形状(这可以尤其是条带),例如当固体支持体是膜时,或任何其他形状。使用本领域技术人员熟知的技术,如在专利US7,470,547B2、US6,576,295B2、US5,916,524A和US5,743,960A中所述的那些,获得斑点。例如,通过将至少一滴含有确定量的一种或多种所述感兴趣的化合物的溶液沉积在区划的表面上的特殊位置中,获得斑点。当斑点包含至少一种聚合物(例如至少一种水凝胶)时,可以通过将至少一滴含有确定量的一种或多种所述感兴趣的化合物的溶液沉积在其上已经预先沉积了所述聚合物的区划的表面上的特殊位置中,获得所述斑点。也可以通过一种或多种所述感兴趣的化合物在区划的表面上的特殊位置中的原位合成,获得斑点。在这种情况下,一种或多种所述感兴趣的化合物有资格作为探针。这可以涉及核酸或肽(见例如文献US5,143,854)。区划的表面也称作“固相”。感兴趣的化合物通常是捕捉配体、偶联到间接标记物的载体分子或间接标记物。捕捉配体、偶联到间接标记物的载体分子和间接标记物尤其是如上文定义的。在一个有利的实施方案中,固体支持体的每个区划包含相同的斑点数量。此外,固体支持体的每个区划包含相同的斑点数量和相同的斑点组成。在另一个有利的实施方案中,支持体可以包含一个或若干个区划,其没有斑点,或具有不同的斑点数量和/或斑点组成。支持体的部分或全部可以例如包含至少两个分开的斑点或区划的组(或类型),分开的组的每个具有不同的斑点数量和/或斑点组成。区划包含至少一个对照斑点(例如,至少一个用于对样品的沉积进行对照的斑点),优选至少两个对照斑点,和至少两个用于被分析物的检测斑点。相对于每种待检测的被分析物,区划通常包含至少一个斑点,每种被分析物例如能够对应于待检测的传染或疾病、传染或疾病的进展、受试者的病况(病理性的或不是病理性的)、发展病况(病理性的或不是病理性的)的风险或对治疗的耐性的标记物。区划的若干斑点也可以意在分析相同的被分析物。用于对样品的沉积进行对照的或用于对被分析物的检测配体的沉积进行对照的斑点优选包含捕捉配体。捕捉配体尤其是如上文所定义的。同一斑点可以包含若干不同的捕捉配体(例如,若干抗体和/或抗原),它们通常针对相同的待检测的病理、传染或疾病是专门的(尤其针对相同的病毒、相同的细菌、相同的真菌或相同的寄生虫是专门的),或者针对相同的传染或疾病的进展、相同的受试者的病况(病理性的或不是病理性的)、相同的发展病况(病理性的或不是病理性的)的风险或相同的对治疗的耐性的标记物是专门的。本发明特别涉及适合用于至少一种样品的多重分析的固体支持体,其包含至少一个区划,所述区划包含至少一个对照斑点和至少两个用于被分析物的检测斑点,其特征在于所述对照斑点是用于对样品的沉积进行对照的斑点或用于对被分析物的检测配体的沉积进行对照的斑点。所述区划还可以包含至少一个用于对报道物的沉积进行对照的斑点。在一个优选的实施方案中,用于对样品的沉积进行对照的斑点或用于对被分析物的检测配体的沉积进行对照的斑点包含一种或至少一种捕捉配体,所述一种或多种捕捉配体不是核酸。更通常地,用于对样品的沉积进行对照的斑点或用于对被分析物的检测配体的沉积进行对照的斑点优选不包含核酸。在一个优选的实施方案中,用于对样品的沉积进行对照的斑点或用于对被分析物的检测配体的沉积进行对照的斑点包含一种或至少一种选自由以下各项组成的组的捕捉配体:抗体、抗原、肽、碳水化合物和脂质。本发明特别涉及适合用于至少一种样品的多重分析的固体支持体,其包含至少一个区划,所述区划包含至少两个对照斑点和至少两个用于被分析物的检测斑点,其特征在于所述对照斑点选自由以下各项组成的组:用于对样品的沉积进行对照的斑点、用于对被分析物的检测配体的沉积进行对照的斑点、和用于对报道物的沉积进行对照的斑点。根据本发明的固体支持体允许安全的多重分析。在一个有利的实施方案中,本发明涉及适合用于至少一种样品的多重分析的固体支持体,其包含至少一个区划,所述区划包含至少两个对照斑点和至少两个用于被分析物的检测斑点,其特征在于所述对照斑点选自用于对样品的沉积进行对照的斑点和用于对被分析物的检测配体的沉积进行对照的斑点中。固体支持体的一个或多个区划可以例如包含至少两个用于对样品的沉积进行对照的斑点或至少两个用于对被分析物的检测配体的沉积进行对照的斑点。在一个优选的实施方案中,固体支持体的一个或多个区划包含至少一个用于对样品的沉积进行对照的斑点和至少一个用于对被分析物的检测配体的沉积进行对照的斑点。如上文解释的,在至少一个检测配体的间接标记的情况下,对于一个或多个区划来说有用的是包含至少一个用于对报道物的沉积进行对照的斑点。本发明也涉及适合用于至少一种样品的多重分析的固体支持体,其包含至少一个区划,所述区划包含至少一个用于对样品的沉积进行对照的斑点、至少一个用于对被分析物的检测配体的沉积进行对照的斑点、至少一个用于对报道物的沉积进行对照的斑点、和至少两个用于检测被分析物的斑点。固体支持体的一个或多个区划因此可以包含至少两个用于对报道物的沉积进行对照的斑点,例如两个或三个用于对报道物的沉积进行对照的斑点,用于涉及至少两种不同的间接标记物的分析。在这种情况下,每个用于对报道物的沉积进行对照的斑点是专门针对标记物的。适合用于安全的多重分析的成套珠当固体支持体是珠时,用一套珠完成对于样品的多重分析方法。本发明因此也涉及一套适合用于样品的多重分析的珠,其包含至少一种对照珠和至少两种用于被分析物的检测珠,其特征在于对照珠选自由以下各项组成的组:用于对样品的沉积进行对照的珠、用于对被分析物的检测配体的沉积进行对照的珠、和用于对报道物的沉积进行对照的珠。在本申请的含义内,“至少一种珠X”意味着至少至少一类(或组)珠X,“珠X”能够意味“对照珠”、“用于对样品的沉积进行对照的珠”、“用于对被分析物的检测配体的沉积进行对照的珠”或“用于对报道物的沉积进行对照的珠”。在本发明的含义内,“珠的类型”(或“珠的组”)包含或由以下组成:若干个可以是彼此同样的珠(例如10、50、100、200、300或500个珠),或至少是其表面上固定有相同的一种或多种感兴趣的化合物的若干珠。类似地,“至少两种珠X”分别意味着至少两种珠X或两个不同类(或组)的珠X,“珠X”能够意味“对照珠”、“用于检测被分析物的珠”、“用于对样品的沉积进行对照的珠”、“用于对被分析物的检测配体的沉积进行对照的珠”或“用于对报道物的沉积进行对照的珠”。每个珠也被结合到珠表面(也称作“固相”)的至少一种感兴趣的化合物覆盖。用于分析样品的一套珠包含至少三种珠(或类珠),例如三、四或五种珠(或类珠),或至少六种珠(或类珠),优选六、七、八种珠(或类珠),更优选至少九种珠(或类珠),例如九、十、十一、十二、十三、十四、十五种珠或十六种珠(或类珠),或多于十六种珠(或类珠)。在本申请中,“珠”、“粒子”、“微珠”或“微粒”意味着任何粒子,优选球形的或大约球形的,具有可以包含以下的大小:直径上0.3μm至100μm,优选0.5μm至40μm。这样的粒子例如由公司Luminex、Merck和Dynal制造。能够用在本发明的环境中的珠也可以是立方或厚片的形式或大约立方或厚片的形式,其侧面的长度会例如包含0.3μm至100μm,优选0.5μm至40μm。根据本发明的珠优选由对于生物样品的组分来说惰性的一种或若干种聚合物组成;它在待分析的样品中是固体的且不可溶的。可以使用的惰性聚合物的实例是聚酯、聚醚、聚烯烃、聚酰胺、多糖、聚氨酯或纤维素。可以将一种或若干种官能团与所述一种或多种惰性聚合物合并,以允许一种或若干种感兴趣的化合物(例如蛋白质、肽、糖蛋白、脂质、碳水化合物或核酸)的固定或偶联。本领域技术人员已知的这些官能团可以选自由以下各项组成的组:胺(=NH2)官能或铵官能(-NH3+或-NHR,R表示脂族链,优选:-1至z个碳原子的烷基链,直链的或支链的(取代的或未取代的),z优选是包含1至20的整数,-2至z个碳原子的烯基,直链的或支链的,z优选是包含1至20的整数,或-芳基自由基),醇官能(-OH)、羧基官能(-COOH)、异氰酸酯官能(-NCO)、硫醇官能(SH)或环氧官能。最一般地用于向聚烯烃中引入-COOH羧基官能的单体是丙烯酸或甲基丙烯酸。实际上,使用本领域技术人员熟知的任何合适方法,用一种或若干种感兴趣的化合物覆盖珠。可以通过静电吸引、亲和作用、疏水作用和/或共价偶联来完成一种或多种感兴趣的化合物在珠的表面上的固定。在一个优选的实施方案中,通过共价偶联将一种或多种感兴趣的化合物固定到珠的表面。用于将一种或多种化合物固定到珠的表面的方法是本领域技术人员熟知的(参见例如LUMINEXAntibodyCouplingKitUserManual,JosephDasso等的论文(JournalofImmunologicalMethods263(2002)23-33)或文献WO1997/014028)。例如,在珠在它的表面上包含羧基化学官能的情况下,可以将这些化学官能转化成通过与1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐和N-羟基磺基琥珀酰亚胺的反应形成的活性酯。随后,可以通过在所述感兴趣的化合物上存在的自由胺基,将感兴趣的化合物,如抗体、蛋白质或肽,接枝在每个珠的活性酯基团上。使用本领域技术人员熟知的程序(参见例如US7,141,362),完成向活性酯形式的转化和感兴趣的化合物在珠上的偶联。珠或一套珠的一部分珠优选是磁性珠,如使用Luminex技术的珠,以允许在方法的不同步骤之间回收珠,并且尤其是在洗涤步骤结束时。将每种珠编码,从而能够将它与成套珠中的其他珠区分,例如荧光编码或条码。可以使用本领域技术人员熟知的任何适合的方法,完成用编码(例如通过荧光或条码)对珠的标记,例如,如在文献EP1,802,710和EP1,049,807中所述的。对于包含至少一个区划的固体支持体,感兴趣的化合物通常是捕捉配体、偶联到间接标记物的载体分子或间接标记物。捕捉配体、偶联到间接标记物的载体分子或间接标记物尤其是如上文定义的。根据本发明的成套珠包含针对每个想要的对照的一种珠(或类珠)和针对每种待检测的被分析物的至少一种珠(或至少一类珠)。若干种珠(或类珠)也可以意在检测相同的被分析物。用于对样品的沉积进行对照或用于对被分析物的检测配体的沉积进行对照的珠优选包含捕捉配体。捕捉配体尤其是如上文定义的。同一种珠(或给定类珠的每个珠)可以被若干种不同的捕捉配体(例如,若干种抗体和/或抗原)覆盖,所述捕捉配体通常专门针对同一种待检测的传染,并且尤其专门针对同一种病毒、同一种细菌或同一种寄生虫。成套珠因此包含至少一种对照珠(例如,至少一种用于对样品的沉积进行对照的珠),优选至少两种对照珠,和至少两种用于被分析物的检测珠。每个待分析样品使用至少一套珠。本发明特别涉及一套适合用于至少一种样品的多重分析的珠,其包含至少一种对照珠和至少两种用于被分析物的检测珠,其特征在于所述对照珠是用于对样品的沉积进行对照的珠或用于对被分析物的检测配体的沉积进行对照的珠。所述成套珠还可以包含至少一种用于对报道物的沉积进行对照的珠。在一个优选的实施方案中,用于对样品的沉积进行对照的珠或用于对被分析物的检测配体的沉积进行对照的珠包含一种或至少一种捕捉配体,所述一种或多种捕捉配体不是核酸。更通常地,用于对样品的沉积进行对照的珠或用于对被分析物的检测配体的沉积进行对照的珠优选不包含核酸。在一个优选的实施方案中,用于对样品的沉积进行对照的珠或用于对被分析物的检测配体的沉积进行对照的珠包含一种或至少一种选自由以下各项组成的组的捕捉配体:抗体、抗原、肽、碳水化合物和脂质。本发明特别涉及一套适合用于样品的多重分析的珠,其包含至少两种对照珠和至少两种用于被分析物的检测珠,其特征在于所述对照珠选自由以下各项组成的组:用于对样品的沉积进行对照的珠、用于对被分析物的检测配体的沉积进行对照的珠、和用于对报道物的沉积进行对照的珠。在一个有利的实施方案中,本发明特别涉及一套适合用于样品的多重分析的珠,其包含至少两种对照珠和至少两种用于被分析物的检测珠,其特征在于所述对照珠选自用于对样品的沉积进行对照的珠和用于对被分析物的检测配体的沉积进行对照的珠中。成套珠可以例如包含至少两种用于对样品的沉积进行对照的珠或至少两种用于对被分析物的检测配体的沉积进行对照的珠。在一个优选的实施方案中,成套珠包含至少一种用于对样品的沉积进行对照的珠和至少一种用于对被分析物的检测配体的沉积进行对照的珠。如上文解释的,在用于被分析物的至少一种检测配体的间接标记的情况下,有利的是使用至少一种用于对报道物的沉积进行对照的珠。本发明也涉及一套适合用于样品的多重分析的珠,其包含至少一种用于对样品的沉积进行对照的珠、至少一种用于对被分析物的检测配体的沉积进行对照的珠、至少一种用于对报道物的沉积进行对照的珠、和至少两种用于检测被分析物的珠。成套珠因此可以包含至少两种用于对报道物的沉积进行对照的珠,例如两种或三种用于对报道物的沉积进行对照的珠,用于涉及至少两种不同的间接标记物的分析物。在这种情况下,每种用于对报道物的沉积进行对照的珠优选是专门针对标记物的。根据本发明的成套珠允许安全的多重分析。样品的沉积的对照样品的沉积的对照使得可以在固体支持体的区划的斑点的存在下或利用成套珠校验已经安放了样品。样品的沉积的对照物包含至少一种专门针对在待分析的样品中天然存在的对照化合物的捕捉配体,尤其是抗体或抗原。对照化合物尤其是如上文定义的。因此,在样品的沉积的对照处检测的信号使得可以验证样品的沉积步骤。样品的沉积由以下构成:将待分析的样品添加到包含至少一个对照斑点和至少两个被分析物检测斑点的根据本发明的固体支持体的区划中,或在至少一套根据本发明的珠的存在下安放样品。对照化合物随后被固定到在样品沉积对照处的捕捉配体。可以通过对照化合物的专门检测配体,检测这样固定的对照化合物。优选地,对照化合物的检测配体专门针对远离所用的捕捉配体特殊结合到的对照化合物的区域的对照化合物的区域,从而避免捕捉配体和检测配体关于对照化合物由于位阻导致的竞争。当对照化合物是至少两种分子的配合物时,检测配体或多种检测配体中的一种可以专门针对两种分子中的一种并且捕捉配体或多种捕捉配体中的一种可以专门针对配合物的另一种分子。备选地,当对照化合物是至少两种分子的配合物时,检测配体或多种检测配体中的一种和捕捉配体或多种捕捉配体中的一种可以专门针对同一种分子,并且甚至是分子的同一个区域,此时配合物包含这些同样的分子中的两个,从而允许在配合物上同时固定检测抗体和捕捉抗体。例如,当对照化合物是配合到运铁蛋白的运铁蛋白的可溶性受体时,沉积对照可以包含运铁蛋白的专门抗体或运铁蛋白的溶性受体的专门抗体作为捕捉配体。优选地,一种或多种捕捉配体或一种或多种捕捉配体中的一种是运铁蛋白的可溶性受体的专门抗体,目的是避免被可能在血液样品中存在的游离的运铁蛋白干扰。在一个优选的实施方案中,沉积对照的一种或多种捕捉配体或一种或多种捕捉配体中的一种专门针对运铁蛋白的可溶性受体,并且所述或一种对照化合物的一种或多种检测配体或一种或多种检测配体中的一种专门针对运铁蛋白,或专门针对运铁蛋白的可溶性受体。在某些实施方案中,样品的沉积的对照也使得可以校验在固体支持体的区划的斑点或成套珠的存在下已经安放了一种或若干种被分析物检测配体,此时,不与待分析的样品同时,但是例如在后来的步骤中,与对照化合物的一种或多种检测配体的添加同时,添加一种或多种所述被分析物检测配体。“与对照化合物的一种或多种检测配体的添加同时”通常意味着将一种或多种所述被分析物检测配体以包含一种或多种所述被分析物检测配体和对照化合物的一种或多种检测配体的溶液的形式添加。备选地,可以在同一步骤中添加一种或多种所述被分析物检测配体和对照化合物的一种或多种检测配体,但是以分开的溶液的形式。事实上,当待分析的样品包含可能干扰对照化合物的检测配体的化合物时,可能必须在样品的沉积步骤之后的步骤中将检测配体添加到对照化合物,尤其是在样品的沉积步骤后的至少一个洗涤步骤之后。在这种情况下,可以与对照化合物的检测配体同时添加被分析物的一种或多种检测配体的全部或部分。沉积的对照随后也使得可以在固体支持体的区划的斑点或成套珠的存在下验证已经安放了这些检测配体。例如,血液药品包含配合到运铁蛋白的运铁蛋白的可溶性受体和游离的(即未结合到受体)运铁蛋白两者。因此,如果一种或多种检测配体或一种或多种检测配体中的一种专门针对运铁蛋白的抗体并且将它与样品同时添加,会有部分结合到游离的运铁蛋白的风险,并且会歪曲对照化合物的检测。在这样的情况下,在后续步骤中投入对照化合物的所述检测配体,即在样品的沉积步骤后至少一个洗涤步骤之后。在一个特别的实施方案中,样品的沉积的一种或多种对照不包含因子XIII的专门抗体(即,既没有四聚物形式的专门抗体,也没有因子XIII的亚单位的专门抗体)。优选地,样品的沉积的一种或多种对照不包含因子XIII的专门捕捉配体(即,既没有四聚物形式的专门捕捉配体,也没有因子XIII的亚单位的专门捕捉配体)。在一个特别的实施方案中,样品的沉积的一种或多种对照不包含IgG、IgM或更通常地免疫球蛋白(尤其人类IgG、人类IgM或人类免疫球蛋白)的专门捕捉配体(尤其是专门抗体)。可以非常有利的是使用样品的沉积的至少两种对照,这些对照检测不同的对照化合物和/或同一对照化合物但具有不同的灵敏度,例如,当对照化合物的浓度可以改变时,例如基于样品的性质和/或从其取得样品的受试者的病况改变时,使用至少两种不同的对照化合物可以是有利的。被分析物的检测配体的沉积的对照被分析物的检测配体的沉积的对照使得可以校验在固体支持体的区划的斑点或成套珠的存在下已经安放了与添加剂的检测配体同时沉积的一种或若干被分析物检测配体和/或与添加剂同时沉积的一种或若干被分析物检测配体。“与添加剂的检测配体同时沉积的”通常意味着以包含一种或多种所述被分析物检测配体和添加剂的一种或多种检测配体的溶液的形式添加一种或多种所述被分析物检测配体。备选地,可以在相同的步骤中,但是以分开的溶液的形式,添加一种或多种所述被分析物检测配体和/或添加剂的一种或多种检测配体。“与添加剂同时沉积的”通常意味着以包含一种或多种所述被分析物检测配体和添加剂的溶液的形式添加一种或多种所述被分析物检测配体。备选地,可以在相同的步骤中,但是以分开的溶液的形式,添加一种或多种所述被分析物检测配体和/或一种或若干种添加剂。被分析物的检测配体的沉积的对照也使得可以校验温育和洗涤步骤。事实上,在固体支持体的区划的斑点或成套珠的存在下安放的添加剂的浓度是已知的,检测的信号的变动使得可以鉴别在方法的步骤尤其是温育和洗涤步骤时的方法的不充分。这可以尤其使得可以避免由不充分的温育和/或洗涤步骤(即,未完成或不良地完成)导致的“假阳性(falsepositives)”。“假阳性”是反映在样品中存在待检测的一种或若干种被分析物的阳性结果,而一种或多种所述被分析物在样品中并不存在并且因此不应当被检测到。被分析物的检测配体的沉积的对照包含在待分析的样品中不存在并且在多重分析方法的执行期间使用的添加剂的至少一个专门捕捉配体。添加剂尤其是如上文定义的。因此,在被分析物的检测配体的沉积的对照处检测的信号使得可以验证与添加剂的检测配体同时沉积的一种或多种被分析物检测配体的沉积步骤。在斑点和/或成套珠的存在下安放的添加剂固定到被分析物的检测配体的沉积的对照处的捕捉配体。可以通过所述添加剂的专门检测配体检测这样固定的添加剂。例如,当添加剂包含地高辛配基时,方法对照的捕捉配体可以是地高辛配基的专门抗体。优选地,添加剂的检测配体也是地高辛配基的专门抗体。使用检测被分析物的沉积的若干种不同的对照,并且因此使用相同数量的不同的添加剂,可以是有利的,例如,如果在若干不同的步骤中尤其是在至少三个不同的步骤期间添加被分析物的检测配体的话。根据本发明的一个特别的实施方案,-通过对照化合物的专门检测配体在执行根据本发明的分析方法期间检测固定到样品的沉积对照的捕捉配体的对照化合物(三明治类型的免疫学格式),并且-通过添加剂的专门检测配体在执行分析方法期间检测固定到被分析物的检测配体的沉积对照的捕捉配体的添加剂(三明治类型的免疫学格式)。这些三明治类型的免疫学格式使得可以与其他免疫学格式尤其是间接格式相比达到高水平的专门性和/或灵敏性。报道物的沉积的对照报道物的沉积的对照使得可以校验在固体支持体的区划的斑点或成套珠的存在下已经安放了检测标记物报道物。报道物的沉积的对照仅用于被分析物的至少一种检测配体的间接标记的情况。报道物的沉积的对照包含间接标记物或偶联到间接标记物的载体分子。报道物的沉积的对照的间接标记物与被分析物的至少一种检测配体的间接标记物是同样的。如果使用至少两种不同的间接标记物检测至少两种被分析物检测配体,优选的是对每个标记物使用报道物的沉积的对照。在一个有利的根据本发明的实施方案中,使用单一且同一间接标记物标记一种或多种检测配体,并且因此可以使用单一的报道物的沉积的对照。因此,在报道物的沉积的对照处检测的信号使得可以验证相应的检测标记物的报道物的沉积步骤。报道物因此固定到在报道物的沉积的对照处的检测标记物,并且获得信号,在报道物的沉积的阳性对照的情况下,如果需要,是在添加所述报道物的标记物的底物之后。例如,当间接标记物是生物素时,报道物的沉积的对照包含生物素或偶联到生物素的载体分子。安全的多重分析方法本发明因此涉及一种用于检测在至少一种样品中至少n种被分析物的多重分析方法,n是大于或等于2的整数,所述方法包括至少如下的步骤a)、c)和e),至少如下的步骤a)、c)和f)或至少如下的步骤a)、b)、c)和d):a)提供至少一种如上定义的包含至少一个区划的固体支持体或至少一种如上定义的成套珠,b)在所述区划的斑点或所述成套珠的存在下,安放:p种待检测的被分析物的1种检测配体,并且,如果可用,至少一种添加剂,1优选大于或等于p,c)在所述区划的一个或多个斑点的存在下或在所述成套珠的存在下安放待分析的样品,d)在所述区划的斑点或所述成套珠的存在下,安放:m种待检测的被分析物的l’种检测配体,并且,如果可用,一种或多种所述添加剂的至少一种检测配体,l’优选大于或等于m,e)在所述区划的斑点或所述成套珠的存在下,安放:对照化合物的至少一种检测配体和y种待检测的被分析物的l”种检测配体,l”优选大于或等于y,以及f)在所述区划的斑点或所述成套珠的存在下,任选地安放至少一种报道物,g)任选地,尤其是当步骤f的所述报道物或所述报道物的一种偶联到标记物时,尤其是间接标记物(例如,酶)时,在所述区划的斑点或所述成套珠的存在下,安放偶联到步骤f)的报道物的所述标记物的至少一种第二报道物(例如,底物,如鲁米诺、异鲁米诺或它们的衍生物的一种),l、l’、l”、m、p和y是大于或等于0的整数,并且m+p+y的和大于或等于1。当至少两种待检测的被分析物是同样的时,用于检测至少n种被分析物的方法可以包括检测小于n的不同数量的被分析物。例如,固体支持体的区划的至少两个斑点或成套珠的至少两种珠(或类珠)意在检测同一种被分析物。数量“n”通常等于固体支持体的区划的被分析物的检测斑点的数量或成套珠的用于检测被分析物的珠种(或珠类)的数量。优选地,和值m+p+y包含1至n。当若干种待分析的被分析物是同样的时,可以使用相同的检测配体,用于所述同样的被分析物中的至少两种或全部。和值m+p+y则可以大于或等于1并且严格地小于n。在另一个实施方案中,和值m+p+y等于n,例如,当固体支持体的区划中有被分析物的n个被分析物时或当有成套珠的用于检测被分析物的n种珠(或类珠)时。如下文概述的,可以同时和/或相继完成(例如,这些步骤的一些可以同时完成,而其他可以相继完成)步骤a)至e),对于它们中的至少两个按a)至e)的顺序或按其他顺序,步骤a)总是进行的第一步骤;当方法[包括]步骤f)和任选的步骤g)时,总是在步骤a)至e)之后进行这些步骤。当方法包括至少步骤a)、c)和e)时,固体支持体包含至少一个区划,所述区划包含至少一个用于对样品的沉积进行对照的斑点,或成套珠包含至少一种用于对样品的沉积进行对照的珠。当方法包含至少步骤a)、c)和f)时,固体支持体包含至少一个区划,所述区划包含至少一个用于对报道物的沉积进行对照的斑点,或成套珠包含至少一个用于对报道物的沉积进行对照的珠。当步骤b)包括在至少一种添加剂的存在下安放斑点或成套珠时,步骤d)优选包括在一种或多种所述添加剂的至少一种检测配体的存在下安放斑点或成套珠。当方法包括至少步骤a)、b)、c)和d),在步骤b)中在斑点或成套珠的存在下安放至少一种添加剂并且在步骤d)中在斑点或成套珠的存在下安放一种或多种所述添加剂的至少一种检测配体时,固体支持体包含至少一个区划,所述区划包含至少一个用于对被分析物的检测配体的沉积进行对照的斑点,或成套珠包含至少一种用于对被分析物的检测配体的沉积进行对照的珠。当方法包括步骤a)、b)、c)和d),但不包括步骤e)时,在步骤b)中在斑点或成套珠的存在下安放至少一种添加剂,并且在步骤d)中在斑点或成套珠的存在下安放一种或多种所述添加剂的至少一种检测配体。表述“在区划的斑点的存在下安放化合物X”意味着将化合物X添加到包含所述斑点的区划,所述区划意在分析样品。表述“在成套珠的存在下安放化合物X”意味着在至少一套意在分析样品的成套珠的存在下,将化合物X安放在任何含有所述成套珠的适合的容器中。适合的容器的一个实例是微管、微量培养板或反应皿。当步骤b)至f)中的至少两个同时完成时,可以在意在分析样品的区划的一个或多个斑点或一种或多种成套珠的一种或多种珠的存在下,分别地,即以分开的组合物的形式,安放一种或多种化合物X。备选地,可以在意在分析样品的区划的一个或多个斑点或一种或多种成套珠的一种或多种珠的存在下,以一种或若干种混合物的形式,安放这些化合物X或这些一种或多种化合物X中的一些。在每个区划的斑点或每种成套珠的存在下,将不同的化合物安放一定的时间长度,例如1秒至2小时,优选1分钟至1小时,更优选5分钟至50分钟,再更优选10分钟至40分钟。本领域技术人员知道如何对于每个温育步骤确定适合的温度。温育的温度可以例如是4℃、包含19℃至24℃、37℃或40℃的温度。在步骤b)、d)、e)、f)和g)期间使用的不同的组分是本领域技术人员熟知的。它们例如使得可以形成抗原-抗体配合物、标记物-报道物配合物。步骤a)包括提供包含至少一个区划的如上定义的固体支持体或至少一种如上定义的成套珠。步骤a)尤其意味着使用所述固体支持体或或所述成套珠来执行多重分析方法,即使用所述固体支持体或所述成套珠。因此,通过使用具有一个或多个区划的固体支持体例如微量培养板型的固体支持体,或利用成套珠,来执行根据本发明的多重分析方法。对于x种待分析的样品,步骤a)包括提供:-包含至少x个区划的固体支持体或若干个固体支持体,从而所有的固体支持体具有至少x个区划(例如,当固体支持体仅包括一个可以在一个特别的实施方案中将其比作固体支持体它自己的区划时,提供至少x个固体支持体),或-至少x种成套珠。根据本发明的多重分析方法例如使得可以检测至少1种样品、至少两种样品、至少5种样品、至少10种样品、优选至少20种样品、例如至少40种样品、至少60种样品或至少80种样品中的n种被分析物。数量n是大于或等于2的整数,例如2、3、4、5,优选大于或等于6,例如6、7、8、9、10、11、12、13、14、15、16、17、18或大于18。当步骤不是同时完成时,它们通常跟随有一个或若干个洗涤步骤。洗涤步骤可以消除这样的化合物,该化合物没有结合到斑点或珠或没有结合到与所述斑点或珠结合的化合物。典型地,洗涤步骤包括在每个区划中或在每种成套珠的存在下至少一个循环、优选至少两个循环、更优选3至6个循环,所述循环用于将洗涤溶液分配(例如,400μl的体积)并抽吸。典型地,洗涤溶液可以是TrisNaCl0.01M缓冲液,pH7.4,掺杂有0.1%的Tween20。当利用包含至少两个区划的至少一个固体支持体执行方法时,固体支持体的区划或支持体优选是同样的,尤其是在斑点的数量和组成方面。备选地,可以利用包含至少两个分开的区划的组(或类型)的至少一个固体支持体执行方法,分开的组的每个具有不同的斑点数量和/或斑点组成。当利用至少两种成套珠执行方法时,成套珠可以是同样的,尤其是在珠的数量和组成方面。备选地,可以利用成套珠的至少两个分开的组(或类)执行方法,尤其是成套珠的分开的组的每个具有不同的珠数量和/或组成。在每个意在分析样品的区划中或在每个含有意在分析样品的成套珠的容器中,进行步骤b)、d)、e)和f)。关于步骤c),每个区域或每个含有成套珠的容器添加一种样品。一种或多种样品、被分析物、一种或多种添加剂、一种或多种对照化合物、被分析物的检测配体、一种或多种添加剂的一种或多种检测配体、一种或多种对照化合物的检测配体和一种或多种报道物尤其是如上文在相应段落中定义的。在根据本发明的方法中使用的添加剂是被被分析物的检测配体的沉积对照的一种或多种捕捉配体所识别的。在样品中存在的对照化合物是被样品的沉积对照的一种或多种捕捉配体所识别的。被分析物的每种检测配体专门针对被在被分析物的检测斑点中或被分析物的检测珠上存在的至少一种捕捉配体所识别的被分析物。当步骤b)不与步骤c)、d)或e)中的一个同时进行时,可以在步骤b)之后且仅当1等于0时在所述步骤c)、d)和e)之前进行一个或若干个洗涤步骤。当步骤b)、c)、d)和e)存在时,可以以任何想要的顺序进行它们:相继地,或者这些步骤中的一个、两个或三个同时地。不过,当步骤b)和步骤d)分别执行至少一种添加剂和所述添加剂的至少一种检测配体时,所述步骤d)仍在所述步骤b)同时或之后完成。同样地,当存在步骤e)时,它总是在步骤c)同时或之后完成,或者在步骤c)之前完成,只要在步骤e)和c)之间不存在洗涤步骤。此外,当步骤c)在其中1大于或等于1的步骤b)之后和/或在其中1’大于或等于1的步骤d)之后和/或在步骤e)之后完成时,在这个或这些步骤与步骤c)之间不完成洗涤步骤。作为实例,当步骤b)至e)存在时,可以同时地和/或以以下顺序相继地完成它们:b)至e)、b)c)e)d)、c)b)d)e)、c)b)e)d)或c)e)b)d)。步骤c)、d)和/或e)可以与步骤b)同时完成。在一个有利的根据本发明的实施方案中,步骤b)和c)同时完成。在另一个有利的根据本发明的实施方案中,步骤c)和d)同时完成。事实上,与当被分析物已经结合到被分析物的捕捉抗体上时相比,在被分析物的检测配体的存在下将样品同时安放是有利的,所述被分析物的检测配体在溶液中与它们专门针对的被分析物更好地相互作用。在还另一个有利的根据本发明的实施方案中,步骤b)、c)和d)同时完成。当使用若干种添加剂时,方法可以包括一个或若干个步骤b)(和一个或若干个步骤d)),步骤b)中的每个能够独立地在步骤c)的之前、之后或同时完成。例如可以存在至少两个步骤b),一个在步骤c)之前或同时完成,另一个在步骤c)之后或同时完成。给定步骤的化合物可以以混合物的形式被提供,即包含那个步骤的化合物的全部和任选地包含一个或若干个同时完成的步骤的化合物的溶液。当两个或多于两个步骤同时完成时,这些不同步骤的化合物可以以一种或若干种混合物的形式投入,即一种或若干种溶液,优选以单一的混合物(即,单一溶液)的形式。例如,当步骤b)、c)和d)同时完成时,可以以单一混合物的形式投入一种或多种添加剂(当它们存在时)、p种待检测的被分析物中的每种的1种检测配体、一种或多种所述添加剂(当它们存在时)的一种或多种检测配体、m种待检测的被分析物中的每种的l”种检测配体。在一个有利的实施方案中,l’等于n,即,在步骤d)中添加n种被分析物的至少n种检测配体。在某些实施方案中,步骤e)在步骤c)之后完成。这尤其涉及用于化合物的检测配体或检测配体中的一种的存在对样品是否有同时导致干扰的风险进行对照的情况。例如,当对照化合物的检测配体是运铁蛋白的专门抗体并且样品包含游离运铁蛋白时,在步骤c)之后进行步骤e)。当步骤c)之后进行步骤e)时,优选在步骤c)之后且在步骤e)之前进行区划的至少一个洗涤步骤。当根据本发明的方法包括步骤f)时,此步骤总是在步骤a)至e)之后完成,并且通常它之前有每个区划的斑点或每种成套珠的至少一个洗涤步骤。如果使用了报道物的至少两个沉积对照,方法也可以包括若干个步骤f),即,优选每种报道物一个步骤f)。当根据本发明的方法包括步骤g)时,此步骤总是在步骤f)之后完成,并且通常它之前有每个区划的斑点或每种成套珠的至少一个洗涤步骤。步骤f)的报道物或报道物中的至少一种优选是偶联到被分析物的至少一种检测配体的间接检测标记物的报道物和在报道物的沉积的至少一种对照中存在的检测标记物的报道物两者。对于用于根据本发明的多重分析方法的执行的对照,可以有利的是,模拟被分析物的检测的不同步骤。例如,如果被分析物的捕捉配体和被分析物的检测配体是抗体,则添加剂的检测配体和优选地对照化合物的检测配体也是抗体。同样地,用与被分析物的检测配体的标记物相同的标记物标记添加剂的检测配体和优选地对照化合物的检测配体。根据本发明的方法通常包括用于检测对应于一种或多种对照(尤其是一个或多个对照斑点或一种或多种对照珠)和一种或多种被分析物的检测标记物的信号的步骤h)。如果在方法的结束检测到阳性信号,对照是阳性的。如果在方法的结束没有检测到阳性信号,对照是阴性的。对于在方法的执行中所用的每种对照的阳性信号的检测使得可以验证整个方法。在一种或若干种对照处没有信号意味着一个或若干个步骤没有正确进行。在这种情况下,必须不使用获得的结果。当在样品的沉积之后且在至少一个洗涤步骤之后沉积时对照化合物的检测配体沉积,样品的沉积的阴性对照意味着样品没有沉积和/或对照化合物的所述检测配体没有沉积。样品的沉积的对照、被分析物的检测配体的沉积的对照、和如果可用的报道物的沉积的对照是互补的,并且使得可以确保方法的步骤的每一个的适当性能,并且使得可以理解在分析方法中遭遇的任何瑕疵的起源。根据本发明的方法还可以包括:-至少两个步骤b)和至少两个步骤d),当使用被分析物的检测配体的沉积的至少两个对照时,-至少两个步骤f),当使用样品的沉积的至少两个对照时,和/或-至少两个步骤f),当使用报道物的沉积的至少两个对照时。一种或若干种对照用于确保样品的多重分析方法的用途。本发明也涉及样品的沉积的至少一种对照和/或被分析物的检测配体的沉积的至少一种对照用于确保样品的多重分析方法的用途。所述用途还可以包括报道物的沉积的至少一种对照的用途。本发明特别涉及选自由以下各项组成的组的至少一种对照用于确保样品的多重分析方法的用途:样品的沉积的对照、被分析物的检测配体的沉积的对照、和报道物的沉积的对照。在此,“确保样品的多重分析”意味着保证多重分析的结果的可靠性,尤其是通过避免“假阴性”的存在。“假阴性”是反映在样品中不存在待检测的一种或若干种被分析物的阴性结果,而一种或多种所述被分析物在样品中存在并且因此应当已被检测到。本发明也涉及选自由以下各项组成的组的至少两种对照用于确保样品的多重分析方法的用途:样品的沉积的对照、被分析物的检测配体的沉积的对照、和报道物的沉积的对照。本发明特别涉及样品的沉积的至少一种对照、被分析物的检测配体的沉积的至少一种对照和报道物的沉积的至少一种对照用于确保样品的多重分析方法的用途。所述用途优选在如上文定义的包含至少一个区划的固体支持体上或在如上文定义的至少一种成套珠上进行。样品的沉积的对照、被分析物的检测配体的沉积的对照、报道物的沉积的对照以及样品尤其是如上文定义的。本发明也涉及试剂盒,其特征在于它包括或由以下构成:至少一个根据本发明的固体支持体和/或至少一种根据本发明的成套珠,和,如果可用,至少一种用于进行根据本发明的多重分析方法的组合物或溶液,和/或用户说明书(instructions)。本发明的其他特征和优点将通过以下作为说明且非限制性地提供的实施例更好地显现。这些实施例和图说明了本发明而不限制它的范围。图图1:用于确保多重分析的微量培养板型的固体支持体的实施例。A显示包括18个孔的微量培养板的框图。B图形地显示了微量培养板的孔的底部。微量培养板的每个孔包含9个斑点,其中的6个斑点每个意在检测一种或若干种使得可以诊断传染的被分析物(分别为A1、A2、A3、A4、A5和A6),以及3个对照斑点:SDC(样品沉积对照(SampleDepositionControl))、PVC(被分析物检测配体沉积对照(analystedetectionliganddepositioncontrol))和RVC(报道物沉积对照(ReporterDepositionControl))。C图形地显示了三个包含结合到固相(PS)的检测抗体的对照斑点。AcCC:对照化合物的检测抗体。AcAdd:添加剂的检测抗体。MS+B:用生物素标记的载体分子。图2:处于同种型格式的阳性样品沉积的对照(SDC)的图。样品的沉积的对照包括对照化合物的捕捉抗体,其固定到固相(PS)。在此,捕捉抗体专门针对运铁蛋白的可溶性受体(sTfR)。对照化合物,在此是配合物2∶2可溶性运铁蛋白受体(sTfR):运铁蛋白(Tf),固定到样品的沉积的对照处的捕捉抗体,并且固定到专门针对运铁蛋白的检测抗体(Ac2)。检测抗体(Ac2)是用生物素(B)标记的。通过添加偶联到过氧物酶的链霉抗生物素蛋白(streptavin)(S-POD),随后添加此酶的底物(未示出),完成显影。捕捉抗体和检测抗体可以是单克隆的或多克隆的抗体。在所有情况下,它涉及异种型三明治。图3:处于同种型格式的阳性样品沉积的对照(SDC)的图。样品的沉积的对照包括对照化合物的捕捉抗体,其固定到固相(PS)。在此捕捉抗体专门针对运铁蛋白的可溶性受体(sTfR)。对照化合物,在此是配合物2∶2可溶性运铁蛋白受体(sTfR):运铁蛋白(Tf),固定到样品的沉积的对照处的捕捉抗体,并且固定到也专门针对可溶性运铁蛋白受体(sTfR)的检测抗体(Ac2)。检测抗体(Ac2)是用生物素(B)标记的。通过添加偶联到过氧物酶的链霉抗生物素蛋白(streptavin)(S-POD),随后添加此酶的底物(未示出),完成显影。捕捉抗体和检测抗体例如是单克隆的抗体。它涉及同种型三明治。图4:阳性的被分析物的检测配体的沉积(PVC)的图。本方法对照包括添加剂的捕捉抗体,其固定到固相(PS)。在此捕捉抗体专门针对地高辛配基(Dig)。添加剂包括地高辛配基和BSA,地高辛配基是配合到BSA的。添加剂经由地高辛配基结合到在被分析物的检测配体的沉积的对照处的捕捉抗体,并且结合到检测抗体(Ac2)。检测抗体(Ac2)是用生物素(B)标记的。通过添加偶联到过氧物酶的链霉抗生物素蛋白(streptavin)(S-POD),随后添加此酶的底物(未示出),完成显影。捕捉抗体和检测抗体可以都是单克隆的抗体或都是多克隆的抗体,在此情况下,它涉及同种型三明治。捕捉抗体可以是单克隆抗体且检测抗体可以是多克隆抗体,或反之亦然,在此情况下它涉及异种型三明治。图5:阳性的报道物的沉积的对照(RVC)的图。报道物的沉积的对照包括偶联到生物素(B)的载体分子(MS),其固定到固相(PH)。通过添加偶联到过氧物酶的链霉抗生物素蛋白(streptavin)(S-POD),完成显影。图6:“涂点(spotting)”格子,其位于微量培养板的孔的底部,并且包括5个待化验的被分析物(A1至A5)的斑点和三个对照斑点SDC、PVC和RVC。图7:处于94个样品的群体的单工格式(simplexformat)的SDC对照珠的信号的分布。Y轴显示样品的数量且X轴显示相对荧光强度(RFI)的间隔。图8:处于38个样品的群体的单工格式的PVC对照珠的信号的分布。Y轴显示样品的数量且X轴显示相对荧光强度(RFI)的间隔。实施例实施例1:“液相芯片”方法原理在此实施例中描述的两种对照使得可以验证(参见表1):-对于SDC(“样品沉积对照”或“样品的沉积的对照”):样品的沉积,以及还有步骤2(共轭物2(即,在步骤2中沉积的检测配体)的沉积)和步骤3)(S-PE报道物(偶联到藻红蛋白的链霉抗生物素蛋白)的沉积),和-对于PVC(“过程校验对照(ProcessVerificationControl)”或“被分析物的检测配体的沉积的对照”):步骤1的沉积(共轭物1(即,在步骤1中沉积的检测配体)的沉积),以及还有步骤2(共轭物2的沉积,以虚线形式,因为未在此实施例中说明)和步骤3)(S-PE报道物的沉积)。表1:通过SDC和PVC对照而进行对照的步骤材料(i)分析系统根据制造商的说明书,使用BioPlex分析仪(Bio-Rad,Marnes-la-Coquette,France)。此免疫分析机器含有流式细胞仪和Luminex100TM检测器(LuminexCorp.,Austin,Texas,UnitedStates),并且使用异种的成套超顺磁粒子。粒子、聚苯乙烯化合物和甲基丙烯酸(COOH官能)的每个同质的并且具有8μm直径的大小的组是用不同百分比的荧色物(CL1和CL2)制造的,所述荧色物产生归于每个粒子组并且可以由Luminex100TM检测器(LuminexCorp.,Austin,Texas,UnitedStates)的激光检测到的独特的鉴别码。在免疫学反应之后,一套珠一个接一个地通过流动池,在液体护套(liquidsheath)的中央,同时被两束分开的激光激发和读取。在每个珠通过时进行测量。具有638nm红色射线的激光激发在每个粒子的表面中包壳的鉴别荧色物(CL1和CL2),并且解译复合信号以鉴别通过粒子检测的被分析物。因此,此激光起到通过鉴别粒子类别来鉴别进行中的试验的作用。具有532nm绿色射线的激光激发S-PE(与藻红蛋白偶联的链霉抗生物素蛋白)报道物,并且发射的荧光与固定在粒子上的报道物的量成比例。因此,此激光起到测量固定不动在所述粒子上的被分析物的反应性的作用。系统的软件将涉及检测配体的存在的信号转化成相对荧光强度(RFI)值。可以计算比率,以将结果定性地评价为阳性或阴性。(ii)固相(珠)使用包含六个单独组的LuminexTM超顺磁粒子(LuminexCorp.,Austin,Texas,UnitedStates)的成套珠。此成套珠包含一组用于对样品的沉积进行对照的珠(SDC珠),一组用于对被分析物的检测配体的沉积进行对照的珠(PVC珠),和4组用于检测被分析物(待化验的被分析物:A1、A2、A3和A4)的珠。每组粒子覆盖有特定试验的专门捕捉配体。每个捕捉配体是通过异双功能试剂偶联的。SDC珠覆盖有以1μg/mg粒子固定不动的可溶性抗受体小鼠运铁蛋白的单克隆抗体(Fitzgerald,UnitedStates)。PVC覆盖有以5μg/mg粒子固定不动的抗地高辛配基绵羊多克隆抗体(Abcam,UnitedStates)。被分析物A1、A2、A3和A4的检测珠覆盖有待检测的被分析物的一种或若干种专门捕捉配体。(iii)检测配体对照化合物(SDC对照)的检测配体pAb-anti-Tf-biot是抗运铁蛋白绵羊多克隆抗体(Bio-Rad,BarneslaCoquette,France),其使用本领域技术人员公知的异双功能试剂偶联到生物素(ThermoScientific,France)。添加剂的检测配体(PVC对照)pAb-anti-DIG-biot是抗地高辛配基绵羊多克隆抗体(Abcam,France),其使用本领域技术人员公知的异双功能试剂偶联到生物素(Pierce,UnitedStates)。(iv)添加剂BSA-DIG添加剂是使用本领域技术人员公知的异双功能试剂接枝在载体分子上的地高辛配基(Sigma,France),在此实施例中是牛血清白蛋白(Millipore,France)。(v)报道物S-PE报道物是使用本领域技术人员公知的异双功能试剂偶联到藻红蛋白(Cyanotech,Hawaii,UnitedStates)的链霉抗生物素蛋白(Roche,Germany)。(vi)稀释剂vi.1.超顺磁粒子的稀释剂三羟甲基氨基甲烷缓冲溶液50mM,pH7.5,含有:NaCl150mM、EDTA20mM、10%的牛血清白蛋白、500μg/mL的小鼠IgG(Meridian,UnitedStates)、0.10%的辛基-n-葡糖苷、0.095%的NaN3。vi.2.共轭物1的稀释剂三羟甲基氨基甲烷缓冲溶液50mM,pH7.5,含有:NaCl150mM;EDTA20mM、Chaps0.1%、甘油10%、0.095%的NaN3。vi.3.共轭物2的稀释剂柠檬酸盐缓冲溶液50mM,pH6.7,含有:NaCl150mM、EDTA5.6mM、1%的牛血清白蛋白、2%的Triton、10%的绵羊血清、500μg/mL的小鼠IgG(Meridian、UnitedStates)、0.5%的Proclin300TM(Supelco公司的商标)、15%的奶牛乳(100%脱脂)、甘油10%、0.095%的NaN3。vi.4.S-PE报道物的稀释剂磷酸盐缓冲液,pH7.4,含有:NaCl150mM、0.1%的Tween20TM(Sigma公司的商标)、0.5%的Proclin300TM(Supelco公司的商标)、2.75%的PEG6000、1%的牛血清白蛋白、1%的正常绵羊血清、0.095%的NaN3。vi.5.洗涤溶液三羟甲基氨基甲烷10mM缓冲溶液,pH7.4,含有:NaCl218mM、0.1%的Tween20TM(Sigma公司的商标),0.002%的Proclin300TM(Supelco公司的商标)。(vii)反应皿免疫学反应在96孔微量培养板的孔中进行,所述微量培养板由聚丙烯制成,最大容量为355μL/孔。(viii)样品使用的阴性样品(血清或血浆)来自里尔的法国血液机构。方法多工格式(multiplexformat)试验方案包括化验4种不同的被分析物,被分析物A1和A2的化验在一个免疫时间中完成,被分析物A3和A4的化验在两个免疫时间中完成。试验的格式示于图2和4中,其中使用S-PE代替S-POD。步骤1:1.在微量培养板的每个孔中相继分配:+100μL的样品+25μl的共轭物1稀释剂,含有:+/-BSA-DIG+/-被分析物A1和A2的检测配体+25μL的免疫反应性超顺磁粒子(粒子、1.2μg/类珠的混合物:SDC、PVC+/-待化验的被分析物的珠)2.将混合物在37℃伴随搅拌温育40分钟。3.进行以下洗涤步骤:通过磁化和3次后续的用至少300μl的洗涤溶液的洗涤,将固和液相分离。在最后一次洗涤中,将粒子放回悬浮液中。步骤2:4.将90μl的共轭物2的稀释剂分配到每个反应孔中,其含有:+/-pAb-anti-Tf-biot对照化合物的检测配体+/-pAb-anti-DIG-biot添加剂的检测配体+/-被分析物A3和A4的检测配体5.将混合物在37℃伴随搅拌温育15分钟。6.进行洗涤步骤(同上第3点)。步骤3:7.将90μL的S-PE报道物分配在每个反应孔中。8.将混合物在37℃伴随搅拌温育15分钟。9.进行洗涤步骤(同上第3点)。10.在添加120μL洗涤溶液的同时,在每个反应孔中将粒子放回悬浮液中,随后摇晃微量培养板。11.通过流式细胞仪抽吸每个孔中的粒子的悬浮液。12.使用两道激光射线读取在每个孔中的粒子的悬浮液。13.读取的结果直接用流式细胞仪处理并以相对荧光强度(RFI)单位记录。14.为了解译结果,对于每个样品,相对于阈值(“截止(cutoff)”)计算比率。比率的计算如下计算样品的SDC比率:相似地,如下计算样品的PVC比率:宣称具有高于1的比率(SDC或PVC)的样品“有效”,宣称比率低于1的那些“无效”。根据在以下结果中描述的统计学研究,已经建立了SDC和PVC阈值。结果(i)单工格式的SDC系统在系统中,不使用被分析物A1至A4的检测珠和它们的检测配体。94个样品的研究使得可以确定SDC系统的阈值(参见图7)。SDC的阈值是通过从群体的信号的平均值减去样品群体的信号的标准差的3倍计算的。表2:对于94个样品的群体的SDC信号的统计和阈值的计算平均值(RFI)334标准差(σ)(RFI)44.02按%计的变异系数(CV)13.2%群体的最大值(RFI)427群体的最小值(RFI)239阈值=平均值-3σ(RFI)201.5在标称方法的情况下(样品的沉积体积=100μL,共轭物2体积=90μL,S-PE体积=90μL)(表3中的情况号1),测量SDC系统的响应。表3的情况2、3、4是降格的方法:情况2=不存在样品沉积,情况3=不存在共轭物2的沉积,情况4=不存在S-PE沉积。在这种情况下,包含“共轭物2”的混合物包含90μL的共轭物2的稀释剂,其含有pAb-anti-Tf-biot对照化合物的检测配体。表3:在标称方法(情况1)和降格的方法(情况2、3和4)期间获得的SDC比率的总结*RFI:相对荧光强度情况2、3、4导致SDC比率低于1,这使得可以使来自这些降格的方法的测量无效。(ii)在多工格式中SDC系统对性能的影响在多工格式(MPX)中的SDC系统中,使用被分析物A1至A4的检测珠和相应的检测配体。通过在没有SDC的MPX格式与具有SDC的MPX之间比较RFI信号(参见表4),SDC格式的添加没有影响包括4个被分析物的多重分析的性能(即,没有SDC的MPX格式与具有SDC的MPX的RFI信号之间的按%计的偏差被包含在+/-20%的区间中,这被认为是在统计学上可以被接受的)。表4:在没有SDC的MPX格式与具有SDC的MPX格式之间获得的RFI信号的比较,按%计(iii)单工格式中的PVC如之前一样,在此格式中,不使用被分析物A1至A4的检测珠和相应的检测配体。38个样品的研究使得可以确定PVC系统的阈值(参见图8)。PVC体系的阈值是通过从群体的信号的平均值减去样品群体的信号的标准差的3倍计算的(参见表5)。表5:对于38个样品的群体的PVC信号的统计和阈值的计算平均值(RFI)356标准差(σ)(RFI)70.92按%计的变异系数(CV)19.9%群体的最大值(RFI)510群体的最小值(RFI)222阈值=平均值-3σ(RFI)143.4在标称方法的情况下(样品的沉积体积=100μL,共轭物1体积=90μL,S-PE体积=90μL)(表6中的情况号1),测量PVC系统的响应。表6的情况2、3是降格的方法:情况2=不存在共轭物1沉积,情况3=不存在S-PE沉积。表6:在标称方法(情况1)和降格的方法(情况2、3)期间获得的PVC比率的总结情况2和3导致PVC比率低于1,这使得可以使来自这些降格的方法的测量无效。(iv)单工与多工模式对PVC系统的性能的影响在多工格式中的PVC系统中,使用被分析物A1至A4的检测珠和相应的检测配体。PVC系统的性能在单工模式和多工模式中是类似的(参见表7)。表7:单工与多工模式中PVC性能的比较此外,通过在没有SDC或PVC的MPX格式与具有SDC和PVC的MPX格式之间比较获得的RFI信号,看起来SDC和PVC的添加试验对包括4种待化验的被分析物的多工检测的性能没有影响(即,没有SDC或PVC的MPX格式与具有SDC和PVC的MPX格式的RFI信号之间的按%计的偏差被包含在+/-20%的区间中,这被认为是在统计学上可以被接受的)。实施例2:涂点方法材料和方法在此实施例中描述的三种对照使得可以验证(参见表8):-对于SDC(“样品沉积对照”或“样品的沉积的对照”):样品的沉积,以及还有步骤2(共轭物2的沉积)、步骤3(S-POD报道物的沉积)和步骤4(鲁米诺底物的沉积)。-对于PVC(“过程校验对照”或“被分析物的检测配体的沉积的对照”):步骤1的沉积(添加剂的沉积和共轭物1的沉积),步骤3(S-POD报道物的沉积)和步骤4(鲁米诺底物的沉积),和-对于RVC(“揭示校验对照(RevelationVerificationControl)”或“报道物的沉积的对照”):揭示步骤,通过对照步骤3(S-POD报道物的沉积)和步骤4(鲁米诺底物的沉积)两者。表8:通过SDC、PVC和RVC对照而进行对照的步骤材料(i)分析系统用于此系统的技术是在生物芯片多工技术上的创新的纳米涂点(参加下文的定义),其通过归因于被辣根过氧物酶的酶标记并且通过鲁米诺型的底物显影的报道物的化学发光显影。术语“生物芯片”是排布在固体支持体上的小型化的试验位置的集合(或“微阵列”),其使得可以同时进行许多试验,以获得更快的节奏。在微量培养板(Greiner,Germany)的每个孔内,使用涂点机器人,以沉积50nL的含有蛋白质或专门针对待化验的被分析物(A1、A2、A3、A4、A5、SDC、RVC和PVC)的抗体的蛋白质溶液的滴(参见图6)。这些微量培养板的每个孔的底部具有本领域技术人员公知的蛋白质和肽吸附容量。这样获得的斑点是被本领域技术人员公知的饱和溶液饱和的。接着可以在1或2个免疫学时间中在这些生物芯片内进行传统的免疫学反应。在免疫学反应之后,显影底物的添加导致光发射。事实上,通过酶催化的鲁米诺的氧化导致与通过斑点固定的链霉抗生物素蛋白-过氧物酶报道物的量成比例的光发射。通过科学照相机完成信号的获得。随后分析所得的图像,以确定由对应于每个斑点的孔的底部的每个地理区域(选址信息)产生的发光的强度。系统的软件将通过斑点测量的信号转化成相对发光单位(RLU)的值。可以计算比率,以将结果定性地评价为阳性或阴性,如下文概述的。(ii)固相(斑点)不同的对照斑点是:-SDC斑点,包含以50μg/mL固定不动的可溶性抗受体小鼠运铁蛋白的单克隆抗体(Fitzgerald,UnitedStates),-PVC斑点,包含以25μg/mL固定不动的可溶性抗地高辛配基小鼠单克隆抗体(Covalab,France),和-RVC斑点,包含使用本领域技术人员公知的异双功能试剂偶联到生物素(ThermoScientific,France)并且以1μg/mL固定不动的抗KLH(匙孔血蓝蛋白(KeyholeLimpetHemocyanin))小鼠单克隆抗体(Genway,UnitedStates)。(iii)检测配体对照化合物的检测配体(关于SDC对照)pAb-anti-Tf-biot是使用本领域技术人员公知的异双功能试剂偶联到生物素(ThermoScientific,France)的抗运铁蛋白绵羊多克隆抗体(Bio-Rad,BarneslaCoquette,France)。添加剂的检测配体(关于PVC对照)mAb-anti-DIG-biot是偶联到生物素(Covalab,France)的抗地高辛配基小鼠单克隆抗体。(iv)添加剂BSA-DIG添加剂是接枝在载体分子(在此实施例中是牛血清白蛋白(Millipore,France))上的地高辛配基(Sigma,France)。偶联是通过本领域技术人员公知的异双功能试剂完成的。(v)报道物S-POD报道物是根据本领域技术人员公知的P.Nakane和A.Kawaoi[JHistochemCytochem(1974)第22卷,第12号.第1084-1091页)所述的方法与过氧物酶(RocheGermany)偶联的链霉抗生物素蛋白(Roche,Germany)。(vi)稀释剂a)添加剂的稀释剂三羟甲基氨基甲烷缓冲溶液50mM,pH7.5,含有:NaCl150mM、EDTA20mM、500μg/mL的小鼠IgG(Meridian,UnitedStates)、15%的奶牛乳(100%脱脂)、10%的绵羊血清、0.095%的NaN3。b)共轭物1的稀释剂三羟甲基氨基甲烷缓冲溶液50mM,pH7.5,含有:NaCl150mM;EDTA20mM、Chaps0.1%、甘油10%、0.095%的NaN3。c)共轭物2的稀释剂柠檬酸盐缓冲溶液50mM,pH6.7,含有:NaCl150mM、EDTA5.6mM、2%的Triton、10%的绵羊血清、500μg/mL的小鼠IgG、0.5%的Proclin300TM(Supelco公司的商标)、15%的奶牛乳(100%脱脂)、甘油10%。0.095%的NaN3。d)S-POD报道物的稀释剂的稀释剂柠檬酸盐缓冲溶液50mM,pH6.7,含有:NaCl2053mM、0.5%的Tween20TM(Sigma公司的商标)、0.5%的Proclin300TM(Supelco公司的商标)、7%的奶牛乳(100%脱脂)、甘油20%。e)洗涤溶液三羟甲基氨基甲烷10mM缓冲溶液,pH7.4,含有:NaCl218mM、0.1%的Tween20TM(Sigma公司的商标)、0.002%的Proclin300TM(Supelco公司的商标)。f)显影底物ELISTARETACUltraELISA显影底物(Cyanagen,Italy)由两种溶液组成:XLSE024L鲁米诺增强剂溶液(A)和XLSE024P过氧化物溶液(B)。(vii)反应皿免疫学反应在96孔微量培养板的孔中进行,所述微量培养板由聚苯乙烯制成,最大容量为392μL/孔。(viii)样品使用的阴性样品(血清或血浆)来自里尔的法国血液机构。方法试验方案包括以下步骤。步骤1:1.在微量培养板的每个孔(包含斑点)中相继分配:+20μl的添加剂的稀释剂,含有BSA-DIG添加剂+20μl的共轭物1稀释剂,其包含:+mAb-anti-DIG-biot添加剂的检测配体,和+待化验的被分析物1、2和3的检测配体+40μl的样品2.将混合物在37℃伴随搅拌温育40分钟。3.完成三次用至少400μl的洗涤溶液的相继洗涤。步骤2:4.将50μl的共轭物2的稀释剂分配到每个反应孔中,其含有:+pAb-anti-Tf-biot对照化合物的检测配体+待化验的被分析物4和5的检测配体。5.将混合物在37℃伴随搅拌温育15分钟。6.进行洗涤步骤(同上第3点)。步骤3:7.将50μL的S-POD报道物分配到每个反应孔中。8.将混合物在37℃伴随搅拌温育15分钟。步骤4:9.将25μL的显影溶液“B″分配到每个反应孔中。10.将25μL的显影溶液“A″分配到每个反应孔中。10.将混合物在37℃伴随搅拌温育1分钟。11.发光信号的获得进行180秒。12.读取的结果直接用图像分析系统处理并以相对光单位(RLU)记录。13.为了解译结果,对于每个样品,相对于阈值(“截止”)计算比率。比率的计算以下说明两种分析模式:分析模式1:单一阈值如下计算样品的SDC比率:相似地,计算样品的PVC比率:同样地,计算样品的RVC比率宣称具有高于1的比率(SDC或PVC或RVC)的样品“有效”;宣称比率低于1的那些“无效”。根据在以下结果章节中描述的统计学研究,已经建立了SDC、PVC和RVC阈值。分析模式2:两个阈值如下计算样品的两个SDC比率:相似地,计算样品的PVC比率:同样地,计算样品的RVC比率:宣称具有高于1的比率(阈值-)(SDC或PVC或RVC)的样品“有效”;宣称比率低于1的那些“无效”。宣称具有低于于1的比率(阈值+)(SDC或PVC或RVC)的样品“有效”;宣称比率高于1的那些“无效”。根据在以下结果章节中描述的统计学研究,已经建立了SDC、PVC和RVC阈值。结果在此实施例中描述的多重分析包括5种待化验的被分析物,其中3种被分析物的检测配体在步骤1中加入(A1、A2和A3),2种被分析物的检测配体在步骤2中加入(A4和A5),以及三种SDC、PVC和RVC对照。表9将在单独或累积的SDC、PVC和RVC对照的无效时可能遭遇的情形组在一起。对于22个样品,在标称方法的情况下(添加剂体积=20μL,共轭物1体积=20μL,沉积的样品体积=40μL,共轭物2体积=50μL,S-POD体积=50μL,鲁米诺体积=25μL溶液B+25μL溶液A),测量SDC、PVC和RVC对照的响应。这22个样品的研究使得可以按平均斑点、标准差、最小和最大值来表征SPC、PVC、RVC响应(参见表10a和10b)。也计算SDC、PVC和RVC对照的阈值。表9:全部SDC、PVC和RVC对照的解译和在方法中缺失的步骤的鉴别。分析模式1:单一阈值表10a:SDC、PVC和RVC对照的响应(平均响应、标准差、最小和最大值、阈值)分析模式2:两个阈值表10b:SDC、PVC和RVC对照的响应(平均响应、标准差、最小和最大值、阈值)通过组合SDC、PVC、RVC对照的响应和算得的阈值(参见表10a和10b),对每个样品计算SDC、PVC和RVC比率(参见表11a和11b)。分析模式1:单一阈值表11a:按RLU计的SDC、PVC和RVC对照的响应和22个样品的群体的比率分析模式2:两个阈值表11b:按RLU计的SDC、PVC和RVC对照的响应和22个样品的群体的(阈值+)比率、(阈值-)比率从SDC、PVC、RVC对照的(阈值+)和(阈值-)比率进行解译的状况是对于全部22个样品都“有效”。从SDC、PVC、RVC对照进行解译的状况是对于全部22个样品都“有效”。按降格方式进行的方法的情况研究示于表12和13a和13b中。存在六种情况:-情况1=不存在样品沉积。-情况2=不存在添加剂沉积。-情况3=不存在共轭物1沉积。-情况4=不存在共轭物2沉积。-情况5=不存在S-POD沉积。-情况6=不存在鲁米诺沉积。分析模式1:单一阈值情况1和4导致SDC比率低于1,这使得来自这些降格方法的测量可能无效。情况2和3导致PVC比率低于1,这使得来自这些降格方法的测量可能无效。情况5和6导致SDC、PVC和RVC比率低于1,这使得来自这些降格方法的测量可能无效。RVC信号特别使得显影步骤(S-POD沉积和鲁米诺沉积)可能无效。然而,通过低于1的RVC比率的程序的无效暗示不存在SDC和PVC对照的系统性信号(参见表9的灰色区)。在这种情况下,不可能确定样品和共轭物2的沉积(由SDC对照的沉积)或添加剂和共轭物1的沉积(由PVC对照的沉积)是否已经正确地发生。分析模式2:两种阈值情况1和4导致SVC(阈值-)比率低于1,这使得来自这些降格方法的测量可能无效。除情况1之外,PVC(阈值+)比率大于1,这反映了在PVC对照上不存在样品的间接影响。情况2和3导致PVC(阈值-)比率低于1,这使得来自这些降格方法的测量可能无效。情况5和6导致SDC、PVC和RVC(阈值-)比率低于1,这使得来自这些降格方法的测量可能无效。RVC信号特别使得显影步骤(S-POD沉积和鲁米诺沉积)可能无效。然而,通过低于1的RVC(阈值-)比率的程序的无效暗示不存在SDC和PVC对照的系统性信号(参见表9的灰色区)。在这种情况下,不可能确定样品和共轭物2的沉积(由SDC对照的沉积)或添加剂和共轭物1的沉积(由PVC对照的沉积)是否已经正确地发生。表12:6种降格方法情况的细节分析模式1:单一阈值表13a:按RLU计的SDC、PVC和RVC对照的响应和22个样品的群体的比率此外,通过在没有SDC或PVC的MPX格式与具有SDC和PVC的MPX格式之间比较获得的RLU信号,看起来SDC和PVC的添加试验对包括4种待化验的被分析物的多重分析的性能没有影响(即,没有SDC或PVC的MPX格式与具有SDC和PVC的MPX格式的RLU信号之间的按%计的偏差被包含在+/-20%的区间中,这被认为是在统计学上可以被接受的)。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1