检测稳定在固体载体材料上的痴呆和阿尔茨海默病相关生物标记的制作方法
发明领域
本发明涉及用于检测稳定在固体载体材料上的痴呆和阿尔茨海默病相关生物标记的方法。
发明背景
痴呆当前影响全球四千四百万个体。到2050年该数字将会上升至一亿三千五百万。当前全球费用为$600bn。对阿尔茨海默病治疗的研究饱受失败。2002到2012年之间,超过99%的旨在预防或逆转该疾病的试验失败。所有的失败均归于已经太晚时才治疗患者,因为症状在疾病开始后约十年出现。因此较早鉴定患者是痴呆研究的优先考虑之一。
近来,研究者在血液中鉴定了一组可预测痴呆起始的血浆蛋白,并且已经提出这些生物标记可用于鉴定个体,用于发展新痴呆药物的血液检验/或试验。将452个健康人的血液中的蛋白质与来自220个具有轻度认知缺损的人和476个具有阿尔茨海默病的人的蛋白质比较。由此,研究者能够以87%准确度告诉哪些具有轻度认知缺损的患者将会继续发展阿尔茨海默病。该结果将允许候选者的早期鉴定,从而增加未来临床试验的成功机会。这些生物标记还代表鉴定将最终发展为阿尔茨海默病的人以及因此可较早进入临床试验的人的潜在手段。早期治疗将增加阳性药物作用以及因此治疗的潜能。
存在对改善的样品储存和检测的需求,以促进鉴定处于痴呆或发展阿尔茨海默病风险中的人。
发明概述
本发明描述一种促进生物标记检测和定量的新方法,其支持检测与痴呆和阿尔茨海默病相关的生物标记。将血液、血浆或其它相关生物样品类型收集在固体载体上,将生物标记例如蛋白质、rna和dna稳定并检测。这些生物标记在固体载体上保持稳定,并且可在长期储存后检测。
在一个方面,提供用于检测源自体液的一种或多种生物标记的方法,包括对来自体液样品的生物标记进行一种或多种测定,其中样品先前保存在固体载体上;其中生物标记的变化提供脑中生物学事件的指示。
在另一个方面,提供用于鉴定人处于痴呆或阿尔茨海默病风险中的方法,包括:使用本发明某些方面的方法检测一种或多种生物标记;和基于检测结果预测人是否处于痴呆或阿尔茨海默病风险中。
在另一个方面,提供用于监测人的痴呆或阿尔茨海默病发病或进展的方法,包括:随时间从人获取并保存许多生物样品到固体载体上;使用本发明某些方面的方法从一些保存样品检测一种或多种生物标记;和基于检测的生物标记随时间的变化预测痴呆或阿尔茨海默病的发病或进展。
在另一个方面,提供用于评估潜在药剂的有效性的方法,包括:随时间从患有痴呆或阿尔茨海默病的人获取并保存许多生物样品到固体载体上,同时人使用潜在的药剂治疗;使用本发明某些方面的方法从一些保存样品检测一种或多种生物标记;和预测所述药剂是否有效治疗患有痴呆或阿尔茨海默病的人。
本发明进一步的细节和优点将会从下列说明和权利要求显现。
附图简述
图1显示模式蛋白(il-2)从固体载体的测量。
图2显示模式酶(dna酶)从固体载体的测量。
图3显示模式酶(rna酶)从固体载体的测量。
图4显示500bp基因组dna片段从用肝素处理并保存在不同固体载体上的人血液直接扩增的结果。
图5显示1kb、3.8kb和7.5kb基因组dna扩增子从用edta处理并保存在不同固体载体上的人血液直接pcr的结果。
图6显示在用edta处理并保存在903和fta基因卡(ftageneccard)样品收集卡上的来自若干哺乳动物物种的血液上进行的直接pcr的结果。
图7显示从wt和nos3缺失的基因敲除小鼠二者衍生的dna扩增产物。
图8显示来自若干组织源(蓝/亮和红/暗柱指不同的固体材料)的gadph的相对表达水平。
发明详述
多种技术为基因组学和蛋白组学分析提供机会,其可用于评估血液和其它组织样品中改变的基因和蛋白质靶表达。将例如血液和/或脑脊液中的生物标记收集/储存在固体载体上,随后可进行简单直接或穿孔(punch-in)技术,其中将固体载体上的样品直接加入检测试剂中并经受生物标记检测方法,例如,但不限于,免疫测定和核酸扩增/检测技术,无需先前纯化目的生物标记或分析物。
本发明人已经综述了几种基因组和蛋白质组生物标记和/或其它目的分析物对于其与脑中事件的关联的重要性,并建议将这些标记收集在固体载体例如whatman/gehealthcare提供的那些上。
因此,在一个实施方案中,本发明提供用于检测源自体液的一种或多种生物标记的方法,所述方法包括对来自体液样品的生物标记进行一种或多种测定,其中样品先前保存在固体载体上;其中生物标记的变化提供脑中生物学事件的指示。在某些实施方案中,所述一种或多种测定包括核酸分子测定,或基于蛋白质的测定,或基于抗体的测定,或基于酶的测定。在某些实施方案中,所述变化可为生物标记水平的增加或减少。变化也可为缺乏对照或正常个体中存在的生物标记,反之亦然。变化也可为基因组水平的变化(即,单核苷酸多态性、插入、缺失或基因组水平的其它突变或多态性)。
在某些实施方案中,所述体液为血液或脑脊液。
科学文献的搜索已经鉴定约25种痴呆或阿尔茨海默病相关蛋白和核酸生物标记。尽管这些生物标记的表达可使用基于蛋白质、抗体、酶或rna的基因表达测定检测,但基因组突变可在dna水平检测。与痴呆和阿尔茨海默病相关的生物标记的列表在下表1中描述。
表1:与脑中某些生物学事件有关的生物标记
用于检测蛋白质和核酸生物标记的测定方法为已知的。这样的测定可选自:使用rt-pcr、聚合酶链反应(pcr)、定量pcr(qpcr)、等温扩增、免疫-pcr、微阵列测定、酶联免疫吸附测定(elisa)、免疫学技术、凝胶电泳(2de)、毛细管电泳(tofms)、高效液相色谱(hplc)、质谱(ms)、火焰光度法、原子吸收分光光度法和可见光分光光度法的基因表达或蛋白质表达谱分析。
在某些实施方案中,样品先前保存在固体载体上。生物样品可简单施加到固体载体并让其在环境温度下干燥用于保存。
在某些实施方案中,所述固体载体为纤维性的,例如纤维素纤维材料或玻璃纤维/微纤维材料。
在某些实施方案中,所述固体载体为多孔聚合物,例如多孔膜材料例如聚酯、聚醚砜(pes)、聚酰胺(nylon)、聚丙烯、聚四氟乙烯(ptfe)、聚碳酸酯、硝酸纤维素、醋酸纤维素、藻酸盐或氧化铝。
在某些其它实施方案中,载体表面用化学品浸渍,所述化学品包括:弱碱、螯合剂、阴离子表面活性剂和/或离液剂例如硫氰酸胍。
在某些其它实施方案中,所述固体载体为,但不限于,fta纸、fta洗脱纸、whatman903纸或藻酸盐包覆的载体。
本文中fta(包括ftamicrocards、ftaindicating和ftaclassic)为用稳定化学品,例如弱碱、螯合剂和阴离子表面活性剂处理的纤维素纤维纸,借此载体表面用稳定化学品浸渍。以这种方式生物样品材料可作为干燥物质在固体载体上储存许多月甚至许多年,从而允许在环境温度下转运固体载体(若需要)至实验室的时间。然后简单回收是可能的,通过例如从固体载体纯化生物样品材料。或者,样品可使用直接或洗涤的穿孔方案处理。将样品储存在固体载体上还使得能够通过按照需要移除部分样品并检验该部分,随时间再检验样品。
fta洗脱(ftaelute)在本文中描述相似的纸,但用离液剂例如硫氰酸胍包覆。在本文中whatman903描述未包覆的纤维素纤维纸。
wo2012113911、wo2012113907、wo2012113906和wo2013165870中描述了某些固体载体,其各自的公开内容通过引用以其整体结合。
上文描述的固体载体意在以总体平坦配置使用,但替代地,可例如在卷形物(roll)上使用。
在某些实施方案中,所述一种或多种测定从自包含样品的固体载体切除的穿孔物(punch)直接进行。因此,所述测定可从穿孔物直接进行,所述穿孔物自生物样品(即,血液)已经施加于其上的固体载体切除。包含样品的穿孔物可直接加入测定反应中。任选地,可进行简单“穿孔(punch-ins)”加入,其中在加入反应前,将切除的穿孔物(固体载体加样品)洗涤以去除任何潜在的抑制性化学品。
在某些实施方案中,将生物标记从固体载体分离和/或纯化,然后检测。用于从干燥在固体载体上的样品纯化蛋白质和核酸分子的方法为已知的。
在一些实施方案,可测定超过一种生物标记。例如,可检测2、3、4或5种生物标记以评估脑中的目的生物学事件。在一些实施方案中,可检测表1中的所有生物标记以评估目的生物学事件。生物标记可使用不同的测定检测,包括上文对于蛋白质和核酸生物标记的检测所描述的那些方法。
在某些实施方案中,测定可为多重的。因此,超过一种生物标记可在单个反应中检测。
在某些实施方案中,一种或多种测定使用冻干试剂进行。冻干试剂例如gehealthcare’sillustraready-to-go(rtg)产品为众所周知的。这些试剂可包含引物以分析特定的核酸例如rna、dna等,或包含抗体以检测特定的目的蛋白质生物标记。
在某些实施方案中,一种或多种测定在环糊精存在下进行。环糊精用作包覆在某些固体载体外部的洗涤剂的螯合剂,因此可进行改善的dna扩增测定,包括直接扩增测定。
在某些实施方案中,生物标记在检测后定量。
在某些实施方案中,样品先前保存在固体载体上并室温储存。保存在固体载体上的生物样品可稳定很长一段时间,参见,例如,gehealthcarelifesciencesapplicationnote29-0082-33aa。
在某些方面,提供用于鉴定人处于痴呆或阿尔茨海默病风险中的方法,包括:通过本发明某些实施方案的方法检测一种或多种生物标记;和基于检测结果预测人是否处于痴呆或阿尔茨海默病风险中。在某些实施方案中,将检测结果与来自有或无痴呆或阿尔茨海默病风险的人的对照比较。
在某些方面,提供用于监测人的痴呆或阿尔茨海默病发病或进展的方法。所述方法包括随时间从人获取并保存许多生物样品到固体载体上;根据本发明某些实施方案从一些保存样品检测一种或多种生物标记;和基于检测的生物标记随时间的变化预测痴呆或阿尔茨海默病的发病或进展。
在某些实施方案中,检测步骤使用一些保存样品的部分进行。在某些实施方案中,检测步骤随时间使用保存样品的部分重复。
在某些实施方案中,用于监测人的痴呆或阿尔茨海默病发病或进展的方法进一步包括比较检测的生物标记结果与来自有或无痴呆或阿尔茨海默病风险的人的对照。
在某些方面,提供用于评估潜在药剂的有效性的方法。所述方法包括随时间从患有痴呆或阿尔茨海默病的人获取并保存许多生物样品到固体载体上,同时人使用潜在的药剂治疗;根据本发明某些实施方案从一些保存样品检测一种或多种生物标记;和预测所述药剂是否有效治疗患有痴呆或阿尔茨海默病的人。
在某些实施方案中,检测步骤使用一些保存样品的部分进行。在某些实施方案中,检测步骤随时间使用保存样品的部分重复。
在某些实施方案中,用于评估潜在药剂的有效性的方法进一步包括比较检测结果与来自有或无痴呆或阿尔茨海默病的人的对照。
实施例:
下列实施例仅意在说明本发明的方法和实施方案,并且因此不应解释为给权利要求强加限制。
实施例1:从固体载体直接测量白介素
使重组il-2±载体(r&dsystems;分别为cat.202-il-cf-10μg;批次ae4309112和cat.202-il-10μg;批次ae4309081)以50pg或100pg/μl溶于血液(tcsbiosciences)。将等分试样(1μl,包含50(b)或100(a)pgil-2)施加到gehealthcare903滤纸。
使这些样品在环境温度和湿度干燥过夜。使用适当大小的打孔器(punch),从各纸类型提取出3mm直径的穿孔圆盘(puncheddisk)。利用来自完全配置的il-2quantikineelisa试剂盒(r&dsystems,cat.d2050,批次273275)的试剂直接分析单个圆盘的il-2。直接测定以“在孔中的穿孔物(punchinwell)”进行,即,在此穿孔出部分903滤纸,并沉积在常规多孔板的反应孔中。
在完成测定时,在450nm监测光密度。通过将值与已知il-2浓度的标准曲线比较而测定il-2的回收。回收率显示于图1中,表明可回收有效量的蛋白质,然后使蛋白质沉积到固体载体上。
表2:当前可用的基于elisa的试剂盒
表1中的许多生物标记可使用市售可得的elisa试剂盒检测,如表2中说明的。
因此,来自生物样品例如血液或脑脊液的蛋白质在固体载体上稳定并且可使用现有蛋白质检测方法检测和定量。
实施例2:从转移至固体载体的细胞或酶的模式酶检测
根据制造商说明书,利用完全配置dna酶和rna酶contamination试剂盒(dnase&rnaasealertqcsystems,目录编号am1970&am1966,lifetechnologies),进行蛋白质和酶检验。
a.双脱氧核糖核酸酶(dna酶)
在第一系列试验中,将0.125-0.5udna酶以10µl体积施加到fta和903纸。如下概括的测量dna酶和rna酶活性(数据未显示)。
在第二系列试验中,从已如上以10µl体积施加到fta和903纸的106个人胚胎干细胞(gehealthcare;细胞系ref:wcb307gehc28)取1.2mm穿孔物(punch)。如下概括的测量dna酶和rna酶活性。
在第三系列试验中,从已以10µl体积施加到fta和903纸的106个人胚胎干细胞(gehealthcare;细胞系ref:wcb307gehc28)(包含加到这些细胞的0.5udna酶或10µurna酶)取1.2mm穿孔物。
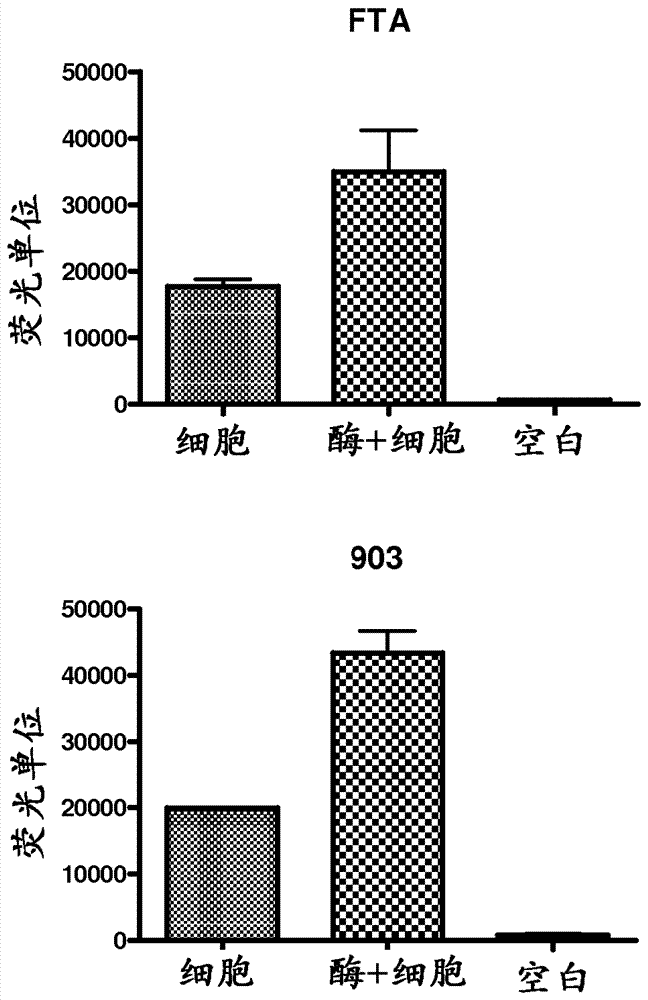
使用可裂解荧光标记dna酶底物,如下进行dna酶活性检测。将各穿孔物弹射到96孔板的单独孔。使经冻干dna酶alert底物溶于te缓冲液(1ml),并分配(10μl)到96孔板的检验孔。加入10xdna酶alert缓冲液(10μl)和无核酸酶的水(80µl),并在37℃孵育检验溶液(100µl)60分钟。dna酶alertqcsystem底物为在由dna酶裂解时发射粉红色荧光的经修饰dna寡核苷酸。对于此测定,荧光在tecanultra(激发/发射535/595nm,使用介质增益)上测量。包含dna酶活性的溶液产生粉红色荧光,而没有dna酶活性的溶液不发荧光。因此,较高水平dna酶相当于光输出量增加。阴性对照由无核酸酶的水(80µl)代替样品组成。可用903或fta纸作为固体载体,以速率依赖性方式检测和定量dna酶活性。图2表明可在fta化学处理的滤纸(fta)和903未处理的滤纸(903)上实现dna酶和酶活性的恢复。
b.核糖核酸酶(rna酶)
使用可裂解荧光标记的rna酶底物,如下进行rna酶检测。将各穿孔物弹射到96孔板的单独孔。使经冻干rna酶alert底物溶于te缓冲液(1ml),并分配(10μl)到96孔板的检验孔。加入10xrna酶alert缓冲液(10μl)和无核酸酶的水(80µl),并在37℃孵育检验溶液(100µl)60分钟。rna酶alertqcsystem底物为在由rna酶裂解时发射绿色荧光的经修饰rna寡核苷酸。对于此测定,荧光在tecanultra(激发/发射485/535nm,使用介质增益)上测量。包含rna酶的溶液产生绿色荧光,而没有rna酶活性的溶液不发荧光。因此,较高水平rna酶相当于光输出量增加。阴性对照由无核酸酶的水(80µl)代替样品组成。rna酶活性可使用903或fta纸以速率依赖性方式检测和定量(图3)。
因此,来自生物样品的酶可在固体载体上干燥并保持稳定。酶活性的检测和酶的定量可使用现有方法进行。
实施例3:从保存在whatmanfta和903卡上的血液直接pcr
thermoscientificphusion血液直接pcr试剂盒显示支持直接从储存在一系列固体载体上的血液样品扩增dna,固体载体包括whatman903、fta和fta洗脱卡(chum和andre2013;thermofisherscientific)。fta和fta洗脱卡为基于化学品包覆纸的卡的实例,而903卡未化学包覆。在直接扩增工作流程中,不需要先前的dna提取或纯化步骤,并且仅将卡加入pcr反应混合物中。
样品制备:按照制造商的说明书将新鲜血液或用肝素(1.4iu/ml)、k2edta(1.8mg/ml)或柠檬酸钠(109mm)保存的血液施加到whatman903卡、fta洗脱卡或fta基因卡并干燥。对于直接pcr,从卡中的样品穿孔出1mm直径圆盘,并以下列pcr反应体积使用:whatman903:10-50μl,fta洗脱卡:25-50μl和fta基因卡:50μl。
当使用更大的穿孔物或更小的反应体积时,将穿孔物用20μl水在50℃洗涤3分钟。去除水之后,将pcr组分直接加至漂洗过的穿孔物。使用的参数和试剂在下表3、4和5中列出。
表3.pcr反应混合物
表4.pcr热循环方案。当引物tm值为69-72℃时使用2步方案
表5.用于扩增示例性目的基因的引物
图4显示从用肝素处理的和保存在不同卡上的人血直接扩增500bp基因组dna片段的结果。反应自漂洗或直接放入50、25或10μl体积pcr反应中的1mm穿孔物进行。使用材料和方法中描述的2步pcr方案。
图5显示1kb、3.8kb和7.5kbgdna扩增子从用edta处理并保存在不同卡上的人血液直接pcr的结果。反应在50μl反应中从1mm穿孔物进行(对于7.5kb片段,将fta基因卡穿孔物通过用于水漂洗洗涤。对于1kb和7.5kb片段使用2步方案,对于3.8kb扩增子使用3步方案。
图6显示在用edta处理并保存在903和fta基因卡上的来自若干哺乳动物物种的血液上进行的直接pcr的结果。反应使用phusion血液直接pcr试剂盒中包含的通用对照引物和20μl反应体积从1mm穿孔物进行(将fta基因卡漂洗)。m大小标记,-阴性对照,+阳性对照(纯化的人基因组dna)。
pcr研究证实dna可从储存在不同滤纸卡上的血液直接扩增。
从903卡衍生的样品几乎不显示抑制,并且1mm穿孔物可以以低至10μl的反应体积使用。fta洗脱和fta卡显示不同水平的抑制。fta洗脱略微抑制直接pcr反应;1mm圆盘在25-50μl反应中良好起作用,但当放置入10μl反应中时,pcr受到完全抑制。fta基因卡显示最大水平的抑制。无任何预处理,fta基因卡的1mm穿孔物仅在50μl反应体积中良好起作用。对于较小的反应体积,非常简单的洗涤方案足以从fta洗脱和fta基因卡二者去除抑制剂。用水洗涤卡穿孔物3分钟后,样品具有足够纯度以用于直接pcr反应,其采用phusion血液直接pcr试剂盒以所检验的所有反应体积进行。
将来自903卡的穿孔物和来自fta洗脱和fta基因卡的漂洗的穿孔物(均为1mm直径)用于具有对1kb、3.8kb和7.5kb扩增子特异的引物的50μl反应体积中。在所有情况下,pcr反应产生适当大小的扩增产物。
phusion血液直接pcr试剂盒与来自多个物种的血液兼容。sox21基因上游的高度保守的237bp区域(a.woolfe,m.goodson,plosbiol.3,e7;2004)成功从干燥在903和fta基因卡上的许多脊椎动物物种的血液扩增。
实施例4:使用施加到固体载体材料上的生物样品基因分型
许多癌症与基因重排有关。尤因肉瘤断裂点区1(ewsr1)在许多肉瘤中易位。最近,其重排已经在唾液腺透明样化透明细胞癌中描述(shahaa等人2013amjsurgpathol.37:571-8ewsr1geneticrearrangementsinsalivaryglandtumors:aspecificandverycommonfeatureofhyalinizingclearcellcarcinoma(唾液腺肿瘤中的ewsr1基因重排:透明样化透明细胞癌的特异性的和非常常见的特征))。本研究说明本文献中所述固体载体材料和想法对潜在地筛查复杂的哺乳动物基因组中的这种基因重排的潜能。
dna样品收集、储存和检测
将来自c57bl/6小鼠和nos3缺失小鼠(129/b6背景)的鼠组织施加到一系列基于不同纸的固体载体上。将小鼠安乐死并解剖以收集器官(血液、心脏、脑、肺、肝和肾)。将器官“夹”在两个纸层之间。压力经由无菌吸移管施加以将组织包埋在每一纤维素基质中。对于组织匀浆,将大约5mg组织使用塑料杜恩斯匀浆器在1.5ml微量离心管中处理,然后施加到适当的纸基质。施加后让所有样品空气干燥2小时,然后储存在具有干燥剂的密封小袋中。在一些情况下样品在处理前储存多达2月。
dna基因分型和定量
使用harris一次性微型打孔器(1.2mm或3mm直径)分别从纸卡以穿孔圆盘的形式切除干燥的组织样品。将样品圆盘从干燥样品的中心切除并放置在洁净的无dna酶的1.5ml微量离心管中。
nos3缺失或基因敲除小鼠通过用内皮一氧化氮合酶(enos)外显子10-特异性正向引物(5’-atttcctgtcccctgccttg–3’)、enosneo特异性正向引物(5’-ttgctacccgtgatattgct-3’)和enos外显子12-特异性反向引物(5’-ggccagtctcagagccatac-3’)pcr扩增基因组dna鉴定。
靶dna使用mjresearch热循环仪,用最初10min变性步骤接着94℃35sec,65℃1min和72℃1min36个循环,接着最后72℃延伸5min扩增。所得的pcr产物使用experion毛细管电泳系统可视化。小鼠dna定量使用用于小鼠样品的primerdesign基因组dna定量试剂盒(gdna-mo-q-dd)按照制造商的说明书实现。将个体野生型(wt)和nos3缺失的组织样品分开施加到不同的纸卡。为了例示从储存在纸基质上的dna区分基因型变异体的能力,某一区域的pcr扩增在wt和转基因(nos3缺失,基因敲除)小鼠上进行。
图7显示pcr扩增子,其与nos基因座有关,使用从来自纸卡的组织分离的dna作为扩增模板。泳道1-5为从wt小鼠组织(分别心脏、肝、脑、肺和肾)分离的dna。泳道6-10为从nos小鼠组织(分别心脏、肝、脑、肺和肾)扩增的dna。
表6:从储存在各种固体载体材料上的组织分离的dna的扩增的概述(nd=未测定)
在表6中,记录了从储存在各种固体载体材料上的组织分离的dna的成功扩增。dna从1.2mm穿孔物分离。“+”表示存在扩增子。
图7和表6(上方)显示分别从wt和nos3缺失基因敲除小鼠二者衍生的dna扩增产物。结果表明对于两种样品源,正确大小的dna扩增子从自施加到固体纸载体基质的所有器官/组织源分离的dna产生。这些数据表明1.2mmharris微型打孔器可从存储在固体纸载体上的组织切除足够的dna以区分两种遗传变异体。
实施例5.rna收集、纯化和定量
如所述的,将组织样品施加到固体载体纸卡,切除样品穿孔物,并如下所述用gehealthcareillustra®rnaspin试剂盒分离rna。利用市售mrna定量试剂盒,在abi7900实时pcr系统上进行rna定量。
使用harris3mm一次性微型打孔器,从经干燥样品点的中心切除穿孔物,并放入洁净无rna酶的1.5ml微量离心管。使illustra缓冲液ra1(350μl)与3.5μlβ-巯基乙醇混合,并将溶液加到圆盘。用20号针将圆盘匀浆化。将所得匀浆转移到rnaspinmini过滤柱,用于随后去除残余物质。使柱在11,000xg离心1min,并弃去rnaspinmini滤器。匀浆化的裂解液包含rna,将此滤液转移到新的无rna酶的1.5ml微量离心管。
将乙醇(70%;350μl)加到匀浆化的裂解液,并通过涡旋2x5sec脉冲而混合。对于各制备,将裂解液上下吸移2–3次,并施加到放入2ml微量离心管的rnamini-离心柱。使管在8000xg离心30sec,弃去穿流物(flowthrough)。将rna离心柱转移到新收集管。
加入illustramdb缓冲液(350μl),使管在11000xg离心1min。再一次弃去穿流物,将柱返回到收集管。根据制造商说明书制备dna酶反应混合物,并加到在rna离心柱内包含的滤器的表面。在室温进行这种dna酶孵育15min。
将洗涤缓冲液ra2(200μl)施加到rnamini-离心柱,并使柱在11000xg离心1min。再一次弃去穿流物,将柱返回到收集管。
将缓冲液ra3600μl施加到rnamini-离心柱,并使柱在11000xg离心1min,弃去穿流物,将柱返回到收集管。也用缓冲液ra3(250μl)进行另外的柱洗涤。为了使膜完全干燥,使柱在11000xg离心2min,最后将柱放入无核酸酶的1.5ml微量离心管。
将无rna酶的水(40μl)施加到柱,使柱在11000xg离心1min。经纯化rna在下游应用立即使用,或在-80℃储存直至使用。
为了确定在长期储存后来自多种组织的rna的完整性,对从纸卡上储存的小鼠组织样品分离的rna进行实时反转录聚合酶链反应(rt-pcr)。这些在干燥剂存在下储存2个月。mrna定量根据制造商说明书进行,使用i)abitaqman啮齿动物gapdh对照试剂盒(part#4308313),ii)invitrogen实时luxmrna引物组,用于鼠hprt、gapdh和β-肌动蛋白基因(分别为cat.105m-02、100m-02和101m-02),或iii)组织特异基因引物组,来自appliedbio-systems。
图8显示使用abitaqman啮齿动物gapdh对照试剂盒,来自数种组织源的gadph的相对表达水平。通过与从小鼠rna标准样品的定量滴定曲线产生的已知值比较,测定从施加两种不同固体载体卡的样品得到的rna水平。从两种纸类型分离的rna检测到可比gapdhrna水平。
编码hprt、gapdh和β-肌动蛋白的鼠mrna的绝对定量用适当的invitrogen实时lux引物组进行。通过与从小鼠rna标准样品的定量滴定曲线产生的已知值比较,测定从施加两种不同固体载体卡的样品得到的rna水平。与rna分离相关的数据在图8中描述,并且证明载体材料能够支持储存和稳定化来自多个组织类型的rna。
尽管已经显示和描述本发明的具体实施方案,但对本领域技术人员将会显而易见的是,可做出变化和修饰而不脱离本发明的教导。前述说明和附图中阐述的情况仅经由举例的方式提供,而非作为限制。本发明的实际范围意在当基于现有技术以适当的角度看待时在所附权利要求中定义。
- 还没有人留言评论。精彩留言会获得点赞!