一种基于核酸适体自催化作用的癌胚抗原检测试剂盒及其制备方法与流程
本发明涉及一种基于核酸适体自催化作用的癌胚抗原检测试剂盒及其制备方法,具体涉及一种磁珠分离技术联合核酸适体特异性捕集和自催化作用比色检测癌胚抗原的试剂盒,属于肿瘤标志物检测技术领域。
背景技术:
癌症是当今医学领域的顽症之一,其严重威胁人类的身体健康,随着人类生存环境的恶化,这种威胁呈上升趋势。据世界卫生组织统计,早期癌症的治愈率可达80%,但大多数恶性肿瘤在疾病早期缺乏特异性的临床表现,且临床上传统的诊断方法如影像学、细胞学检查等方法灵敏度不够高,再者在医疗资源匮乏的地区精密诊断仪器尚难以普及,故大多数癌症患者确诊时已为中晚期,只有约10%的病人具有手术切除的条件,难以挽救更多人的生命。因此,恶性肿瘤的早期发现,早期诊断和治疗仍是迄今为止治疗恶性肿瘤最为有效的手段之一,而癌症的早期诊断最新、最有效的方法是通过血液检查,寻找肿瘤标志物。
肿瘤标志物是指在恶性肿瘤发生和增殖过程中,由肿瘤细胞的基因表达而合成分泌的或是由机体对肿瘤反应而异常产生或升高的反应肿瘤存在或者生长的一类物质,包括胚胎抗原类、糖链抗原类、激素、酶、蛋白质类及基因类标志物等,这一类物质通常不存在于正常成人组织而见于胚胎组织,或者肿瘤组织中的含量超过正常组织的含量。在临床检验工作中,肿瘤标志物的血清学检测标本易获得,方法简单快捷,无创,已经广泛用于肿瘤的诊断,判断癌症的分期评价治疗的方案和判断预后。
癌胚抗原(cea)是大肠癌组织产生的一种糖蛋白,能反映人体的多种肿瘤的存在,是一类广谱性肿瘤标志物,正常人血清中癌胚抗原的含量极低,癌胚抗原升高主要见于结肠癌,其对于胰腺癌、乳腺癌、胃癌、肺癌等恶性肿瘤诊断也具有重要价值。目前检测血清中cea含量主要采用免疫学方法,如放射免疫分析法、化学发光免疫分析法、酶免疫分析法等,均依据癌胚抗原与其抗体的免疫反应。而优质抗体需由免疫动物获得,费时,成本较高,且易受动物机体状态及抗体纯化技术的影响,不同批次的抗体在特异性和性能方面常存在较大的差异而影响检验结果的准确性。再者,化学发光免疫分析法灵敏度高但仪器昂贵,放射免疫分析还存在同位素危害,不利于基层医疗机构的普及使用。目前酶免疫分析法试剂盒应用较为广泛,此类方法结果判读依据酶催化底物显色,需要先将抗原或抗体与酶结合制备酶标试 剂。酶标记过程繁复,且酶活性易受温度等因素的影响,呈溶液状态的酶标试剂的保质期会严重缩短,故抗体质量、酶标记技术及低温保存条件成为影响酶免疫分析法试剂盒准确性的重要因素。
核酸适体是一段由碱基组成的单链寡核苷酸片段,通过筛选得到的适体不仅具有类似抗体对目标分子高特异性,结构简单、易合成,反应速度快等优点,而且人工合成的核酸适体不依赖于动物免疫,相对抗体而言,适体的稳定性和环境耐受性更好,检验的成本更低。目前,就适体在血样肿瘤标志物的检测分析中的应用已取得了重要的进展,主要集中在电化学分析法,荧光分析法,电化学发光分析法等,表面增强罗曼散射法,表面增强等离子共振法等,方法在灵敏度、选择性等方面都有很大改进,但仍对检测仪器,实验技术有较高的要求。
技术实现要素:
本发明针对现有技术的不足,提供一种基于核酸适体自催化作用的癌胚抗原检测试剂盒及其制备方法。
本发明技术方案如下:
一种基于核酸适体自催化作用的癌胚抗原检测试剂盒,包括:
第一适体由核苷酸序列如seqidno.1所示的核苷酸片段的3’端通过羟基结合一个生物素构成;
第二适体由核苷酸序列如seqidno.2所示的核苷酸片段构成;
链霉亲和素包被的磁珠;
0.2~1.0mol/l的kcl溶液,体积为5~30μl;
5~10μmol/l的氯化血红素溶液,体积为1~5μl。
反应缓冲液、显色液、终止反应液。
根据本发明优选的,所述第一适体的反应浓度为1~5μmol/l,体积为5~30μl。
根据本发明优选的,所述第二适体的反应浓度为1~5μmol/l,体积为5~30μl。
根据本发明优选的,所述链霉亲和素包被的磁珠浓度为2~10mg/ml,用量为2~10μg。
根据本发明优选的,所述反应缓冲液为ph7.2~7.4的磷酸盐缓冲溶液,体积为30~40μl。
根据本发明优选的,所述终止反应液为浓度为0.5~2mol/l的h2so4溶液,体积为40~100μl。
根据本发明优选的,所述显色液为浓度为0.1~0.3mg/ml的3,3',5,5'-四甲基联苯胺(tmb)溶液,体积为50~100μl。
上述基于核酸适体自催化作用的癌胚抗原检测试剂盒的制备方法,步骤如下:
(1)化学合成第一适体;
(2)化学合成第二适体;
(3)配制浓度为0.2~1.0mol/l的kcl溶液、浓度为5~10μmol/l的氯化血红素溶液、反应缓冲液、显色液、终止反应液,用0.01mol/l、ph7.2~7.4磷酸盐(pbs)缓冲溶液配制链霉亲和素包被的磁珠;
(4)对步骤(1)第一适体、步骤(2)制得的第二适体、步骤(3)配制的kcl溶液、氯化血红素溶液、反应缓冲液、显色液、终止反应液以及链霉亲和素包被的磁珠进行装配,制得基于核酸适体自催化作用的癌胚抗原检测试剂盒。
根据本发明优选的,所述步骤(3)中,kcl溶液为按如下步骤配制:
将kcl固体以超纯水配制为浓度1mol/lkcl溶液,再以超纯水稀释至0.2~1.0mol/l;
根据本发明优选的,所述步骤(3)中,氯化血红素溶液为按如下步骤配制:
采用二甲亚砜溶解并稀释至5~10μmol/l;
根据本发明优选的,所述步骤(3)中,反应缓冲液为按如下步骤配制:
称取nah2po4·2h2o0.5g,na2hpo4·12h2o5.9g和nacl8.5g,加入超纯水1000ml配制含有0.01mol/lpo43-的ph7.2~7.4磷酸盐(pbs)缓冲溶液;
根据本发明优选的,所述步骤(3)中,显色液为由如下三种溶液在使用前按比例混合制得:
将ph5.2柠檬酸-na2hpo4缓冲溶液、1mg/mltmb溶液、30%h2o2按照700~900:100~300:1.0~3.0体积比混合;
上述1mg/mltmb溶液采用无水乙醇配制;ph5.2柠檬酸-na2hpo4缓冲溶液由0.1mol/l柠檬酸和0.2mol/lna2hpo4按体积比9.28:10.72配制;0.1mol/l柠檬酸和0.2mol/lna2hpo4采用超纯水配制;
根据本发明优选的,所述步骤(3)中,终止反应液为按如下步骤配制:
将h2so4加入超纯水中配制0.5~2mol/lh2so4溶液。
根据本发明优选的,所述步骤(3)中,链霉亲和素包被的磁珠为按如下步骤配制:
将链霉亲和素包被的磁珠加入0.01mol/l、ph7.2~7.4磷酸盐(pbs)缓冲溶液中,配制质量浓度为2~10mg/ml的链霉亲和素包被的磁珠。
反应原理
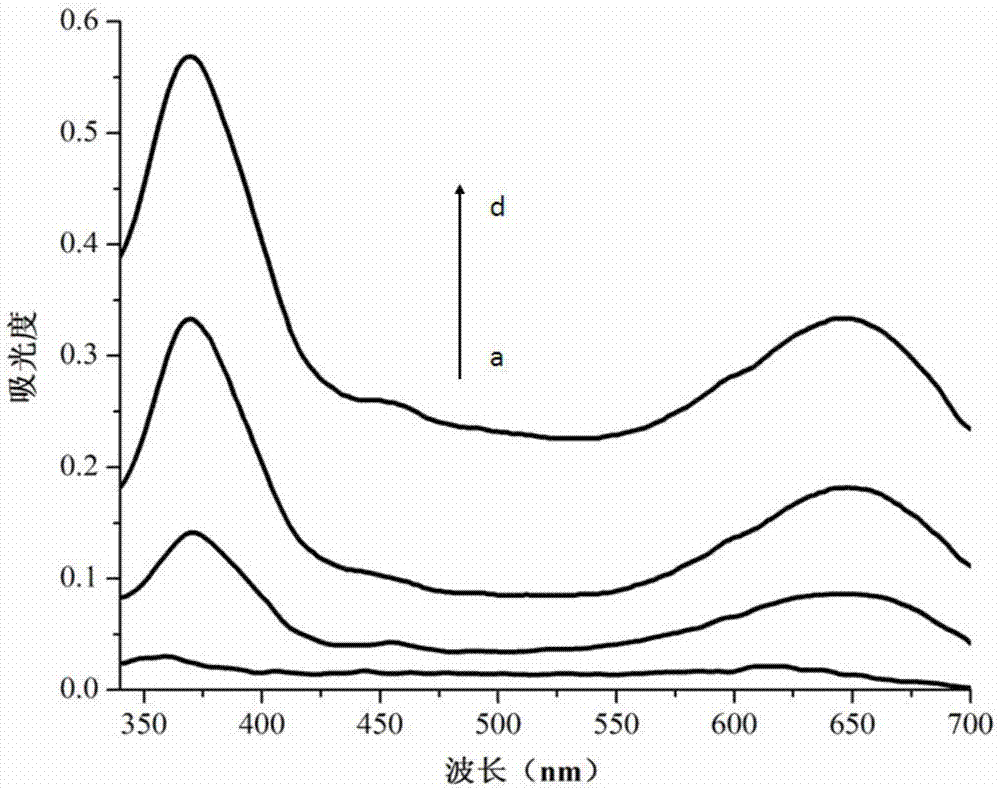
本发明所述试剂盒检测反应原理如图1所示;分别对浓度为0,10,25,50nmol/l的癌胚 抗原第二适体进行吸光度检测并绘制吸收曲线,结果如图2所示。根据显色情况及a到d的对比结果可看出,在加入不同浓度癌胚抗原第二适体溶液后,蓝色产物的吸光度值明显增加,说明癌胚抗原特异性第二适体本身的富g序列可形成分子间的g-四链体,其在嵌插氯化血红素后可具有过氧化物酶活性,可代替过氧化物酶催化底物tmb显色。
有益效果
1、本发明所述试剂盒通过链霉亲和素-生物素作用,将生物素化的癌胚抗原第一适体结合到链霉亲和素包被的磁珠表面,癌胚抗原与第一适体和第二适体特异性结合形成类似夹心的结构富集到磁珠的表面实现与血清中其他成分的高效相分离,再巧妙利用癌胚抗原第二适体富g的dna序列区域,在kcl作用下可形成分子间g-四链体,g-四链体嵌插氯化血红素后具有过氧化物酶活性可直接催化3,3',5,5'-四甲基联苯胺显色,从而实现癌胚抗原的检测;
2、本发明所述试剂盒对癌胚抗原进行检测,较现有检测方法,无需动物免疫抗体和酶标记过程,核酸适体为化学方法合成,稳定性和环境耐受性更好,且试剂保存更为方便,定量检测仅需要一台可见分光光度计即可。与其他的免疫学分析方法相比,方法简单、方便、费用低,可用于肿瘤的普查,诊断,治疗及预后判断,尤其是对于经济不发达,医疗资源匮乏地区居民的癌症诊断和疗效判断有重要意义,可促进癌症的早期诊断在基层医疗机构开展。
附图说明
图1为本发明所述试剂盒检测反应原理的示意图;
图2为癌胚抗原第二适体在嵌插氯化血红素后催化底物tmb显色的吸收曲线图;
图中:a到d的吸收曲线对应最终浓度分别为0,10,25,50nmol/l癌胚抗原第二适体;
图3为在不同浓度癌胚抗原条件下催化显色后蓝色产物对应的吸收曲线图;
图中:a到d的吸收曲线分别对应最终浓度为0,1,2,4ng/ml癌胚抗原;
图4为在不同浓度癌胚抗原条件下催化显色并硫酸终止后的黄色产物对应的吸收曲线图;
图中:a到d的吸收曲线分别对应最终浓度为0,1,2,4ng/ml癌胚抗原;
图5为cea分析结果的线性回归分析曲线。
具体实施方式
下面结合实施例对本发明的技术方案做进一步说明,但本发明所保护范围不限于此。
实施例中所述的链霉亲和素包被磁珠购自郑州英诺生物技术有限公司。
cea标准品购自上海领潮生物科技有限公司。
tmb购自aladdin公司;
第一适体和第二适体由生工生物工程(上海)股份有限公司化学合成。
实施例1
一种基于核酸适体自催化作用的癌胚抗原检测试剂盒,包括:
第一适体由核苷酸序列如seqidno.1所示的核苷酸片段的3’端通过羟基结合一个生物素构成;
第一适体序列为5'-ttaacttattcgaccatatttttttttt-生物素-3';
第二适体由核苷酸序列如seqidno.2所示的核苷酸片段构成;
第二适体序列为5'-cccatagggaagtggggga-3';
浓度4mg/ml的链霉亲和素包被的磁珠,用量为4μg;
0.2mol/l的kcl溶液,20μl;
10μmol/l的氯化血红素溶液,1μl;
反应缓冲液为ph7.4的磷酸盐缓冲溶液、显色液为0.1mg/ml的3,3',5,5'-四甲基联苯胺(tmb)溶液、终止反应液为浓度2mol/l的h2so4溶液。
上述基于核酸适体自催化作用的癌胚抗原检测试剂盒的制备方法,步骤如下:
(1)化学合成第一适体;
(2)化学合成第二适体;
(3)配制kcl溶液、氯化血红素溶液、反应缓冲液、显色液、终止反应液;
将kcl固体以超纯水配制为浓度1mol/lkcl溶液,再以超纯水稀释至0.2mol/l,配制kcl溶液;
采用二甲亚砜溶解氯化血红素并稀释至10μmol/l,配制氯化血红素溶液;
称取nah2po4·2h2o0.5g,na2hpo4·12h2o5.9g和nacl8.5g,加入超纯水1000ml配制含有0.01mol/lpo43-的ph7.4磷酸盐(pbs)缓冲溶液;
使用前将ph5.2柠檬酸-na2hpo4缓冲溶液、1mg/mltmb溶液、30%h2o2按照900:100:1.5体积比混合,配制显色液;上述1mg/mltmb溶液采用无水乙醇配制;ph5.2柠檬酸-na2hpo4缓冲溶液由0.1mol/l柠檬酸和0.2mol/lna2hpo4按体积比9.28:10.72配制;0.1mol/l柠檬酸和0.2mol/lna2hpo4采用超纯水配制;
将h2so4加入超纯水中配制2mol/lh2so4溶液,制得终止反应液;
将链霉亲和素包被的磁珠加入0.01mol/l、ph7.4磷酸盐(pbs)缓冲溶液中,配制质量浓度为4mg/ml的链霉亲和素包被的磁珠。
(4)对步骤(1)第一适体、步骤(2)制得的第二适体、步骤(3)配制的kcl溶液、氯化血红素溶液、反应缓冲液、显色液、终止反应液以及链霉亲和素包被的磁珠进行装配,制得基于核酸适体自催化作用的癌胚抗原检测试剂盒,避光保存。
实施例2
上述基于核酸适体自催化作用的癌胚抗原检测试剂盒在检测癌胚抗原中的应用,具体步骤如下:
1、待测血清样品准备:采用真空促凝管采集全血3ml,静置1小时,转速3000转,离心10分钟,取上层清液10μl待测。
实验中用到的缓冲溶液均为po43-浓度为0.01mol/lph7.4磷酸盐(pbs)缓冲溶液。
2、制备癌胚抗原第一适体功能化的磁珠:
将实施例1制得的试剂盒中30μlph7.4的磷酸盐(pbs)缓冲溶液,1μl4mg/ml的直径为1μm链霉亲和素包被磁珠,将第一适体用反应缓冲液(0.01mol/l、ph7.4磷酸盐缓冲溶液)稀释至100μmol/l,充分振荡10分钟,再逐级稀释至1μmol/l;取20μl1μmol/l的apt1(第一适体)溶液依次加入0.5ml塑料离心管中,振荡混合均匀。然后将离心管放置于磁力架上,静置5~10分钟,待磁珠吸附至离心管管壁,溶液变为澄清时吸去液体,用100μlph7.4的pbs缓冲溶液洗涤磁珠;磁分离及洗涤3次,完全去除未与磁珠结合还游离在溶液中的第一适体,再用ph7.4的磷酸盐(pbs)缓冲溶液将负载有apt1的磁珠固体重悬至40μl溶液,制得apt1功能化磁珠。
3.癌胚抗原与其特异性第一适体的温育反应:
(i)将cea标准品用po43-浓度为0.01mol/l、ph7.4的磷酸盐(pbs)缓冲溶液稀释至浓度分别为1ng/ml、2ng/ml、5ng/ml、10ng/ml、20ng/ml、40ng/ml、80ng/ml、120ng/ml、160ng/ml的cea溶液,备用。
(ii)向制得的apt1功能化磁珠中加入10μl不同浓度的cea溶液(浓度为1-160ng/ml),37℃水浴恒温振荡30~40分钟,重复步骤2的磁分离洗涤过程,磁分离及洗涤3次,去除未与磁珠表面apt1结合的游离cea,再用ph7.4的磷酸盐(pbs)缓冲溶液将负载有cea-apt1复合物的磁珠固体重悬至30μl溶液,制得负载有cea-apt1复合物的磁珠。
4.癌胚抗原与其特异性第二适体的温育反应:
向制得负载有cea-apt1复合物的磁珠中加入20μl1μmol/l的apt2(第二适体)溶液,第二适体先用反应缓冲液(0.01mol/l、ph7.4磷酸盐缓冲溶液)稀释至100μmol/l,充分振荡10分钟,再逐级稀释至1μmol/l;取37℃水浴恒温振荡30~40分钟,重复步骤2的 磁分离洗涤过程,磁分离及洗涤3次,去除未负载到磁珠表面的游离apt2得到磁珠负载的apt1-cea-apt2夹心复合物,再用ph7.4的磷酸盐(pbs)缓冲溶液将负载有apt1-cea-apt2夹心复合物的磁珠固体重悬至30μl溶液,制得负载有apt1-cea-apt2夹心复合物的磁珠。
5.显色反应:
向负载有apt1-cea-apt2夹心复合物的磁珠中加入实施例1制得的试剂盒中20μl0.2mol/l的kcl,1μl10μmol/l氯化血红素,振荡20~30分钟,加入配制后的100μltmb显色液,再放置30分钟,目视观察颜色定性判读。
6.cea的检测
cea的定性检测结果就显色情况可以目视辨别,加入10μl10ng/mlcea标准溶液(最终计算浓度为0.5ng/mlcea)裸视就可辨别出蓝色,即样品中cea浓度达到10ng/ml时可直接根据tmb显色情况判读阳性。
蓝色产物在370nm和652nm获得较强的吸光度如图3所示,可根据吸光值进行定量检测。为保证结果的稳定性可加入酸性终止液,其在450nm处有最大吸光度。
图3的a到d吸收曲线分别对应最终浓度为0,1,2,4ng/ml癌胚抗原。根据a到d的对比结果可看出,在加入不同浓度癌胚抗原后,通过适体和癌胚抗原的反应,负载到磁珠上的癌胚抗原第二适体的量不同,得到的模拟酶活性大小不同,故吸光度值不同,可根据蓝色产物的吸光值的不同判断体系中癌胚抗原的加入量。
cea的定量测定采用可见分光光度计完成。将步骤5得到的蓝色溶液再加入48μl浓度为2mol/l的h2so4溶液定容至200μl,转移至比色皿,待测。对一系列不同浓度的cea标准溶液和未加入cea的空白溶液进行扫描获得吸收曲线如图4所示。
图4a到d的吸收曲线分别对应最终浓度为0,1,2,4ng/ml癌胚抗原。由于酸终止酶促反应吸光度值更为稳定,tmb显色的蓝色产物通常加硫酸终止反应后得到黄色产物,其最大吸收峰在450nm处。图4a到d的对比结果与图3的趋势一致,在加入不同浓度癌胚抗原后,负载到磁珠上的癌胚抗原第二适体的量不同,得到的模拟酶活性大小不同,故最终得到的黄色产物的量不同,可依据吸光值大小的判断体系中癌胚抗原的加入量。
测定450nm处的吸光度值,绘制工作曲线。得到吸光度差值δi450nm=(i-i0)450nm与cea最终浓度ccea的线性关系为δi450nm=0.1411ccea+0.0025,δi与0.1-6ng/mlcea具有良好的线性关系,检出限为0.05ng/ml,r2=0.9781。
采集待测人血清样本,取样量为10μl,代替cea标准溶液进行测定,血清中cea浓度为2~120ng/ml无需稀释可直接测定。
实施例3
一种基于核酸适体自催化作用的癌胚抗原检测试剂盒,包括:
第一适体由核苷酸序列如seqidno.1所示的核苷酸片段的3’端通过羟基结合一个生物素构成;
第一适体序列为5'-ttaacttattcgaccatatttttttttt-生物素-3';
第二适体由核苷酸序列如seqidno.2所示的核苷酸片段构成;
第二适体序列为5'-cccatagggaagtggggga-3';
浓度10mg/ml的链霉亲和素包被的磁珠,用量为10μg;
1.0mol/l的kcl溶液,10μl;
5μmol/l的氯化血红素溶液,5μl;
反应缓冲液为ph7.2的磷酸盐缓冲溶液、显色液为浓度0.1mg/ml的3,3',5,5'-四甲基联苯胺(tmb)溶液、终止反应液为浓度1.0mol/l的h2so4溶液。
上述基于核酸适体自催化作用的癌胚抗原检测试剂盒的制备方法同实施例1。
实施例4
将实施例3制得的基于核酸适体自催化作用的癌胚抗原检测试剂盒于常温条件下避光放置1个月,然后进行如下检测:
1、采用真空促凝管采集病人全血各3ml,共15例,静置1小时,转速3000转,离心10分钟,取上层清液即为人血清样本,备用;
2、将实施例3制得的试剂盒中40μlph7.2的磷酸盐(pbs)缓冲溶液,1μl10mg/ml的直径为1μm链霉亲和素包被磁珠,将第一适体用反应缓冲液(0.01mol/l、ph7.4磷酸盐缓冲溶液)稀释至100μmol/l,充分振荡10分钟,再逐级稀释至5μmol/l;然后将10μl5μmol/l的apt1溶液依次加入0.5ml塑料离心管中,振荡混合均匀。磁分离及洗涤3次,完全去除未与磁珠结合还游离在溶液中的癌胚抗原第一适体,再用ph7.2的磷酸盐(pbs)缓冲溶液将负载有apt1的磁珠固体重悬至40μl溶液;
3、加入10μl步骤1制得的人血清样本,37℃水浴恒温振荡30~40分钟,磁分离及洗涤3次,去除未与磁珠表面apt1结合的游离cea,再用ph7.2的磷酸盐(pbs)缓冲溶液将负载有cea-apt1复合物的磁珠固体重悬至40μl溶液;
4、实施例3制得的第二适体先用反应缓冲液(0.01mol/l、ph7.4磷酸盐缓冲溶液)稀释至100μmol/l,充分振荡10分钟,再逐级稀释至5μmol/l;然后向步骤3制得的负载有cea-apt1复合物的磁珠固体重悬液中加入10μl5μmol/l的apt2溶液,37℃水浴恒温振荡 30~40分钟,磁分离及洗涤3次,去除未负载到磁珠表面的游离apt2,再用ph7.2的磷酸盐(pbs)缓冲溶液将负载有apt1-cea-apt2夹心复合物的磁珠固体重悬至40μl溶液;
5、在apt1-cea-apt2夹心复合物溶液中加入实施例3制得的试剂盒中10μl1mol/l的kcl溶液,5μl5μmol/l氯化血红素溶液,振荡20~30分钟,加入配制后的100μltmb显色液,再放置30分钟,目视观察颜色定性判读,其中有9例出现明显蓝色;
6、再加入98μl浓度为1mol/l的h2so4溶液定容至250μl,在可见分光光度计上450nm读取吸光度值,根据该条件下工作曲线方程计算不同病人血清中cea含量,分别为5.62ng/ml,6.51ng/ml,17.47ng/ml,10.94ng/ml,2.53ng/ml,24.02ng/ml,17.71ng/ml,35.61ng/ml,14.79ng/ml,26.24ng/ml,3.15ng/ml,8.35ng/ml,19.41ng/ml,7.74ng/ml,24.86ng/ml。
采用电化学发光免疫分析方法测得病人血清中cea含量分别为3.53ng/ml,5.44ng/ml,15.65ng/ml,8.21ng/ml,0.74ng/ml,27.58ng/ml,17.63ng/ml,30.76ng/ml,18.41ng/ml,21.04ng/ml,1.71ng/ml,5.09ng/ml,15.65ng/ml,6.21ng/ml,20.05ng/ml,作两种方法分析结果的回归分析,y=0.9891x+1.9661,r2=0.9257,采用相关系数检验法对回归方程进行检验,两种方法相关性较好,如图5所示。并且,实施例3制备的基于核酸适体自催化作用的癌胚抗原检测试剂盒并未因长时间放置而导致检测结果的不准确,因此可以解决现有酶标试剂盒的酶常温保质期短,催化底物显色后灵敏度低的弊端。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 一组特异性结合结核分枝杆菌的核酸适配体及其应用
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 几种识别灭草松的核酸适配体序列及其衍生物的制作方法