犬瘟热病毒胶体金免疫层析检测试纸条及其制备方法与流程
本发明涉及胶体金检测试纸条技术领域,具体涉及一种犬瘟热病毒胶体金免疫层析检测试纸条及其制备方法。
背景技术:
犬瘟热(Canine Distemper,CD)是由犬瘟热病毒(Canine Distemper Virus,CDV)引起的一种高度接触性、致死性传染病。感染犬瘟热病毒毛皮兽临床症状为精神沉郁、体温升高、厌食、拉稀,后期出现神经症状,表现为共济失调、四肢瘫痪等。最终,口吐白沫、尖叫而死亡。被称为毛皮动物三大疫病之一。
现有的犬瘟热病毒检测方法主要包括血清中和试验、免疫荧光试验、ELISA、RT-PCR、病毒分离及包涵体检查。但是这些方法都需要专业人员在特殊仪器下进行操作,并且耗时几小时到几天不等。因此建立一种在临床上操作简易、快速、可靠并且廉价的犬瘟热病毒检测方法非常重要。
技术实现要素:
为了解决现有的CDV检测技术存在的检测步骤繁琐、耗时,需要专业人员进行操作且主要依赖实验室的问题,本发明提供一种犬瘟热病毒胶体金免疫层析检测试纸条及其制备方法。
本发明为解决技术问题所采用的技术方案如下:
本发明的犬瘟热病毒胶体金免疫层析检测试纸条,包括PVC底板,依次粘贴在PVC底板上的样品垫、金标结合垫、带有检测线和质控线的硝酸纤维素膜、吸收垫:金标结合垫包被有纯化的犬瘟热病毒单克隆抗体N18与胶体金的偶联标记物,硝酸纤维素膜上的检测线包被有纯化的犬瘟热病 毒单克隆抗体C42,硝酸纤维素膜上的质控线包被有羊抗鼠IgG。
本发明还提供了上述犬瘟热病毒胶体金免疫层析检测试纸条的制备方法,包括以下步骤:
步骤一:犬瘟热病毒单克隆抗体N18、C42的制备:选6~8周龄的雌性Balb/c小鼠,腹腔注射降植烷0.5mL/只,7天后分别腹腔注射两株犬瘟热病毒单克隆抗体杂交瘤细胞,接种量均为4×106~6×106细胞/mL/只;待小鼠腹部膨大后分别抽取腹水,5000rpm离心15min,取上清;将腹水上清分别用50%饱和度的硫酸铵盐析2次,透析除盐后,获得纯化的犬瘟热病毒单克隆抗体N18和犬瘟热病毒单克隆抗体C42;
步骤二:犬瘟热病毒单克隆抗体N18与胶体金的偶联标记物的制备:逐级稀释法确定犬瘟热病毒单克隆抗体N18与胶体金溶液的用量比例为8.8μg~9.6μg:1mL,按照此用量比例逐滴加入犬瘟热病毒单克隆抗体N18,再加入终浓度为5%的牛血清蛋白,搅拌后获得犬瘟热病毒单克隆抗体N18与胶体金的偶联标记物,采用低温超速离心法对该偶联标记物进行纯化;
步骤三:试纸条的组装:采用喷金仪将犬瘟热病毒单克隆抗体N18与胶体金的偶联标记物喷在玻璃纤维素膜,室温条件下自然干燥,密封,获得金标结合垫;采用划膜仪将犬瘟热病毒单克隆抗体C42、羊抗鼠IgG分别划膜于硝酸纤维素膜上的检测线和质控线上;将处理好的样品垫、金标结合垫、硝酸纤维素膜依次粘贴在PVC底板上,切条、组装、密封,获得犬瘟热病毒单克隆抗体胶体金检测试纸条,室温保存。
进一步的,步骤一中,两株犬瘟热病毒单克隆抗体杂交瘤细胞采用以下方法制备:将提纯的犬瘟热病毒接种Balb/c小鼠,加强免疫后,收集其脾细胞,与事先准备好的骨髓瘤细胞进行融合,用1%HAT培养液培养; 融合2周左右,采用间接ELISA方法筛选出两株阳性杂交瘤细胞株,并对筛选后的阳性杂交瘤细胞进行克隆,得到两株犬瘟热病毒单克隆抗体杂交瘤细胞株。
进一步的,步骤二所述胶体金溶液采用柠檬酸三钠还原法制备:取1%氯金酸溶液1ml加入99ml的超纯水配置成终浓度为0.01%的氯金酸溶液,加热至沸腾后,加入1%柠檬酸三钠1ml并继续加热,溶液由淡黄色转为蓝黑色最终变为酒红色,颜色稳定后继续加热5分钟,室温冷却,获得胶体金溶液,4℃保存备用,胶体金颗粒直径为30nm。
进一步的,步骤二中,所述逐级稀释法确定犬瘟热病毒单克隆抗体N18与胶体金溶液的用量比列的具体过程如下:用0.1mol/L的碳酸钾溶液调节胶体金溶液的PH值为8.4,向11支离心管中分别加入1ml胶体金溶液;将犬瘟热病毒单克隆抗体N18逐级稀释后即含量分别为2μg、4μg、6μg、8μg、10μg、12μg、14μg、16μg、18μg、20μg,按照上述顺序加入到2号管至11号管中,并与离心管中的胶体金溶液混匀,5分钟后在2号管至11号管中分别加入10%的氯化钠溶液1ml混匀,室温静置2小时以上观察结果,1号管为空白对照;
2号管至4号管中,出现由红变蓝的聚沉现象,5号管至11号管中,保持胶体金的红色不变;因此,胶体金红色不变且犬瘟热病毒单克隆抗体N18加入量最低的离心管即5号管中的犬瘟热病毒单克隆抗体N18含量,即为稳定1ml胶体金溶液所需的最低稳定量,在该最低稳定量的基础上再加上20%~30%即为稳定1ml胶体金溶液所需的犬瘟热病毒细胞单克隆抗体N18的实际使用量,即犬瘟热病毒细胞单克隆抗体N18与胶体金溶液的用量比例为8.8μg~9.6μg:1mL。
进一步的,步骤二中,采用低温超速离心法对该偶联标记物进行纯化的具体过程如下:首先将体积为V的金标犬瘟热病毒单克隆抗体N18在4℃下以3000rpm/min离心40分钟,吸取上清液,弃沉淀:再将上清液在4℃下以10000rpm/min离心40分钟,弃去上清,用0.01mol/L、pH7.4的PBS缓冲溶液解沉淀至原体积即金标犬瘟热病毒单克隆抗体N18的体积V的1/10,获得纯化的金标犬瘟热病毒单克隆抗体N18,4℃保存备用。
进一步的,所述PBS缓冲液中含有1%BSA和0.02%叠氮钠。
进一步的,犬瘟热病毒单克隆抗体N18与胶体金的偶联标记物的标记量为8.8μg~9.6μg:1mL。
进一步的,步骤三中,犬瘟热病毒单克隆抗体C42的标记量为2μg/cm。
进一步的,步骤三中,羊抗鼠IgG的标记量为4μg/cm。
本发明的有益效果是:本发明的犬瘟热病毒胶体金免疫层析检测试纸条具有特异性强、敏感度高、简单快速、操作简单快捷等特点,易于推广,适用于基层养殖场检测,具有广阔的市场前景。
本发明将酶联免疫原理与胶体金层析技术结合,制备检测犬瘟热病毒胶体金免疫层析检测试纸条并拟应用于临床,提高水貂阿留申病的预防能力,具有操作简单快速、检测结果清楚易于判断、特异性强、敏感性高、无需仪器设备等优点,因此,非常适用于现场、门诊等实验室条件有限的场所进行临床样品检测。本发明提供了上述试纸条的制备方法,适用于工业生产。
附图说明
图1为本发明的犬瘟热病毒胶体金免疫层析检测试纸条的结构示意图。
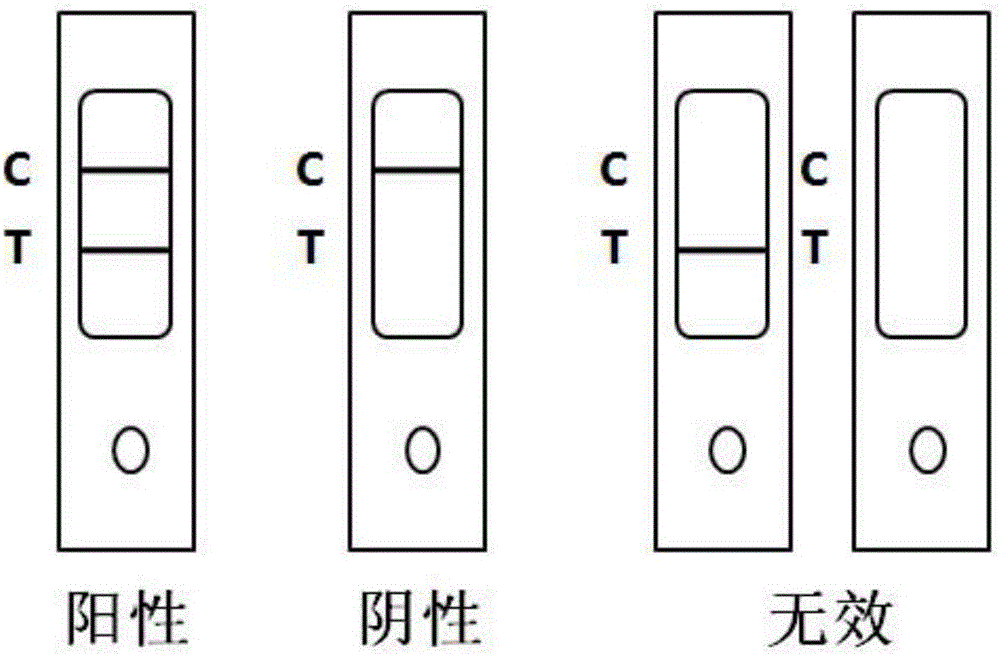
图2为本发明的犬瘟热病毒胶体金免疫层析检测试纸条结果判定示意图。
图中:1、PVC底板,2、样品垫,3、金标结合垫,4、硝酸纤维素膜,5、检测线,6、质控线,7、吸收垫。
具体实施方式
本发明的犬瘟热病毒胶体金免疫层析检测试纸条,包括PVC底板1、样品垫2、金标结合垫3、带有检测线5和质控线6的硝酸纤维素膜4、吸收垫7,样品垫2、金标结合垫3、带有检测线5和质控线6的硝酸纤维素膜4、吸收垫7依次粘贴在PVC底板1上,金标结合垫3包被有纯化的犬瘟热病毒单克隆抗体N18与胶体金的偶联标记物,硝酸纤维素膜4上的检测线5包被有纯化的犬瘟热病毒单克隆抗体C42,硝酸纤维素膜4上的质控线6包被有羊抗鼠IgG。
本发明的犬瘟热病毒胶体金免疫层析检测试纸条的使用方法如下:
用塑料吸头吸取待检测动物的尿液样品于加样孔中,5~10分钟即可显示结果,对比检测线5和对照线6的颜色即可判断被检水貂体内是否带有犬瘟热病毒或者被犬瘟热病毒感染。
结果判断如图2所示:
1、阳性:在检测线5和质控线6处各出现一条红色条带,判定为阳性;检测线5条带色泽的深浅依检测样品中犬瘟热病毒抗原含量的高低而变化,抗原含量越高色带越深,反之越浅。
2、阴性:在质控线6出现一条红色条带,检测线5未出现红色条带,说明检测样品中无犬瘟热病毒抗原存在。
3、无效:仅在检测线5有条带或在检测线5和质控线6均无明显条带 出现,视为试纸条检测无效。
以下结合实施例和附图对本发明作进一步详细说明。
实施例1犬瘟热病毒单克隆抗体N18、C42的制备
(1)将提纯的犬瘟热病毒接种Balb/c小鼠,加强免疫后,收集其脾细胞,与事先准备好的骨髓瘤细胞进行融合,用1%HAT培养液培养;融合2周左右,采用间接ELISA方法筛选出两株阳性杂交瘤细胞株,并对筛选后的阳性杂交瘤细胞进行克隆,得到两株犬瘟热病毒单克隆抗体杂交瘤细胞株;
(2)选6~8周玲的雌性Balb/c小鼠,腹腔注射降植烷0.5mL/只,7天后分别腹腔注射两株犬瘟热病毒单克隆抗体杂交瘤细胞,接种量均为4×106~6×106细胞/mL/只;待小鼠腹部膨大后(约一周)分别抽取腹水,5000rpm离心15min,取上清;将腹水上清分别用50%饱和度的硫酸铵盐析2次,透析除盐后,获得纯化的犬瘟热病毒单克隆抗体N18和犬瘟热病毒单克隆抗体C42。
实施例2胶体金溶液的制备
采用柠檬酸三钠还原法制备胶体金溶液:取1%氯金酸溶液1ml加入99ml的超纯水配置成终浓度为0.01%的氯金酸溶液,加热至沸腾后,加入1%柠檬酸三钠1ml并继续加热,溶液由淡黄色转为蓝黑色最终变为酒红色,颜色稳定后继续加热5分钟,室温冷却后4℃保存备用,获得胶体金溶液。吸取少量胶体金颗粒用透射电竞观察,胶体金颗粒大小基本一致,分布均匀,胶体金颗粒直径约40nm为合格。
实施例3犬瘟热病毒单克隆抗体N18与胶体金的偶联标记物(金标犬瘟热病毒单克隆抗体N18)的制备
(1)逐级稀释法确定犬瘟热病毒单克隆抗体N18与胶体金溶液的用量比例:用0.1mol/L的碳酸钾溶液调节胶体金溶液的PH值为8.4,取11支洁净的离心管,编号为1号管至11号管,每管加入1ml胶体金溶液;将纯化的犬瘟热病毒单克隆抗体N18逐级稀释后即含量分别为2μg、4μg、6μg、8μg、10μg、12μg、14μg、16μg、18μg、20μg,按照上述顺序加入到2号管至11号管中,并与离心管中的胶体金溶液混匀,5分钟后在2号管至11号管中分别加入10%的氯化钠溶液1ml混匀,室温静置2小时以上观察结果;1号管中未加入犬瘟热病毒单克隆抗体N18和氯化钠溶液,设为对照管;
犬瘟热病毒单克隆抗体N18加入量不足以稳定胶体金的离心管(2号管至4号管),即出现由红变蓝的聚沉现象,而犬瘟热病毒单克隆抗体N18加入量达到或超过最低稳定量的离心管(5号管至11号管),则保持胶体金的红色不变。因此,胶体金红色不变且犬瘟热病毒单克隆抗体N18加入量最低的离心管(5号管)中的犬瘟热病毒单克隆抗体N18含量(8μg),即为稳定1ml胶体金溶液所需的最低稳定量,在该最低稳定量的基础上再加上10%~20%即为稳定1ml胶体金溶液所需的犬瘟热病毒细胞单克隆抗体N18的实际使用量,即犬瘟热病毒细胞单克隆抗体N18与胶体金溶液的用量比例为8.8μg~9.6μg:1mL。
(2)用0.1mol/L碳酸钾溶液调节胶体金溶液的PH值为8.4,在磁力搅拌下,按照上述确定的犬瘟热病毒单克隆抗体N18与胶体金溶液的用量比例(8.8μg~9.6μg:1mL)向胶体金溶液中逐滴加入犬瘟热病毒单克隆抗体N18,继续搅拌20分钟,加入终浓度为5%的牛血清白蛋白,再搅拌15分钟,获得犬瘟热病毒单克隆抗体N18与胶体金的偶联标记物即金标犬瘟热 病毒单克隆抗体N18,4℃保存备用。
(3)金标犬瘟热病毒单克隆抗体N18的纯化
采用低温超速离心法纯化金标犬瘟热病毒单克隆抗体N18,以去除溶液中未标记的犬瘟热病毒单克隆抗体N18和未充分标记的胶体金以及在标记中可能形成的各种聚合物。首先将金标犬瘟热病毒单克隆抗体N18(体积为V)在4℃下,以3000rpm/min低速离心40分钟,吸取上清液,弃沉淀;再将上清液在4℃下,以10000rpm/min离心40分钟,弃去上清,用0.01mol/L、pH7.4的PBS缓冲溶液(内含1%BSA和0.02%叠氮钠)溶解沉淀至原体积(指的是金标犬瘟热病毒单克隆抗体N18的体积V),充分稳定后过夜:4℃下,再以10000rpm/min离心40分钟,弃去上清,用0.01mol/L、pH7.4的PBS缓冲溶液(内含1%BSA和0.02%叠氮钠)溶解沉淀至原体积(指的是金标犬瘟热病毒单克隆抗体N18的体积V)的1/10,获得纯化的金标犬瘟热病毒单克隆抗体N18,该纯化的金标犬瘟热病毒单克隆抗体N18位于离心管底部,为深红色的松散沉淀,4℃保存备用。
实施例4试纸条的组装
(1)采用喷金仪将犬瘟热病毒单克隆抗体N18与胶体金的偶联标记物喷在玻璃纤维素膜,犬瘟热病毒单克隆抗体N18与胶体金的偶联标记物的标记量为8.8μg~9.6μg:1mL,室温条件下自然干燥,密封,获得金标结合垫3,4℃保存备用;
(2)采用划膜仪将犬瘟热病毒单克隆抗体C42、羊抗鼠IgG分别划膜于硝酸纤维素膜4上的检测线5和质控线6上,犬瘟热病毒单克隆抗体C42、羊抗鼠IgG的标记量分别为2μg/cm、4μg/cm,室温条件下自然干燥,密封,获得带有检测线5(包被有纯化的犬瘟热病毒单克隆抗体C42)和质控线6 (包被有羊抗鼠IgG)的硝酸纤维素膜4,4℃保存备用;
(3)将上述处理好的样品垫2、金标结合垫3、带有检测线5和质控线6的硝酸纤维素膜4、吸收垫7等材料依次粘贴在PVC底板上,切条、组装、密封,获得本发明的犬瘟热病毒胶体金免疫层析检测试纸条,室温保存备用。组装后的试纸条如图1所示。
实施例5特异性试验
采用本发明的试纸条对犬瘟热病毒(CDV)、犬细小病毒(CPV)、犬冠状病毒(CCV)、犬副流感病毒(CPIV)、伪狂犬病毒(PRV)、新城疫病毒(NDV)进行检测。
结果显示:仅犬瘟热病毒细胞毒样品和犬瘟热病毒感染的水貂尿液样品出现明显的检测线5和对照线6,其余样品检测均为阴性,说明本发明的试纸条具有良好的特异性。
实施例6敏感性试验
选择同一批次制备的胶体金试纸条对稀释的不同浓度的犬瘟热病毒细胞毒样品进行检测,稀释浓度依次为100μg/mL、50μg/mL、25μg/mL、12.5μg/mL、6.25μg/mL、3.13μg/mL。结果显示:病毒稀释液浓度大于等于3.13μg/mL时,在检测线和质控线均能出现红色条带,证明本发明试纸条的敏感性较强。
实施例7重复性试验
(1)组内重复性检测:
用同一批次的本发明的试纸条检测犬瘟热病毒阴性样品、犬瘟热病毒阳性样品各30份样本(三次重复试验)。结果显示,本发明的试纸条检测的阴性、阳性结果分别为30例,这表明本发明的试纸条具有良好的重复性。
(2)组间重复性检测:
用3个不同批次的本发明的试纸条检测犬瘟热病毒阴性样品、犬瘟热病毒阳性样品各30份样本(三次重复试验)。结果显示,每个批次试纸条检测的阴性、阳性结果分别为30例,这再次表明本发明的试纸条具有良好的重复性。
- 还没有人留言评论。精彩留言会获得点赞!