一种重组人角质细胞生长因子生物学活性检测方法与流程
本发明属于生物制品质量检测分析领域,具体涉及一种重组人角质细胞生长因子生物学活性检测方法。
背景技术:
人角质细胞生长因子-1(human keratinocyte growth factor-1,hKGF-1),即成纤维生长因子7(fibroblast growth factor-7,FGF-7),hKGF-1由间质细胞产生,通过旁分泌特异性作用于上皮细胞,是一种可刺激胚胎发育,促进上皮细胞增殖和生长,参与免疫重建,以及肿瘤形成与发展等重要生物学功能的细胞生长因子。
美国Amgen公司开发的静脉注射液Palifermin(商品名kepivance,含重组hKGF-1(rhKGF-1))2004年12月获美国FDA批准上市,用于减少正在进行放化疗以准备骨髓移植的恶性血液病患者患口腔黏膜炎的几率,或缩短该疾病的发病时间。该rhKGF-1是由大肠杆菌表达的天然hKGF-1的N末端前23个氨基酸残基缺失的hKGF类似物,可增强hKGF-1的稳定性和生物学活性。rhKGF-1的生物学活性是rhKGF-1产品质量控制的重要评价参数,关系到rhKGF-1的治疗效果,因此,应建立切实可行的生物学活性分析方法,对rhKGF-1产品进行有效的质量控制。
目前,rhKGF-1生物学活性常规检测方法主要通过检测细胞代谢或DNA合成来检测细胞的增殖活性。其中,检测细胞代谢方法有MTT比色法和CCK8比色法、Hoechst荧光染色法。MTT法和CCK8法检测细胞增殖原理基本一致,都是检测的化学试剂被活细胞线粒体中脱氢酶还原后生成甲瓒产物(Formazan),而死细胞无此功能。在一定细胞数范围内,生成的甲瓒物的数量与活细胞的数量成正比,因此利用这一特性可反映活细胞数量,从而间接检测rhKGF-1生物学活性的情况。Hoechst荧光染色法利用非嵌入性荧光染料在活细胞中DNA聚AT序列富集区域的小沟处与DNA结合的原理,检测活细胞核着色情况。MTT法和CCK8法、Hoechst荧光染色法快速、简便,但前两种方法均检测的线粒体中酶的活性,后一种方法检测的是活细胞核,此三种方法直接反映的是活细胞数目。
现有技术文献:Biomimetic Delivery of Keratinocyte Growth Factor upon Cellular Demand for Accelerated Wound Healing in Vitro and in Vivo.(Am J Pathol 2005,167:1575–1586)中公开了使用Hoechst荧光检测法检测Amgen公司生产的rhKGF-1对4MBr-5的促细胞增殖活性。
现有技术文献:重组人角质细胞生长因子在毕赤酵母中的表达、纯化及活性测定(中国病理生理杂志2012,28(8):1526-1531)中公开了使用MTT法检测由巴斯德毕赤酵母(Pichia pastoris)重组表达的rhKGF-1对4MBr-5细胞的促增殖活性。
以上现有技术均直接反映的是活细胞数目,并不完全等同于细胞的增殖数,由于活细胞包括处于凋亡边缘和没有完全凋亡的细胞,因此,不能直接反映细胞的增殖情况。所以,利用以上方法检测rhKGF-1生物学活性时,检测背景较高、不够灵敏,检测结果也不够直观准确,不能直接真实地反映出rhKGF-1促细胞的增殖活性。
最直接精确的细胞增殖检测方法是检测新合成的DNA,可通过对DNA前体物质——脱氧胸腺嘧啶核苷进行标记,被标记后的脱氧胸腺嘧啶核苷能够掺入到正在复制中处于S期细胞的DNA中,再通过对细胞的固定和染色等处理后可被观察或量化。传统细胞核标记物主要有放射性核素(常为同位素3H掺入法)和免疫化学染色(常为5-溴-2′脱氧尿嘧啶核(BrdU)掺入法),这两种检测方法在研究细胞周期、DNA复制、以及在检测正常或病变细胞和组织细胞的增殖中起了很大作用。
现有技术文献,如CN1169733A中公开了使用3H掺入法检测rhKGF-1对Balb/C MK细胞促增殖活性,由于3H掺入法在常规镜下观察时的分辨率和仪器检测时的信噪比都较低,而使用放射性自显影技术耗时,且该方法具有放射性而不能被广泛的应用到常规实验室中;CN1217022A中公开了使用BrdU法体内检测rhKGF-1促进兔毛囊组织中细胞增殖活性,以及使用BrdU法检测rhKGF-1对成年大鼠肝脏上皮组织的影响,由于BrdU免疫化学染色法需要细胞或组织经过变性处理才能进行检测,由于变性处理会破坏细胞或组织结构,使得检测结果信噪比降低,同时,染色程度过分依赖于不同实验所应用的不同条件,导致实验结果的重复性差。由此可见,理想的细胞核标记物应该是对细胞无毒、操作简单、标记效率高、稳定性好的标记物。
近年来,5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine,EdU)标记法是一种检测细胞增殖的简单、快速、有效的新型示踪染料标记法,该方法通过加入胸腺嘧啶核苷的类似物EdU和结合荧光染色定量分析细胞的增殖。EdU的分子结构特点是脱氧胸腺嘧啶环上与5位C原子相连的甲基被乙炔基取代,在S期细胞增殖时可替代脱氧胸腺嘧啶掺入到正在复制的DNA链中,而乙炔基在Cu2+催化下能够与一种荧光标记的小分子叠氮化合物探针发生反应,快速形成稳定的生物结构体三唑环,该反应被称为“点击(click)”化学作用或Huisgen’s反应,可高效快速检测细胞的增殖活性。同时,由于该反应在生物学中并不常见,反应形成的三唑环结构复杂稳定,使得检测产生的背景较淡、灵敏度较高;EdU分子小、渗透快,使得检测操作更加简便、快捷;且无需对样本进行变性处理,有效保持了双链DNA结构的完整性,且不会破坏细胞的形态学特征以及细胞核抗原的识别位点,克服了BrdU存在的最大缺陷,使检测结果更真实可靠。
尽管EdU标记法已广泛应用于细胞增殖检测中,但细胞类型、细胞密度、细胞活性、细胞增殖速率、细胞培养基(如血清浓度)等因素常影响EdU标记法检测的重复性和重现性。目前尚无文献报道将EdU标记法应用到rhKGF-1生物学活性检测中,但是如何利用EdU标记法真实准确反映出rhKGF-1的促细胞增殖活性是本发明亟需解决的技术难点。
技术实现要素:
鉴于现有技术存在的技术缺陷,本发明提供了一种5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine,EdU)检测重组人角质细胞生长因子生物学活性的方法,即在处于对数生长期细胞的测定培养基中同时加入rhKGF-1和EdU,以保证rhKGF-1在促进细胞增殖时,培养基中的EdU能够随着细胞核DNA的复制不断掺入到新合成的DNA链中,随着新合成细胞逐渐增多,增殖细胞标记率也逐渐增高。当细胞长满皿底时,细胞存在生长接触抑制,增殖细胞标记率则不会再升高。由于EdU标记的细胞是经rhKGF-1作用后增殖的细胞,因此,再通过对标记的细胞进行固化、透化和荧光染色等处理后可观察和量化增殖细胞DNA的总量,从而直接检测细胞的增殖变化,达到测定rhKGF-1促细胞增殖活性的目的。另一方面,本发明还提供了优化的rhKGF-1浓度、细胞密度及rhKGF-1作用于细胞的时间、EdU浓度和血清浓度等条件,以保证增殖细胞的标记率,使得该方法在检测rhKGF-1对细胞的增殖活性时具有良好的重复性和稳定性。该方法具有检测背景低、灵敏度高、重复性好、重现性强等优点,可用于rhKGF-1稳定的质量研究中并建立相应的药物产品质量标准。
本发明提供的一种重组人角质细胞生长因子生物学活性检测方法,包括以下步骤:
1)细胞培养:在含有rhEGF的培养基中将细胞培养至对数生长期;优选在37℃、5%CO2饱和湿度的条件下培养;
2)细胞接种:取步骤1)对数生长期的细胞,经处理过程,接种于细胞培养板中,继续培养;
3)rhKGF-1样品经处理后,做若干个浓度梯度稀释的rhKGF-1供试品溶液,并在各稀释浓度的rhKGF-1供试品溶液中加入5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine,EdU),以制备为含有EdU的不同浓度rhKGF-1的上样样品;
4)对步骤2)所述的细胞板中的细胞进行洗涤,去除培养基;
5)将步骤3)所述的上样样品上样于步骤4)中所述的细胞培养板中,37℃、5%CO2饱和湿度的条件下孵育;
6)将步骤5)所述的细胞进行固化和透化处理后,EdU进行“Click-iT”反应;
7)将步骤6)中经过处理后的细胞放置于多功能酶标仪中读取荧光强度(RFU),通过数据处理计算rhKGF-1生物学活性。
所述步骤1)中细胞选自上皮细胞,优选恒河猴肺部支气管的上皮细胞(4MBr-5);具体培养方法为使用含有终浓度为50ng/ml重组人表皮生长因子(Recombinat human Epidermal Growth Factor,rhEGF)和10%胎牛血清(FBS)的Ham’s F-12完全培养基培养细胞。
所述步骤2)中,所述对数生长期细胞活率≥95%;所述细胞接种于细胞板的密度为5.0×104~1.0×105/ml,所述继续培养是指在37℃、5%CO2条件下培养22~24h。优选所述的细胞培养板在96孔板中进行,细胞接种密度优选1.0×105/ml。
所述细胞经过处理过程包括:细胞消化,细胞收集、离心后重悬,细胞计数和细胞活率测试等步骤。具体地,包括:
(1)吸弃培养基,用胰酶消化细胞,加入含有10%FBS的Ham’s F-12培养基终止消化,并收集细胞;
(2)将上述步骤中收集的细胞,800转离心3min,用含有终浓度为50ng/ml rhEGF和10%FBS的Ham’s F-12完全培养基重悬细胞沉淀,计数。
由于EdU标记细胞过程与细胞密度和细胞活性相关,细胞密度过低或活性低使得细胞进入平台期时细胞分裂增殖慢,EdU标记率低;细胞密度过高,细胞会产生生长接触抑制,不利于细胞增殖生长,从而影响EdU的标记效果;活性高的细胞分裂增殖快,在相同时间内EdU标记率高。本发明选择的是状态优良且处于对数生长期、活率≥95%的细胞进行标记,细胞密度为5.0×104~1.0×105/ml,优选1.0×105/ml,可保证在细胞倍增时EdU可以不断掺入到DNA中,有利于标记结果的准确性和稳定性。
所述步骤3)中,所述的rhKGF-1为冻干重组人角质细胞生长因子或rhKGF-1原液或rhKGF-1对照品,所述的rhKGF-1样品处理采用含有体积比为3~7%FBS的Ham’s F-12测定培养基稀释至终浓度50~100ng/ml,稀释成9~10个浓度梯度,所述的上样样品中含有不同浓度的rhKGF-1,其rhKGF-1上样起始浓度为50~100ng/ml。优选所述的FBS体积比为5%;所述的浓度梯度稀释方法优选为3~4倍系列稀释9~10个浓度梯度,优选所述的浓度梯度稀释是3倍系列稀释,共10个浓度梯度,以保证rhKGF-1生物学活性的检测曲线符合典型的S型曲线,具有良好的信噪比。
由于实验体系中rhKGF-1的浓度会直接影响细胞的增殖活性,而EdU标记细胞的过程又与细胞增殖活性直接相关,增殖活性高的细胞,EdU标记DNA的效率也高。因此,本发明选择rhKGF-1上样起始浓度优选50~100ng/ml,可有效保证细胞的增殖活性,有利于EdU标记结果的稳定性和重现性。
血清是维持细胞生长所必需的,因此,本发明在检测过程中的基础培养基需添加血清可维持4MBr-5细胞的活力,以保持细胞对rhKGF-1增殖作用的反应性。但血清的浓度存在选择,一方面要维持细胞的生长活性,另一方面需要使细胞在rhKGF-1刺激作用下进行增殖,以保证4MBr-5细胞是在rhKGF-1作用下进行增殖。因此,本发明通过大量实验发现,需要选择FBS体积比为3~7%,优选的FBS体积比是5%。与上述浓度的rhKGF-1配合,才能充分体现rhKGF-1的促进细胞增殖特性。
所述的上样样品中所含EdU终浓度为10~20μM,优选10μM。尽管EdU分子量小,对细胞影响较小,但高浓度会影响细胞的代谢及增殖分裂,甚至有可能导致部分细胞死亡,影响检测结果的准确性;EdU浓度低又会影响DNA标记效率,不能真实反映出细胞增殖的过程。因此,本发明提供的EdU浓度为10~20μM,优选10μM,既可以保证EdU对细胞的低毒性,又有利于检测结果的背景较低,信噪比高、灵敏度高,可准确反映出细胞的增殖活性。
所以,步骤2)中细胞密度及步骤3)中各物质的浓度控制对于本方案的实现是至关重要的。
所述步骤4)中,所述的细胞洗涤使用的是Ham’s F-12培养液,200μl/孔洗涤细胞,洗板一次;
所述步骤5)中,所述的加入细胞板中待测样品体积为100μl/孔;所述的培养孵育时间即待测样品与细胞培养板中细胞作用的时间24~72h,优选46~48h。
在细胞培养孵育时间内,应该保证细胞有较好的增殖活力。如果rhKGF-1作用时间过短,会导致细胞增殖的测试体系反应不充分;rhKGF-1作用时间过长,又会影响细胞活力,甚至有可能导致细胞产生凋亡,进而影响细胞的增殖活性,导致EdU标记结果不准确。因此,本发明提供的细胞培养孵育时间为24~72h,优选46~48h,可保证细胞处于对数生长期,且具有较好的活力,EdU检测结果的信噪比高,可真实反映出rhKGF-1促进细胞增殖的活性。
所述步骤6)中细胞固化、透化及EdU的“Click-iT”反应使用EdU检测试剂盒,优选Plus EdU Imaging Kits(life technologies公司)。
所述步骤7)中多功能酶标仪的激发波长为495nm,发射波长为519nm。所述的计算rhKGF-1生物学活性的方法为绘制四参数曲线,计算半数有效浓度(concentration for50%of maximal effect,EC50)值。
本发明相对于现有技术具有如下的优点及有益效果:
1、提供了一种重组人角质细胞生长因子生物学活性检测方法,即在处于对数生长期细胞的测定培养基中同时加入rhKGF-1和EdU,并经过一段时间的孵育培养,以保证rhKGF-1在促进细胞增殖时,EdU能够随着细胞核DNA的复制不断掺入到新合成的DNA链中。由于EdU标记的细胞是经rhKGF-1作用后增殖的细胞,因此,再通过对标记的细胞进行固化、透化和荧光染色等处理后可量化增殖细胞DNA的总量,从而直接检测细胞的增殖变化,达到直观准确测定rhKGF-1促细胞增殖活性的目的。
2、提供了一种重组人角质细胞生长因子生物学活性检测方法,通过优化细胞密度、rhKGF-1浓度及其作用于细胞的时间、EdU浓度、血清浓度等条件,以保证增殖细胞的标记率,使得该方法在检测rhKGF-1对细胞的增殖活性时具有较高信噪比、高灵敏度、重复性好、重现性强等优点;
3、提供了一种重组人角质细胞生长因子生物学活性检测方法,方法专属性强、准确度高,可用于rhKGF稳定的质量研究中并建立相应的药物产品生物学活性检测的质量标准。
附图说明
图1为4MBr-5细胞在不同浓度rhKGF-1作用下的生长曲线图;
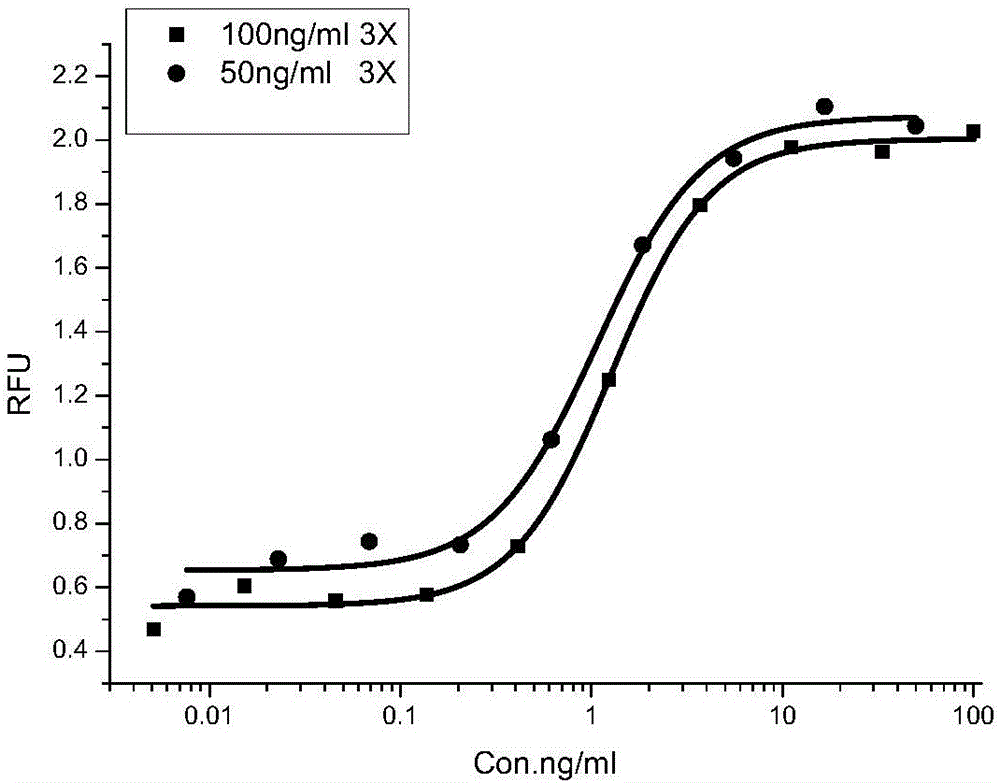
图2为不同浓度rhKGF-1促进4MBr-5细胞增殖的四参数曲线,其中,■表示:rhKGF-1上样起始浓度为100ng/ml及其3倍系列浓度稀释;●表示:rhKGF-1上样起始浓度为50ng/ml及其3倍系列浓度稀释。
图3为浓度为100ng/ml的rhKGF-1对不同接种密度的4MBr-5细胞增殖的四参数曲线,其中,■表示细胞接种密度为1.0×105个/ml,●表示细胞接种密度为5.0×104个/ml;
图4为浓度为100ng/ml的rhKGF-1作用于4MBr-5细胞不同时间时4MBr-5细胞增殖的四参数曲线,其中,■表示:作用时间为1天,●表示:作用时间为2天,表示:作用时间为3天;
图5为验证EdU检测rhKGF-1生物学活性最优条件的重复性时,4MBr-5细胞增殖的四参数曲线;
图6为验证EdU检测rhKGF-1生物学活性最优条件的重现性时,4MBr-5细胞增殖的四参数曲线,其中,■表示:rhKGF-1成品(供试品9),●表示:rhKGF-1原液(供试品10),表示:rhKGF-1原液(供试品11),表示:rhKGF-1对照品;
图7为Edu浓度为5μM,rhKGF-1浓度为500ng/ml,4倍系列浓度稀释,对不同接种密度的4MBr-5细胞增殖的四参数曲线,其中,■表示:细胞接种密度为6.0×104个/ml,●表示:细胞接种密度为1.0×105个/ml;
图8为测定培养基中含有不同浓度血清时,4MBr-5细胞增殖的四参数曲线,其中,■表示:含有2%FBS的测定培养基,●表示:含有5%FBS的测定培养基,表示:含有10%FBS的测定培养基;
图9为采用不同检测方法,rhKGF-1促进4MBr-5细胞增殖的四参数曲线,其中,■表示:MTT比色法检测细胞增殖活性,●表示:CCK-8比色法检测细胞增殖活性,表示:Hoechst荧光染色法检测细胞增殖活性,表示:EdU标记法检测细胞增殖活性。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但发明的实施方式不限于此。
实施例使用的重组人角质细胞生长因子(rhKGF-1)原液和rhKGF-1对照品采用专利文献CN1169733A实施例1-2中所述方法,其中rhKGF-1对照品于-70℃中保存;使用的冻干重组人角质细胞生长因子(rhKGF-1)采用专利文献CN101084008A中所述方法,所得rhkGF-1冻干制剂用注射用水复溶后,得到含1mg/ml的rhKGF-1样品,纯度98.0%。
实施例1.一种重组人角质细胞生长因子的检测方法——rhKGF-1浓度筛选
1)、恒河猴肺部支气管的上皮细胞(4MBr-5,来源于ATCC,细胞编号CCL-208)培养
使用含有终浓度为50ng/ml重组人表皮生长因子(rhEGF,来源于Sigma公司)和10%胎牛血清(FBS,来源于Gibco公司)的Ham’s F-12完全培养基,37℃、5%CO2,饱和湿度的条件下培养4MBr-5细胞。每周传代2-3次。
2)、4MBr-5细胞接种
2.1)取步骤1中对数生长期4MBr-5细胞,吸弃培养基,用胰蛋白酶宕洗,加入0.5ml胰蛋白酶消化细胞,将培养瓶置于显微镜下观察,待细胞全部变圆后,加入含有10%FBS的Ham’s F-12培养基终止消化,并收集细胞;再用含10%FBS的Ham’s F-12培养基洗涤培养瓶,再次收集细胞。
2.2)将上述步骤1)中收集的细胞,800转离心3min,用含有终浓度为50ng/ml rhEGF和10%FBS的Ham’s F-12完全培养基重悬细胞沉淀,计数,细胞活率≥95%;得到4MBr-5细胞悬液,以1×105个/ml的密度接种于96孔细胞培养板,每孔100μl,置于37℃,5%CO2饱和湿度的培养箱中培养22-24小时。
3)、制备上样样品
将rhKGF-1样品用含有5%FBS的Ham’s F-12测定培养基稀释至终浓度为1000ng/ml、100ng/ml、10ng/ml、0.1ng/ml,同时加入终浓度为10μM的EdU溶液(来源于:Plus EdU Imaging Kits,Life Technologies公司)混匀,制备为上样样品。
4)、用Ham’s F-12培养基洗涤步骤2中96孔板中的细胞,200μl/孔,洗板一次,去除培养基;
5)、rhKGF-1上样样品上样及细胞培养共孵育
将步骤3制备的待测样品以100μl/孔加入到步骤4中的细胞中,每个浓度做2-3个复孔,将上样后的96孔细胞培养板置于37℃,5%CO2饱和湿度条件下孵育48h。
6)、细胞固化、透化及“Click-iT”反应
将步骤5中培养共孵育的细胞,使用Plus EdU Imaging Kits检测试剂盒进行固化和透化处理后,并进行EdU的“Click-iT”反应;
7)、检测及分析
将步骤6中经过处理后的细胞放置于多功能酶标仪(型号:VARIDSKAN LUX,Thermo公司)中检测,激发波长为495nm,发射波长为519nm,读取RFU值。以rhKGF-1浓度值为横坐标,对应的RFU值为纵坐标,绘制4MBr-5细胞的生长曲线图。
检测结果如图1所示,当rhKGF-1终浓度为0.1~100ng/ml时,rhKGF-1浓度与RFU值呈线性递增关系,当rhKGF-1终浓度为1000ng/ml时,RFU值反而减少,表明rhKGF-1在终浓度为0.1~100ng/ml时,可以促进4MBr-5细胞增殖,当rhKGF-1浓度>100ng/ml时,促进4MBr-5细胞增殖的作用已减弱,不适于作为检测rhKGF-1生物学活性的上样起始浓度。
实施例2.一种重组人角质细胞生长因子的检测方法——rhKGF-1浓度筛选
1)、恒河猴肺部支气管的上皮细胞(4MBr-5,来源于ATCC,细胞编号CCL-208)培养
使用含有终浓度为50ng/ml重组人表皮生长因子(rhEGF,Sigma公司)和10%胎牛血清(FBS,Gibco公司)的Ham’s F-12完全培养基,37℃、5%CO2饱和湿度的条件下培养4MBr-5细胞。每周传代2-3次。
2)、4MBr-5细胞接种
2.1)取步骤1中对数生长期4MBr-5细胞,吸弃培养基,用胰蛋白酶宕洗后,加入胰蛋白酶消化细胞,将培养瓶置于显微镜下观察,待细胞全部变圆后,加入含有10%FBS的Ham’s F-12培养基终止消化,并收集细胞;再用含10%FBS的Ham’s F-12培养基洗涤培养瓶,再次收集细胞。
2.2)将上述步骤1)中收集的细胞,800转离心3min,用含有终浓度为50ng/ml rhEGF和10%FBS的Ham’s F-12完全培养基重悬细胞沉淀,计数,细胞活率≥95%;得到4MBr-5细胞悬液,以1×105个/ml的密度接种于96孔细胞培养板,每孔100μl,37℃,5%CO2饱湿度条件下培养22-24小时。
3)、制备上样样品
将rhKGF-1样品用含有5%FBS的Ham’s F-12测定培养基稀释至含rhKGF-1终浓度为100ng/ml供试品1和含rhKGF-1终浓度为50ng/ml供试品2,并分别对供试品1和供试品2进行3倍系列浓度稀释,分别做10个和9个稀释度。同时,在供试品1和供试品2及其各自的稀释浓度中加入终浓度为10μM的EdU溶液(来源于:Plus EdU Imaging Kits,Life Technologies公司)混匀,制备为含有不同rhKGF-1浓度的上样样品,其中供试品1和供试品2的rhKGF-1上样起始浓度分别为100ng/ml和50ng/ml。
4)、用Ham’s F-12培养基洗涤步骤2中96孔板中的细胞,200μL/孔,洗板一次,去除培养基;
5)、rhKGF-1上样样品上样及细胞培养共孵育
将步骤3制备的供试品1的上样样品以及各rhKGF-1浓度稀释度的上样样品,和供试品2的上样样品以及各rhKGF-1浓度稀释度的上样样品,以100μl/孔加入到步骤4中的细胞中,每个浓度做2-3个复孔,并设置阴性对照,阴性对照组细胞中只加入含有5%FBS的Ham’s F-12培养基。将上样后的96孔细胞培养板于37℃、5%CO2饱湿度条件下培养共孵育48h。
6)、细胞固化、透化及“Click-iT”反应
将步骤5中培养共孵育的细胞,使用Plus EdU Imaging Kits检测试剂盒进行固化和透化处理后,并进行EdU的“Click-iT”反应;
7)、检测及分析
将步骤6中经过处理后的细胞放置于多功能酶标仪中检测,激发波长为495nm,发射波长为519nm,读取RFU值,绘制四参数曲线图,计算EC50值。
以rhKGF-1浓度值为横坐标,对应的RFU值为纵坐标,通过四参数origin拟合,绘制rhKGF-1供试品与细胞密度的剂量-反应曲线,其中,四参数包括:无限大荧光强度值、斜率、EC50值和无限小荧光强度值。
检测结果如图2所示,以rhKGF-1终浓度为100ng/ml(供试品1)作为上样起始浓度,3倍系列稀释,共10个稀释度时,四参数曲线呈典型的“S”型曲线,上下限之间RFU差异在0.3以上,有利于真实反映出rhKGF-1促细胞增殖活性;以rhKGF-1终浓度为50ng/ml(供试品2)作为上样起始浓度,3倍系列稀释,共9个稀释度时,四参数曲线呈典型的“S”型曲线,但曲线上平台点数相对较少,在检测rhKGF-1供试品时可能会增大检测结果的CV%值。
实施例3.一种重组人角质细胞生长因子的检测方法——细胞密度筛选
1)、采用与实施例2中相同的方法,培养4MBr-5细胞;
2)、采用与实施例2中相同的方法,将步骤1中得到的4MBr-5细胞悬液,以5×104个/ml和1×105个/ml的密度分别接种于96孔细胞培养板,每孔100μl,37℃、5%CO2饱湿度条件下培养22-24小时。
3)、采用与实施例2相同的方法,制备rhKGF-1终浓度为100ng/ml的供试品1,并进行3倍系列浓度稀释,共10个稀释度,并在供试品1及其各稀释浓度中加入终浓度为10μM的EdU溶液混匀,制备为上样样品;
4)、采用与实施例2相同的方法,对步骤2中的细胞进行洗涤,去除培养基;
5)、采用与实施例2相同的方法,将步骤3制备的上样样品,以100μl/孔加入到步骤4中的细胞中,于37℃、5%CO2饱湿度条件下培养共孵育48h;
6)、采用与实施例2相同的方法,细胞固化、透化及“Click-iT”反应;
7)、采用与实施例2相同的方法,进行检测与分析。
检测结果如图3所示,当细胞接种密度为5×104个/ml和1×105个/ml时,四参数曲线均呈现典型的“S”型曲线,但当细胞接种密度为5×104个/ml时,四参数曲线的信噪比相对较低;当细胞接种密度为1×105个/ml时,四参数曲线的信噪比较高,更能真实反映rhKGF-1的促细胞增殖活性。
实施例4.一种重组人角质细胞生长因子的检测方法——rhKGF-1作用于4MBr-5细胞的时间筛选
1)、采用与实施例2中相同的方法,培养4MBr-5细胞;
2)、采用与实施例2中相同的方法,接种4MBr-5细胞;
3)、采用与实施例2相同的方法,制备rhKGF-1终浓度为100ng/ml的供试品1,以及rhKGF-1浓度的3倍系列稀释、10个稀释度的上样样品,所有上样样品中均包含终浓度为10μM的EdU;
4)、采用与实施例2相同的方法,对步骤2中的细胞进行洗涤,去除培养基;
5)、采用与实施例2相同的方法,将步骤3制备的上样样品,以100μl/孔加入到步骤4中的细胞中,于37℃、5%CO2饱湿度条件下培养共孵育24h、48h和72h;
6)、采用与实施例2相同的方法,细胞固化、透化及“Click-iT”反应;
7)、采用与实施例2相同的方法,进行检测与分析。
检测结果如图4所示,上样样品与4MBr-5细胞作用时间为24h、48h和72h时,四参数曲线均呈现典型的“S”型曲线。当作用时间48h时,RFU值与作用时间24h的有明显变化,表明4MBr-5细胞正处于对数生长期;当作用时间72h时,RFU值与作用时间48h相比出现下降趋势,表明4MBr-5细胞已过对数生长期,开始出现凋亡现象。
实施例5.一种重组人角质细胞生长因子生物学活性检测方法的重复性
选取同一批次的rhKGF-1样品(标示为:对照品),按照本发明实施例2中供试品1的制备方法制备为供试品,进行3倍系列浓度稀释,做10个稀释度。同时,在供试品及其各自的稀释浓度中加入终浓度为10μM的EdU溶液混匀后,制备为上样样品,进行3次重复性实验,检测结果见表1和图5,EC50平均值为(1.423±0.126)ng/ml,变异系数CV%为8.86,<30%,在常规要求范围内。以上结果表明,本发明的检测方法具有良好的重复性。
表3:重复性结果统计表
实施例6.一种重组人角质细胞生长因子生物学活性检测方法的重现性
按照本发明实施例2的方法,选取3个不同批次的rhKGF-1样品(分别标示为:供试品9、供试品10和供试品11),以对照品为标准品,按照实施例2中供试品1的制备方法制备为不同的供试品,分别进行3倍系列浓度稀释,做10个稀释度。同时,在各供试品及其各自的稀释浓度中加入终浓度为10μM的EdU溶液混匀后,测定rhKGF样品的相对生物学活性,以对照品的EC50值2.21ng/ml,按以下计算公式计算待测样品的相对生物学活性:待测样品的生物学活性(%)=标准品EC50(ng/ml)÷待测品的EC50(ng/ml)×100%结果见表2和图6,其中rhKGF-1冻干制剂(供试品9)相对活性为78.4%,rhKGF-1原液(供试品10)相对活性为100.5%;rhKGF-1原液(供试品11)相对活性为83.8%。以上结果表明,本发明检测方法的重现性高。
表2 重现性结果统计
对比实施例1.一种重组人角质细胞生长因子生物学活性检测方法——不同EdU浓度
1)、采用与实施例2中相同的方法,培养4MBr-5细胞;
2)、采用与实施例2中相同的方法,将步骤1中得到的4MBr-5细胞悬液,以6×104个/ml和1×105个/ml的密度分别接种于96孔细胞培养板,每孔100μl,37℃,5%CO2条件下培养22-24小时。
3)、采用与实施例2相同的方法,将rhKGF-1样品用含有5%FBS的Ham’s F-12测定培养基稀释至终浓度为500ng/ml,制备为供试品3,并对供试品3进行4倍系列浓度稀释,共8稀释度,在供试品3及其各浓度稀释度样品中加入终浓度为5μM的EdU溶液混匀,制备为上样样品;
4)、采用与实施例2相同的方法,对步骤2中的细胞进行洗涤;
5)、采用与实施例2相同的方法,将步骤3制备的上样样品,以100μl/孔加入到步骤4中的细胞中,于37℃、5%CO2饱湿度条件下培养共孵育48h;
6)、采用与实施例2相同的方法,细胞固化、透化及“Click-iT”反应;
7)、采用与实施例2相同的方法,进行检测与分析。
检测结果如图7所示,当上样样品中EdU终浓度为5μM,四参数曲线呈现的非典型完整的“S”型曲线,曲线缺少下平台。当上样样品中EdU终浓度为20μM时,与EdU终浓度为10μM时的检测效果一致,rhKGF-1生物学活性的四参数曲线的信噪比较高、检测背景低,但是会增加检测成本。
对比实施例2.一种重组人角质细胞生长因子生物学活性检测方法——不同血清浓度
1)、采用与实施例2中相同的方法,培养4MBr-5细胞;
2)、采用与实施例2中相同的方法,接种4MBr-5细胞;
3)、将rhKGF-1样品分别用含有2%和10%FBS的Ham’s F-12测定培养基稀释至含rhKGF-1终浓度为100ng/ml供试品4和含rhKGF-1浓度为100ng/ml供试品5,并对供试品4和供试品5分别进行3倍系列浓度稀释,共10个稀释度。同时,在供试品4以及各rhKGF-1浓度稀释度,和供试品5以及各rhKGF-1浓度稀释度中加入终浓度为10μM的EdU溶液混匀后,制备为上样样品。
4)、采用与实施例2相同的方法,对步骤2中的细胞进行洗涤;
5)、采用与实施例2相同的方法,将实施例2制备的供试品1的上样样品以及各rhKGF-1浓度稀释度的上样样品,步骤3制备的供试品4的上样样品以及各rhKGF-1浓度稀释度的上样样品,和供试品5以及各rhKGF-1浓度稀释度的上样样品,以100μl/孔加入到步骤4中的细胞中,于37℃、5%CO2饱湿度条件下培养共孵育48h;
6)、采用与实施例2相同的方法,细胞固化、透化及“Click-iT”反应;
7)、采用与实施例2相同的方法,进行检测与分析。
检测结果如图8和表1所示,当FBS体积比为5%时,EdU标记法可准确检测4MBr-5对rhKGF-1促增殖作用的反应性;当FBS体积比为2%时,由于4MBr-5对于rhKGF-1促增殖作用的反应性降低,使得EdU标记法检测rhKGF-1促细胞增殖活性的四参数曲线未出现上平台,使曲线不完整,以至于降低了检测的信噪比;当FBS体积比为10%时,由于4MBr-5细胞产生了自增殖效应,使检测本底升高,降低了检测的信噪比。但是当FBS体积比为3%和7%时,可以达到与5%FBS相同的检测效果,即能保证EdU标记法检测rhKGF-1促细胞增殖活性的四参数曲线是典型的S型曲线,具有较低的检测背景和较高的信噪比。
表1:测定培养基中不同血清浓度对rhKGF-1促4MBr-5细胞增殖活性的影响
对比实施例3.MTT法检测重组人角质细胞生长因子生物学活性的方法
1)、采用与实施例2中相同的方法,培养4MBr-5细胞;
2)、采用与实施例2中相同的方法,将步骤1中得到的4MBr-5细胞悬液,以1.5×105个/ml的密度分别接种于96孔细胞培养板,每孔100μl,37℃、5%CO2饱湿度条件下培养22-24小时。
3)、采用与实施例2相同的方法,将rhKGF-1样品用含有5%FBS的Ham’s F-12测定培养基稀释至终浓度为500ng/ml供试品6,并对供试品6进行4倍系列浓度稀释,共8个稀释度,制备为各rhKGF-1浓度稀释度上样样品。
4)、采用与实施例2相同的方法,对步骤2中的细胞进行洗涤,共洗涤两次,吸尽残留液体;
5)、采用与实施例2相同的方法,将步骤3制备的供试品6的上样样品以及各rhKGF-1浓度稀释度的上样样品,以150μl/孔加入到步骤4中的细胞中,于37℃、5%CO2饱湿度条件下培养72h;
6)、加入MTT:
培养结束后,观察步骤5所培养的细胞,若细胞形态正常,无污染,吸弃96孔细胞培养板中的培养液,每孔加入100μl Ham’s F-12培养基和20μl MTT溶液(Sigma),37℃、5%CO2饱湿度条件下培养4h。
7)、检测及结果分析:
取步骤6中的96孔板,弃上清,每孔加入细胞裂解液(DMSO溶液)150μl,充分震荡,溶解后于多功能酶标仪上读取OD值,测定波长570nm,参比波长630nm,记录测定结果,以样品浓度(ng/ml)为X轴,以其570nm处的OD值为Y轴,拟合四参数曲线。
检测结果如图9所示,使用MTT法检测rhKGF-1生物学活性时,四参数曲线的信噪比低,检测背景高,检测结果不灵敏。
对比实施例4.CCK-8法检测重组人角质细胞生长因子生物活性的方法
1)、采用与实施例2中相同的方法,培养4MBr-5细胞;
2)、采用与实施例2中相同的方法,将步骤1中得到的4MBr-5细胞悬液,以1.5×105个/ml的密度分别接种于96孔细胞培养板,每孔100μl,37℃、5%CO2饱湿度条件下培养22-24小时。
3)、采用与实施例2相同的方法,将rhKGF-1样品用含有5%FBS的Ham’s F-12测定培养基稀释至终浓度为500ng/ml供试品7,并对供试品7进行4倍系列浓度稀释,共8个稀释度,制备为各rhKGF-1浓度稀释度的上样样品;
4)、采用与实施例2相同的方法,对步骤2中的细胞进行洗涤,共洗涤两次,吸尽残留液体;
5)、采用与实施例2相同的方法,将步骤3制备的供试品7以及各rhKGF-1浓度稀释度的上样样品,以150μl/孔加入到步骤4中的细胞中,于37℃、5%CO2饱湿度条件下培养72h;
6)、加入CCK-8
培养结束后,观察步骤5所培养的细胞,若细胞形态正常,无污染,每孔加入20μl CCK-8工作液(Dojindo公司),37℃,5%CO2反应4h。
7)、检测及结果分析
步骤6反应完毕后,将96孔细胞培养板在酶标仪450nm处测定吸光度,以样品浓度(ng/ml)为X轴,以其450nm吸光度为Y轴,拟合四参数曲线
检测结果如图9所示,使用CCK-8法检测rhKGF-1生物学活性时,四参数曲线的信噪比低,检测背景高,检测结果不灵敏。
对比实施例5.Hoechst法检测重组人角质细胞生长因子生物活性的方法
1)、采用与实施例2中相同的方法,培养4MBr-5细胞;
2)、采用与实施例2中相同的方法,将步骤1中得到的4MBr-5细胞悬液,以1.5×105个/ml的密度分别接种于96孔细胞培养板,每孔100μl,37℃、5%CO2饱湿度条件下培养22-24小时。
3)、采用与实施例2相同的方法,将rhKGF-1样品用含有5%FBS的Ham’s F-12测定培养基稀释至终浓度为500ng/ml供试品8,并对供试品8进行4倍系列浓度稀释,共8个稀释度,制备为各rhKGF-1浓度稀释度的上样样品;
4)、采用与实施例2相同的方法,对步骤2中的细胞进行洗涤,共洗涤两次,吸尽残留液体;
5)、采用与实施例2相同的方法,将步骤3制备的供试品8以及各rhKGF-1浓度梯度稀释的上样样品,以150μl/孔加入到步骤4中的细胞中,于37℃、5%CO2饱湿度条件下培养72h;
6)、加入Hoechst荧光染色液:
弃去步骤5中96孔细胞培养板中的上清液,每孔加入150μl 4%多聚甲醛进行固定,室温静置20min;200μl/孔/次用PBS缓冲液洗板,共洗板3次;弃去PBS缓冲液,加入100μl,1μM Hoechst33258染色液(Sigma公司),室温避光保存至少30min;200μl/孔/次用PBS缓冲液洗板,共洗板2次。
7)、检测及结果分析:
将步骤6中经Hoechst染色的96孔细胞培养板置于酶标仪中检测,激发波长为350nm,发射波长为461nm,读取RFU值,绘制四参数曲线图,其中,样品浓度(ng/ml)为X轴,以RFU为Y轴。
检测结果如图9所示,使用Hoechst荧光染色法检测rhKGF-1生物学活性时,参数曲线与EdU标记法检测相比,四参数曲线信噪比低,使用荧光染色法检测背景高,检测结果不灵敏。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种重组人角质细胞生长因子-2突变体的活性稳定剂的制作方法
- 一种含有角质细胞生长因子kgf2的植物油体的制作方法
- 人角质细胞生长因子1在制备治疗糖尿病足部及腿部溃疡的药物中的应用的制作方法
- 一种人角质细胞生长因子-1结构类似物及其制备方法和应用的制作方法
- 角质形成细胞生长因子-2(kgf-2或成纤维细胞生长因子-12
- 人角质细胞生长因子1在制备治疗肛裂的药物中的应用的制作方法
- 一种含有重组人角质细胞生长因子-2滴眼液及其制备方法
- 抗重组人角质细胞生长因子-2抗体的应用的制作方法
- 一种热稳定人角质细胞生长因子突变体的制备方法及其应用的制作方法
- 一种含有重组人角质细胞生长因子-2滴眼液及其在干眼症治疗中的应用的制作方法
- UCP1在人重组FGF21蛋白活性检测中的应用的制造方法与工艺
- UCP3在人重组FGF21蛋白活性检测中的应用的制造方法与工艺
- 原核表达载体及rbFGF‑2表达方法与工程菌和应用与流程
- 一种利用鱼卵母细胞提取物诱导成纤维细胞重编程为成骨细胞样细胞的试剂盒及方法与流程
- 控制影响角化细胞和/或成纤维细胞和真皮的皮肤失调和皮肤老化的组合产品和美容组合物的制造方法与工艺
- 在CHO细胞中rhIL‑12表达系统的构建方法与制造工艺
- 人皮肤成纤维细胞诱导为神经细胞的方法与应用与制造工艺
- 一种制备人皮肤成纤维细胞膜片的细胞培养基和使用方法与制造工艺
- 检测人FGFR3基因突变的引物组及其试剂盒的制造方法与工艺
- 一种氧调控性碱性成纤维细胞生长因子修饰细胞的方法与制造工艺