一种快速检测单核细胞增生李斯特氏菌的方法与流程
本发明属于食品中抗生素残留快速检测技术领域,特别是一种以还原氧化石墨烯/纳米金复合物作为非酶标记的免疫传感器用于快速检测单核细胞增生李斯特氏菌的方法。
背景技术:
单核细胞增生李斯特氏菌(Listeria monocytogenes,L.monocytogenes)作为一种人类食源性致病菌,普遍存在于家禽、肉类和乳制品中。人类受感染后可导致胃肠炎、败血症、脑膜炎、流产,对孕妇、婴儿、老年人及免疫力低下者更容易发生。在感染者中有导致25%-30%致死率。所以,食品中对L.monocytogenes的快速检测极为重要。
近年来电化学免疫传感器(Electrochemical Immunosensor)作为一种具有良好选择性、高灵敏度、简单和低成本等优势备受关注,其中非酶标记电化学免疫传感器(Non-enzymatic Electrochemical Immunosensors)与传统的酶标记电化学免疫传感器(Enzymatic Electrochemical Immunosensors)相比,前者不仅能够保证高度敏感性且响应迅速的优点,同时克服了传统酶标记电化学免疫传感器种由于酶本身受温度、pH值等的影响,在一些特殊的化学环境中,酶易丧失活性而使免疫传感器不稳定的缺点。所以,越来越多的研究趋向于模拟酶标记免疫传感器中酶的信号催化放大作用,同时提高灵敏度和稳定性。以单金属纳米材料(如纳米金,纳米银)、多金属结合(如Pt-Pb)和氧化石墨烯等材料作为非酶标记产生信号,达到检测目的。
技术实现要素:
为了克服现有技术中的上述缺陷,本发明提供了一种快速检测单核细胞增生李斯特氏菌的方法。
一种快速检测单核细胞增生李斯特氏菌的方法,其特征在于,包括以下步骤:
(1)制备Fe3O4/SiO2–NH2纳米微球:FeCl3溶解于蒸馏水中,加入FeSO4,最后加入NH3·6H2O,在无氧条件下磁力搅拌60min,得到Fe3O4磁性纳米材料;在反应容器中加入无水乙醇、蒸馏水、TEOS和NH3·6H2O,搅拌均匀后加入Fe3O4磁性纳米材料,25℃下搅拌24h,得Fe3O4/SiO2磁性纳米材料;在反应容器中加入无水乙醇、APTES和Fe3O4/SiO2磁性纳米材料;25℃下搅拌24h,得到Fe3O4/SiO2–NH2纳米微球;
(2)制备Ab/SiO2/Fe3O4:Fe3O4/SiO2–NH2纳米微球加入2.5%的戊二醛,25℃避光磁力搅拌3h,氨基活化后加入Anti-L.Monocytogenes(Ab),25℃下搅拌2h后用BSA封闭非特异性结合位点,得Ab/SiO2/Fe3O4(IMNPS);
(3)制备rGO/AuNPs/Ab:氧化石墨烯溶于蒸馏水中,加入HAuCl4,加热至煮沸,迅速加入柠檬酸钠反应,得rGO/AuNP纳米材料;往rGO/AuNPs纳米材料中加入Anti-L.monocytogenes(Ab),在4℃下孵育12h,用BSA封闭非特异性结合位点,得rGO/AuNPs/Ab纳米材料;
(4)双抗夹心法制备免疫传感器:在待测样品溶液中加入步骤(2)所得Ab/SiO2/Fe3O4(IMNPS),混合均匀后25℃下孵育40min,PBS洗,得到IMNPS免疫吸附L.monocytogenes的复合物,再加入步骤(3)所得rGO/AuNPs/Ab,混合均匀后25℃下孵育40min,PBS洗涤,得到rGO/AuNPs/Ab/L.monocytogenes/IMNPS;取rGO/AuNPs/Ab/L.monocytogenes/IMNPS滴加到丝网印刷电极工作电极表面,同时在工作电极背面放置磁铁,保证rGO/AuNPs/Ab/L.monocytogenes/IMNPS复合物牢固的吸附在工作电极表面,制备获得免疫传感器;
(5)DPV检测:在工作电极表面滴加100μL0.2M HCl测试底液,进行DPV检测,其中工作电极为免疫传感器电极,对电极为碳电极,参比电极为Ag/AgCl电极,用DPV进行表征并定性判断免疫电极;DPV检测方法的设置:氧化电位1.25V,氧化时间120s,DPV电位扫描范围为1.0V-0.0V;获得峰电流值y;
(6)结果判断:将峰电流值y代入公式:y=0.02933x-0.01996,计算出L.Monocytogenes菌浓度x值。
由于纳米金(AuNPs)可以通过简单的化学方法快速合成,粒径均匀,比表面积高,导电性好,方便标记生物分子,从而使纳米金作为信号放大材料广泛应用于电化学免疫传感器。石墨烯具有良好的导热性和高导电性,同时由于其二维平面的碳纳米结构可作为固定金属纳米材料的基板,从而使单位面积内金属纳米材料的量增加,进一步使金属纳米材料的催化放大作用增大。在本发明中,以柠檬酸钠作为还原剂一步还原氧化石墨烯和氯金酸,得到还原氧化石墨烯/纳米金(rGO/AuNPs)纳米材料复合物,采用差分脉冲伏安法(Differential Pulse Voltammetry,DPV)以rGO/AuNPs中AuNPs作为信号放大材料,原理如下:AuNPs在HCl底液中,以恒定电压氧化为AuCl-4,在DPV条件下AuCl-4被还原成Au0,此过程产生了响应信号,得到还原峰峰电流。在rGO/AuNPs的基础上为进一步增加电信号,提高灵敏度,利用免疫磁性纳米微球高比表面积、磁导向性、易从复杂样品中富集分离目标物等优点,用于构建电化学免疫传感器。本发明以非酶标抗体结合免疫磁性纳米微球,构建了稳定性强、应用范围广、达到快速检测单核细胞增生李斯特氏菌的电化学免疫传感器。
本发明的检测方法以还原氧化石墨烯为基板固定的AuNPs作为电化学标记,以免疫磁性纳米微球(Immunomagnetic nanoparticles,IMNPS)为捕获探针,用来富集待检样品中的目标物。以修饰Anti-L.monocytogenes抗体的还原氧化石墨烯/纳米金(rGO/AuNPs)作为非酶标记物与富集L.monocytogenes的IMNPS形成夹心结构。在外加磁场的作用下将夹心结构复合物吸附在丝网印刷碳电极(Screen Printed Carbon Electrode,SPCE)表面,用差分脉冲伏安法(Differential Pulse Voltammetry,DPV)进行分析。DPV响应信号在103CFU/mL-109CFU/mL有良好的线性关系,线性回归方程为y=0.02933x-0.01996,R2=0.99367,检出限为1.8×104CFU·mL-1(S/N=3),即在检测中3μL的检测样品中54CFU的L.monocytogenes即可被检出。本发明所制备的电化学免疫传感器,成本低,操作简便,在实际应用中具有良好的前景。
附图说明
图1是IMNPS的凝集表征示意图。
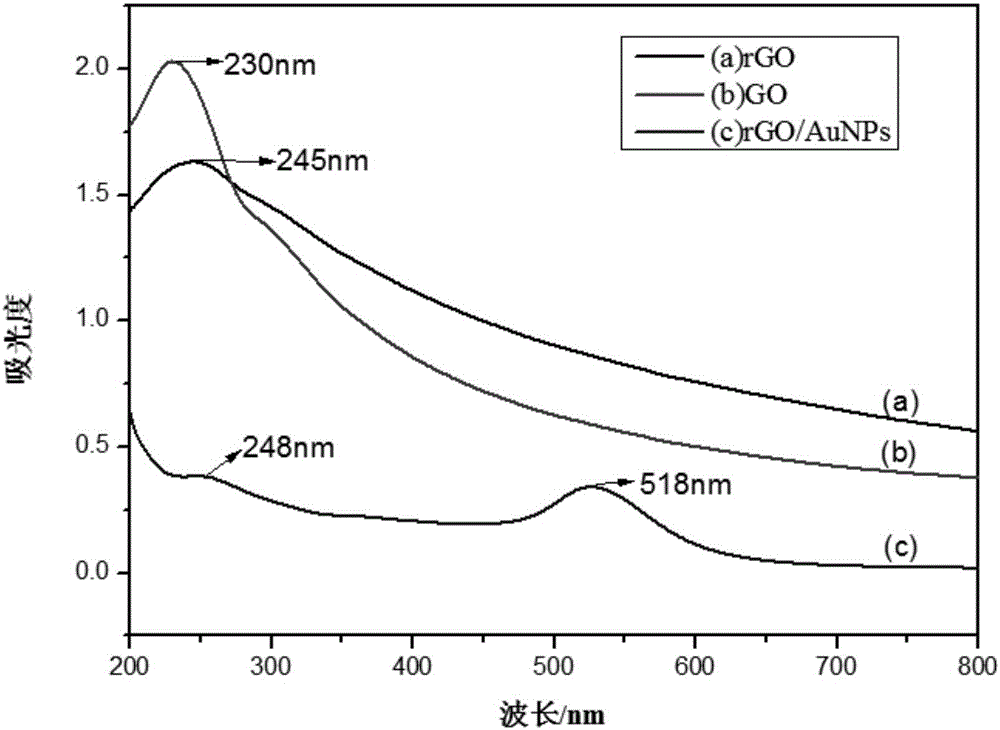
图2是GO,rGO和rGO/AuNPs的紫外可见光谱图。
图3是在免疫电极上不同修饰阶段的DPV曲线图。(A:裸电极,B:修饰L.monocytogenes/IMNPS,C:修饰rGO/AuNPs/Ab/L.monocytogenes/IMNPS。测试底液为除氧的0.2M HCl)。
图4是IMNPS与L.monocytogenes在不同孵育时间对应的还原峰电流值的曲线关系图。
图5是rGO/AuNPs/Ab与L.monocytogenes/IMNPS在不同孵育时间对应的还原峰电流值的曲线关系图。
图6是免疫电极还原峰电流值与L.monocytogenes浓度对数值的对应关系图。
图7是免疫电极还原峰电流值与L.monocytogenes浓度对数值的标准曲线图。
图8是免疫电极的特异性示意图。
具体实施方式
实施例1
一、Fe3O4/SiO2–NH2纳米微球的制备
采用共沉淀方法制备Fe3O4磁性纳米材料。合成方法如下:2.70mM FeCl3溶解于70mL蒸馏水中,然后加入1.35mM FeSO4,最后加入NH3·6H2O在无氧条件同时保证80℃下磁力搅拌60min。使用乙醇和蒸馏水分别洗涤3次,洗涤完成后定容至60mL。即成功制备60mLFe3O4磁性纳米材料。
在反应容器中加入60mL无水乙醇、10mL蒸馏水、1mL TEOS和9mL NH3·6H2O,搅拌均匀后加入1mL上述制备Fe3O4磁性纳米材料,25℃下搅拌24h,洗涤多次定容至1mL即可得到Fe3O4/SiO2磁性纳米材料。在反应容器中加入40mL无水乙醇、160μL APTES,和1mL Fe3O4/SiO2磁性纳米材料25℃下搅拌24h,使用乙醇和PBS分别洗涤3次,定容直1mL,即可得到Fe3O4/SiO2–NH2磁性纳米材料。
二、Ab/SiO2/Fe3O4的制备
取250μL Fe3O4/SiO2–NH2磁性纳米材料加入2.5%的戊二醛,室温下(25℃)避光磁力搅拌3h,氨基活化后PBS洗3次,且重悬于PBS。加入50μL Anti-L.Monocytogenes(Ab),25℃下搅拌2h,PBS清洗3次。然后取1mL的0.2%BSA,室温下搅拌1.5h进行非特异性结合位点封闭,清洗3次后重悬于4mL PBS,即得IMNPS(Ab/SiO2/Fe3O4),4℃下储藏备用。
为验证SiO2/Fe3O4是否分别与Anti-L.monocytogenes修饰成功,进行凝集实验验证。过程如下:分别取10μL IMNPS加入左右凝集玻片中,左侧加入10μL PBS,右侧加入目的菌L.monocytogenes(108CFU·mL-1),快速搅拌20s,观察凝集现象,现象如图1所示。由凝集结果可知:与PBS空白对照相比,右侧出现明显凝集斑块,溶液变澄清,Anti-L.monocytogenes成功修饰到SiO2/Fe3O4上。
三、rGO/AuNPs/Ab的制备
采用一步法合成rGO/AuNPs纳米材料。取4mg氧化石墨烯溶于100mL蒸馏水中,超声分散处理3h。取HAuCl4(2.5mM)加入混合液中,加热至煮沸,迅速加入柠檬酸钠反应一定时间。离心洗涤至上清液无色,重悬于PBS中,4℃下储藏备用,即得到rGO/AuNP纳米材料。采用紫外分光光度计分别测定GO,rGO和rGO/AuNPs,从而表征rGO/AuNPs复合物的合成。结果如图2所示,在200-800nm的吸收波长范围内,GO由于C=C的π-π*的跃迁在230nm处有明显吸收峰(曲线b);GO还原得到rGO,rGO的吸收峰红移至245nm,恢复至π-π共轭结构(曲线a)。在制备rGO/AuNPs复合物后,复合物在248nm和518nm处有吸收峰,248nm为rGO的吸收峰,518nm为明显AuNPs的吸收特征峰(曲线c)。说明AuNPs成功结合到rGO表面,形成rGO/AuNPs复合物。
取4mL rGO/AuNPs纳米材料加入40μL Anti-L.monocytogenes(Ab),在4℃下孵育12h,然后离心3次,加入4mL的0.2%BSA在4℃条件下孵育1h进行非特异性结合位点封闭,离心洗涤3次,重悬于2mL PBS中,4℃下储藏备用,即得到rGO/AuNPs/Ab纳米材料。
四、电化学免疫传感器的制备及检测原理
采用双抗夹心法制备免疫传感器:利用免疫磁球可以从复杂的样品中捕获目标物从而达到富集目的,在1mL样品溶液加入40μL IMNPS,混合均匀后25℃下孵育40min,PBS洗涤3次。得到IMNPS免疫吸附L.monocytogenes的复合物,再加入40μL rGO/AuNPs/Ab,混合均匀后25℃下孵育40min,PBS洗涤3次,重悬于40μL PBS中,即得到rGO/AuNPs/Ab/L.monocytogenes/IMNPS。取3μL rGO/AuNPs/Ab/L.monocytogenes/IMNPS滴加到丝网印刷电极工作电极表面,同时在工作电极背面放置磁铁,保证rGO/AuNPs/Ab/L.monocytogenes/IMNPS复合物牢固的吸附在工作电极表面,即成功采用双抗夹心法制备免疫传感器。在电极表面滴加100μL 0.2M HCl测试底液,进行DPV检测。
检测方法及原理:采用CHI 660C电化学工作站对于SPCE中工作电极表面(其中工作电极为免疫电极,对电极为碳电极,参比电极为Ag/AgCl电极),用DPV进行表征并定性判断免疫电极。
DPV检测方法的设置:氧化电位1.25V,氧化时间120s,DPV电位扫描范围为1.0V-0.0V,检测原理:在氧化电位下,工作电极表面的rGO/AuNPs/Ab/L.monocytogenes/IMNPS中Au在除氧测试底液0.2M HCl中,氧化为Au3+。在DPV电化学方法作用下Au3+被还原为Au,产生电子传递的过程,实现检测目的。
免疫传感器以rGO/AuNPs/Ab/L.monocytogenes/IMNPS在SPCE的工作电极上发生氧化还原反应,从而产生对应的电流信号。原理上产生信号的原因滴加在工作电极表面的复合物中的AuNPs产生的,为了排除背景和复合物中其他纳米材料的影响,进行电极表面不同修饰的DPV表征,在最优条件下进行,分别滴加100μL 0.2M HCl在A:裸电极、B:修饰L.monocytogenes/IMNPS、C:修饰rGO/AuNPs/Ab/L.monocytogenes/IMNPS。结果如图3所示。
在修饰条件C下,0.34V处出现明显还原峰;在条件A和条件B下,0.34V处都无还原峰,证明本发明中制备的免疫传感器中响应信号来源于非酶标记物AuNPs,而且不受其他修饰过程中的材料和测试底液的影响。
实施例2
1、IMNPS和单核细胞增生李斯特氏菌孵育时间的优化
IMNPS和L.monocytogenes在适宜的孵育时间内,抗体修饰的磁性纳米材料与目的菌特异性结合的更加牢固。如图4所示:随着IMNPS与L.monocytogenes孵育时间的变化,免疫电极的还原峰的峰电流值也有相对应的变化。随着在孵育时间在10min到40min内增加时还原峰的峰电流值逐渐增大,其中在孵育时间为30min时,与孵育时间为20min时的峰电流值有较小的降低,可能是在抗体与目的菌特异性结合的过程中,在孵育时间在20min以后,磁球表面未特异性结合的抗体位置减少,在抗原与抗体结合的过程中,抗原竞争磁球表面抗体位置,是峰电流值稍微减小,但随着孵育时间的继续增加,抗原与抗体结合增加,在40min时峰电流值最大,随后又逐渐减小。所以选择孵育40min为IMNPS和L.monocytogenes的孵育时间。
2、rGO/AuNPs/Ab2与IMNPS/L孵育时间的优化
同上,rGO/AuNPs复合物标记的抗体在适宜的孵育时间内,可与IMNPS富集的L.monocytogenes最大限度的特异性结合,从而得到较大响应信号。由图5所示:孵育时间在40min条件下峰电流值最大,所以选择孵育40min为rGO/AuNPs/Ab与L.monocytogenes/IMNPS孵育时间。
3、免疫传感器对不同浓度梯度的单核细胞增生李斯特氏菌的响应信号曲线
在最优条件下采用DPV的检测方法免疫电极对不同浓度梯度的单核细胞增生李斯特氏菌检测得到对应的峰电流值,如图6所示,随着菌浓度的增加,抗原与IMNPS上修饰得抗体特异性结合增加,从而与rGO/AuNPs/Ab特异性结合形成夹心结构的量增加,其对应的还原峰峰电流值也逐渐增大。同时,由图7可得,在菌浓度为103CFU/mL-109CFU/mL是峰电流值与菌浓度的对数值成良好的线性关系,线性关系为y=0.02933x-0.01996,R2=0.99367,检出限为1.8×104CFU·mL-1(S/N=3),即在检测中3μL的检测样品中54CFU L.monocytogenes即可被检出。
4、特异性试验
在免疫传感器的研究中其特异性决定了在实际应用中的抗干扰性,在本发明中选择S.aureus,B.subtilis,C.freundii,S.sonnei为干扰菌,以PBS为空白对照,进行特异性检测,结果如图8所示。以峰电流值大小作为判定标准,目的菌L.monocytogenes的Ipc=0.221μA,PBS空白对照Ipc=0.042μA,S.aureus的Ipc=0.062μA,B.subtilis的Ipc=0.024μA,C.freundii的Ipc=0.058μA,S.sonnei的Ipc=0.04μA,L.monocytogenes的峰电流值明显大于PBS空白对照以及其他四种菌,证明该免疫传感器具有特异性。
实施例3样品检测
为验证本发明中制备的免疫传感器的准确性,以牛奶为实际样品检测对象,根据本发明方法进行检测,根据标准曲线得到回收率,从而判断其准确性。在牛奶中加入2.9×107CFU/mL浓度的L.monocytogenes,按照上述发明方法测得回收率为78%。有回收率结果显示本发明中的设计方法可以较好的检测出脱脂牛奶中的L.monocytogenes,是一种有较好优势的免疫传感器。
表1实际样品检测
为了进一步验证该免疫传感器的实用性,采用盲测法;具体过程如下:对每个实际样品进行编号,分两组进行检测,其中A组采用制备的免疫传感器检测实际样品,B组采用国标(GB4789.30-2010)进行检测,编号者不参加A、B两组检测,且禁止相互交流。实验结果如表2所示,制备的免疫传感器具有93%(n=30)的准确率,说明具有良好的准确性和实际应用价值。
表2免疫电极准确性验证结果
本发明以柠檬酸钠作为还原剂一步还原GO与HAuCl4制备rGO/AuNPs,在rGO/AuNPs修饰抗体作为以AuNPs信号指示物的非酶标抗体,特异性结合L.monocytogenes,避免了酶标电化学传感器中酶易失活等不稳定因素对免疫传感器稳定性的影响。同时使用IMNPS富集分离L.monocytogenes,使免疫传感器的制备更加方便,而且灵敏度也得到提高。在检测中IMNPS/L.monocytogenes/rGO/AuNPs滴加在具有磁场作用下的SPCE进行,避免了电极表面繁琐的修饰过程,更加快速方便。
在优化条件下进行检测,本发明制备的免疫传感器有明显的信号放大作用和较好的准确性;检测L.monocytogenes的线性范围为103CFU/mL-109CFU/mL,检出限为1.8×104CFU·mL-1(S/N=3),即在检测中3μL的检测样品中54CFU L.monocytogenes即可被检出。同时通过特异性检测可知本发明中制备的传感器在检测非目的菌电流峰值明显低于目的菌。所以本发明中制备的快速检测L.monocytogenes的免疫传感器具有较好的准确性、灵敏度和重现性。可以用于微生物的快速筛选,临床诊断和食品安全等方面。
- 还没有人留言评论。精彩留言会获得点赞!
- 食品中李斯特氏菌属微生物检测试剂盒及检测方法
- 一种高特异高敏感检测单核细胞增生李斯特氏菌的方法
- 一种用于检测单核细胞增生李斯特氏菌的核苷酸序列及检测方法与检测试剂盒的制作方法
- 一种用于检测单核细胞增生李斯特氏菌核苷酸片段的引物和探针序列的制作方法
- 活体单核细胞增生李斯特氏菌rt-pcr检测试剂盒及检测方法
- 单核细胞增生李斯特氏菌核酸标准样品、其建立方法及应用的制作方法
- 一种检测单核细胞增生李斯特氏菌的方法和试剂盒的制作方法
- 用于检测李斯特氏菌的寡核苷酸及其应用的制作方法
- 单核细胞增生李斯特氏菌的链置换恒温扩增(sda)快速检测试剂盒及其检测方法
- 一种用于检测单增李斯特氏菌的F<sub>0</sub>F<sub>1</sub>-ATPase旋转分子马达传感器试剂盒的制作方法