一种云南重楼或其多芽品系中多种甾体皂苷的UPLC检测方法与流程
本发明涉及中药材质量检测领域,具体涉及对云南重楼或其多芽品系中多种甾体皂苷的UPLC检测方法。
背景技术:
《中华人民共和国药典》2015年版一部收载重楼品种为百合科植物云南重楼Paris polyphylla Smith var.yunnanensis(Franch.)Hand.-Mazz.或七叶一枝花Paris polyphylla Smith var.chinensis(Franch.)Hara的干燥根茎,具有清热解毒、消肿止痛、凉肝定惊的功效。现代研究表明,重楼具有抗肿瘤、止血、免疫调节、镇静、镇痛等作用,甾体皂苷成分为发挥作用的主要活性成分。近年来,因重楼市场需求巨大、野生资源濒危及人工繁育技术要求高、栽培周期长等多因素导致重楼价格飙升,从十年前的50元/kg上涨到700~900元/kg。目前重楼人工种植市场上,尚无优质、稳定的种源供给,已成为制约云南白药、宫血宁等著名中成药可持续发展的瓶颈,人工种植重楼日益受到制药企业和种植企业等的高度关注。
云南重楼多芽品系,是近几年新发现的一类具有典型的云南重楼植物学特征的新品系,如花瓣上部常扩大为宽2~5mm的狭匙形,药隔凸出部分明显等[1],但与云南重楼相比其根茎具有众多的丛生芽,每个芽可作为栽培材料,因此,可以快速繁殖和显著增产。高产量和高繁育率的云南重楼多芽品系越来越受重视,但其质量评价却鲜有研究报道。
本发明希望以UPLC-ELSD法检测出云南重楼(多芽品系)中的多个化学成分,为评价和比较云南省不同栽培地区的云南重楼及多芽品系质量打下基础。
技术实现要素:
本发明目的在于首次提供一种对云南重楼多芽品系的质量检测方法。
具体地,本发明提供了一种云南重楼或其多芽品系中多种甾体皂苷的UPLC检测方法,它包括如下操作步骤:
(1)取干燥的待检样品,粉碎,以醇类溶剂或含水醇类溶剂提取,合并提取液,除去溶剂后所剩残渣用甲醇、含水甲醇、乙腈或含水乙腈复溶,制备供试品溶液;
(2)取重楼皂苷Ⅰ、Ⅱ、Ⅴ、Ⅵ、Ⅶ、H、纤细薯蓣皂苷中的任意四种或四种以上的甾体皂苷混合物,制备对照品溶液;
(3)将供试品溶液、对照品溶液分别注入超高效液相色谱仪中,采用外标法检测即可;其中,色谱条件如下:
色谱柱:十八烷基硅烷键合硅胶为填料
ELSD检测器条件:漂移管温度55±2℃,氮气压力40±2psi,增益500,冷却模式;
流动相:乙腈(A)-水(B)系统,其梯度程序如下:
0~1min(5%或10%)~25%A;1~2.5min,25%~30%A;2.5~4min,30%~35%A;4~6min,35%~40%A;6~(8min或9min),40%~(42%或45%)A;(8或9min)~21min,(42%或45%)~50%A;(21~22~23min,50%~70%~90%A)或者(21~23min,50%A~90%A);
流动相流速0.2mL·min-1;柱温40±2℃。
其中,步骤(1)中,醇类溶剂选自甲醇、乙醇或丙醇,含水醇类溶剂选自含水甲醇、含水乙醇或含水丙醇。
进一步地,步骤(1)中醇类溶剂选自甲醇或乙醇,含水醇类溶剂选自含水甲醇或含水乙醇。本发明一个具体实施方式中,选用甲醇作为提取溶剂。
其中,复溶这一步中所用的溶剂可以选自甲醇、含水甲醇、乙腈或含水乙腈。本发明一个具体实施方式中使用甲醇作为溶剂。但是,流动相对待检目标成分同样应具有良好的溶解性能,因此,在实际使用过程中,同样可以使用流动相溶剂——乙腈或含水乙腈进行复溶。
其中,提取方式选自超声、浸渍、渗漉或回流。本发明一个具体实施方式中,选用超声作为提取方式。当然,本发明无论选择何种提取方式,都是以尽量不影响待测样品中目标成分的检测准确度为前提,在实际操作过程中,可以通过本发明相同的检测方法来对提取方式进行筛查,其筛查实验即为普通的验证实验,无需付出创造性劳动。
本发明一个具体实施方式中,步骤(1)中,采用减压蒸发的方式除去溶剂。其中,“减压蒸发”的使用,也是基于尽量不影响待测样品中目标成分的检测准确度为目的,当然,除了这种方法,还可以使用其他的溶剂去除手段,如自然蒸发、低温加热蒸发等。即,除去溶剂的方式为本领域常规的操作手段,可根据实际情况进行选择,不应限于“减压蒸发”。
2015年版《中国药典》中,以重楼皂苷Ⅰ、重楼皂苷Ⅱ、重楼皂苷Ⅵ和重楼皂苷Ⅶ的质量分数作为评价重楼质量指标,然而,本发明通过对大量不同产地的云南重楼(主要是多芽品系)研究发现,云南各地区的云南重楼及多芽品系中普遍具有重楼皂苷Ⅶ、重楼皂苷H、重楼皂苷II及重楼皂苷I这4个甾体皂苷,而药典中记载的重楼皂苷VI仅在四份样品中检测到,因此,本发明中建议用重楼皂苷H替代重楼皂苷VI或增加重楼皂苷H来评价重楼类药材的质量。
基于上述分析,进一步地,步骤(2)中,所述任意四种或四种以上的甾体皂 苷混合物中,至少含有重楼皂苷I、II、Ⅶ和H。
进一步地,本发明还可以取重楼皂苷Ⅰ、Ⅱ、Ⅴ、Ⅵ、Ⅶ、H、纤细薯蓣皂苷中任意5~7种的混合物,制备对照品溶液进行检测,当然,其中至少应含有上述重楼皂苷I、II、Ⅶ和H这4种皂苷。
进一步地,步骤(2)中,对照品溶液的溶剂选自甲醇、含水甲醇、乙腈或含水乙腈。
其中,步骤(3)中,所述色谱柱填料的粒径为1.7~3.5μm,为1.7~1.8μm,更优选为1.8μm。
其中,所述色谱柱尺寸为:2.1×(50mm~100mm);优选地,所述色谱柱尺寸为:2.1×50mm;进一步优选地,所述色谱柱的型号为:CQUITY BEH C18色谱柱,2.1mm×50mm,1.7μm。
其中,流动相:乙腈(A)-水(B)系统,其梯度程序如下之一:
梯度程序一:0~1min 10%~25%A;1~2.5min,25%~30%A;2.5~4min,30%~35%A;4~6min,35%~40%A;6~8min,40%A~42%A;8~21min,42%A~50%A;21~23min,50%A~90%A;
梯度程序二:0~1min 5%~25%A;1~2.5min,25%~30%A;2.5~4min,30%~35%A;4~6min,35%~40%A;6~9min,40%A~45%A;9~21min,45%A~50%A;21~22min,50%A~70%A;22~23min,70%A~90%A;
梯度程序三:0~1min 10%~25%A;1~2.5min,25%~30%A;2.5~4min,30%~35%A;4~6min,35%~40%A;6~8min,40%A~45%A;8~21min,45%A~50%A;21~23min,50%A~90%A。
实验表明,上述三种梯度程序能够有效将重楼中的多个化合物有效分离,从而达到进一步检测各成分的目的。而在其他色谱条件下,部分化合物不能在色谱图中有效分离,因此本发明优选上述三种梯度程序。
另外,本发明研究发现,在本发明UPLC色谱条件下,可以对云南重楼及其多芽品系中的10余种成分在色谱图中有效分离,且各色谱峰分离度良好,这也有利于对云南重楼及其多芽品系的质量研究与控制,在此基础上,可以使用指纹图谱技术建立云南重楼及其多芽品系的质量检测标准。基于上述实验结果,本发明还提供一种云南重楼或其多芽品系的UPLC检测方法,它包括如下操作步骤:
(1)取干燥的待检样品,粉碎,以醇类溶剂或含水醇类溶剂提取,合并提取液,除去溶剂后所剩残渣用甲醇、含水甲醇、乙腈或含水乙腈复溶,制备供试品溶液;
(2)将供试品溶液注入超高效液相色谱仪中,采用指纹图谱技术检测即可;其中,色谱条件如下:
色谱柱:十八烷基硅烷键合硅胶为填料
ELSD检测器条件:漂移管温度55±2℃,氮气压力40±2psi,增益500,冷却模式;
流动相:乙腈(A)-水(B)系统,其梯度程序如下:
0~1min(5%或10%)~25%A;1~2.5min,25%~30%A;2.5~4min,30%~35%A;4~6min,35%~40%A;6~(8min或9min),40%~(42%或45%)A;(8或9min)~21min,(42%或45%)~50%A;(21~22~23min,50%~70%~90%A)或者(21~23min,50%A~90%A);
流动相流速0.2mL·min-1;柱温40±2℃。
其余优选条件同上。
本发明检测方法,能够在23min内对云南重楼及其多芽品系中的10余种成分有效分离,这对指纹图谱的研究提供了良好的检测基础。同时,本发明还对其中的7种甾体皂苷成分进行了分析,此方法极大地缩短了重楼类药材分离分析的时间,方法的精密度、稳定性、重复性和加样回收试验等均表明所建方法稳定可靠。
附图说明
图1混合对照品(A)和样品(B)色谱图;5.重楼皂苷Ⅶ;6.重楼皂苷H;7.重楼皂苷Ⅱ;8.重楼皂苷Ⅰ;9.重楼皂苷Ⅵ;10.纤细薯蓣皂苷;11.重楼皂苷Ⅴ
图2不同产地样品指纹图谱
图3对照指纹图谱
图4实施例2色谱图
图5实施例3色谱图
图6对比例1色谱图
图7对比例2色谱图
具体实施方式
除非本文中另外定义,否则结合本发明使用的科技术语应具有一般技术者通常理解的含义。术语的含义及范畴应为明确的;然而,若存在任何潜在含糊性,则本文所提供的定义优先于任何词典或外来定义。
实施例1
1仪器和材料
Waters Acquity H-Class超高效液相色谱仪(美国Waters公司);KQ-5200E型超声波清洗器(40kHz、250W,昆山超声仪器有限公司);BP211D型电子天平(德国Sartorius公司);METTLER AE240电子分析天平(上海梅特勒- 托利多仪器有限公司)。乙腈为色谱纯(美国Sigma公司);水为屈臣氏蒸馏水;甲醇为分析纯(成都市科龙化工试剂厂)。
重楼皂苷Ⅰ(批号:MUST-15061611,Purity:98.34%)、Ⅱ(批号:MUST-15060801,Purity:98.45%)、Ⅵ(批号:MUST-14071904,Purity:98.67%)、Ⅶ(批号:MUST-14060302,Purity:99.03%)、纤细薯蓣皂苷(批号:MUST-15081110,Purity:98.86%)均购自成都曼思特生物科技有限公司;重楼皂苷H和重楼皂苷V为四川大学华西药学院生药学教研室自制,结构鉴定为重楼皂苷H和重楼皂苷V,HPLC检测纯度均≧98.00%。
试验样品于2015年7月至2015年8月自采于云南省不同地区,见表1,所有样品均经四川大学华西药学院张浩教授、西南民族大学民族医药研究院刘圆教授鉴定为百合科植物云南重楼Paris polyphylla Smith var.yunnanensis(Franch.)Hand.-Mazz.。
表1样品来源
2方法与结果
2.1色谱条件 ACQUITY BEH C18色谱柱(2.1mm×50mm,1.7μm);ELSD检测器漂移管温度55℃,氮气压力40psi,增益500,冷却模式;柱温40℃;流速0.2mL·min-1;进样量:3μL;流动相为乙腈(A)-水(B),梯度洗脱程序为:0~1min 10%~25%A;1~2.5min,25%~30%A;2.5~4min,30%~35%A;4~6min,35%~40%A;6~8min,40%A~42%A;8~21min,42%A~50%A;21~23min,50%A~90%A。对照品和样品色谱图见图1。
2.2对照品溶液的制备 分别精密称取各重楼皂苷对照品,用色谱甲醇溶解,混合对照品溶液中7种对照品浓度分别为1.051(VII)、1.026(H)、1.024(VI)、1.006(II)、1.009(纤细薯蓣皂苷)、1.129(I)、0.311(V)mg·mL-1,经0.22μm微孔滤膜过滤,备用。
2.3供试品溶液的制备 将干燥的重楼药材粉碎,过40目筛,取药材粉末0.500g,精密称定,置100mL锥形瓶中,按料液比1:100(g:mL)加入甲醇,摇匀,静置4h后,超声30min,过滤,取滤液,重复上述操作2次。合并滤液,真空旋转蒸干,残渣用色谱甲醇复溶,定容于25mL容量瓶,0.22μm微孔滤膜过滤,备用。
2.4方法学考察
2.4.1精密度试验 取同一供试品溶液,连续进样6次,记录各共有峰的相对保留时间和相对峰面积。结果各共有峰相对保留时间RSD<2%,各共有峰相对峰面积RSD<3%,表明仪器精密度良好。
2.4.2重复性试验取同一批样品共5份,按“2.2”项下平行制备5份供试品溶液,按“2.1”项下色谱条件进行测定,记录各共有峰的相对保留时间和相对峰面 积。结果各共有峰相对保留时间的RSD<2%,各共有峰相对峰面积的RSD<3%,表明方法重复性良好。
2.4.3稳定性试验 取同一供试品溶液,按“2.1”项下色谱条件,分别于0、2、4、8、12、24h进样测定,记录各共有峰的相对保留时间和相对峰面积。结果各共有峰相对保留时间RSD<2%,各共有峰相对峰面积RSD<3%,表明该供试品溶液在24h内稳定。
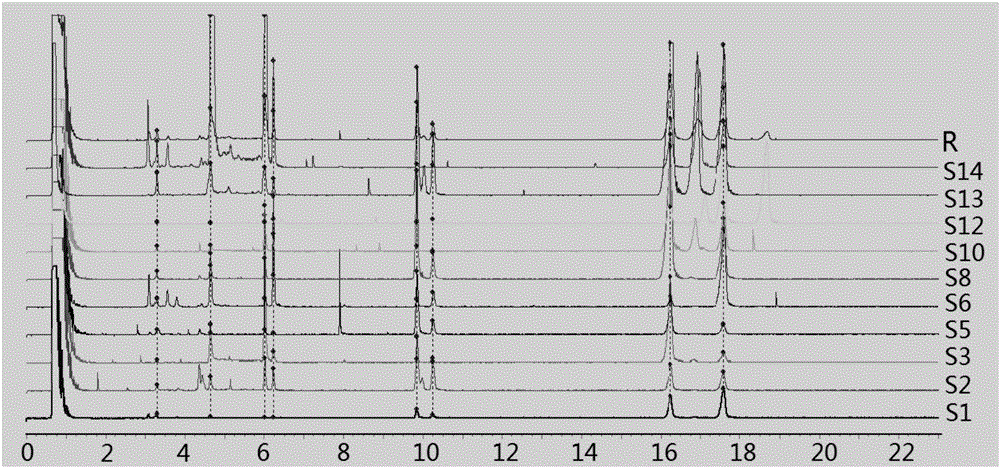
2.5高黎贡山地区云南重楼(多芽品系)指纹图谱的建立 取高黎贡山地区云南重楼(多芽品系)供试品溶液,按“2.1”项下色谱条件进样,进行UPLC分析,选取共有峰峰面积相对较大的10批样品,得到高黎贡山地区云南重楼(多芽品系)指纹图谱,采用《2012年版中药色谱指纹图谱相似度评价系统》分析,得到8个共有峰,见图2;采用中位数法,时间窗宽度为0.50,经过多点矫正生成对照指纹图谱(R),见图3,其中1~8号峰为共有特征峰。计算样品间及指纹图谱与对照指纹图谱的相似度,结果见表2。由结果可知,相似度计算结果小于0.9,表明样品间差异较大。将混合对照品色谱峰与样品色谱峰比较,指定样品指纹图谱中5~8号峰分别为重楼皂苷Ⅶ、重楼皂苷H、重楼皂苷Ⅱ、重楼皂苷Ⅰ。
表2不同产地样品相似度
2.6 7种皂苷成分含量测定
2.6.1线性关系考察 精密吸取混合对照品溶液适量均稀释到2mL,制成不同稀释倍数的混合对照品溶液,按“2.1”项下色谱条件测定。以峰面积为纵坐标(Y), 进样量(μg)为横坐标(X),绘制标准曲线,结果见表3。
表3对照品的线性回归方程
2.6.2加样回收试验 取同一批已知含量的重楼药材样品5份,分别加精密称量加入重楼皂苷H和重楼皂苷Ⅰ对照品,按“2.2”项下步骤操作制样,25mL容量瓶定容,测定,计算回收率。两种重楼皂苷平均加样回收率分别为:重楼皂苷H为96.83%,RSD为0.65%;重楼皂苷Ⅰ为95.91%,RSD为0.76%。
2.6.3样品测定 精密吸取“2.2”项下制得供试品溶液,按“2.1”项下色谱条件测定,结果见表4。
表4 23份样品中7个甾体皂苷含量(%)
注:“—”表示无
3讨论
云南是云南重楼的道地产区,云南重楼几乎分布于云南各地,其多芽品系主要分布于丽江、大理、腾冲等滇西地区,本试验采集了23份云南各地区的云南重楼药材,对其药效成分进行了含量测定。因甾体皂苷结构近似,极性较大,不易分离,且无紫外吸收或只有紫外末端波长吸收,因此,不宜采用紫外检测器检测。
本试验采用超高效液相色谱结合蒸发光散射检测器(UPLC-ELSD)检测技术建立了高黎贡山地区云南重楼(多芽品系)指纹图谱和对不同地区云南重楼药材中7个甾体皂苷进行了分析。试验结果表明,在23min内可将甾体皂苷完全分离分析,此方法极大地缩短了重楼类药材分离分析的时间,方法的精密度、稳定性、重复性和加样回收试验等均表明所建方法稳定可靠。使用蒸发光散射检测器避免了紫外末端吸收波长造成的基线漂移等不稳定因素,提高了检测的灵敏度。
2015年版《中国药典》以重楼皂苷Ⅰ、重楼皂苷Ⅱ、重楼皂苷Ⅵ和重楼皂苷Ⅶ的质量分数作为评价重楼质量指标,以其总量≧0.6%为合格[2]。本实验检测的23份样品中19份符合药典要求,4个皂苷平均含量达1.42%,RSD高达62.7%,说明不同样品间四个皂苷含量差别较大;云南重楼和其多芽品系以药典项下4个皂苷或7个皂苷比较,二者不论化合物种类还是含量均无规律性变化。本发明研 究发现,云南重楼和其多芽品系各样品之间几种甾体皂苷无显著差异,这说明二者间可能只存在生物学性状上的差异。
高黎贡山地区的多芽品系从指纹图谱分析结果显示该地区的多芽品系的化学成分和含量有明显差异,这可能由以下原因所致:不同的采集点,农户对重楼的肥水等管理方式不一;高黎贡山地区广泛分布各重楼品种,重楼植物种间可能进行了杂交;环境对云南重楼化学累积有显著影响,样品采集点的气温、海拔等气候特征有差异;该地区供试的14份多芽品系样品均合格,药典项下4个皂苷平均含量为1.660%,高于其他地区的0.64%;7个皂苷平均含量为1.93%,高于其他地区的0.87%;该地区的多芽品系丛生芽较多,进行光合作用的地上植株较多,能积累更多的次生代谢产物。以上说明该地区的云南重楼(多芽品系)是一个值得推广栽培和深入研究的品种。
云南各地区的云南重楼及多芽品系中普遍具有重楼皂苷Ⅶ、重楼皂苷H、重楼皂苷II及重楼皂苷I这4个甾体皂苷,重楼皂苷VI仅在四份样品中检测到,而2015年版《中国药典》以重楼皂苷Ⅰ、重楼皂苷Ⅱ、重楼皂苷Ⅵ和重楼皂苷Ⅶ的质量分数作为评价重楼质量指标,因此,建议用重楼皂苷H替代重楼皂苷VI或增加重楼皂苷H来评价重楼类药材的质量。
实施例2
(1)取干燥的待检云南重楼多芽品系,粉碎,以甲醇溶剂提取,合并提取液,除去溶剂后所剩残渣用甲醇复溶,制备供试品溶液;
(2)取重楼皂苷Ⅰ、Ⅱ、Ⅴ、Ⅵ、Ⅶ、H、纤细薯蓣皂苷的混合物,制备对照品溶液;
(3)将供试品溶液、对照品溶液分别注入超高效液相色谱仪中,采用外标法检测即可;其中,色谱条件如下:
色谱柱:CQUITY BEH C18色谱柱,2.1mm×50mm,1.7μm;
ELSD检测器条件:漂移管温度55℃,氮气压力40psi,增益500,冷却模式;
流动相:乙腈(A)-水(B)系统,其梯度程序如下:
0~1min 5%~25%A;1~2.5min,25%~30%A;2.5~4min,30%~35%A;4~6min,35%~40%A;6~9min,40%A~45%A;9~21min,45%A~50%A;21~22min,50%A~70%A;22~23min,70%A~90%A。
流动相流速0.2mL·min-1;柱温40℃;进样量:3μL。
该实施例检测所得对照品图谱见图4。
实施例3
(1)取干燥的待检云南重楼多芽品系,粉碎,以甲醇溶剂提取,合并提取液,除去溶剂后所剩残渣用甲醇复溶,制备供试品溶液;
(2)取重楼皂苷Ⅰ、Ⅱ、Ⅴ、Ⅵ、Ⅶ、H、纤细薯蓣皂苷的混合物,制备对照品溶液;
(3)将供试品溶液、对照品溶液分别注入超高效液相色谱仪中,采用外标法检测即可;其中,色谱条件如下:
色谱柱:CQUITY BEH C18色谱柱,2.1mm×50mm,1.7μm;
ELSD检测器条件:漂移管温度55℃,氮气压力40psi,增益500,冷却模式;
流动相:乙腈(A)-水(B)系统,其梯度程序如下:
0~1min 10%~25%A;1~2.5min,25%~30%A;2.5~4min,30%~35%A;4~6min,35%~40%A;6~8min,40%A~45%A;8~21min,45%A~50%A;21~23min,50%A~90%A。流动相流速0.2mL·min-1;柱温40℃;进样量:3μL。
该实施例检测所得对照品图谱见图5。
另外,对于本发明色谱条件,发明人还希望在此强调,并非随意选择流动相、蒸发光检测器条件都能够达到本发明相同或相似的检测效果,例如:
对比例1:
色谱条件:ACQUITY BEH C18色谱柱(2.1mm×50mm,1.7μm);ELSD检测器漂移管温度55℃,氮气压力40psi,增益500,冷却模式;柱温40℃;流速0.2mL·min-1;进样量:3μL;流动相为乙腈(A)-水(B),梯度洗脱程序为:0~2.5min 5%~25%A;2.5~3.5min,25%~30%A;3.5~4.5min,30%~34%A;4.5~10.5min,34%~40%A;10.5~13.5min,40%A~45%A;13.5~18.5min,45%A~58%A;18.5~20min,58%A~90%A。
标准品色谱图见图6。
对比例2:
色谱条件:ACQUITY BEH C18色谱柱(2.1mm×50mm,1.7μm);ELSD检测器漂移管温度55℃,氮气压力40psi,增益500,冷却模式;柱温40℃;流速0.2mL·min-1;进样量:2μL;流动相为乙腈(A)-水(B),梯度洗脱程序为:0~2.5min 5%~25%A;2.5~3.5min 25%~30%A;3.5~4.5min 30%~34%A;4.5~9.5min 34%~40%A;9.5~14.5min 40%~45%A;14.5~20min 45%~58%A;20~22min 58%~90%A。
标准品色谱图见图7。
本发明检测的对照品色谱图中,前三个甾体皂苷及后四个甾体皂苷因它们化合物极性极其相似,较难完全分离、分析。本发明中合格的检测条件,必须是以重楼中分离鉴别的7个甾体皂苷完全分离为基础的,而对比例1-2的色谱图中,部分标准品没有完全分离,这就导致无法同时对每一个化合物进行检测,并且保 留时间较长,对试剂和能源都是一种极大的浪费。
除了上述对比例外,在进行色谱条件摸索前,发明人还使用了韩燕全等[3]的色谱条件,但是,分离效果不佳,最终放弃了现有技术中的色谱条件。
参考文献
[1]李恒.重楼属植物[M].北京:科学技术出版社,1998:118.
[2]国家药典委员会.中国药典.2015年版.一部[M.北京:中国医药科技出版社,2015:260.
[3]韩燕全,等.UPLC-ELSD法同时测定重楼中重留皂苷I、II、VI、VII.中草药,2012年43卷2期:305-307。
- 还没有人留言评论。精彩留言会获得点赞!