一种用于铁离子和铜离子检测单独或同时的纳米传感方法及应用与流程
本发明涉及离子诊断技术领域,具体涉及一种金纳米簇复合物以及传感器的制备,用于铁离子和铜离子检测应用,更具体的说就是利用金纳米簇的过氧化物酶性质与双氧水和3,3',5,5'-四甲基联苯胺反应,构建离子检测传感器,之后通过铁离子和铜离子对GSH-AuNCs--TMB--H2O2体系的颜色改变以及不同螯合剂的引入实现了对铁离子和铜离子的可视化定量检测。
背景技术:
金属纳米材料由于其特殊的物理与化学性质,目前已经被广泛应用于各个领域,如分子检测、生物成像、基因标记、药物控释等。金属纳米簇作为一种新型的荧光纳米材料近年来引起了学者的广泛研究兴趣。高荧光强度,高稳定性的金属纳米簇作为荧光探针被密集的报道,用于检测很多种类的目标物。
贵金属纳米团簇的催化性能是一个很有前途的应用。例如,金最初被认为是具有催化惰性的,但纳米级别的金目前已经被证明在一个广泛的化学反应中具有良好的催化活性。研究表明,颗粒大小为2nm左右的金纳米簇,具有很强的内在过氧化物酶活性,因其超微小的体积、低毒等优点在分子成像、生物传感、医药以及催化领域有着潜在的应用价值。
铜是人体必需的微量元素之一,其在中枢神经系统中具有重要作用。内分泌疾病、神经疾病、骨肌肉疾病、消化系统疾病等会使血清中Cu2+含量升高,而鬈发综合征、肾病综合征、wilson综合征等会使血清中Cu2+含量降低。溶血性贫血、铅中毒、急性肝细胞损害等会使血清中Fe3+含量升高,而消化性溃疡、肾炎、尿毒症等会使血清中Fe3+含量降低。因此血清中Fe3+和Cu2+含量对人体健康起着至关重要的作用。有关血清中铁离子和铜离子测定的报道常用原子吸收光谱法、伏安法、电感耦合等离子体质谱法等等,这些方法虽灵敏可靠,但仪器昂贵或操作繁琐,使用不方便。因此通过简单、快速、灵敏的方法实现对生物体中以及环境中铁铜离子的含量的测定变得越来越重要。
本发明中通过以谷胱甘肽(GSH)作为还原剂制备的金纳米簇具有良好的过氧化物酶活性,GSH-AuNCs可以在H2O2存在的条件下催化氧化3,3',5,5'-四甲基联苯胺(TMB),而产生氧化态的ox-TMB(蓝绿色),并且在652nm处出现明显的吸收峰,在对离子的检测中,对Fe3+和Cu2+具有很好的选择性,通过螯合剂乙二胺四乙酸二钠(EDTA)和氟化铵(NH4F)的引入,实现了对Fe3+或Cu2+的可视化以及定量检测。
技术实现要素:
本发明的技术方案如下:
一种用于铁离子或铜离子单独或同时检测的纳米传感方法,说明如下:
1)空白实验:向金纳米簇水溶液和TMB溶液中加入双氧水溶液,充分反应后,观察溶液的颜色以及测其紫外吸光度值。
2)单独检测:向金纳米簇水溶液、TMB溶液和双氧水溶液体系中加入Fe3+或者Cu2+,待充分反应后,通过颜色变化以及紫外吸光度值的变化,实现对两种离子的分别检测;
3)同时检测:向金纳米簇水溶液、TMB溶液和双氧水溶液体系中或者同时加入Fe3+和Cu2+,通过螯合剂NH4F和EDTA分别对Fe3+和Cu2+进行掩蔽,待反应完成后,通过颜色变化以及紫外吸光度值的变化,实现对两种离子的同时检测。
用于Fe3+或Cu2+检测的纳米传感方法空白实验具体如下:
本发明的一种用于Fe3+或Cu2+检测的纳米传感方法空白实验具体如下:
在100-200μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入摩尔质量比为1:10~100的双氧水溶液和TMB溶液,反应完成后,观察颜色变化,并且用紫外分光光度计检测溶液在652nm处的紫外吸光度值,以此时溶液的颜色以及652nm处的吸光度值作为空白基准(A0)。
本发明的一种用于Fe3+或Cu2+单独检测的纳米传感方法具体如下:
在100-200μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入不同浓度的Fe3+或者Cu2+,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应30分钟,之后再加入摩尔质量比为1:10~100的双氧水溶液和TMB溶液,待反应完成后,观察颜色变化,并且用紫外分光光度计检测其溶液在652nm处的紫外吸光度值(A),与空白实验组中溶液在652nm处的吸光度值进行差值计算,并建立ΔA(A-A0)值与离子浓度的相对应关联公式。
本发明的一种用于Fe3+和Cu2+同时检测的纳米传感方法具体如下:
(1)在100-200μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入Fe3+和Cu2+,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,用紫外分光光度计检测溶液在652nm处的紫外吸光度值(A1),之后加入NH4F溶液,充分反应,再加入摩尔质量比为1:10~100的双氧水溶液和TMB溶液,待反应完成后,观察颜色变化,检测溶液在652nm处的紫外吸光度值(A2),并建立ΔA(A1-A2)值与离子浓度的相对应关联公式,实现对Fe3+的选择性检测。
(2)在100-200μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入Fe3+和Cu2+,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后加NH4F溶液,检测溶液在652nm处的紫外吸光度值(A3),反应完成后,实现对Fe3+的掩蔽,之后加入EDTA溶液以及摩尔质量比为1:10~100的双氧水溶液和TMB溶液,待充分反应后,观察颜色变化,检测溶液在652nm处的紫外吸光度值(A4),并建立ΔA(A4–A3)值与离子浓度的相对应关联公式,实现对Cu2+的选择性检测。
本发明的一种用于人血清中Fe3+或Cu2+同时检测的纳米传感方法具体如下:
(1)在100-200μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入未经处理的人血清,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,用紫外分光光度计检测溶液在652nm处的紫外吸光度值(A1),之后加入NH4F溶液,反应完成后,再加入摩尔质量比为1:10~100的双氧水溶液和TMB溶液,待反应完成后,观察颜色变化,检测溶液在652nm处的紫外吸光度值(A2),根据ΔA(A1-A2)值与离子浓度的相对应关联公式,计算出血清中Fe3+的浓度。
(2)在100-200μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入经处理后的人血清,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后加NH4F溶液,检测溶液在652nm处的紫外吸光度值(A3),反应完成后,实现对铁离子的掩蔽,充分反应,加入EDTA溶液,之后再加入摩尔质量比为1:10~100的双氧水溶液和TMB溶液,待充分反应后,观察颜色变化,检测溶液在652nm处的紫外吸光度值(A4),根据ΔA(A4–A3)值与离子浓度的相对应关联公式,计算出血清中Cu2+的浓度。
具体说明如下:
以谷胱甘肽(GSH)为还原剂制备的金纳米簇(AuNCs)具有过氧化物酶的特性,在双氧水存在的条件下可以催化氧化TMB变成氧化态(ox-TMB),并且溶液变为蓝绿色,ox-TMB在652nm处会出现明显的吸收峰。在向AuNCs溶液中加入Cu2+后,其过氧化物酶活性减弱,不能使TMB氧化,溶液颜色不会变为蓝绿色并且在652nm处没有明显的吸收峰。在向AuNCs溶液中加入Fe3+后,Fe3+自身的氧化性质使得TMB变成氧化态(ox-TMB),溶液变为蓝绿色,在652nm处出现明显的吸收峰。
检测结果
(1)定性检测:AuNCs在双氧水存在的条件可以催化TMB变成氧化态(ox-TMB),并且溶液变为蓝绿色,在Cu2+单独存在的情况下,体系的颜色随着Cu2+浓度的增大逐渐变浅;当Fe3+单独存在的情况下,体系的颜色随着Fe3+浓度的增大逐渐变深。当溶液中同时存在Fe3+以及铜离子时,加入NH4F溶液,溶液颜色变浅;而掩蔽Fe3+后,加入EDTA溶液,溶液的颜色加深。
(2)定量检测:根据溶液在652nm处的吸光度值
根据ΔA值与不同离子浓度的相对应关联公式,计算出血清中Fe3+和Cu2+的浓度。
本发明制备的一种用于铁离子和铜离子检测单独或同时的纳米传感方法及应用优势在于:
1、采用金纳米簇这种具有优异的光学性质、高荧光强度、高稳定性以及具有良好的催化活性的,已经被广泛应用于子检测、生物成像、基因标记、生物传感、医药以及催化领域的纳米材料作为检测载体,将纳米技术应用到离子检测领域。
2、采用TMB作为显色底物,通过其颜色的变化实现了对铜离子或铁离子的可视化检测,通过紫外吸光度值的改变实现了定量检测,其简单迅速、价格低廉。
3、采用螯合剂NH4F和EDTA实现了对铜离子或铁离子的同时检测,并成功应用于人血清中铜离子和铁离子的检测。
附图说明
图1为本发明实施例1的一种用于Fe3+或Cu2+检测的纳米传感方法空白实验,即GSH-AuNCs–TMB–H2O2体系的颜色变化以及紫外吸收光谱图;其中,图1中a曲线为GSH-AuNCs–TMB–H2O2体系的紫外吸收谱图,b曲线为TMB与H2O2反应的紫外光谱图,c曲线为GSH-AuNCs与TMB反应的紫外光谱图,d曲线为向GSH-AuNCs–TMB–H2O2体系中加入Cu2+后的紫外光谱图,e曲线为向GSH-AuNCs–TMB–H2O2体系中加入Fe3+后的紫外光谱图。
图2为本发明实施例4制备的用于Fe3+或Cu2+检测的纳米传感方法对Fe3+离子的检测;其中,a为向GSH-AuNCs–TMB–H2O2体系中加入不同浓度Fe3+后溶液颜色的变化,b为向GSH-AuNCs–TMB–H2O2体系中加入不同浓度Fe3+后溶液的紫外吸收光谱图,c为Fe3+检测标准曲线。
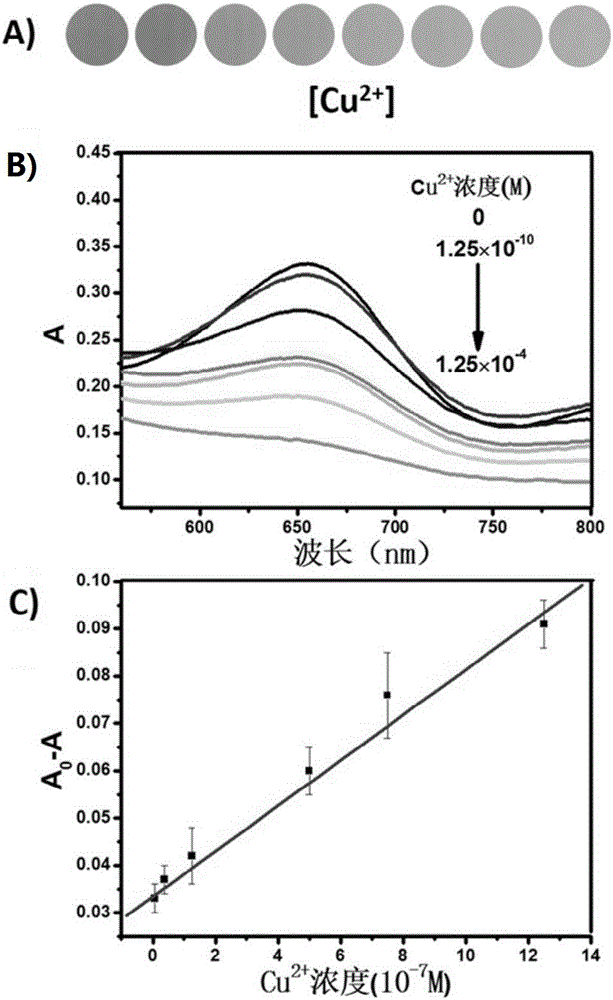
图3为本发明实施例4制备的用于Fe3+或Cu2+检测的纳米传感方法对Cu2+离子的检测;其中,a为向GSH-AuNCs–TMB–H2O2体系中加入不同浓度Cu2+后溶液颜色的变化,b为向GSH-AuNCs–TMB–H2O2体系中加入不同浓度Cu2+后溶液的紫外吸收光谱图,c为Cu2+检测标准曲线。
图4为本发明实施例4制备的用于Fe3+或Cu2+检测的纳米传感方法在Fe3+和Cu2+共存的情况下对Fe3+的选择性检测。
图5为本发明实施例4制备的用于Fe3+或Cu2+检测的纳米传感方法在Fe3+和Cu2+共存的情况下对Cu2+的选择性检测。
图6为本发明实施例4制备的用于Fe3+或Cu2+检测的纳米传感方法在Fe3+和Cu2+共存,双氧水溶液和TMB溶液摩尔质量比为1:10的情况下对Fe3+和Cu2+的检测标准曲线。
图7为本发明实施例4制备的用于Fe3+或Cu2+检测的纳米传感方法在Fe3+和Cu2+共存,双氧水溶液和TMB溶液摩尔质量比为1:50的情况下对Fe3+和Cu2+的检测标准曲线。
图8为本发明实施例4制备的用于Fe3+或Cu2+检测的纳米传感方法在Fe3+和Cu2+共存,双氧水溶液和TMB溶液摩尔质量比为1:100的情况下对Fe3+和Cu2+的检测标准曲线。
具体实施方式
下面的实施案例中将对本发明作进一步的阐述,但本发明不限于此。
实施例1:
取150μL金纳米簇溶液,向其中加入摩尔质量比为1:10的双氧水溶液和TMB溶液,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,用紫外分光光度计进行监测,并观察颜色变化。图1为本实施例制备的Fe3+和Cu2+检测的传感器GSH-AuNCs–TMB–H2O2体系的颜色变化以及紫外吸收光谱图。从图中可以得出,在向GSH-AuNCs溶液中加入TMB溶液以及双氧水后,溶液的颜色变为绿色,并且在652nm处出现明显的吸收峰,而当TMB溶液与H2O2或者GSH-AuNCs与TMB溶液共存时,溶液不会变为绿色,并且无明显吸收峰出现。当GSH-AuNCs–TMB–H2O2体系中存在铜离子时,溶液的颜色变浅,并且吸光度值下降,而当GSH-AuNCs–TMB–H2O2体系中存在铁离子时,溶液的颜色变深,并且吸光度值增大。表明GSH-AuNCs可以在H2O2存在的条件下催化氧化TMB变为ox-TMB,并且三者缺一不可。
实施例2:
取150μL金纳米簇溶液,向其中加入摩尔质量比为1:50的双氧水溶液和TMB溶液,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,用紫外分光光度计进行监测,并观察颜色变化。结果表明GSH-AuNCs可以在H2O2存在的条件下催化氧化TMB变为ox-TMB,并且三者缺一不可。
实施例3:
取150μL金纳米簇溶液,向其中加入摩尔质量比为1:100的双氧水溶液和TMB溶液,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,用紫外分光光度计进行监测,并观察颜色变化。结果表明GSH-AuNCs可以在H2O2存在的条件下催化氧化TMB变为ox-TMB,并且三者缺一不可。
实施例4:
(1)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入不同浓度的Fe3+(1.25×10-9-1.25×10-3M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后再加入摩尔质量比为1:10的双氧水溶液和TMB溶液,待充分反应后,观察到溶液的颜色随着Fe3+浓度的增大逐渐加深,并且在652nm处的吸光度值逐渐增大,如图2所示。
(2)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入不同浓度的Cu2+(1.25×10-10-1.25×10-4M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应30分钟,之后再加入摩尔质量比为1:10的双氧水溶液和TMB溶液,待充分反应后,观察到溶液的颜色随着Cu2+浓度的增大逐渐变浅,并且在652nm处的吸光度值逐渐减小,如图3所示。
(3)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入Cu2+(1.1×10-6M)和Fe3+(1.1×10-3--1.1×10-8M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,测其吸光度值为A1,之后加入NH4F溶液,充分反应后再加入摩尔质量比为1:10的双氧水溶液和TMB溶液,待充分反应后,测其吸光度值为A2,根据吸光度差值与Fe3+浓度建立标准曲线,如图4和图6所示,ΔA(A1–A2)=0.00217+0.0196c。
(4)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入Cu2+(1.1×10-3--1.1×10-7M)和Fe3+(2×10-6M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后加NH4F溶液,测其吸光度值为A3,实现对铁离子的掩蔽,之后加入EDTA溶液以及摩尔质量比为1:10的双氧水溶液和TMB溶液,待充分反应后,观察颜色变化,测其吸光度值为A4,根据吸光度差值与Cu2+浓度建立标准曲线,如图5和图6所示,ΔA(A4–A3)=0.0442+0.0508c。
(5)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入20-30μL稀释不同倍数的未经处理的不同人血清,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,测其吸光度值为A1,之后加入NH4F溶液,充分反应后再加入摩尔质量比为1:10的双氧水溶液和TMB溶液,测其吸光度值为A2,根据图6中吸光度差值与Fe3+浓度标准曲线,计算出血清中Fe3+的含量。
(6)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入20-30μL稀释不同倍数的经处理过的不同人血清,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后加NH4F溶液,测其吸光度值为A3,实现对铁离子的掩蔽,之后加入EDTA溶液以及摩尔质量比为1:10的双氧水溶液和TMB溶液,待充分反应后,观察颜色变化,测其吸光度值为A4,根据图6中吸光度差值与Cu2+浓度标准曲线,计算出血清中Cu2+的含量。
(7)检测结果
1、定性检测:AuNCs在双氧水存在的条件可以催化TMB变成氧化态(ox-TMB),并且溶液变为蓝绿色,在铜离子单独存在的情况下,体系的颜色随着铜离子浓度的增大逐渐变浅;当铁离子单独存在的情况下,体系的颜色随着铁离子浓度的增大逐渐变深。当溶液中同时存在铁离子以及铜离子时,加入NH4F溶液,溶液颜色变浅;而掩蔽铁离子后,加入EDTA溶液,溶液的颜色加深。
2、定量检测:根据图6中Fe3+、Cu2+检测相对标准曲线,计算出不同人血清中Fe3+与Cu2+的浓度,检测结果如表1和表2所示,通过与医院检测结果进行对比,发现本发明的纳米传感方法检测结果与医院检测结果基本一致,具有一定的可靠性。
表1 Fe3+浓度检测结果(10-6 M)
表2 Cu2+浓度检测结果(10-6 M)
实施例5:
(1)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入不同浓度的Fe3+(1.25×10-9-1.25×10-3 M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后再加入摩尔质量比为1:50的双氧水溶液和TMB溶液,待充分反应后,观察到溶液的颜色随着Fe3+浓度的增大逐渐加深,并且在652 nm处的吸光度值逐渐增大,如图2所示。
(2)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入不同浓度的Cu2+(1.25×10-10-1.25×10-4M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后再加入摩尔质量比为1:50的双氧水溶液和TMB溶液,待充分反应后,观察到溶液的颜色随着Cu2+浓度的增大逐渐变浅,并且在652nm处的吸光度值逐渐减小,如图3所示。
(3)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入Cu2+(1.1×10-6M)和Fe3+(1.1×10-3--1.1×10-8M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,测其吸光度值为A1,之后加入NH4F溶液,充分反应后再加入摩尔质量比为1:50的双氧水溶液和TMB溶液,待充分反应后,测其吸光度值为A2,根据吸光度差值与Fe3+浓度建立标准曲线,如图4和图6所示,ΔA(A1–A2)=0.00217+0.0196c。
(4)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入Cu2+(1.1×10-3--1.1×10-7M)和Fe3+(2×10-6M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后加NH4F溶液,测其吸光度值为A3,实现对铁离子的掩蔽,之后加入EDTA溶液以及摩尔质量比为1:50的双氧水溶液和TMB溶液,待充分反应后,观察颜色变化,测其吸光度值为A4,根据吸光度差值与Cu2+浓度建立标准曲线,如图5和图6所示,ΔA(A4–A3)=0.0442+0.0508c。
(5)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入20-30μL稀释不同倍数的未经处理的不同人血清,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,测其吸光度值为A1,之后加入NH4F溶液,充分反应后再加入摩尔质量比为1:50的双氧水溶液和TMB溶液,测其吸光度值为A2,根据图6中吸光度差值与Fe3+浓度标准曲线,计算出血清中Fe3+的含量。
(6)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入20-30μL稀释不同倍数的经处理过的不同人血清,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后加NH4F溶液,测其吸光度值为A3,实现对铁离子的掩蔽,之后加入EDTA溶液以及摩尔质量比为1:50的双氧水溶液和TMB溶液,待充分反应后,观察颜色变化,测其吸光度值为A4,根据图6中吸光度差值与Cu2+浓度标准曲线,计算出血清中Cu2+的含量。
(7)检测结果
1、定性检测:AuNCs在双氧水存在的条件可以催化TMB变成氧化态(ox-TMB),并且溶液变为蓝绿色,在铜离子单独存在的情况下,体系的颜色随着铜离子浓度的增大逐渐变浅;当铁离子单独存在的情况下,体系的颜色随着铁离子浓度的增大逐渐变深。当溶液中同时存在铁离子以及铜离子时,加入NH4F溶液,溶液颜色变浅;而掩蔽铁离子后,加入EDTA溶液,溶液的颜色加深。
2、定量检测:根据图6中Fe3+、Cu2+检测相对标准曲线,计算出不同人血清中Fe3+与Cu2+的浓度,检测结果如表3和表4所示,通过与医院检测结果进行对比,发现本发明的纳米传感方法检测结果与医院检测结果基本一致,具有一定的可靠性。
表3 Fe3+浓度检测结果(10-6M)
表4 Cu2+浓度检测结果(10-6M)
实施例6:
(1)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入不同浓度的Fe3+(1.25×10-9-1.25×10-3M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后再加入摩尔质量比为1:100的双氧水溶液和TMB溶液,待充分反应后,观察到溶液的颜色随着Fe3+浓度的增大逐渐加深,并且在652nm处的吸光度值逐渐增大,如图2所示。
(2)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入不同浓度的Cu2+(1.25×10-10-1.25×10-4M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后再加入摩尔质量比为1:100的双氧水溶液和TMB溶液,待充分反应后,观察到溶液的颜色随着Cu2+浓度的增大逐渐变浅,并且在652nm处的吸光度值逐渐减小,如图3所示。
(3)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入Cu2+(1.1×10-6M)和Fe3+(1.1×10-3--1.1×10-8M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,测其吸光度值为A1,之后加入NH4F溶液,充分反应后再加入摩尔质量比为1:100的双氧水溶液和TMB溶液,待充分反应后,测其吸光度值为A2,根据吸光度差值与Fe3+浓度建立标准曲线,如图4和图6所示,ΔA(A1–A2)=0.00217+0.0196c。
(4)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入Cu2+(1.1×10-3--1.1×10-7M)和Fe3+(2×10-6M),在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后加NH4F溶液,测其吸光度值为A3,实现对铁离子的掩蔽,之后加入EDTA溶液以及摩尔质量比为1:100的双氧水溶液和TMB溶液,待充分反应后,观察颜色变化,测其吸光度值为A4,根据吸光度差值与Cu2+浓度建立标准曲线,如图5和图6所示,ΔA(A4–A3)=0.0442+0.0508c。
(5)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入20-30μL稀释不同倍数的未经处理的不同人血清,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,测其吸光度值为A1,之后加入NH4F溶液,充分反应后再加入摩尔质量比为1:100的双氧水溶液和TMB溶液,测其吸光度值为A2,根据图6中吸光度差值与Fe3+浓度标准曲线,计算出血清中Fe3+的含量。
(6)在150μL以谷胱甘肽(GSH)为还原剂制备的金纳米簇分散体系中加入20-30μL稀释不同倍数的经处理过的不同人血清,在涡旋仪上旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应,之后加NH4F溶液,测其吸光度值为A3,实现对铁离子的掩蔽,之后加入EDTA溶液以及摩尔质量比为1:100的双氧水溶液和TMB溶液,待充分反应后,观察颜色变化,测其吸光度值为A4,根据图6中吸光度差值与Cu2+浓度标准曲线,计算出血清中Cu2+的含量。
(7)检测结果
1、定性检测:AuNCs在双氧水存在的条件可以催化TMB变成氧化态(ox-TMB),并且溶液变为蓝绿色,在铜离子单独存在的情况下,体系的颜色随着铜离子浓度的增大逐渐变浅;当铁离子单独存在的情况下,体系的颜色随着铁离子浓度的增大逐渐变深。当溶液中同时存在铁离子以及铜离子时,加入NH4F溶液,溶液颜色变浅;而掩蔽铁离子后,加入EDTA溶液,溶液的颜色加深。
2、定量检测:根据图6中Fe3+、Cu2+检测相对标准曲线,计算出不同人血清中Fe3+与Cu2+的浓度,检测结果如表5和表6所示,通过与医院检测结果进行对比,发现本发明的纳米传感方法检测结果与医院检测结果基本一致,具有一定的可靠性。
表5 Fe3+浓度检测结果(10-6M)
表6 Cu2+浓度检测结果(10-6M)
- 还没有人留言评论。精彩留言会获得点赞!