一种脂蛋白相关磷脂酶A2的测定试剂盒及其检测方法与流程
本发明属于生物医学检验技术领域,涉及一种脂蛋白相关磷脂酶a2的测定试剂盒及其检测方法。
背景技术:
脂蛋白相关磷脂酶a2(lp-pla2)是磷脂酶a2超家族的成员之一,由441个氨基酸组成,相对分子质量为45kda。因其最初发现时能降解血小板活化因子(platelet-activatingfactor,paf)的活性,也被称为血小板活化因子乙酰水解酶(platelet-activatingfactoracetylhydro-lase,paf-ah)。人血浆lp-pla2主要由巨噬细胞、单核细胞、t淋巴细胞以及肥大细胞等分泌产生,并受γ干扰素、脂多糖、血小板活化因子等多种炎性因子的调节。早期研究中,lp-pla2能将paf水解为无活性的溶血paf,减少炎症和血栓的形成,认为其具有抗炎和抗动脉粥样硬化的作用。但近年来的临床及实验室研究已经证实,lp-pla2在血浆中占主要优势的作用是水解氧化卵磷脂。lp-pla2能通过水解动脉内膜上氧化低密度脂蛋白(ldl)上的氧化磷脂而生成溶血磷脂酰胆碱(lysophosphatidylcholine,lyso-pc)和氧化型游离脂肪酸(oxidizedfreefattyacids,ox-fa),这两种促炎介质能刺激黏附因子和细胞因子的产生,促进动脉粥样硬化的发生和发展,导致血栓形成和心血管事件的发生。因此lp-pla2可作为心血管疾病中一种新的炎症酶,是心血管疾病(cvd)、冠心病(chd)、以及缺血性脑卒中的独立危险因素。检测人外周血lp-pla2浓度能给临床医生提供预防和治疗心脑血管疾病的新靶点,为临床疾病的早期干预、临床应用治疗提供新思路新方向。
目前用于检测lp-pla2的主要方法有酶联免疫吸附法(elisa)、化学发光免疫分析法(clia)、免疫比浊法。酶联免疫吸附法具有检测精确度高、灵敏度好等优势,但该方法自动化程度不高,操作繁琐,检测时间长,受人为因素影响较大,结果重复性差,且样本只能批量检测,不能满足医院对该检测指标的时效性、可重复性、及操作简单等特异性方面的需求。化学发光免疫分析法(clia)是利用化学发光物质经催化剂催化和氧化剂氧化,形成一个激发态的中间体,这种激发态的中间体回到稳定基态时,发出光子,利用发光信号测量仪测量光子数,从而间接测定lp-pla2的浓度。此法存在吖啶酯、鲁米诺、异鲁米诺直接标记抗体的发光效率低,标记物不稳定等问题,因这种直接标记法属于瞬间发光型,所以很难保证测试结果的稳定性和重复性,且需要特殊的检测仪器,不便于临床应用。胶乳增强免疫比浊法是一种灵敏、简洁、快速的检测方法,但受血脂浓度的影响较大,而心血管病人有很大一部分都存在血脂浓度高的情况,容易产生假阳性。另外抗凝剂的使用,血清中的类风湿因子对该方法的影响也比较大。
采用分光光度法测定lp-pla2活性的原理有两种:一是使用paf硫酯类为底物,lp-pla2水解底物后释放出游离硫醇,然后加入可以检测的硫醇的5,5-二硫(二硝苯甲酸),在405nm处检测吸光度的变化,来测定lp-pla2的活性。此方法的优点是底物可以自己合成或者从市场上购买,来源方便,但该反应易受巯基基团的影响。二是以sn-2位带有4-硝基苯酚基团的paf类似物为底物,lp-pla2水解底物后释放出带有4-硝基苯酚基团的物质,该物质不稳定,在水溶液中马上降解生成对硝基苯酚,试剂吸光度的升高速率与lp-pla2活性成正比,可通过检测405nm波长下吸光度的升高速率求得样本中lp-pla2的活性。该反应受到外界的影响较少且操作简单,可以上全自动生化分析仪。但该方法也存在灵敏度和准确性低的问题。主要是底物在水中的水解度直接影响其水解效率和吸光度变化。paf类似物为脂类,在水中的溶解度有限,另外样本中血清酶也能水解paf类似物,影响测定结果。
技术实现要素:
本发明针对现有分光光度计法测定lp-pla2活性的不足,提供一种lp-pla2测定试剂盒及其检测方法,该试剂盒制备成本低廉、灵敏度高、检测方法简单、能够在全自动生化分析仪上迅速检测。
为了达到上述发明目的,本发明采用以下技术方案:
一种脂蛋白相关磷脂酶a2的测定试剂盒,所述试剂盒包括试剂r1、试剂r2a和试剂r2b,其中:
试剂r1由缓冲液、电解质、抑制剂、防腐剂组成,ph为7.0-7.5;
试剂r2a由缓冲液、抑制剂、保护剂、防腐剂组成,ph为2.5-6.0;
试剂r2b由缓冲液、脂蛋白相关磷脂酶a2底物、助溶剂、防腐剂组成,ph为7.0-7.5。
试剂r1和试剂r2a中的抑制剂用来抑制样本中的血清酶活性,降低血清酶对lp-pla2底物的降解作用;试剂r2a和试剂r2b中的保护剂和助溶剂用于保护lp-pla2底物不被其它干扰物质降解,同时提高lp-pla2底物在水中的溶解性。
其中,试剂r1中的电解质可以为10-30mmol/l的氯化钠、氯化钾、乙二胺四乙酸二钠等等。脂蛋白相关磷脂酶a2底物为5-15mmol/l的1-十四酰-2-(4-硝基苯基琥珀酰)-3-磷脂酰胆碱。
作为优选,试剂r1、试剂r2a和试剂r2b中的缓冲液为碳酸盐缓冲液、磷酸盐缓冲液、hepes缓冲液、tris缓冲液中的一种或多种,缓冲液的浓度为10-100mmol/l。
作为优选,试剂r1和试剂r2a中抑制剂为1-壬烷磺酸钠或3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐,抑制剂的浓度为10-30mmol/l。在试剂r1和试剂r1a缓冲液中加入1-壬烷磺酸钠或者3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(chaps)作为血清酯酶活性抑制剂,在不影响lp-pla2的活性的前提下有效的抑制血清中其他酯酶对paf类似物的水解活性,使底物能与lp-pla2充分反应,且能消除血清中胆红素、维生素c、乳糜等杂质对结果造成干扰,提高准确度,除此之外,抑制剂还能提高脂蛋白相关磷脂酶a2的活性。
作为优选,试剂r2a的保护剂10-40%v/v的乙醇。
作为优选,试剂r2b中的助溶剂为10-40%v/v的甘油。
在试剂r2a中加入乙醇做保护剂,在试剂r2b中加入甘油做助溶剂,使r2a和r2b混匀后,底物能够均匀的分散在缓冲液中,提高lp-pla2的水溶性,扩大样本与lp-pla2的反应面积,提高反应速率,提高灵敏度。
作为优选,试剂r1、试剂r2a和试剂r2b中的防腐剂为叠氮钠、硫酸庆大霉素、硫柳汞中的一种或多种,防腐剂的浓度为0.03-0.08%w/v。
作为优选,所述试剂盒还包括校准品和/或质控品,校准品和质控品成分包括脂蛋白相关磷脂酶a2、缓冲液、电解质和稳定剂。
为了达到本发明的另一个目的,采用以下技术方案:
在全自动生化分析仪上设置主波长为405nm,副波长为505nm;
将试剂r2a和试剂r2b以体积比为25-30:1的混匀,配成试剂r2;
将样本和试剂r1混匀后于35-40℃孵育3-5分钟,随即加入试剂r2,其中,样本、试剂r1和试剂r2的体积比为3:240:80,混匀后于35-40℃孵育60秒,读取吸光度a1,再孵育180秒后,读取吸光度a2,计算a2与a1的差值,根据校准曲线计算,得出样本中脂蛋白相关磷脂酶a2的活性。
本发明脂蛋白相关磷脂酶a2测定试剂盒,加入血清酯酶活性抑制剂以及助溶剂,有效提高反应速率、精密度、准确度以及灵敏度。且该lp-pla2测定试剂盒制备成本低廉、特异性好、操作简便、不容易受其他外界因素干扰、能够在全自动生化分析仪上实现快速检测。
附图说明
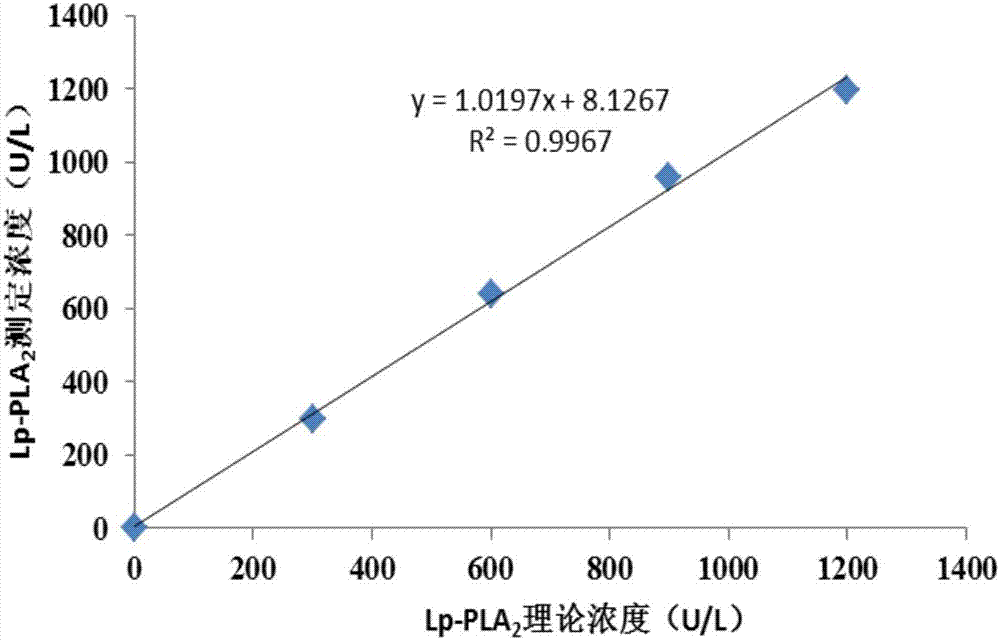
图1为lp-pla2测定试剂盒的校准曲线。
图2为实施例1的lp-pla2测定试剂盒的线性范围。
具体实施方式
下面通过具体实施例以及附图对本发明的技术方案作进一步描述说明。如果无特殊说明,本发明的实施例中所采用的原料均为本领域常用的原料,实施例中所采用的方法,均为本领域的常规方法。
本发明试剂盒测定lp-pla2活性的检测方法为:
在全自动生化分析仪上设置主波长为405nm,副波长为505nm;将试剂r2a和试剂r2b以体积比为25-30:1的混匀,配成试剂r2;
具体的操作步骤如表1所示,但是表1仅限操作步骤中的一种实例,不限制保护范围。
表1测定lp-pla2活性的检测步骤
在测定样本前,需要进行校准和质控程序,使用配套的校准品作校准曲线,本发明的校准曲线如图1所示,采用两点速率法定标。校准曲线每7天重新制作一次,当发生如下情形时,需要重新校准:试剂批号更换时,仪器更换零部件或者保养时,质控品或样本结果异常时。质控程序:采用配套的质控品,,每天进行质控实验;每个浓度质控品重复测量10次,计算精密度cv,控制在质控品偏差范围内。
根据图1的校准曲线,计算样本的lp-pla2活性:
实施例1
试剂r1:50mmol/l碳酸缓冲液,25mmol/l氯化钠,20mmol/l1-壬烷磺酸钠,0.05%叠氮化钠,ph7.4。
试剂r2a:50mmol/l碳酸缓冲液,20mmol/l1-壬烷磺酸钠,20%乙醇,0.05%叠氮化钠,ph4.5。
试剂r2b:50mmol/l的磷酸缓冲液,10%甘油,5mmol/l1-十四酰-2-(4-硝基苯基琥珀酰)-3-磷脂酰胆碱,0.05%叠氮化钠,ph7.0。
实施例2
试剂r1:20mmol/l磷酸盐缓冲液,15mmol/l乙二胺四乙酸二钠,10mmol/lchaps,0.05%叠氮化钠,ph7.0。
试剂r2a:20mmol/l碳酸缓冲液,10mmol/l1-壬烷磺酸钠,40%甘油,0.05%叠氮化钠,ph2.7。
试剂r2b:100mmol/lhepes缓冲液,15%乙醇,10mmol/l1-十四酰-2-(4-硝基苯基琥珀酰)-3-磷脂酰胆碱,0.05%叠氮化钠,ph7.2。
实施例3
试剂r1:25mmol/ltris缓冲液,10mmol/l氯化钾,10mmol/l1-壬烷磺酸钠,0.05%叠氮化钠,ph7.5。
试剂r2a:10mmol/lhepes缓冲液,20mmol/lchaps,15%乙醇,0.05%叠氮化钠,ph6.0。
试剂r2b:10mmol/l磷酸盐缓冲液,20%甘油,8mmol/l1-十四酰-2-(4-硝基苯基琥珀酰)-3-磷脂酰胆碱,0.05%叠氮化钠,ph7.0。
实施例1-实施例3中的校准品中lp-pla2活性为336u/l,质控品中lp-pla2活性为529u/l,用20mmol/l磷酸盐缓冲液、150mmol/l氯化钠、2%(w/v)bsa、0.5%(v/v)吐温-20的溶液将脂蛋白相关磷脂酶a2抗原配制成浓度分别为336u/l和529u/l的溶液。
对比例1
对比例1与实施例1中的lp-pla2测定试剂盒的区别仅在于试剂r1和试剂r2a中没有添加1-壬烷磺酸钠,其它与实施例1相同,此处不再赘述。
对比例2
对比例2与实施例1中的lp-pla2测定试剂盒的区别仅在于试剂r2a中没有添加乙醇,试剂r2b中没有添加甘油,其它与实施例1相同,此处不再赘述。
将实施例1-3以及对比例1-2的lp-pla2测定试剂盒进行线性范围、精密度、准确度的测定。
1、线性范围测定:
线性范围在试剂盒中的评价中很重要,是衡量试剂盒质量的重要指标。选择接近线性范围下限的低值样品和接近线性范围上限的高值样品各一份,本发明中取两份不同浓度的血清,标本浓度分别为0u/l和1200u/l,按不同比例混合成五个稀释浓度:0u/l、300u/l、600u/l、900u/l和1200u/l,分别用lp-pla2测定试剂盒中的试剂按照参数将每个稀释浓度检测三次,求出检测结果的均值。结果如表2所示。
表2实施例1-3对五个稀释浓度的测定结果
表2中理论值、测定值、平均值、估计值的单位为u/l。后续表格中lp-pla2活性单位皆为u/l,在此统一说明。以稀释浓度为自变量,以检测结果为因变量求出线性回归方程,获得的线性回归方程:y=a+bx,实施例1的线性回归方程如图2所示,a=8.1267,b=1.0197,相关系数r=0.9967;实施例2中a=11.3667,b=1.0035,相关系数r=0.9989;实施例3中a=3.8267,b=1.0033,相关系数r=0.9992;对比例1中a=45.0667,b=0.5405,相关系数r=0.9793;对比例2中a=55.3900,b=0.6913,相关系数r=0.778。其中,表2中估计值=理论值*b+a,绝对偏差=估计值-平均值,相对偏差=(估计值-平均值)/平均值*100%,表格中0值求得的是绝对偏差,一方面0值测出来的平均值接近0,不能用相对偏差的公式计算,另一方面,即使平均值不为0,按公式算出来的值也不符合性能验证的要求。
实施例1-3试剂盒的线性范围为30~1000u/l,正常参考区间:男性≤670u/l,女性≤535u/l,基本满足临床需求。对比例1-2试剂盒的线性范围为100~600u/l,灵敏度低,检测不准确,线性范围窄,易出现前带效应,这样的线性范围无法满足临床需求。
2、精密度测定
a.批内差
在重复性条件下,用低高值校准品或质控品测试同一批号试剂盒,至少重复测试10次,本次实验中使用的低值为336u/l的校准样品,高值为529u/l的质控品,分别计算测量值的平均值(x)和标准偏差(s),按公式cv=s/x×100%,计算变异系数(cv),以及相对误差。
表3低高值校准品测试实施例1-3和对比例1-2同一批号试剂盒的精密度值
b.批间差
用高低值校准品或质控品分别测试3个不同批号的试剂盒,每个批号测试3次,分别计算三批试剂盒测定平均值的相对极差。极差r是一组观察值中,最大值与最小值之差,相对极差=极差(r)/平均值(x)。
表4低高值校准品测试实施例1-3和对比例1-2的3个不同批号试剂盒的相对极差
根据表3和表4可知,实施例1-3试剂盒在批内差和批间差实验中精密度良好,而对比例1-2的重复性较差。
3、准确度测定
a.回收试验
采用回收试验,在1ml的人源样品中加入0.1ml的浓度为1300u/l的lp-pla2高值血清,重复检测3次,按公式计算回收率。
表5实施例1-3和对比例1-2的回收率
实施例1-3所测得的回收率在85%~115%范围内,准确度高,而对比例1-2的回收率偏离正常范围,检测不准确。
b.比对试验
参照ep9a2的方法,收集新鲜的临床样本共40份,所选lp-pla2浓度在试剂线性范围之内并均匀分布。用本发明的试剂和市售某lp-pla2试剂的两种方法同时进行实验,计算两组结果的相关系数(r)和直线回归方程。
表6实施例1-3与市售某lp-pla2试剂的相关性
线性回归方程:y=a+bx(实施例1中a=0.9914,b=1.4766,相关系数r=0.9996;实施例2中a=0.9899,b=1.8746,相关系数r=0.9993;实施例3中a=1.0021,b=-0.0759,相关系数r=0.9998),实施例1-3的试剂与市售的某lp-pla2试剂产品相关性好,且相比市售试剂,本发明的成本更低。
综上所述,实施例1-3的线性范围满足临床应用的需求,其精密度和准确度都很高,与市售的某lp-pla2试剂产品相关性好,但是本发明的试剂成本相对更低,进入市场后有望取代该市售产品。而对比例1-2因缺少必要的抑制剂、助溶剂或保护剂,制备出的试剂无论是精密度还是准确度都较差,且线性范围不能满足临床需求。
另外,本发明要求保护的技术范围中点值未穷尽之处以及在实施例技术方案中对单个或者多个技术特征的同等替换所形成的新的技术方案,同样都在本发明要求保护的范围内;同时本发明方案所有列举或者未列举的实施例中,在同一实施例中的各个参数仅仅表示其技术方案的一个实例(即一种可行性方案)。
本文中所描述的具体实施例仅仅是对本发明精神作举例说明。本发明所属技术领域的技术人员可以对所描述的具体实施例做各种修改或补充或采用类似的方式替代,但并不会偏离本发明的精神或者超越所附权利要求书所定义的范围。
- 还没有人留言评论。精彩留言会获得点赞!