区别间充质干细胞的方法及测定间充质干细胞的纯度的方法与流程
本发明涉及在源自胎盘相关组织的细胞培养物中区别间充质干细胞(msc)的方法。本发明还涉及在源自胎盘相关组织的细胞培养物中增加间充质干细胞(msc)群体的纯度的方法。另一方面,本发明涉及评估源自胎盘相关组织的细胞培养物中的间充质干细胞(msc)的纯度的方法。
背景技术:
间充质干细胞或基质细胞(mesenchymalstemorstromalcells,msc)是属于胚胎中胚层来源的多能性细胞,具有类纤维母细胞的形态。所述细胞视刺激及培养条件可分化为脂肪细胞、骨细胞、软骨细胞、神经系细胞及肌细胞与其它细胞类型。虽然人类间充质干细胞(hmsc)的可塑性及其在组织修复与再生的作用已被广泛研究,近来得到最多的关注的是其免疫调控性质[1-2]。人类间充质干细胞已从各种组织分离出。最常用的msc来源为骨髓(bonemarrow,bm)。然而,其分离程序为极具侵入性的。为避免侵入性的分离程序,诸如人类脐带及胎盘的组织由于通常在生产后被丢弃而被视为良好的候选物。先前研究已证实hmsc可自脐带或胎盘有效率的分离[3]。
msc为包含在间充质组织中的更复杂的基质细胞组成的子群体。由于间充质干细胞的异质性及对其具有特异性的已知生物标记物的缺乏,定义msc表型及特征是一项具挑战性的任务[4-6]。负责msc功能的分子组份(特别是在细胞膜上的)大多数仍属未知。此外,特异性细胞表面标记物的缺乏使得细胞培养处于可能为其它细胞类型污染的风险中,特别是诸如纤维母细胞的成熟基质细胞,其相对地大量存在于间充质组织中[4-6]。在从胎盘源组织分离msc的过程中,非msc(包括纤维母细胞、胎盘源上皮细胞及胎盘源网状细胞)常常在体外培养中与msc共存。纤维母细胞尤其是污染的主要来源。
纤维母细胞被视为成熟间充质细胞,尤其大量存在于结缔组织中。因此,该细胞为许多细胞培养系统中最常存在的污染细胞表型。不仅成功地从培养物去除纤维母细胞的技术困难,在相同培养物中区别msc与纤维母细胞也尤为复杂。纤维母细胞及msc具有极相似的形态外观;二者均可良好地增生并具有许多相同的细胞表面标记物[7-8]。国际细胞治疗研讨会(internationalsocietyofcellulartherapy,isct)目前定义msc为表达cd73、cd90及cd105的具有塑料贴附性的多能性类纤维母细胞的细胞,且不表达造血标记物cd14、cd34及cd45。然而,纤维母细胞亦具有所述性质及标记物。因此,目前由isct建议的定义无法区别msc与一般纤维母细胞。至今,区别msc与纤维母细胞的最佳方式是基于这两种细胞的功能特性的分析;msc保留多能性干细胞性及免疫调控能力,而纤维母细胞在此二功能特性中皆显得较为受限。
自friedenstein在辨别msc上的开创性成果以来[48],在寻求稳定且明确地区别离体培养扩增的msc与纤维母细胞方面,培养衍生方法学、形态学及基因表达特征并无明显的差异[9-12]。目前,对于分离msc与纤维母细胞不存在公认的标准或单一细胞表面标记物。由于纤维母细胞为常见于源自胎盘的msc培养物中的污染细胞群体的事实,作为生物标记物以区别msc与纤维母细胞的新颖表面蛋白对于确保胎盘源msc的初代培养的均一性极为重要。
cd146(黑素瘤细胞粘附分子,melanomacelladhesionmolecule,mcam)是一种血管内皮细胞的表面标记物,通过促进细胞-细胞相互作用以及血管生成作用而发挥功能。最近的研究揭露,一些间充质干细胞(msc)会表达cd146[13-14、16],而且cd146的表达量与其自我更新能力或分化成脂肪细胞以及成骨能力有关[13、15]。此外,自不同组织分离的间充质干细胞(msc)表现出不同的cd146表达量:从骨髓分离的间充质干细胞(msc)约有40%表达cd146,且其表达量随着继代次数增加而降低[13-15],而从脂肪组织分离的间充质干细胞(msc)只有少于10%表达cd146[14]。
美国第9,470,685号专利公开一种使用在间充质干细胞(msc)上表达的标记物epha2以区别间充质干细胞(msc)和纤维母细胞的方法。
技术实现要素:
在本发明中意外地发现,基于特异性的表面标记物cd146(黑素瘤细胞粘附分子,melanomacelladhesionmolecule,mcam)的表达量,可以在源自胎盘相关组织的细胞培养物中区别间充质干细胞(msc)。
因此,在一方面,本发明提供一种区别间充质干细胞(mesenchymalstemcells(msc)与纤维母细胞的方法,包含使用在msc上表达的标记物cd146从纤维母细胞中分离出msc,以区别msc与纤维母细胞,其中所述msc与纤维母细胞来自源自胎盘相关组织的细胞培养物。
在本发明的部分具体实施例中,该方法进一步包含以下的初步步骤:从该胎盘相关组织收集msc与纤维母细胞;以及在一培养基中培养msc与纤维母细胞以制备该细胞培养物。
另一方面,本发明提供一种增加细胞培养物中的间充质干细胞(msc)群体的纯度的方法,包含使用在msc上表达的标记物cd146分离并收集msc,其中所述msc来自源自胎盘相关组织的细胞培养物;以及培养所述msc。
根据本发明,该胎盘相关组织可选自羊膜、绒毛膜盘、绒毛膜及脐带。在一较佳具体实施例中,该胎盘相关组织为脐带。
根据本发明,分选步骤可使用本领域已知或待开发的技术进行,例如一基于抗体或一基于核苷酸的分离方法。
在本发明的部分具体实施例中,该源自胎盘相关组织的细胞培养于一间充质干细胞用的培养基中。
另一方面,本发明提供一种评估在源自胎盘相关组织的细胞培养物中的间充质干细胞(msc)的纯度的方法。该方法包含测定在该培养物中表达cd146的细胞的百分比的步骤。
根据本发明,所述msc的纯度与该表达cd146的细胞的百分比具有正相关性。在本发明的较佳具体实施例中,该表达cd146的细胞的百分比通过流式细胞法测定。在一具体实施例中,所述msc的纯度通过以下的方程计算:y=sx+i,其中y为间充质干细胞(msc)的纯度(%),x为表达cd146的细胞的百分比,s为自1.129至1.283之间的数值,且i为自-28.676至-17.964之间的数值。
应了解先前的一般描述及以下的详述两者皆仅为示例性及解释性且并不限制本发明。
附图说明
本发明先前的概述以及以下详述在配合随附附图阅读时得以更佳地被了解。为说明本发明,在附图中显示目前较佳的实施例
在附图中:
图1显示间充质干细胞(msc)和纤维母细胞的混合群体的流式细胞仪分析的结果。将来自捐献者的脐带的msc与不同比例的纤维母细胞混合。结果显示由流式细胞仪侦测到的cd146+群体的百分比相应于增加的纤维母细胞群体而成比例减少。fb=纤维母细胞。
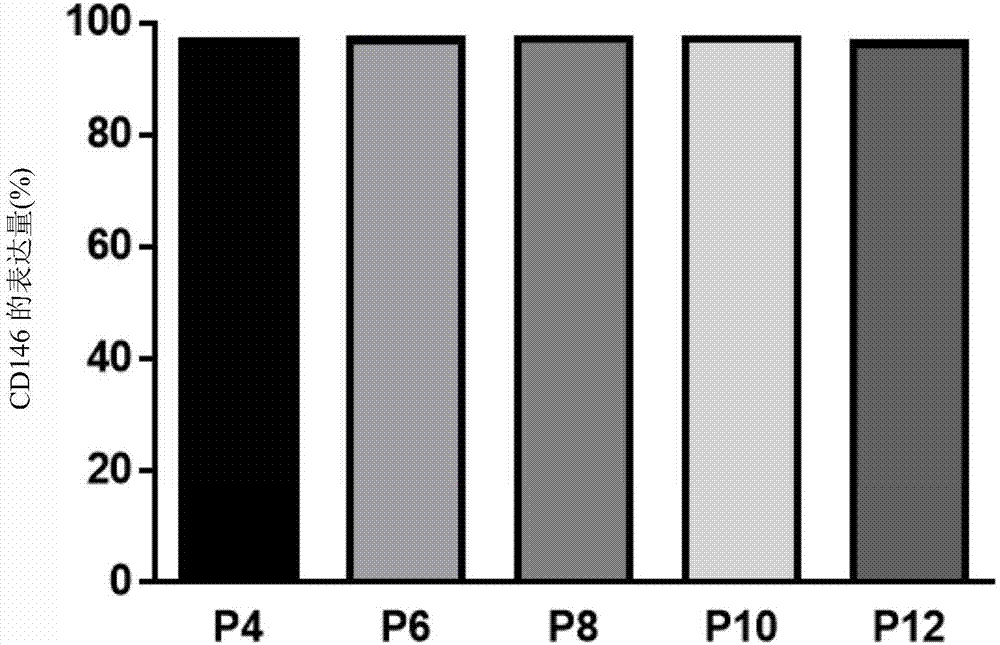
图2显示以流式细胞仪分析不同继代数的源自脐带的msc的cd146表达量的分析结果。
图3显示在源自胎盘相关组织的细胞培养物中msc的纯度(%)与表达cd146的细胞的百分比之间的线性回归。
图4a显示cd146高的msc和cd146低的msc的cd146的表达量。图4b显示来自cd146高的msc与cd146低的msc的脂肪生成分化的结果。其中,每组平均msc细胞数目:140。
图5显示pbmc增殖分析的结果。
图6显示在cd146高的msc和cd146低的msc的条件培养基中肝细胞生长因子(hgf)的含量。
图7显示在cd146高的msc和cd146低的msc中细胞ros、粒线体ros以及β-半乳糖苷酶(老化标记物)的相对量。
具体实施方式
本发明基于意外的发现,亦即通过表面标记物cd146的细胞分选,可以在源自胎盘相关组织的细胞培养物中区别出间充质干细胞(msc)。
在一方面,本发明提供了一种区别间充质干细胞(msc)与纤维母细胞的方法。该方法包含使用在msc上表达的标记物cd146自纤维母细胞中分离出msc,以区别msc与纤维母细胞,其中所述msc与纤维母细胞来自源自胎盘相关组织的细胞培养物。
在本发明的部分具体实施例中,该方法进一步包含以下的初步步骤:从该胎盘相关组织收集msc与纤维母细胞;以及在一培养基中培养msc与纤维母细胞以制备该细胞培养物。
另一方面,本发明提供一种增加细胞培养物中的间充质干细胞(msc)群体的纯度的方法,包含使用在msc上表达的标记物cd146分离并收集msc,其中所述msc来自源自胎盘相关组织的细胞培养物;以及培养所述msc。
又一方面,本发明提供了分离间充质干细胞(msc)群体的方法,包含使用在msc上表达的标记物cd146分离并收集msc,其中所述msc来自源自胎盘相关组织的细胞培养物,且所述msc群体具有较高的分化能力、引起较高的抗发炎效果、具有较低的老化程度,及/或分泌较高量的生长因子。
根据本发明,依照本领域已知的实验操作程序,例如shen等人的实验操作程序[21],所述细胞新鲜地得自、获得自或收集自胎盘相关组织。在部分较佳具体实施例中,源自胎盘相关组织的细胞接着培养于一msc用的培养基。msc用的标准培养基包含α最低必需培养基(具有不同的修改版本)、胎牛血清(fetalbovineserum,fbs)、l-麸酰胺酸,以及碱性纤维母细胞生长因子(basicfibroblastgrowthfactor,bfgf)[3,16-20]。
该胎盘相关组织可选自羊膜、绒毛膜盘、绒毛膜及脐带。在本发明的一较佳具体实施例中,该胎盘相关组织为脐带。
在本发明方法的实行中,使源自胎盘相关组织的细胞培养物接受cd146的细胞分选。该细胞分选可经由本领域已知或待开发的技术进行,例如:一基于抗体或一基于核苷酸的分离方法。较佳地,该细胞分选通过一基于抗体的磁性细胞分选进行。例如,macs法(
此外,在本发明中意外地发现,所述msc的纯度与表达cd146的细胞的百分比具有正相关性。
据此,本发明另一方面提供了一种评估在源自胎盘相关组织的细胞培养物中的间充质干细胞(msc)的纯度的方法。该方法包含测定在该培养物中表达cd146的细胞的百分比的步骤。
在本发明的较佳具体实施例中,表达cd146的细胞的百分比通过流式细胞法测定。
在一具体实施例中,所述msc的纯度通过以下的方程式计算:y=sx+i,其中y为间充质干细胞(msc)的纯度(%),x为表达cd146的细胞的百分比,s为自1.129至1.283之间的数值,且i为自-28.676至-17.964之间的数值。
根据本发明的部分具体实施例,通过本发明的方法分离的msc群体具有较高的分化能力。在一具体实施例中,所述msc群体具有较高的脂肪生成能力。
根据本发明的部分具体实施例,通过本发明的方法分离的msc群体引起较高的抗发炎效果。在一具体实施例中,所述msc群体表达出较高的抑制pbmc增殖的能力。
根据本发明的部分具体实施例,通过本发明的方法分离的msc群体具有较低的老化程度。在一些具体实施例中,所述msc群体表达出较低量的细胞ros、粒线体ros或β-半乳糖苷酶。
根据本发明的部分具体实施例,通过本发明的方法分离的msc群体分泌较高量的生长因子。在一具体实施例中,所述msc群体分泌较高量的肝细胞生长因子(hepatocytegrowthfactor,hgf)。
应当理解的是,上述一般性描述与以下详细描述都仅为示例性和解释性的,而非对本发明的限制。
本发明通过以下实例进一步说明,其提供作为例示的用途而非限制本发明。
实例
实例1:间充质干细胞(msc)与纤维母细胞的混合群体的流式细胞仪分析
为证明cd146可作分离源自胎盘的间充质干细胞(msc)与纤维母细胞的生物标记物,在微量离心管(eppendorf)中,将源自脐带的msc及纤维母细胞以下列比例(msc:纤维母细胞的细胞数)混合:2x105:0、1.8x105:2x104、1x105:1x105、2x104:1.8x105,或0:2x105。接着通过流式细胞仪分析每一微量离心管中的cd146+群体。参照图1,结果显示,经由流式细胞仪,通过抗cd146抗体(抗人类cd146-v450,bdbiosciences公司)侦测到的cd146+群体的百分比相应于增加的纤维母细胞群体而成比例减少。
实例2:随着继代次数增加cd146的表达量依然维持
以不同的继代数(继代数:4、6、8、10,以及12)收获源自脐带的msc,并通过流式细胞仪分析cd146的表达量。结果显示经过继代,cd146的表达量依然维持(图2)。
实例3:msc的纯度的评估
在微量离心管中,将源自脐带的msc与纤维母细胞以下列比例(msc:纤维母细胞的细胞数)混合:2x105:0、1.8x105:2x104、1x105:1x105、2x104:1.8x105,或0:2x105。接着通过流式细胞仪分析每一微量离心管中的cd146+群体。随后,通过简单线性回归分析msc的纯度(%)与表达cd146的细胞的百分比之间的关系,其结果显示于图3。回归方程式为y=1.206x–23.32,其中y为msc的纯度(%),x为表达cd146的细胞的百分比。结果证实cd146的表达量与msc的纯度之间存在线性关系。
实例4:cd146高的msc相对cd146低的msc表达出较高的分化能力
使用流式细胞仪检查来自不同脐带的msc的cd146的表达。获得二组msc:cd146高的msc与cd146低的msc(图4a)。将2x105细胞/孔的msc接种至12孔培养盘中,培养整夜,然后在添加脂肪生成补充物(invitrogen公司)的脂肪细胞分化基础培养基(invitrogen公司)中培养。培养14天后,将该二组msc以福马林固定,以油红(oilred)染色,并在显微镜下观察以计算脂肪细胞的数目。如图4b所示,cd146高的msc展现出较高的脂肪生成能力。
实例5:cd146高的msc相对cd146低的msc产生较高的抗发炎效果
cd146高的msc及cd146低的msc的获得如实例4所述。通过pbmc增殖测定分析间msc的免疫调节能力。羧基荧光素琥珀酰亚胺酯(carboxyfluoresceinsuccinimidylester,cfse)标记的pbmc由植物凝集素(phytohemagglutinin,pha)刺激,并且与msc共同培养。通过facs分析增殖的pbmc的百分比。通过评估荧光细胞可渗透染料cfse的强度的降低来测定pbmc的增殖速率。结果显示,cd146高的msc较cd146低的msc更有效地抑制pbmc的增殖(图5),表示cd146高的msc产生较高的抗发炎效果。
实例6:cd146高的msc相对cd146低的msc分泌出较高量的生长因子
cd146高的msc及cd146低的msc的获得如实例4所述。以elisa分析来自该二组的条件培养基中的肝细胞生长因子(hepatocytegrowthfactor,hgf)的量,并通过bca方法分析msc的总蛋白。hgf的量以hgf总量与msc的总蛋白量的比率来表示。如图6所示,cd146高的msc相对cd146低的msc分泌出显著较高量的hgf。
实例7:cd146高的msc相对cd146低的msc具有较低的老化程度
cd146高的msc及cd146低的msc的获得如实例4所述。较高量的细胞ros、粒线体ros及β-半乳糖苷酶被认为与老化有关。在本实验中,使用市售套组(分别为sigma公司的dcfda以及invitrogen公司的mitosox)测定细胞ros量及粒线体ros量。使用c12fdg(molecularprobes公司)测定与老化相关的β-半乳糖苷酶的量。结果显示,在cd146高的msc中的细胞ros、粒线体ros及β-半乳糖苷酶的量低于在cd146低的msc中的量(图7),表示cd146高的msc相对cd146低的msc具有较低的老化程度。
本领域技术人员应了解可对上述的实施例进行改变而不背离其广泛的发明概念。因此,应了解本发明不受限于所揭示的特定实施例,而是意欲涵盖在如随附权利要求书所定义的本发明的精神与范畴内的修改。
参考文献:
[1]staggj等人,currmolmed.13(5):856-67(2013).
[2]casadojg等人,stemcellrev.9(2):184-9(2013).
[3]fukuchiy等人,stemcells.2004;22(5):649-58.
[4]javazoneh等人,exphematol.32(5):414-25(2004).
[5]nombela-arrietac等人,natrevmolcellbiol.12(2):126-31(2011).
[6]keatinga.,cellstemcell.10(6):709-16(2012).
[7]lingec等人,expcellres1989,185:519-528.
[8]lorenzk等人,expdermatol2008,17:925-932.
[9]blasi等人,vascularcell2011,3:5.
[10]covasa等人,第36卷,第5期,第642–654页(2008).
[11]muzlifaha.haniffa等人,haematologica94:258-263(2009).
[12]pittenger等人,sciencevol.284no.5411pp.143-147(1999).
[13]lvf.j.等人,stemcells.2014;32(6):1408-19.
[14]dmitrievar.i.等人,cellcycle.2012;11(2):377-83.
[15]halfons.等人,stemcellsdev.2011;20(1):53-66.
[16]miaoz等人,cellbiolint.2006sep;30(9):681-7.
[17]maleka等人,jstemcells.2011;6(2):75-92.
[18]cavalloc等人,jcellbiochem.2011五月;112(5):1418-30.doi:10.1002/jcb.23058.
[19]shalinivellasamy等人,worldjstemcells.jun26,2012;4(6):53–61.
[20]luanx等人,tissuecell.2013feb;45(1):32-8.doi:10.1016/j.tice.2012.09.002.epub2012oct27.
[21]shen等人,taiwanjobstetgynecol.2015dec;54(6):749-56.doi:10.1016/j.tjog.2015.10.012.
- 还没有人留言评论。精彩留言会获得点赞!