用于确定纤维蛋白原的方法与流程
本发明涉及凝血诊断领域并且涉及一种用于根据Clauss方法确定人体血浆样本中的纤维蛋白原浓度的方法。
背景技术:
纤维蛋白原是纤维蛋白的水溶性前身,纤维蛋白形成用于伤口愈合的基质。凝血蛋白酶Thrombin(因子IIa)使纤维蛋白原分裂并且以该方式激活纤维蛋白形成、即血块形成。降低的纤维蛋白原水平伴随着出血倾向。急剧升高的纤维蛋白原水平通常出现在发炎、术后或其它的情况中。长期升高的纤维蛋白原水平适合作为血栓疾病的风险指标。
在现有技术中已知了用于确定纤维蛋白原浓度的一系列不同方法。
在CA 1062501中描述了基于对凝血酶时间进行测量的纤维蛋白原确定方法,其中,凝血酶时间已知不能实现精确地确定纤维蛋白原浓度,因为除了纤维蛋白原之外还有另外的因素、例如抗凝血剂(如肝素)或直接的凝血酶抑制剂又或者存在能够影响凝血酶时间的纤维蛋白或纤维蛋白原分裂物,并且凝血酶时间通常仅在纤维蛋白原严重不足的状态下起作用。在凝血酶时间方法中,通常以较小的凝血酶数量混合未稀释的血浆样本,并且光度地测量纤维蛋白形成、即反应混合物的吸光变化并且随后确定凝血时间。然而,根据CA 1062501不确定凝血时间,而是确定反应曲线的一阶导数的最大值,或者换句话说反应曲线的最大吸光变化。所发现的是,最大吸光变化与纤维蛋白原浓度呈线性相关,从而后者能够借助于校准曲线来确定,该校准曲线从已知的纤维蛋白原浓度与最大吸光变化的对应关系来建立。
用于确定纤维蛋白原浓度的基本上精确并且经常应用的方法是所谓的Clauss方法(Clauss,A.,用于确定纤维蛋白原的凝血生理学的快速方法。1957年,Actahaemat.17:237-246)。该测试是凝血酶时间的变体方案,其中血浆样本与凝血酶混合并且确定凝血时间。在Clauss方法中,在反应混合物中,较低的纤维蛋白原浓度与较高的标准化的凝血酶浓度组合,由此纤维蛋白形成速度在实际上仅与纤维蛋白原浓度相关。反应混合物中的相对较低的纤维蛋白原浓度通常通过应用事先稀释的血浆样本建立。
在反应混合物中随后光度地确定纤维蛋白形成、即血块形成。由于纤维蛋白形成使得反应混合物浊度增加,从而能够通过吸收测量定量地测量纤维蛋白形成。
随后,通常确定样本的凝血时间。样本的凝血时间与纤维蛋白原数量成比例。样本的凝血时间是从凝血酶加入样本的时间点到测量到可辨认的纤维蛋白形成、即反应混合物的浊度的时间点的时间。在此,“可辨认的纤维蛋白形成”能够限定为测试和设备专用的阈值,该阈值-当超过其的时候-表明了凝血时间。可替换地,从凝血反应开始之前与结束之后的信号差出发,“可辨认的纤维蛋白形成”能够限定为测试和设备专用的百分比信号差值,其-当超过其的时候-表明了凝血时间。Clauss测试中的纤维蛋白形成的反应动力学与凝血酶时间测试中的纤维蛋白形成的反应动力学明显不同。在Clauss测试中,在添加了凝血酶试剂之后3秒,已经开始了取决于纤维蛋白原浓度的纤维蛋白形成,即明显早于在凝血酶时间测试中最早在10秒后才实现的纤维蛋白形成。此外,在Clauss测试中,纤维蛋白形成速度至少在浓度比较高的样本中高于凝血酶时间测试的情况。因此,与凝血酶时间测试相比,Caluss测试中的具有高纤维蛋白原浓度的样本的反应曲线的特征在于较短的迟滞期、陡峭的上升和相对较快地到达稳定阶段。与凝血酶时间测试相比,Caluss测试中的具有低纤维蛋白原浓度的样本的反应曲线的特征在于同样较短的迟滞期、平缓的上升和主要在结束测量之后才迟迟进入的稳定阶段。相对而言,在凝血酶时间中,稳定阶段很不明显或者甚至完全没有。
问题在于,由于Caluss测试中的血浆样本的相对较高的稀释度而仅获得相对较低的信号强度,这种信号强度能够由于光学系统中较低的信噪比和已经由于轻微的干扰(例如反应混合物中的能够由于应用冷却的试剂产生的气泡)而导致不精确的测量结果。
为了避免该问题,在现有技术中应用未冷却的试剂,和/或添加陶土作为增强信号的附加试剂。
应用未冷却的试剂的缺点在于,试剂具有减少的稳定性并且会尽可能快地耗尽。此外,在现代的分析设备中,常常为试剂储存器仅设置冷却的保存位置,从而甚至不能够设置未冷却的试剂。应用增强信号的附加试剂同样是不期望的,一方面出于经济原因,并且另一方面,因为由于附加要求的移液步骤而延长了测试的处理。此外,所形成的血块特别是在血浆纤维蛋白原水平较低的情况下呈球状并且作为“纤维蛋白陶土球”在反应混合物中四处飘散。
此外的问题在于,在Clauss测试中确定样本的凝血时间时理想地应当在将凝血酶添加给样本之后立即开始测量。然而实际上,在分析设备上自动化地执行时,在将凝血酶试剂添加到反应容器中与反应容器沉淀到测量位置之间经过了短时间间隔(几秒钟)。然而,在血浆纤维蛋白原水平的非常高的情况中,能够在这短时间中已经开始反应并且因此出现信号上升。在该情况下,惯例地确定凝血时间是困难的,因为对于“可辨认的纤维蛋白形成”来说(不仅关于测试和设备专用的阙值或可替换地关于与凝血反应的开始和结束相关的百分比的信号差)都必须已知初始值。
技术实现要素:
因此,本发明的目的在于,修改用于确定人体血浆样本中的纤维蛋白原浓度的Clauss方法,从而能以高精度执行自动处理,并且能够放弃应用增强信号的附加试剂、例如陶土。
该目的由此实现,即不再确定样本的迄今为止常用的凝血时间,而是测量纤维蛋白形成的反应动力学并且为了确定纤维蛋白原浓度而应用反应速度。
因此,本发明的内容为用于根据Clauss方法确定人体血浆样本中的纤维蛋白原浓度的方法,该方法包括步骤:
提供包含血浆样本和凝血酶的反应混合物,
测量反应混合物关于时间的吸光值,
由所测量的吸光值关于时间建立反应曲线,
借助于回归法测定最大吸光变化,并且
借助于校准曲线确定纤维蛋白原浓度,该校准曲线由已知的纤维蛋白原浓度与最大吸光变化的对应关系来建立。
对于专业人员来说,充分已知了血浆样本和凝血酶单元的混合比例,即相对较低的纤维蛋白原浓度(来自于样本)与相对较高的凝血酶浓度的组合,其用于根据Clauss方法提供反应混合物从而使纤维蛋白形成速度实际上仅与纤维蛋白原浓度相关(参见Thomas,L.,实验和诊断,第7版,TH-Books出版社有限公司,法兰克福,2008年,16.15.2章)。
优选地,反应混合物对此包含大约0.03至0.4mg/mL的纤维蛋白原和大约25至40IU/mL的凝血酶。这些浓度例如能够由此得到,即将缓冲器中的大约1:10地稀释的要试验的血浆样本与凝血酶浓度大约100IU/mL的、已缓冲的凝血酶试剂以2+1的比例混合。因此,能够确定大约0.5g/L至6.0g/L的纤维蛋白原浓度。通过改变样本的预稀释能够测量人体血浆中纤维蛋白原的总体生理学出现范围。
反应混合物关于时间的吸光值的测量能够光度地、即通过测量穿过反应混合物发出的光射线的光衰减,或者浊度地、即通过测量穿过反应混合物发出的光射线的散射光分量来实现。理想地,在将凝血酶添加给样本之后立即开始测量,并且连续地执行吸光值测量直到纤维蛋白形成结束。然而实际上,在分析设备上自动化地执行时,在将凝血酶试剂添加到具有随后的混合物的反应容器中与反应容器沉淀到测量位置之间经过了较短的时间间隔(几秒钟)。
已发现,根据本发明的方法特别适用于以下的测试记录,在其中例如因为反应混合物首先必须传输到测量站中而不能够立即测量吸光值。在特殊的实施方式中,其中反应混合物的提供包括将凝血酶添加给血浆样本,在将凝血酶添加给血浆样本的时间点与开始测量反应混合物的吸光值之间存在0.5至5秒、优选3至4秒的时间间隔。
用于确定最大吸光变化的回归法是动力学的评估方法,其对于专业人员来说是已知的,并且在其中,根据在第一评估步骤中粗略地测定的反应曲线的斜率,在第二评估步骤中确定用于计算最大反应速度、即最大吸光变化的单个的且优化的回归区间。
优选地,回归法包括以下步骤:
第一步骤,在其中利用预先规定的第一回归区间确定反应曲线中的第一初步最大吸光变化,
第二步骤,在其中根据确定的第一初步最大吸光变化并且根据预先规定的参数确定第二回归区间,和
第三步骤,在其中利用第二回归区间确定最大吸光变化。
因此优选地,首先在测试和设备专用的限定的评估范围中从第一测量值(其尽可能靠近凝血酶添加的时间点)开始经由测试和设备专用的回归区间根据最小二乘法为每次回归计算斜率(=反应速度或者吸光变化)。通过将第二、第三、第四等等测量值用作为回归区间的起点,多次重复该计算。
因此测定的最大斜率(粗略斜率)用于经由具有预先规定的经验参数、因数和指数的幂函数计算最终的回归区间。经由负指数得到所期望的作用,即回归区间随着斜率递增变短。然而原则上,也能够经由其它的方程式实现最终回归区间的计算或者由存储在软件中的表格所获得。
利用所计算的最终回归区间,再次从第一测量值开始,为每次回归根据最小二乘法如上所述地测定最终最大斜率。通过将第二、第三、第四等等测量值用作为回归区间的起点,多次重复该计算。
已发现,即使当在反应动力学中存在干扰、例如反应混合物中存在气泡时(该干扰与实际测量信号叠加并且因此包含“错误”的最大斜率),应用用于测定Clauss测试反应动力学的最大斜率的二阶回归法不仅能够在高纤维蛋白原浓度的样本中,也能够在低纤维蛋白原浓度的样本中精确地确定纤维蛋白浓度。
现在,借助于校准曲线确定样本的纤维蛋白原浓度,该校准曲线由已知的纤维蛋白原浓度与最大斜率(最大吸光变化)的对应关系来建立。
本发明的另外的内容是自动分析设备,具有至少一个移液装置、光度或浊度测量站和数据处理单元,其特征在于,分析设备还包括控制装置,其配置用于控制根据Clauss方法确定纤维蛋白原浓度的方法,该方法具有步骤:
提供包含血浆样本和凝血酶的反应混合物,
测量反应混合物关于时间的吸光值,
由所测量的吸光值关于时间建立反应曲线,
借助于回归法测定最大吸光变化,并且
借助于校准曲线确定纤维蛋白原浓度,该校准曲线由已知的纤维蛋白原浓度与最大吸光变化的对应关系来建立。
这样的自动分析设备常规地应用在分析学、司法学、微生物学和临床诊断学中,以便快速、准确和可重现地在多个化验方法中分析多个样本。
具有配置用于与上述动力学评估系统相组合以控制Clauss测试的执行的控制装置的、根据本发明的分析设备的优点在于,能够实现精确的纤维蛋白原确定,其中,不必为用于提供反应混合物的试剂、特别是为凝血酶试剂设置未冷却的保存位置。
自动分析设备中提供包含血浆样本和凝血酶的反应混合物通常借助于一个或多个自动移液装置执行。
测量反应混合物关于时间的吸光值通常在光度或浊度的测量站中实现。
“光度测量站”理解为以下测量单元,其具有至少一个光源和至少一个光探测器并且设计为,其能够实现样本中的特定波长的光的吸收率的测量。通常这样选择由光源发射的光的波长,即其由样本中要检测的物质、在此为纤维蛋白所衰减(吸收、反射或散射)。
“浊度测量站”理解为这样的测量单元,其具有至少一个光源和至少一个光探测器并且设计为,其能够实现样本中的光的吸收的测量。通常这样选择光源和光探测器的布置,即能测量散射光,其由样本中要检测的物质、例如由在反应混合物中用于取决于分析反应所产生的颗粒集合或者在此由纤维蛋白所散射。
为了借助于校准曲线确定纤维蛋白原浓度,优选地在数据处理单元中存储已知的纤维蛋白原浓度和最大吸光变化的相应的对应关系。此时,在数据处理单元中,也通过读取与反应混合物的所测定的最大吸光变化相对应的纤维蛋白原浓度实现纤维蛋白原浓度的测定。
根据本发明的自动分析设备的一个实施方式还包括用于反应容器的、设置用于提供反应混合物的第一容纳位置和用于反应容器的、对应于测量站的第二容纳位置,和用于将反应容器从第一容纳位置运输到第二容纳位置的装置,其中,控制装置还配置用于控制以下步骤:
在用于反应容器的第一容纳位置中,通过将凝血酶添加给位于反应容器中的血浆样本提供包含反应混合物的反应容器,
将反应容器从第一容纳位置运输到第二容纳位置,并且随后
测量反应混合物关于时间的吸光值,
其中,在将凝血酶添加给血浆样本的时间点与开始测量反应混合物的吸光值之间存在0.5至5秒、优选3至4秒的时间间隔。
优选地,反应容器是由塑料或玻璃制成的透明的小管状的比色皿。
用于反应容器的“容纳位置”指的是以下地点,其设置用于放置反应容器。在此常常涉及构造上匹配的容纳装置,其能够实现液体容器、例如套管的稳定的保存,特殊设计的反应容器能够形状配合地插入到套管中。容纳位置常常在能运动的容纳装置、例如能转动的比色皿盘或环上,其具有多个容纳位置。对应于测量站的容纳位置设计和布置为,在其中能够对位于反应容器中的反应混合物进行测量。
为了在空间分离的容纳装置上的两个容纳位置之间运输反应容器,常常设置夹钳,其紧固在能水平和垂直运动的转臂上,例如在移液装置已经访问的并且其中能够提供和温育反应混合物的第一容纳位置与反应混合物进行测量的第二容纳位置之间,。
附图说明
接下来根据附图阐述本发明。
在此示出
图1是根据本发明的自动分析设备;
图2是根据Clauss的纤维蛋白原方法中的具有高纤维蛋白原浓度的血浆样本的反应动力学;
图3是根据Clauss的纤维蛋白原方法中的具有低纤维蛋白原浓度的血浆样本的反应动力学;
图4是根据Clauss的纤维蛋白原方法的根据本发明的校准曲线;
图5和6是根据Clauss的纤维蛋白原方法的具有凝血时间的根据现有技术的校准曲线。
具体实施方式
图1示意地示出具有几个包含在其中的部件的自动分析设备10。在此,仅非常简化地示出了最重要的部件,以便阐述自动分析设备10的基本功能,而不在此详细示出每个部件的单个部分。
自动分析设备10设计用于,全自动地执行血液或其它体液的不同分析,而对此不需要使用者的活动。确切地说,使用者的必要干涉限制在维护或修理和再填充工作上,当例如必须再填充比色皿或替换液体容器时。
病人样本以初级样本容器在未详细示出的滑板上经由输送轨道20输送给自动分析设备10。有关每个样本要执行的分析的信息例如能够借助于装在样本容器上的条形码递交,其在自动分析设备10中读取。从样本容器中借助于第一移液装置21借助于移液针取出样本等分量。
样本等分量同样输送给未详细示出的比色皿,其布置在能转动的加温到37℃的温育装置23的容纳位置22中。从比色皿存储器24中取出比色皿。在冷却到大约8-10℃的试剂容器存储器25中保存具有各种试剂液体、例如凝血酶试剂液体的试剂容器26。试剂液体借助于第二移液装置27的移液针从试剂容器26中所取出,并且为了提供反应混合物而传到已经包含了样本等分量、例如血浆样本的比色皿中。具有反应混合物的比色皿由具有夹紧钳29的转臂28从温育装置23的容纳位置22中取出,并且为了充分混合反应混合物而传输至振动装置31。在混合过程结束之后将比色皿继续传输到用于光度测量站30的能转动的容纳装置33的容纳位置32中,在那里测量反应混合物的吸光。
整个过程由中央的控制单元40、例如经由数据线路连接的计算器来控制,通过多个另外的未详细示出的电路和在自动分析设备10内部的微处理器和其部件得到支持。
接下来的实例作用于阐述本发明,但不局限于此。
实例
根据Clauss执行纤维蛋白原方法
在Owren’s Veronal缓冲器中以大约1g/L至大约5g/L的纤维蛋白原浓度范围建立人体血浆样本的1:12.5稀释。该稀释的样本的100μL在+37℃中温热,并且添加50μL温热的凝血酶试剂(大约100IU/mL)。反应混合物被混合,并且利用波长405nm的光经过大约80秒的时间段光度地测量吸光。在自动分析设备中执行提供混合物以及测量吸光。
反应动力学的根据本发明的评估
根据本发明,通过借助于回归法测定反应动力学的最大吸光变化,实现反应动力学、即关于时间所测量的吸光值的评估。
以同样的方式建立具有已知的纤维蛋白原浓度的血浆样本与所属的根据本发明测定的最大吸光变化的校准曲线。
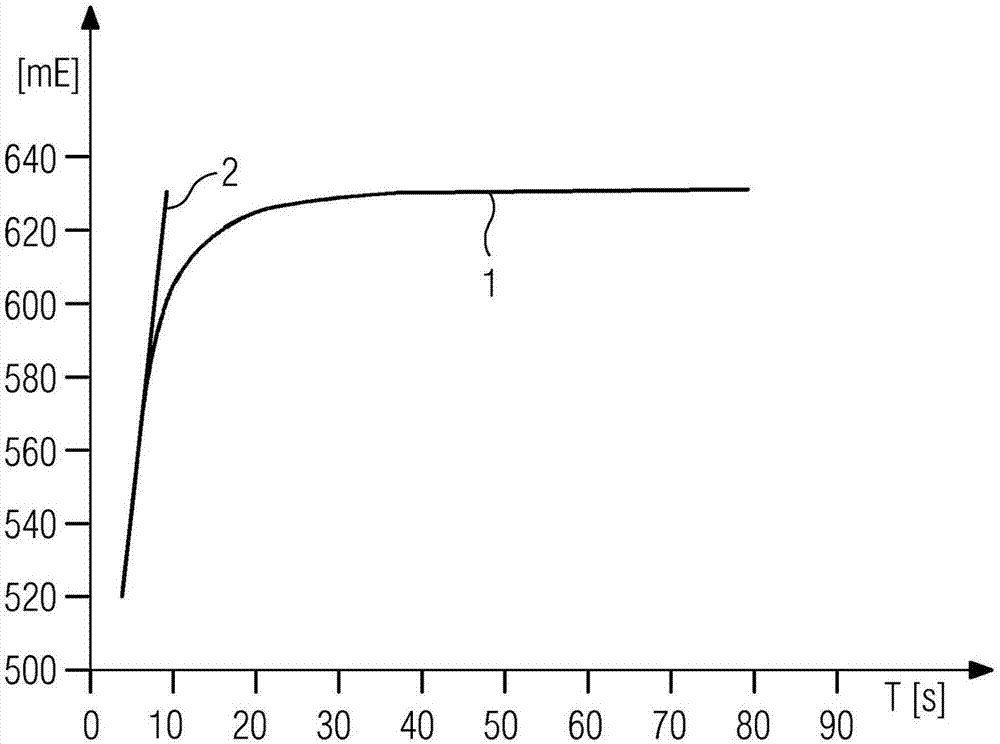
图2示出了具有高纤维蛋白原浓度(大约5g/L)的血浆样本的吸光测量值(mE)的时间变化曲线,即反应动力学(1)。在将反应容器插入到测量通道中(添加试剂之后大约3-4秒)时已经开始反应、即纤维蛋白形成。在此,借助于信号差值法常规地确定凝血时间已经不再能准确地执行,因为初始信号是未知的。根据本发明借助于匹配的回归区间确定最大反应速度是在此所选择的方法。匹配的回归区间在此非常短(2秒)。直线(2)是最大反应速度的直线(吸光变化)。
图3示出了具有低纤维蛋白原浓度(大约1g/L)的血浆样本的吸光测量值(mE)的时间曲线,即反应动力学(1)。在此,纤维蛋白原到纤维蛋白的转换表现得非常缓慢并且部分地没有清楚体现的平稳结束。在该情况下所选择的方法同样是确定反应速度。匹配的回归区间在此是延长的(9秒)。直线(2)是最大反应速度的直线(吸光变化)。
图4示出了用于根据本发明确定纤维蛋白原浓度的校准曲线。利用根据本发明的方法分析具有在0.5和6.0g/L之间的已知纤维蛋白原浓度的10个血浆样本,并且分别确定最大吸光变化[mE/s]。在所有的区间中,在插值点之间都有良好分布。通过改变样本稀释度、例如纤维蛋白原浓度小于1.0g/L的样本的1:4.2的稀释或纤维蛋白原浓度多于6.0g/L的的样本的1:25的稀释,能测量的纤维蛋白原浓度能够相应地扩展。
作为比较,图5和6示出了根据Clauss利用关于阙值(图5)或关于百分比信号差(图6)的凝血时间的评估的、迄今为止常规的纤维蛋白原确定方法的校准曲线。在两种情况下,校准曲线的变化曲线在大约4g/L之上已经是平坦的,即实际上不再能够实现原始值的有效评估。因此,纤维蛋白原浓度多于4g/L的样本必须已经强烈地稀释并且再次被测量。此外,极度平坦的原因在于在第一测量值采集的时间点已经开始反应。
此外,利用阙值法确定的凝血时间的评估在0.5g/L浓度时不再可行,因为信号无法到达最小阙值。以减少阙值作为可能的解决方案由于在反应曲线中的叠加(例如由于气泡)而带来了错误评估的风险。
附图标记列表
1 反应动力学
2 直线
10 分析设备
20 输送轨道
21 移液装置
22 容纳位置
23 温育装置
24 比色皿存储器
25 试剂容器存储器
26 试剂容器
27 移液装置
28 转臂
29 夹紧钳
30 测量站
31 振动装置
32 容纳位置
33 容纳装置
40 控制单元。
- 还没有人留言评论。精彩留言会获得点赞!