基于免疫磁珠和荧光量子点的纳米生物传感器快速检测肉鸡中恩诺沙星的方法与流程
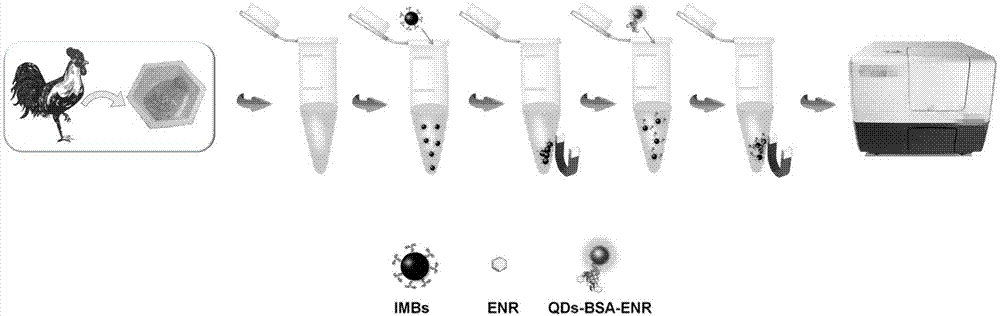
本发明涉及一种基于免疫磁珠(imbs)和荧光量子点(qds)的纳米生物传感器快速检测肉鸡中恩诺沙星的方法。
背景技术:
恩诺沙星(enrofloxacin,enr),又称乙基环丙沙星,是一种氟喹诺酮类抗生素,能通过抑制dna旋转酶的活性达到杀菌的作用,具有抗菌范围广、抗菌活性大、组织穿透力强等特点,被广泛应用于水产、畜禽动物的疾病治疗。但是该药物会对人体造成潜在的毒副作用,而且大量使用会诱发细菌耐药性,间接危害人类健康。因此欧盟、日本及我国均对恩诺沙星在动物源食品中的最大残留限量(mrls)做了明确规定。我国规定恩诺沙星和环丙沙星的总量在牛、猪、家禽的肌肉组织中的最高限量为100μgkg-1。因此实现动物源食品中恩诺沙星的快速、灵敏检测显得尤为重要。
样品前处理是影响检测效果的重要过程之一。以固相萃取柱萃取和有机试剂提取等传统的样品前处理方法能够有效减少基质效应,但是操作复杂,而且耗时、耗力,因此不适用于现场快速检测。5-磺基水杨酸能够有效去除样品中的蛋白质,减少样品基质的干扰,而且酸性的环境有利于恩诺沙星的提取,因此有望应用于鸡肉样品的前处理过程中。
在恩诺沙星的检测领域,高效液相色谱法(hplc)是目前检测恩诺沙星的主流方法,其灵敏度高、精确度好,但是需要复杂的样品前处理过程,而且检测时间长、检测费用高,因此不适用于现场快速检测。酶联免疫吸附法(elisa)可以较大地简化分析过程,特异性较高,而且相对快捷,但是稳定性较差。
技术实现要素:
本发明的目的在于针对现有技术的不足,探索出了针对肉鸡中恩诺沙星检测的一种基于免疫磁珠和荧光量子点的纳米生物传感器方法和鸡肉样品前处理方法,该发明方法灵敏、快速、特异性好,而且操作简单,易于实现便携化,不需要复杂的样品前处理过程,具备现场快速检测恩诺沙星的潜力,有望成为一种现场快速检测手段,具有良好的发展前景。
本发明主要步骤为:样品中的恩诺沙星首先被免疫磁珠(imbs)捕获并且占据imbs表面的部分结合位点;经磁分离和洗涤后,加入作为竞争物的量子点-牛血清白蛋白-恩诺沙星(qds-bsa-enr)复合物与imbs表面的剩余位点结合;最终通过检测免疫磁珠-恩诺沙星-牛血清白蛋白-量子点(imbs-enr-bsa-qds)复合物的荧光信号实现对恩诺沙星的定量检测。
本发明采用的技术方案是方法包括以下步骤:
1)在羧基化磁珠表面修饰恩诺沙星单克隆抗体,用牛血清白蛋白封闭,制备含牛血清白蛋白封闭的、恩诺沙星单克隆抗体修饰的免疫磁珠(imbs)溶液;
2)将恩诺沙星(enr)与牛血清白蛋白(bsa)偶联,制备恩诺沙星-牛血清白蛋白(bsa-enr)复合物;
3)将步骤2)中得到的bsa-enr复合物与羧基化量子点(qds-cooh)偶联,制备量子点-牛血清白蛋白-恩诺沙星(qds-bsa-enr)复合物;
4)处理鸡肉组织样品,获得鸡肉样品提取液,具体如下:
4.1)称取1-5g切碎的鸡肉样品于均质袋中;
4.2)向步骤4.1)所述含鸡肉样品的均质袋中加入质量浓度为1-5%的5-磺基水杨酸,于拍打式均质机中均质,得到含鸡肉组织的混合液;
4.3)将上述步骤4.2)得到的含鸡肉组织的混合液在常温下3,000rpm以上离心5-10min,得到上清液;
4.4)将上述步骤4.3)得到的上清液用孔径0.22-0.45μm的微孔滤膜过滤,得到鸡肉组织的提取液;
4.5)将上述步骤4.4)得到的鸡肉组织的提取液用naoh溶液调整至ph5-7.4,4℃下保存备用;
5)定量检测步骤4)所述提取液中恩诺沙星的浓度,具体如下:
5.1)建立恩诺沙星浓度与荧光值之间的标准曲线模型;
5.1.1)在ph5-8的磷酸盐缓冲液中配制一系列已知浓度10-2-105ngml-1的恩诺沙星溶液;
5.1.2)将步骤1)所述的含牛血清白蛋白封闭的、恩诺沙星单克隆抗体修饰的免疫磁珠溶液与上述步骤5.1.1)所述的含不同恩诺沙星浓度的溶液混合,置于旋转混匀仪上反应,反应后的混合液用ph5-8的磷酸盐缓冲液重复清洗3次,再分散于磷酸盐缓冲液中,获得表面修饰恩诺沙星的免疫磁珠(imbs-enr)和未修饰恩诺沙星的磁珠(imbs-nonenr)构成的混合溶液;
5.1.3)取步骤5.1.2)获得的混合液,加入步骤3)的含牛血清白蛋白封闭的qds-bsa-enr复合物的分散液,置于旋转混匀仪上反应,反应后用ph7.4的磷酸盐缓冲液重复清洗3次,再分散于磷酸盐缓冲液中,检测特定波长的荧光信号强度;
5.1.4)将上述步骤5.1.3)所得的荧光信号强度与各自对应的恩诺沙星已知不同浓度通过拟合建立标准曲线模型;
5.2)利用标准曲线模型检测待测鸡肉样品的恩诺沙星浓度。
本发明一方面制备imbs和qds-bsa-enr复合物,另一方面处理鸡肉样品,然后将两者结合利用imbs和qds-bsa-enr复合物来定量检测鸡肉组织中的恩诺沙星。
所述步骤1)制备过程具体如下:
1.1)配制1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺磺酸钠盐(nhss)的混合溶液;
1.2)将羧基化磁珠分散在ph6.0的2-(n-吗啡啉)乙磺酸(mes)缓冲液中,用mes缓冲液重复洗涤3次,重悬于步骤1.1)的混合液中,常温下旋转混匀反应30min,得到活化的磁珠溶液;
将活化的磁珠溶液用ph7.4-8.5的硼酸盐缓冲液重复清洗3次,然后分散在硼酸盐缓冲液中,获得含有活化磁珠的硼酸盐缓冲分散液;
1.3)将含有活化磁珠的硼酸盐缓冲分散液与恩诺沙星单克隆抗体溶液混合,于常温下震荡反应2.5h,得到含恩诺沙星单克隆抗体修饰的免疫磁珠的硼酸盐缓冲分散液;
1.4)向步骤1.3)得到的硼酸盐缓冲分散液中加入质量浓度为2%的含牛血清白蛋白溶液,常温震荡反应1h,用ph7.4的磷酸盐缓冲液重复洗涤3次,然后分散在磷酸盐缓冲液中,获得磷酸盐分散液,即为含牛血清白蛋白封闭的、恩诺沙星单克隆抗体修饰的免疫磁珠溶液,4℃下保存备用。
所述步骤1.1)所述混合溶液为含edc和nhss的mes缓冲液,ph6.0,edc和nhss的浓度分别为10mm和15mm。
所述步骤1.2)所述羧基化磁珠的表面羧基含量为2.7mmolg-1,粒径为130-170nm,浓度为10mgml-1。
所述步骤1.3)所述的恩诺沙星单克隆抗体为鼠源,igg2b,蛋白g纯化,纯度大于95%,浓度为1mgml-1,单克隆抗体的用量为0.02-0.1mg每毫克磁珠。
本发明在所述步骤1.1)-1.4)中的各个缓冲液均特殊地添加有质量分数为0.01%的吐温-20溶液,能够有效防止磁珠在修饰的过程中粘在管壁上。
所述步骤2)制备过程具体如下:
2.1)恩诺沙星、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺磺酸钠盐(nhss)溶于n,n-二甲基甲酰胺(dmf)中,恩诺沙星、nhss和edc的质量比为2:1:1.25,常温下震荡反应过夜,制成a液;
2.2)牛血清白蛋白溶于ph7.4的磷酸盐缓冲液中制成b液,2.5mg牛血清白蛋白每毫克恩诺沙星;
2.3)将上述步骤2.1)的a液逐滴加入上述步骤2.2)的b液中,边加边搅拌,接着在常温下搅拌3h,然后将混合物装入透析袋,在4℃下透析3天,每天换3次透析液,离心取上清液,获得含bsa-enr复合物的分散液,分散液中牛血清白蛋白浓度为1mgml-1。
所述步骤2.1)中恩诺沙星、nhss和edc的质量比为2:1:1.25。
所述步骤2.3)中透析袋的截留分子量为8,000-14,000d,离心条件为3,000rpm以上,离心时间为5-10min。
所述步骤3)制备过程具体如下:
3.1)配制1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺磺酸钠盐(nhss)的混合溶液;
3.2)将羧基化量子点(qds)分散在上述步骤3.1)获得的混合溶液中,常温下震荡反应40min,得到活化的量子点溶液;
将活化的量子点溶液用ph7.4-8.5的硼酸盐缓冲液重复清洗、离心超滤3次,然后分散在硼酸盐缓冲液中,获得含有活化量子点的硼酸盐缓冲分散液;
3.3)将含有活化量子点的硼酸盐缓冲分散液与步骤2)的含bsa-enr复合物的分散液混合,于常温下震荡反应2.5h,得到含qds-bsa-enr复合物的硼酸盐缓冲分散液;
3.4)向步骤3.3)的含qds-bsa-enr复合物的硼酸盐缓冲分散液中加入质量浓度为2%的含牛血清白蛋白溶液,常温震荡反应1h,用ph7.4的磷酸盐缓冲液重复洗涤、离心超滤3次,然后分散在磷酸盐缓冲液中,获得含牛血清白蛋白封闭的qds-bsa-enr复合物的分散液,4℃下保存备用。
步骤3.1)所述混合溶液为含edc和nhss的mes缓冲液,ph6.0,edc和nhss的浓度分别为10mm和15mm。
所述步骤3.2)中羧基化量子点为水溶性cdse/zns核壳结构的量子点,最大发射波长位于610-625nm之间,浓度为8μm;超滤膜的截留分子量为50kd,离心条件为8,000rpm以上,离心时间为10min以上。
所述步骤3.3)中,含有活化量子点的硼酸盐缓冲分散液与含bsa-enr复合物的分散液之间的配比用量为0.5gbsa-enr每微摩尔量子点。
所述步骤3.4)中超滤膜的截留分子量为100kd,离心条件为8,000rpm,离心时间为10min以上。
所述步骤5.1.3)中的荧光信号强度通过以下方式检测:以300-450nm为激发波长激发,采集500-700nm范围内的荧光信号强度。
本发明在上述步骤5.1.1和5.1.2)的ph5-8的磷酸盐缓冲液中特殊地添加有含质量分数为0.05%的吐温-20溶液和质量分数为0.1%的牛血清白蛋白溶液,能够减小非目标物的非特异性吸附。
上述步骤5.1.2)中添加的含牛血清白蛋白封闭的、恩诺沙星单克隆抗体修饰的的免疫磁珠溶液的浓度为1mgml-1(以磁珠的浓度计),用量为2-25μl,反应时间不少于10min。
上述步骤5.1.3)中添加的含牛血清白蛋白封闭的qds-bsa-enr的磷酸盐缓冲分散液的浓度为0.2μm(以量子点的浓度计),用量为0.5-10μl,反应时间不少于30min。
本发明在上述步骤5.1.3)的ph7.4的磷酸盐缓冲液中特殊地添加有含质量分数为0.1%的吐温-20溶液,能够减小非特异性吸附,同时防止反应过程中imbs粘在管壁上。
所述步骤5.2)具体如下:对待测的鸡肉样品按步骤4)处理后得到鸡肉提取液,然后按步骤5.1.2)-5.1.3)处理获得荧光信号值,与步骤5.1)获得的标准曲线模型对照,获得待测样品的恩诺沙星浓度。
本发明方法采用5-磺基水杨酸浸泡、均质、离心、滤膜过滤等步骤处理鸡肉组织样品,获取样品提取液并且减少样品基质对检测效果的影响。所构建的纳米生物传感器主要涉及恩诺沙星单克隆抗体修饰的imbs和牛血清白蛋白-恩诺沙星(bsa-enr)功能化的量子点,即qds-bsa-enr。
本发明方法结合免疫磁珠的高效分离效率和量子点的优良光学特性,构建了一种纳米生物传感器实现对恩诺沙星的快速、灵敏及特异性检测,并对鸡肉样品前处理方法进行了研究,简化操作步骤,并且减少基质效应对检测效果的影响。
本发明方法方便快捷,不需要复杂的仪器及有机试剂,而且有望与便携式荧光仪相结合,具有在家禽生产链现场快速检测肉鸡中恩诺沙星的潜力。
本发明的有益效果是:结合免疫磁珠的高效分离效率和量子点的优良光学特性,构建了一种纳米生物传感器实现对恩诺沙星的快速、灵敏检测。与现有hplc和elisa技术相比,本发明方法的主要优点在于:
(1)不需要复杂的样品前处理过程,操作简单,只需进行简单的5-磺基水杨酸浸泡、均质、离心和滤膜过滤即可完成样品前处理过程,有效缩短了整个检测分析时间,一般可以在1h左右完成检测;
(2)利用免疫磁珠作为分离富集工具,提高了检测灵敏度;
(3)以量子点为荧光信号报告分子,与传统的酶等生物分子相比,稳定性更高;
(4)整个检测过程简单、快速,不需要复杂的仪器以及有机试剂,而且有望与便携式荧光仪结合,具有在家禽生产链现场快速检测肉鸡中恩诺沙星的潜力。
附图说明
图1为本发明的原理图。
图2为imbs制备的验证图。
其中(a):为羧基化磁珠(mbs-cooh)(a)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺磺酸钠盐(nhss)活化的磁珠(mbs-edc/nhss)(b)和imbs(c)的傅里叶变换红外光谱图;
其中(b):为mbs-cooh、mbs-edc/nhss和imbs的zeta电位图。
图3为恩诺沙星(enr)、牛血清白蛋白(bsa)和bsa-enr复合物的紫外吸收光谱图。
图4为qds-bsa-enr制备的验证图;
其中(a):为羧基化量子点(qds-cooh)(a)、edc/nhss活化的量子点(qds-edc/nhss)(b)和qds-bsa-enr(c)的傅里叶变换红外光谱图;
其中(b):为qds-cooh、qds-edc/nhss和qds-bsa-enr的zeta电位图;
图5为生物传感器对恩诺沙星检测的标准曲线模型。
表1为本发明应用于11个浓度实施例的检测参数与性能。
表2为生物传感器在鸡肉样品检测中的加标回收率。
具体实施方式
以下结合附图及具体实施例对本发明做详细描述,但并不是限制本发明。
本发明的实施例如下:
实施例
1)制备恩诺沙星单克隆抗体修饰的imbs
1.1)配制400μl的10mm的edc和15mm的nhss的混合溶液;
1.2)将羧基化磁珠(购自美国大洋纳米科技有限公司)分散在ph6.0的2-(n-吗啡啉)乙磺酸(mes)缓冲液中,用mes缓冲液进行依次磁分离和去除洗涤上清液的处理步骤并重复3次,重悬于400μl的步骤1.1)所述的edc和nhss混合液中,常温下旋转混匀反应30min,得到活化的磁珠溶液;将活化的磁珠溶液用ph7.4的硼酸盐缓冲液进行依次磁分离和去除洗涤上清液的处理步骤并重复3次,然后分散在400μl的硼酸盐缓冲液中,获得含有活化磁珠的硼酸盐缓冲分散液;
1.3)将400μl含有0.1mg活化磁珠的硼酸盐缓冲分散液与4μl含有0.004mg恩诺沙星单克隆抗体(购自武汉华美生物工程有限公司)的溶液混合,于常温下震荡反应2.5h,得到恩诺沙星单克隆抗体修饰的imbs的硼酸盐缓冲分散液;
1.4)向步骤1.3)所述含恩诺沙星单克隆抗体修饰的imbs的硼酸盐缓冲分散液中加入400μl质量浓度为2%的含牛血清白蛋白溶液,常温震荡反应1h,用ph7.4的磷酸盐缓冲液进行依次磁分离和去除洗涤上清液的处理步骤并重复3次,然后分散在100μl磷酸盐缓冲液中,获得含牛血清白蛋白封闭的、恩诺沙星单克隆抗体修饰的imbs的磷酸盐分散液(imbs的终浓度为1mgml-1),4℃下保存备用。
图2为mbs-cooh,mbs-edc/nhss和imbs的傅里叶变换红外光谱图(a)和zeta电位(b)。由图(a)可知,mbs-cooh(a)、mbs-edc/nhss(b)和imbs(c)在1650cm-1及1530cm-1附近均出现较强的吸收峰,分别对应于酰胺ⅰ带和酰胺ⅱ带的吸收峰,三者均出现该吸收峰的原因是,根据厂家说明书,所购买的羧基化磁珠表面预先包被了牛血清白蛋白,而牛血清白蛋白中含有酰胺键。相比于mbs-cooh和mbs-edc/nhss,imbs在1516cm-1附近的吸收峰相对强度明显增强,这是由于在免疫磁珠制备过程中,磁珠表面的羧基与抗体氨基之间形成新的酰胺键以及抗体中也含有酰胺键。为进一步说明imbs的成功制备,分别对mbs-cooh,mbs-edc/nhss和imbs进行zeta电位表征。由图(b)可知,mbs-cooh的zeta电位为-39.1mv,这是由于磁珠表面带负电的coo-基团的存在;经edc/nhss活化之后,磁珠表面的负电荷被部分中和,zeta电位偏移至-27.5mv;偶联抗体后,zeta电位进一步偏移至-2.67mv,这是由于抗体在该条件下带正电,磁珠表面的负电荷被进一步中和,综合傅里叶变换红外光谱图和zeta电位可以说明imbs的成功制备。
2)bsa-enr的制备
2.1)将恩诺沙星、nhss和edc(恩诺沙星、nhss和edc的质量比为2:1:1.25)溶于1ml的n,n-二甲基甲酰胺(dmf)中,常温下震荡反应过夜,制成a液;
2.2)将牛血清白蛋白(2.5mg牛血清白蛋白每毫克恩诺沙星)溶于ph7.4的磷酸盐缓冲液中制成b液;
2.3)将上述步骤2.1)中的a液逐滴加入上述步骤2.2)的b液中,边加边搅拌,接着在常温下搅拌3h,然后将混合物装入透析袋(8,000-14,000d),在4℃下透析3天,每天换3次透析液,离心(3,000rpm,5min)取上清,获得含bsa-enr复合物的分散液(1mgml-1,以牛血清白蛋白的浓度计)。
图3为enr,bsa和bsa-enr的紫外吸收光谱图,enr的主要吸收峰位于271nm,322nm和334nm处,载体蛋白bsa在278nm处有最大吸收峰,而bsa-enr的吸收峰位于275nm,322nm和334nm处,bsa-enr兼具enr和bsa的紫外特征吸收峰,而且由于bsa与enr二者吸收峰的叠加效应,使bsa-enr出现的特征峰与enr和bsa纯品相比,有一定的位移,据此可以判定bsa-enr的成功合成。
3)qds-bsa-enr的制备
3.1)配制10mmedc和15mmnhss的混合溶液;
3.2)将羧基化量子点分散在200μl上述步骤3.1)的edc和nhss混合溶液中,常温下震荡反应40min,得到活化的量子点溶液;将活化的量子点溶液用ph7.4的硼酸盐缓冲液依次进行离心超滤和去除废液的步骤重复清洗3次,然后分散在160μl硼酸盐缓冲液中,获得含有活化量子点的硼酸盐缓冲分散液;
3.3)将160μl含有8×10-11mol活化量子点的硼酸盐缓冲分散液与40μl步骤2.3)所述的含0.04mg的bsa-enr复合物的分散液(0.5gbsa-enr复合物每微摩尔量子点)混合,于常温下震荡反应2.5h,得到含qds-bsa-enr的硼酸盐缓冲分散液;
3.4)向步骤3.3)所述含qds-bsa-enr的硼酸盐缓冲分散液中加入200μl质量浓度为2%的含牛血清白蛋白溶液,常温震荡反应1h,用ph7.4的磷酸盐缓冲液进行依次离心超滤和去除废液的处理步骤并重复3次,然后分散在400μl磷酸盐缓冲液中,获得含bsa封闭的qds-bsa-enr的磷酸盐缓冲分散液(qds-bsa-enr的终浓度为0.2μm,以量子点的浓度计),4℃下保存备用。
图4为qds-cooh,qds-edc/nhss和qds-bsa-enr的傅里叶变换红外光谱图(a)和zeta电位(b)。由图(a)可知,qds-cooh(a)在1704cm-1附近有明显的吸收峰,对应于qds-cooh表面的羧基中-c(=o)-的伸缩振动,经edc/nhss活化后,由于量子点表面羧基含量的下降,qds-edc/nhss(b)在1705cm-1附近的吸收峰相对强度发生明显减小;进一步偶联bsa-enr复合物后,qds-bsa-enr(c)在1651cm-1,1601cm-1和1493cm-1处出现新的吸收峰,其中1651cm-1处的吸收峰为量子点上的羧基与bsa-enr复合物上的氨基所形成的酰胺键中-c(=o)-的伸缩振动,1601cm-1及1493cm-1处的吸收峰则为偶联的bsa-enr复合物中苯环骨架的伸缩振动,由此可以说明bsa-enr成功偶联至量子点表面。由图(b)可知,qds-cooh的zeta电位为-37.6mv,这是由于量子点表面大量带负电的coo-基团的存在;经edc/nhss活化之后,量子点表面的负电荷被部分中和,zeta电位偏移至-30.0mv;偶联bsa-enr后,zeta电位进一步偏移至-27.4mv,综合傅里叶变换红外光谱图和zeta电位可以说明qds-bsa-enr复合物的成功制备。
4)鸡肉样品预处理
4.1)称取1g切碎的鸡肉样品于均质袋中;
4.2)向步骤4.1)所述含鸡肉样品的均质袋中加入2%的5-磺基水杨酸,于拍打式均质机中均质,得到含鸡肉组织的混合液;
4.3)将上述步骤4.2)得到的含鸡肉组织的混合液在常温下12,000rpm离心10min,得到上清液;
4.4)将上述步骤4.3)得到的上清液用孔径0.22μm的微孔滤膜过滤,得到鸡肉组织的提取液;
4.5)将上述步骤4.4)得到的鸡肉组织的提取液用naoh溶液调整至ph6,4℃下保存备用。
5)鸡肉样品中恩诺沙星的检测
5.1)建立恩诺沙星浓度与荧光值之间的标准曲线模型;
5.1.1)于ph6.0的磷酸盐缓冲液中配制一系列已知浓度(10-2-105ngml-1)的恩诺沙星溶液。
5.1.2)将20μl步骤1.4)所述的含0.02mg的牛血清白蛋白封闭的imbs的磷酸盐分散液与180μl上述步骤5.1.1)所述的含不同恩诺沙星浓度(10-2-105ngml-1)的溶液混合,置于旋转混匀仪上常温反应10min,反应后的混合液用ph6.0的磷酸盐缓冲液进行依次磁分离和去除洗涤上清液的处理步骤并重复3次,再分散于磷酸盐缓冲液中,获得表面修饰恩诺沙星的免疫磁珠(imbs-enr)和未修饰恩诺沙星的磁珠(imbs-nonenr)构成的混合溶液;
5.1.3)取步骤5.1.2)获得的混合液,加入4μl步骤3.4)所述的含8×10-11mol牛血清白蛋白封闭的qds-bsa-enr的磷酸盐缓冲分散液,置于旋转混匀仪上常温反应30min,反应后用ph7.4的磷酸盐缓冲液进行依次磁分离和去除洗涤上清液的处理步骤并重复3次,再分散于200μl磷酸盐缓冲液中,检测特定波长的荧光信号。荧光信号通过以下方式采集:以450nm为激发波长激发,采集614nm下的荧光信号强度;
5.1.4)将上述步骤5.1.3)所得的荧光信号强度与已知的样品中恩诺沙星的浓度通过拟合建立标准曲线;
实施例通过11个已知不同恩诺沙星浓度以及进行子实施例检测结果如表1所示:
表1
以恩诺沙星浓度的对数值为横坐标,614nm处的相对荧光强度为纵坐标建立关系曲线,可以得到该生物传感器的线性检测范围为1-100ngml-1,线性回归方程为:y=-941logx+2929(r2=0.976),检测限为0.94ngml-1(如图5),由此建立恩诺沙星浓度与荧光值之间的标准曲线模型。
5.2)具体实例测定鸡肉样品加标回收率
对待测的鸡肉样品按步骤4)处理后得到鸡肉提取液,向鸡肉提取液中添加已知浓度的恩诺沙星溶液(最终鸡肉提取液中恩诺沙星浓度分别为:5ngml-1,25ngml-1和100ngml-1),然后按步骤5.1.2)-5.1.3)处理获得荧光信号值,与步骤5.1)获得的标准曲线模型对照,获得待测鸡部位样品中的恩诺沙星浓度。
表2
本发明方法在鸡肉样品检测的回收率在93%-107%之间(回收率在100%的情况为最准确,本领域技术人员认为80%-120%之间为良好)。由此可说明本发明的基于免疫磁珠和荧光量子点的纳米生物传感器能够较好地应用于鸡肉样品中恩诺沙星的检测。
由上述两个实施例可见,本发明提出的针对肉鸡中恩诺沙星检测的一种基于免疫磁珠和荧光量子点的纳米生物传感器结合鸡肉样品前处理方法灵敏、快速、操作简单,不需要复杂的样品前处理过程,而且有望与便携式荧光仪结合,具备现场快速检测恩诺沙星的潜力,有望成为一种现场快速检测手段,具有良好的发展前景。
- 还没有人留言评论。精彩留言会获得点赞!