一种用于肾病检测的试剂盒、及其制备和使用方法与流程
本发明涉及生物
技术领域:
,尤其涉及一种用于肾病检测的试剂盒、及其制备和使用方法。
背景技术:
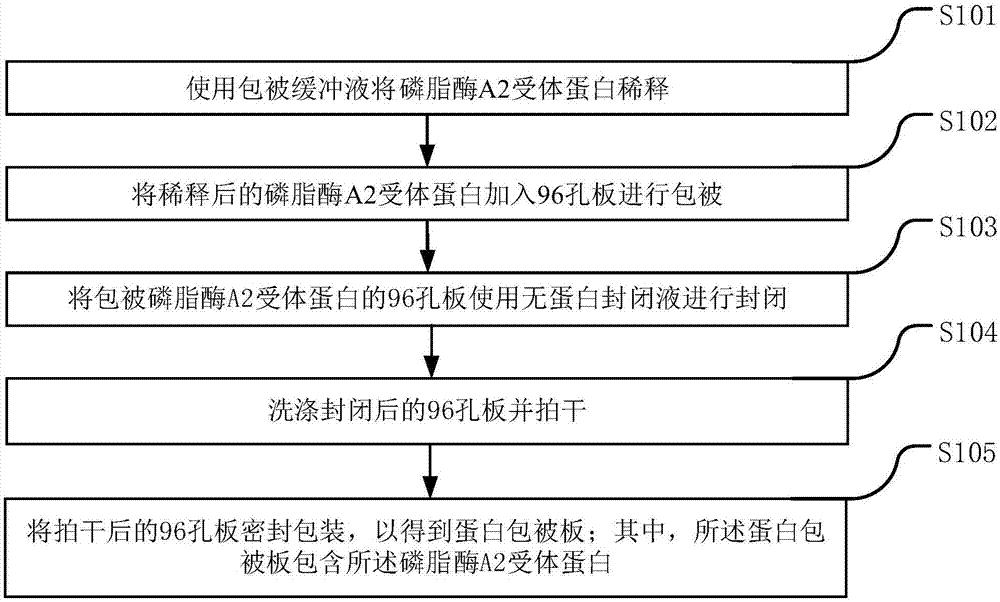
:膜性肾病(membranousnephropathy,mn)是成人肾病综合征(nephroticsyndrome,ns)最常见的病理类型,为我国原发性肾小球疾病的第二大病因,其中70%膜性肾病患者表现为持续反复的蛋白尿,从而导致肾脏损伤,甚至危及生命。膜性肾病可分为特发性膜性肾病(idiopathicmembranousnephropathy,imn)和继发性膜性肾病(secondarymembranousnephropathy,smn),其中imn患者约占70%~80%,smn患者约占20%~30%。其中75%~85%的imn患者有肾病程度的蛋白尿,约40%~60%的imn患者会在5~20年内发展为终末期肾衰竭。传统的imn临床诊断方法为肾脏穿刺进行肾组织病理学检查,包括光镜、荧光和电镜,这是一种侵入式的检测方法,不仅需要有较高的技术要求,还对患者有一定的损伤。目前已经证实pla2r受体,即磷脂酶a2受体,是自身抗体的主要靶抗原,研究发现75%的imn患者血清中抗pla2r受体抗体为阳性,而在继发性膜性肾病患者极少表现为阳性,其他类型肾小球疾病患者、健康人群均为阴性。因此,临床中迫切需要研制一种无创伤、低风险、操作方便、灵敏度高的pla2r定量检测方法。技术实现要素:本发明提供一种用于肾病检测的试剂盒、及其制备和使用方法,以解决pla2r自身抗体定量检测的问题。根据本发明第一方面,提供一种用于肾病检测的试剂盒,包括:蛋白包被板、酶标液、显色液、洗涤液、样本稀释液、终止液、阴性对照品、阳性对照品、以及至少两个与不同梯度对应的阳性校准品;其中,所述蛋白包被板设有磷脂酶a2受体蛋白。进一步,本发明所述的试剂盒,所述样本稀释液采用无蛋白封闭液;所述洗涤液采用磷酸盐吐温缓冲液;所述显色液采用四甲基联苯胺溶液;所述终止液采用浓度为0.25%至0.35%的硫酸溶液。进一步,本发明所述的试剂盒,所述磷脂酶a2受体蛋白通过如下步骤制备得到:根据pla2r胞外片段基因设计pcr引物,并且进行pcr扩增处理;将所述pla2r胞外片段基因转入质粒载体,以得到连接产物;对所述连接产物进行基因测序以验证克隆结果,并选取基因测序正确的所述连接产物;利用所述连接产物进行转染处理,以得到转染细胞;对所述转染细胞进行压力筛选处理;对所述转染细胞进行重组蛋白检测,并筛选出符合重组蛋白表达的所述转染细胞;对所述转染细胞进行细胞株单克隆化处理;对所述转染细胞进行重组蛋白检测,并筛选出符合重组蛋白表达的所述转染细胞;对所述转染细胞进行工程细胞大规模表达;利用所述转染细胞提取pla2r蛋白,并进行纯化处理。根据本发明的第二方面,提供一种用于肾病检测的试剂盒的制备方法,包括:使用包被缓冲液将磷脂酶a2受体蛋白稀释;将稀释后的磷脂酶a2受体蛋白加入96孔板进行包被;将包被磷脂酶a2受体蛋白的96孔板使用无蛋白封闭液进行封闭;洗涤封闭后的96孔板并拍干;将拍干后的96孔板密封包装,以得到蛋白包被板;其中,所述蛋白包被板包含所述磷脂酶a2受体蛋白。进一步,本发明所述的制备方法,还包括:制备阳性校准品;所述制备阳性校准品的步骤包括:使用蛋白稳定剂稀释阳性血清标本,以得到原始阳性标准品;对所述原始阳性标准品进行梯度稀释,得到与每个梯度相对应的所述阳性标准品。进一步,本发明所述的制备方法,还包括:根据至少两个与不同梯度对应的所述阳性标准品绘制校准曲线。进一步,本发明所述的制备方法,还包括:制备酶标液;所述制备酶标液的步骤包括:按照1:4900至1:5100的工作浓度稀释酶结合物;其中,所述酶结合物采用兔抗人或鼠抗人的免疫球蛋白偶联的辣根过氧化物酶。进一步,本发明所述的制备方法,还包括:制备阴性对照品和阳性对照品;其中,所述阴性对照品采用健康人标本血清制备,所述阳性对照品采用患者临床标本血清制备。根据本发明的第三方面,提供一种用于肾病检测的试剂盒的使用方法,所述使用方法适用于本发明所述的试剂盒;所述使用方法包括:使用样本稀释液稀释待测样本;将稀释后的所述待测样本加入蛋白包被板,并且将阴性对照品、阳性对照品、以及至少两个与不同梯度对应的阳性校准品分别加入所述蛋白包被板;其中,所述蛋白包被板包含磷脂酶a2受体蛋白;使用洗涤液洗涤所述蛋白包被板并拍干;在所述蛋白包被板加入酶标液;使用所述洗涤液洗涤所述蛋白包被板并拍干;使用显色液对所述蛋白包被板进行显色反应;使用终止液对所述蛋白包被板终止反应;读取所述蛋白包被板中每孔的od值,并根据所述阳性标准品的od值和校准曲线计算所述待业样本的磷脂酶a2受体蛋白抗体的浓度。进一步,本发明所述的使用方法,还包括:当磷脂酶a2受体蛋白抗体的浓度超过第一预设浓度值时,判断所述待测样本为阳性;其中,所述第一预设浓度值为19至21ru/ml。进一步,本发明所述的使用方法,还包括:当所述磷脂酶a2受体蛋白抗体的浓度超过第二预设浓度值时,对所述待测样本再次稀释后,重新进行磷脂酶a2受体蛋白抗体检测;其中,所述第二预设浓度值为115至125ru/ml。本发明提供的用于肾病检测的试剂盒、及其制备和使用方法,蛋白包被板包含pla2r受体,能够定量检测患者的pla2r抗体浓度,为后续的特发性膜性肾病诊断提供基于以pla2r抗体为中间品的判断依据,使用该试剂盒可避免目前临床中的侵入性肾病活体检测,具有无创伤、低风险、操作方便、灵敏度高的特点。附图说明通过阅读参照以下附图所作的对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:图1为本发明实施例一的用于肾病检测的试剂盒的制备方法的流程示意图;图2为本发明实施例的标准曲线示意图;图3为本发明实施例三的用于肾病检测的试剂盒的使用方法的流程示意图;图4为本发明实施例四的磷脂酶a2受体蛋白的制备方法的流程示意图。具体实施方式下面结合附图对本发明作进一步详细描述。实施例一图1为本发明实施例一的用于肾病检测的试剂盒的制备方法的流程示意图,如图1所示,本发明实施例一的用于肾病检测的试剂盒的制备方法包括:步骤s101,使用包被缓冲液将磷脂酶a2受体蛋白稀释。步骤s102,将稀释后的磷脂酶a2受体蛋白加入96孔板进行包被。其中,包被缓冲液采用ph9.6的0.05m碳酸盐缓冲液,磷脂酶a2受体指pla2r蛋白。利用包被缓冲液将pla2r蛋白稀释至1ug/ml,向96孔板的每孔加入100μl的pla2r蛋白稀释溶液,在4℃包被24小时。96孔板可采用corning公司产品。步骤s103,将包被磷脂酶a2受体蛋白的96孔板使用无蛋白封闭液进行封闭。其中,将无蛋白封闭液按照250ml/孔的标准加入已经包被pla2r的酶标板(96孔板),37℃放置2小时后弃液,在37℃放置2小时使干燥。无蛋白封闭液采用piercetmprotein-free(tbs)blockingbuffer(thermo公司生产)。步骤s104,洗涤封闭后的96孔板并拍干。其中,封闭结束后,将96孔板内的包被缓冲液吸掉后,在96孔板的每孔加入300μl的洗涤液,洗涤2次并拍干,每次2分钟。其中,洗涤液采用含0.1%吐温-20的pbs缓冲液(ph7.0),即pbst。其中,pbs缓冲液指磷酸缓冲盐溶液,pbst指磷酸盐吐温缓冲液。步骤s105,将拍干后的96孔板密封包装,以得到蛋白包被板;其中,所述蛋白包被板包含所述磷脂酶a2受体蛋白。其中,将96孔板密封包装后,4℃保存待用,从而得到用于本发明试剂盒的蛋白包被板。进一步,本发明所述的制备方法,还包括:制备阳性校准品。所述制备阳性校准品的步骤包括:使用蛋白稳定剂稀释阳性血清标本,以得到原始阳性标准品;对所述原始阳性标准品进行梯度稀释,得到与每个梯度相对应的所述阳性标准品。其中,蛋白稳定剂采用蛋白稳定剂ⅱ(湖州英创生物科技有限公司,货号pr-ss-002)或biostabantibodystabilizer(sigma公司,货号55514-250ml-f)。取临床上的阳性标本,经过鉴定未检测出传染源的样本,检测定量确定校准曲线的浓度点,相对浓度为720ru/ml。使用蛋白稳定剂对阳性血清标本(720ru/ml)作1:20稀释,4℃可保存12月以上,得到原始阳性标准品,为360ru/ml。对原始阳性标准品使用无蛋白封闭液(piercetmprotein-free(tbs)blockingbuffer)进行3倍梯度稀释,共稀释7个梯度,得到与7个梯度相对应的7个阳性校准品,将其分别编号为阳性校准品1-7号。例如,以原始阳性标准品作为阳性校准品1。吸取样品稀释液500ul入1.5ml离心管,吸取250ul阳性校准品1入该离心管,缓慢颠倒3-5次使充分混匀,即得到阳性校准品2,为120ru/ml。吸取样品稀释液500ul入1.5ml离心管,吸取250ul阳性校准品2入该离心管,缓慢颠倒3-5次使充分混匀,即得到阳性校准品3,为40ru/ml。吸取样品稀释液300ul入1.5ml离心管,吸取150ul阳性校准品3入该离心管,缓慢颠倒3-5次使充分混匀,即得到阳性校准品4,为13.3ru/ml。吸取样品稀释液500ul如1.5ml离心管,吸取250ul阳性校准品4入该离心管,缓慢颠倒3-5次使充分混匀,即得到阳性校准品5,为4.4ru/ml。吸取样品稀释液500ul入1.5ml离心管,吸取250ul阳性校准品5入该离心管,缓慢颠倒3-5次使充分混匀,即得到阳性校准品6,为1.5ru/ml。以此类推,可形成与n个梯度相对应的n个阳性标准品。进一步,本发明所述的制备方法,还包括:根据至少两个与不同梯度对应的所述阳性标准品绘制校准曲线。其中,图2为本发明实施例的标准曲线示意图,如图2所示,以阳性校准品的浓度值为横坐标,各浓度的阳性校准品的od值(opticaldensity,光密度)为纵坐标,绘制得到校准曲线,标准的校准曲线如图2所示。进一步,本发明所述的制备方法,还包括:制备酶标液;所述制备酶标液的步骤包括:按照1:4900至1:5100的工作浓度稀释酶结合物;其中,所述酶结合物采用兔抗人或鼠抗人的免疫球蛋白偶联的辣根过氧化物酶。其中,将hrp(辣根过氧化物酶)标记兔抗人或羊抗人igg(免疫球蛋白)抗体(millipore公司生产)经过预试验确定其工作浓度的比例为1:5000。用hrp偶联物稳定剂(hrp耦联物稳定/稀释剂ⅱ,湖州英创生物科技有限公司,货号hrp-sd-002;或,biostabperoxidaseconjugatestabilizer,sigma公司,货号18995-250ml-f)稀释hrp标记兔抗人igg抗体5000倍,12ml/管分装,4℃可保存12月以上。进一步,本发明所述的制备方法,还包括:制备阴性对照品和阳性对照品;其中,所述阴性对照品采用健康人标本血清制备,所述阳性对照品采用患者临床标本血清制备。其中,取健康人的标本血清,经验证检测pla2r为阴性,经过多支混合、灭活和过滤后,用蛋白稳定剂稀释100倍后分装为单独的小管,并保存在-80℃,作为阴性对照品备用。取临床标本血清,经验证检测pla2r为阳性,然后经过多支混合、灭活和过滤后,用蛋白稳定剂稀释100倍,分装为单独的小管,保存在-80℃,作为阳性对照品备用。实施例二本发明实施例二提供一种用于肾病检测的试剂盒,所述试剂盒采用本发明实施例一所述的试剂盒的制备方法制备得到。所述试剂盒包括:蛋白包被板、酶标液、显色液、洗涤液、样本稀释液、终止液、阴性对照品、阳性对照品、以及至少两个与不同梯度对应的阳性校准品。其中,所述蛋白包被板可包括:检测区域和对照区域。所述检测区域包含磷脂酶a2受体蛋白,对照区域用于分别加入阴性对照品、阳性对照品和阳性校准品。此外,也可以采用其他96孔板替代蛋白包被板的对照区域。例如,蛋白包被板仅设有磷脂酶a2受体蛋白的检测区域,而其他96孔板用于分别加入阴性对照品、阳性对照品和阳性校准品。也可以蛋白包被板包括检测区域和部分对照区域,剩余的对照区域用其他96孔板替代。其中,所述样本稀释液采用无蛋白封闭液,例如无蛋白封闭液(piercetmprotein-free(tbs)blockingbuffer)。所述洗涤液采用磷酸盐吐温缓冲液,例如含0.1%吐温-20的pbs缓冲液(ph7.0)。所述显色液采用四甲基联苯胺溶液,例如tmb(3,3",5,5"-四甲基联苯胺)。所述终止液采用浓度为0.25%至0.35%的硫酸溶液,例如浓度3%的硫酸溶液。此外,本发明实施例二的试剂盒还包括通过本发明实施例一的制备方法得到的阴性对照品、阳性对照品、以及至少两个与不同梯度对应的阳性校准品,例如编号为1-7的7个阳性校准品,并采用本发明实施例一的制备方法得到的校准曲线。实施例三本发明实施例三的用于肾病检测的试剂盒的使用方法适用于本发明实施例二所述的试剂盒。图3为本发明实施例三的用于肾病检测的试剂盒的使用方法的流程示意图,如图3所示,发明实施例三用于肾病检测的试剂盒的使用方法包括:步骤s301,使用样本稀释液稀释待测样本。例如,吸取495ul样品稀释液、5ul待测样本于0.5ml灭菌管子内,混合均匀后待用。步骤s302,将稀释后的所述待测样本加入蛋白包被板的检测区域,并且将阴性对照品、阳性对照品、以及至少两个与不同梯度对应的阳性校准品分别加入所述蛋白包被板的对照区域。其中,所述蛋白包被板包括:检测区域和对照区域;所述检测区域包含磷脂酶a2受体蛋白。取100μl稀释后的待测样品加入检测区域,并将本发明实施例一的制备方法得到的1-7号阳性标准品分别取100μl,并取本发明实施例一的制备方法得到的阴性对照品和阳性对照品各100μl,将阳性标准品、阴性对照品和阳性对照品分别加入对照区域,以每种上述样本3个复孔,在37℃室温反应1小时。步骤s303,使用洗涤液洗涤所述蛋白包被板并拍干。其中,将蛋白包被板内的液体吸掉,然后每孔加入300ul洗涤液,洗板2次,每次2分钟,再吸掉孔内的液体,拍干待用。洗涤液采用含0.1%吐温-20的pbs缓冲液(ph7.0)。步骤s304,在所述蛋白包被板的所述检测区域和对照区域加入酶标液。其中,在蛋白包被板的每孔加入100ul的酶标液,37℃温育30分钟。酶标液采用本发明实施例一的制备方法得到。步骤s305,使用所述洗涤液洗涤所述蛋白包被板并拍干。其中,将蛋白包被板内的液体吸掉,然后每孔加入300ul的pbst磷酸盐吐温缓冲液,洗板5次并拍干,每次1分钟。步骤s306,使用显色液对所述蛋白包被板进行显色反应。其中,在蛋白包被板的每孔加入显色液100μl,室温避光反应10分钟。显色液采用tmb(3,3",5,5"-四甲基联苯胺)。步骤s307,使用终止液对所述蛋白包被板终止反应。其中,在蛋白包被板的每孔加入终止液50μl,混匀。终止液采用浓度为3%的硫酸溶液。步骤s308,读取所述蛋白包被板的所述检测区域和所述对照区域中每孔的od值,并根据所述阳性标准品的od值和校准曲线计算所述待业样本的磷脂酶a2受体蛋白抗体的浓度。其中,在450nm波长下读取蛋白包被板的每孔的od值,依据阳性标准品的od值与浓度的标准曲线(根据本发明实施例一的制备方法得到),计算各个孔内待测样本中pla2r抗体的含量。进一步,本发明实施例三所述的使用方法,当磷脂酶a2受体蛋白抗体的浓度超过第一预设浓度值时,判断所述待测样本为阳性。其中,所述第一预设浓度值为19至21ru/ml。例如,第一预设浓度值为20ru/ml,当待测样本的pla2r抗体的相对浓度大于20ru/ml,判定为pla2r阳性;当待测样本的pla2r抗体的相对浓度小于20ru/ml时,判断为pla2r阴性。第一预设浓度值的具体数值根据临床实验测得。进一步,本发明实施例三所述的使用方法,还包括:当所述磷脂酶a2受体蛋白抗体的浓度超过第二预设浓度值时,对所述待测样本再次稀释后,重新进行磷脂酶a2受体蛋白抗体检测。其中,所述第二预设浓度值为115至125ru/ml。当待测样本中抗体浓度过高时会存在hook效应,故需要对产生hook效应的最低浓度进行摸索。对于产生hook效应的待测样本,应将该对待测样本稀释至线性范围内再检测,才能保证检测的准确性,所以需要对待测样本的稀释倍数进行评估,根据待测样本的稀释倍数可以推断出试剂盒的可报告范围的高限。具体地,用三批次试剂盒对上述所有高浓度稀释待测样本重复测定若干次,计算各指标的浓度的od值,当出现浓度升高od值反而下降时,确定该浓度为产生hook效应的最低浓度。根据实验结果发现:pla2r抗体浓度在120ru/ml时od值明显不成比例的上升,故试剂盒中pla2r抗体产生hook效应的浓度为≥120ru/ml。因此,设定第二预设浓度值为115至125ru/ml,以预防出现hook效应。对本发明的试剂盒进行临界值、精密性检测、准确性检测以及在临床样本的检测,以判定该试剂盒的性能指标。临界值的确定:通过检测150份正常人血清,pla2r抗体浓度平均值为8.1ru/ml,sd(标准差)为3.9ru/ml,用平均值加上3倍标准差之和作为临界值,得出临界值为19.8ru/ml,以此界定标准为20ru/ml,即得到第一预设浓度值的具体数值范围。精密性检测:选取高、中、低三个浓度的血清标本,在同次试验内每个样本重复检测10次,分别计算平均值(m)和标准差(sd),然后计算试验内的变异系数(cv)分别为8.6%、7.5%、6.5%;每天测定一次,连续检测10天,计算试验间的变异系数(cv)分别为9.7%、9.2%、8.4%。准确性检测:选择高低2个浓度水平的阳性血清样本,每个浓度水平重复检测3次,每个指标取3次检测结果的平均值记为(m),理论浓度记为(t),分别计算高浓度、低浓度的相对偏差(b)为8.5%、7.2%。与金标准的比较:选择通过组织病理学检验确诊的临床样本进行试验,评价试剂盒的特异性和敏感度。临床样本分为二组:第一组为44例特发性膜性肾病患者血清,第二组为50例正常人血清。特异性和敏感度的计算方式如下:特异性=真阴性/阴性总数×100%;敏感性=真阳性/阳性总数×100%使用本发明实施例的试剂盒根据本发明实施例的使用方法对临床样本进行检测,结果显示如下表所示,本试剂盒的特异性为100%,敏感性为88.64%。实施例四图4为本发明实施例四的磷脂酶a2受体蛋白的制备方法的流程示意图,如图4所示,本发明实施例四的磷脂酶a2受体蛋白的制备方法包括:步骤s401,根据pla2r胞外片段基因设计pcr引物,并且进行pcr扩增处理。其中,步骤s401中根据pla2r胞外片段基因设计pcr引物的步骤具体包括:设计所述pcr引物的pla2r胞外片段基因正向引物和pla2r胞外片段基因反向引物。其中,所述pla2r胞外片段基因正向引物设有第一限制性酶切位点fsel,所述pla2r胞外片段基因反向引物设有第二限制性酶切位点nhel。具体地,根据如下基因序列设计所述pla2r胞外片段基因正向引物:5’-cgtggccggccgccgccaccatgctgctg-3’。其中,所述第一限制性酶切位点fsel为:ggccggcc。并且,具体根据如下基因序列设计所述pla2r胞外片段基因反向引物:5’-taagctagctcatttgtcgtcatcatccttatagtccttatcatcgtcgtctttgtaatccttgtcatcgtcatccttgtagtcgctgccaccgccaccgctgtgacttggtcctttttctggc-3’。其中,所述第二限制性酶切位点nhel为:gctagc。其中,步骤s401中pcr扩增处理的步骤具体包括:利用pcr缓冲液、所述pla2r胞外片段基因正向引物、所述pla2r胞外片段基因反向引物和cdna模板配制pcr反应溶液进行pcr反应,以获取扩增的pcr产物。具体地,具体按照如下表1的体积比配制所述pcr反应溶液:试剂名称体积比pcr缓冲液49%~51%脱氧核糖核苷三磷酸化合物溶剂1%~3%pla2r胞外片段基因正向引物3%~5%pla2r胞外片段基因反向引物3%~5%cdna模板3%~5%dna聚合酶溶剂1%~3%双蒸水40%~28%表1并且,具体按照如下表2的条件进行所述pcr反应:表2。具体地,根据表1配制pcr反应溶液后,在94℃~96℃温度条件下预变性29秒~31秒,然后,94℃~96℃条件下变性14秒~16秒、57℃~59℃条件下退火14秒~16秒、70℃~74℃条件下延伸4分~5分,29~31个循环,然后,在70℃~74℃条件下维持9分~11分,使引物延伸完全,最后在2℃~6℃条件下停止pcr反应。优选地,按照如下表6的比例混合以进行所述pcr反应:表6其中,2×phantamaxbuffer缓冲液为pcr缓冲液,10mmdnptmix溶剂指脱氧核糖核苷三磷酸化合物溶剂,cdna模板指互补脱氧核糖核酸模板,phantamaxsuper-fidelitydnapolymerase为dna聚合酶溶剂,ddh2o指双蒸水。并且,根据如下表7的条件进行所述pcr反应;表7其中,在配制pcr反应溶液进行pcr反应之后,还包括:利用1%的琼脂糖凝胶检测所述pcr产物,查阅并按照dna分子量标准,将符合pla2r蛋白dna分子量标准的所述pcr产物进行回收和纯化处理。例如,利用天根切胶试剂盒回收并纯化pcr产物,提升pla2r蛋白的制备纯度。步骤s402,将所述pla2r胞外片段基因转入质粒载体,以得到连接产物。其中,步骤s402具体包括步骤s4021~步骤s4023。步骤s4021,利用所述第一限制性酶切点和所述第二限制性酶切点对质粒进行双酶切处理,以获取所述质粒载体。其中,第一限制性酶切点采用fsel:ggccggcc。第二限制性酶切位点采用nhel:gctagc。步骤s4021中具体按照如下表3的体积比混合以对质粒进行双酶切处理:试剂名称体积比限制性内切酶缓冲液9%~11%第一限制性酶切位点酶1%~3%第二限制性酶切位点酶1%~3%表达质粒1%~3%小牛肠碱性磷酸酶11%~13%双蒸水77%~67%表3其中,对质粒进行双酶切处理的条件为:36℃~38℃水浴1.4小时~1.6小时,使用生工pcr产物柱式纯化试剂盒回收所述质粒载体。优选地,按照如下表8的体积比混合以对质粒进行双酶切处理:表8对质粒进行双酶切处理的条件为:37℃水浴1.5小时,使用生工pcr产物柱式纯化试剂盒对酶切产物纯化并回收,以得到所述质粒载体。其中,10×cutsmartbuffer指限制性内切酶缓冲液,fsel酶指第一限制性酶切位点酶,nhel酶指第二限制性酶切位点酶,ucoemu-p质粒是一种商品化表达质粒名称,ciap指小牛肠碱性磷酸酶,ddh2o指双蒸水。步骤s4022,利用所述第一限制性酶切点和所述第二限制性酶切点对所述pcr产物进行双酶切处理,以获取所述pla2r胞外片段基因。其中,第一限制性酶切点采用fsel:ggccggcc。第二限制性酶切位点采用nhel:gctagc。步骤s4022中具体按照如下表4的体积比混合以对所述pcr产物进行双酶切处理:试剂名称体积比限制性内切酶缓冲液9%~11%第一限制性酶切位点酶1%~3%第二限制性酶切位点酶1%~3%pcr产物29%~31%双蒸水60%~52%表4其中,对所述pcr产物进行双酶切处理的条件为:36℃~38℃水浴2.4小时~2.6小时,使用pcr产物柱式纯化试剂盒回收所述pla2r胞外片段基因。优选地,按照如下表9的体积比混合以对所述pcr产物进行双酶切处理:表9其中,对所述pcr产物进行双酶切处理的条件为:37℃水浴2.5小时,使用pcr产物柱式纯化试剂盒对酶切产物纯化并回收,以得到pla2r胞外片段基因。步骤s4023,将所述pla2r胞外片段基因与所述质粒载体进行连接处理,以获取所述连接产物。步骤s4023中具体按照如下表5的体积比混合以进行所述连接处理:试剂名称体积比t4脱氧核糖核酸连接酶缓冲液24%~26%t4脱氧核糖核酸连接酶12%~13%pla2r胞外片段基因12%~13%质粒载体24%~26%双蒸水28%~22%表5其中,所述连接处理的条件为:24℃~26℃水浴4.4小时~4.6小时。优选地,按照如下表10的体积比混合以进行所述连接处理:表10所述连接处理的条件为:25℃水浴4.5小时,以得到连接产物。其中,10×t4dnaligasebuffer指t4脱氧核糖核酸连接酶缓冲液,t4dnaligase指t4脱氧核糖核酸连接酶,ucoemu-p是一种商品化表达质粒名称,ddh2o指双蒸水。步骤s403,对所述连接产物进行基因测序以验证克隆结果,并选取基因测序正确的所述连接产物。其中,可选用常规的基因测序手段对连接产物进行基因测序,选取符合pla2r胞外片段基因的连接产物。步骤s404,利用所述连接产物进行转染处理,以得到转染细胞。其中,步骤s404具体包括步骤s4041~步骤s4043。步骤s4041,培养种子细胞。其中,所述种子细胞采用仓鼠卵巢细胞(cho),培养所述种子细胞的密度至1.1e6/毫升以上。种子细胞需提前培养,例如,至少在转染前一天,提前约23~25小时,将种子细胞培养传代至密度为0.5e6/ml,这样在进行转染当天,种子细胞密度增长为1.2e6/ml并且细胞活力大于95%,以得到符合转染标准的密度和活力指标。步骤s4042,利用所述连接产物得到dna复合物。其步骤s3042具体包括:使用第一无血清培养基稀释所述连接产物得到经过稀释的连接产物;使用第二无血清培养基稀释转染试剂得到经过稀释的转染试剂;将所述经过稀释的连接产物与所述经过稀释的转染试剂混合,以得到所述dna复合物。例如,使用第一无血清培养基sfm(商品化无血清培养基)将50μg步骤s302得到的连接产物,即包含有pla2r胞外片段基因的质粒载体,稀释至750μl。同时使用第二无血清培养基sfm将150μg转染试剂pei(聚醚酰亚胺)稀释至750μl。将稀释后的连接产物和稀释后的转染试剂pei混合,并震荡混匀3次,每次1秒,在室温条件下静置20分钟,以得到包含pla2r胞外片段基因的dna复合物。步骤s4043,将所述dna复合物加入所述种子细胞进行转染,以得到所述转染细胞。其中,将所述dna复合物加入所述种子细胞进行转染,例如,将dna复合物逐滴加入经稀释得到的包含种子细胞的细胞液中,在37℃条件下过夜培养,细胞密度可以达到1.5/ml,能够得到符合后续实验的转染细胞。步骤s405,对所述转染细胞进行压力筛选处理。其中,步骤s405具体包括:步骤s4051~步骤s4052。步骤s4051,将所述转染细胞加入至含有抗生素的筛选培养基;步骤s4052,当所述转染细胞的存活率达到预设存活阈值以上时,对所述转染细胞进行恢复培养。例如,将转染细胞换液至含有20μg/mlpuro(嘌呤霉素)的筛选培养基,传代密度为0.5e6/ml,静置培养。当转染细胞的存活率达到30%以上时,即达到预设存活率阈值以上,将转染细胞转移至摇瓶进行恢复培养。当存活率达到90%以上时,冻存3支转染细胞以保种,其中保种的转染细胞需达到密度1e7/ml。之后根据需要扩大若干克隆pool进行补液培养,以获取重组后的pla2r蛋白。步骤s406,对所述转染细胞进行重组蛋白检测,并筛选出符合重组蛋白表达的所述转染细胞。例如,在步骤s404和步骤s405中分为若干组分别进行转染处理、压力筛选处理,通过pla2r蛋白的分子量标准对每组转染细胞取样进行重组蛋白检测和筛选,选取出符合pla2r重组蛋白表达的一组或几组转染细胞,剔除不具有pla2r胞外片段基因的转染细胞,使后续的细胞株单克隆化处理仅针对携带pla2r胞外片段基因的转染细胞,提高pla2r胞外片段基因的表达效果。步骤s407,对所述转染细胞进行细胞株单克隆化处理。其中,步骤s407具体包括:按照细胞培养板中每孔一个细胞的标准,将所述转染细胞加入至所述细胞培养板中进行培养。具体地,步骤s407包括:步骤s4071~步骤s4072。步骤s4071,稀释包含所述转染细胞的细胞液,并将所述细胞液加入至含谷氨酰胺的cd培养基(成分固定培养基);其中,所述转染细胞的密度不超过0.5/200毫升。步骤s4072,将所述cd培养基加入至细胞培养板以对所述转染细胞进行培养。例如,将步骤s402得到的转染细胞的细胞液以10倍梯度进行稀释,稀释后转染细胞密度为1.1×103/ml。将1.8ml稀释后的转染细胞加入400ml含glu(谷氨酰胺)的cdforiti培养基(一种商品化培养基,赛默飞世而公司thermofisherscientific)中,混合均匀。取200ml包含有转染细胞的cdforiti培养基溶液,加入到400细胞培养板(96孔板)的孔内,按照每个孔一个细胞,37℃条件下静置培养。步骤s408,对所述转染细胞进行重组蛋白检测,并筛选出符合重组蛋白表达的所述转染细胞。例如,在步骤s407中以细胞培养板的每个孔的转染细胞作为一组,分别进行细胞株单克隆化处理,由于细胞株单克隆化处理的基因传代并不非常稳定,可能产生并不携带有pla2r胞外片段基因的转染细胞。通过pla2r蛋白的分子量标准对每组转染细胞取样进行重组蛋白检测和筛选,选取出符合pla2r重组蛋白表达的转染细胞,剔除不具有pla2r胞外片段基因的转染细胞,使后续的工程细胞大规模表达仅针对携带pla2r胞外片段基因的转染细胞,进一步提高pla2r胞外片段基因的表达效果。步骤s409,对所述转染细胞进行工程细胞大规模表达。其中,步骤s409具体包括:步骤s4091~步骤s4094。步骤s4091,将所述转染细胞接种至细胞培养摇瓶进行工程细胞培养处理。其中,在36.5℃~37.5℃温度范围内,细胞培养摇瓶内保持体积比为4.5%~5.5%的二氧化碳,以145~155转/每分钟的速度旋转细胞培养摇瓶对转染细胞进行培养。优选地,工程细胞培养处理条件为:37℃,5%二氧化碳,细胞培养摇瓶旋转速度150转/分钟。步骤s4092,当所述转染细胞的密度达到工程细胞最低培养密度之上时,进行补料处理。例如,设工程细胞最低培养密度为1.5e6/ml。起始时,转染细胞密度为0.1e6/ml,定期计数转染细胞的密度,例如每天计数转染细胞的密度。当转染细胞密度达到1.5e6/ml时,开始向细胞培养摇瓶补充补料液。其中,按照所述转染细胞的密度增量,逐步增加每次加入的补料液总量。例如,第5天转染细胞密度为3.4e6/ml,添加补料液24ml。第6天转染细胞密度增加为6.0e6/ml,则添加的补料液增加至36ml,以保证转染细胞有充足养分。步骤s4093,当所述转染细胞的活性细胞密度开始下降并且存活率低于预设工程细胞培养存活率时,结束工程细胞培养处理。例如,设工程细胞培养存活率为90%,当发现转染细胞中的活细胞密度开始下降而且存活率率低于90%时,结束培养。通过工程细胞大规模表达可获得大量能够稳定表达pla2r胞外片段基因的转染细胞,便于大规模生产pla2r蛋白。步骤s410,利用所述转染细胞提取pla2r蛋白,并进行纯化处理。其中,步骤410具体包括:步骤4101~步骤4104。步骤4101,离心收集包含所述转染细胞的培养上清。例如,提取工程细胞大规模表达后转染细胞的培养液上清。步骤4102,对所述培养上清进行超滤浓缩处理。例如,将收集提取的培养上清超滤更换缓冲液至20mmpbs磷酸缓冲液(ph7.0)并浓缩10~20倍,以用于sourse30q阴离子交换柱层析纯化,其测电导设为2.3ms/cm。步骤4103,对所述培养上清进行离子洗脱处理,以得到pla2r蛋白溶液。步骤4103具体包括:步骤41031~步骤41033。步骤41031,使用0.22μm滤膜对所述培养上清进行过滤。步骤41032,按照至少三个洗脱梯度对所述培养上清进行洗脱处理,并收集在pla2r蛋白洗脱梯度下进行洗脱处理所得到的洗脱液,以得到所述pla2r蛋白溶液。其中,所述洗脱梯度包括:所述pla2r蛋白洗脱梯度和至少两个杂质洗脱梯度。所述pla2r蛋白洗脱梯度位于所述杂质洗脱梯度之间。pla2r蛋白洗脱梯度优选采用290至310mm的氯化钠。例如,采用sourse30q(一种商品化阴离子交换填料,ge公司)离子柱对蛋白溶液进行洗脱,以分别含50mm、200mm、300mm和500mm氯化钠的20mmpbs磷酸缓冲液(ph7.0)进行梯度洗脱,根据紫外280nm吸收峰收集洗脱液。其中,50mm、200mm、300mm和500mm的氯化钠浓度为洗脱梯度,300mm的氯化钠浓度为pla2r蛋白洗脱梯度,剩余的50mm、200mm和500mm的氯化钠浓度为杂质洗脱梯度。培养上清中除了含有pla2r蛋白,还含有其他蛋白杂质。在50mm、200mm和500mmnacl洗脱液的洗脱处理下,pla2r蛋白以外的其他蛋白被洗脱掉,在300mmnacl洗脱液的洗脱处理下,pla2r蛋白被洗脱掉,因此收集300mmnacl洗脱液的洗脱处理后的培养上清,就得到了pla2r蛋白溶液。因此将300mm氯化钠浓度作为pla2r蛋白洗脱梯度,其他氯化钠浓度作为杂质洗脱梯度。pla2r蛋白洗脱梯度可以洗脱符合pla2r蛋白分子量的蛋白,从而得到pla2r蛋白溶液。在pla2r蛋白洗脱梯度之前的杂质洗脱梯度可以洗脱小于pla2r蛋白分子量的杂质蛋白,在pla2r蛋白洗脱梯度之后的杂质洗脱梯度可以洗脱大于pla2r蛋白分子量的杂质蛋白,从而起到分离pla2r蛋白的作用。步骤41033,使用氢氧化钠对所述pla2r蛋白溶液进行离子交换层析柱再生,使pla2r蛋白可以重复使用。例如,同样采用sourse30q离子柱对洗脱处理得到的蛋白溶液进行再次洗脱。其中,洗脱液根据如下条件配制:平衡缓冲液:20mmpbs,ph7.0;洗脱缓冲液:20mmpbs;naoh溶液:0.5m,ph7.0。步骤4104,对所述pla2r蛋白溶液进行分子筛纯化处理。其中,步骤s4104具体包括:步骤s41041~步骤s41043。步骤s41041,对所述pla2r蛋白溶液进行超滤浓缩;步骤s41042,使用0.22μm滤膜对所述pla2r蛋白溶液进行过滤;步骤s41043,对所述pla2r蛋白溶液进行凝胶过滤柱层析纯化。例如,以s200hr柱(ge公司的商品化凝胶过滤柱)进行凝胶过滤柱层析,缓冲体系为20mmpbs(ph7.0),根据紫外280nm吸收峰收集洗脱液。洗脱时的上流速度设为:1.3ml/min。在pbs(ph7.0)缓冲液体系下,在安捷伦hplc1200仪器上,以tskg3000sw凝胶过滤hplc层析柱,分析纯化的pla2r蛋白的纯度,结果表明,pla2r蛋白经凝胶过滤柱层析纯化后,纯度为98%以上,除pla2r蛋白主峰外,基本不见杂质峰,这个结果与sds-page的分析结果一致。其中,步骤s406和步骤s408中对所述转染细胞进行重组蛋白检测的步骤具体包括:步骤s501,对所述转染细胞的培养液进行离心并取上清点样并置于硝酸纤维素膜(pvdf膜,merckmiliproe),例如,将培养液300g离心5分钟,取2μl上清点样于硝酸纤维素膜,在36.5c°~37.5c°条件下风干25~30分钟。步骤s502,采用3%bsa-pbs(牛血清白蛋白-磷酸缓冲液)对风干后的硝酸纤维素膜进行封闭。步骤s503,将封闭后的所述硝酸纤维素膜与辣根过氧化物酶标记的抗flag抗体稀释液在36.5℃~37.5℃条件下孵育30~60分钟。步骤s504,使用缓冲液清洗掉未结合的辣根过氧化物酶标记的抗flag抗体。步骤s505,将所述硝酸纤维素膜与化学发光剂(immobilonwesternchemiluminescenthrpsubstrate,millipore公司,货号wbkls0500)在室温避光条件下孵育1~2小时。步骤s506,利用生物分子成像仪(ge公司,型号las400mini)对所述硝酸纤维素膜进行成像处理。步骤s507,根据所述成像处理的成像结果判定所述转染细胞的重组蛋白表达结果。例如,根据成像有/无和强/弱判定重组pla2r蛋白的多或少。本领域技术人员在考虑说明书及实践这里公开的发明后,将容易想到本发明的其它实施方案。本申请旨在涵盖本发明的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本发明的一般性原理并包括本公开未公开的本
技术领域:
中的公知常识或惯用技术手段。说明书和实施例仅被视为示例性的,本发明的真正范围和精神由下面的权利要求指出。应当理解的是,本发明并不局限于上面已经描述并在附图中示出的精确结构,并且可以在不脱离其范围进行各种修改和改变。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1