电化学检测芯片、电化学传感器及其制备方法和应用与流程
本发明涉及凝血检测技术领域,具体涉及一种电化学检测芯片、电化学传感器、电化学检测芯片的工作电极的修饰方法,以及电化学传感器的制备方法。
背景技术:
凝血功能正常与否关系着人体生理健康状态,凝血功能的评估实验对多种疾病的诊断、治疗和预后判断有重要意义。凝血时间则是衡量凝血状态的重要指标,其中,凝血酶原时间(pt,prothrombintime)是目前临床上外源性凝血功能检测的常规指标,是判断机体止血和凝血系统发生病理变化、术前进行凝血性疾病筛查的重要指标,也是目前临床上诊断和观察血栓形成、抗凝药物治疗效果监测的一个首选指标。
凝血酶原时间pt取决于血液中的凝血酶原、纤维蛋白原及凝血因子ⅱ、ⅴ、ⅶ、x等的水平,其中凝血因子主要由肝脏合成,因此pt对于肝硬化、肝炎等许多肝病患者的治疗具有极其重要意义,对于一些先天或后天型凝血因子缺乏患者、血栓性疾病患者和先天性fv增多症患者等也都需要严密监控pt凝血时间的变化。目前常规的pt检测多以来大型血凝仪,多采用血栓弹性描记法、光学法等方法来测量凝血时间,不仅对操作人员的操作技能有较高要求,还存在操作复杂、耗时较长等问题。
基于电化学方法的凝血酶原时间检测不需要使用大型设备,操作简单、降低了检测成本。中国专利文献cn106680339a中公开了一种基于电化学方法的凝血酶原时间测试卡:混合一定量的重组组织因子(rtf)和磷脂溶液,制备组织因子酯化物。将组织因子脂化物均匀分散在导电基板上并烘干成膜,得到一种基于电化学方法的凝血酶原时间检测卡。上述基于电化学方法的凝血酶原时间检测卡,凝血酶原时间检测试剂直接分散于导电基板中,凝血反应过程中产生的电信号向导电基板直接传递。由于凝血反应过程涉及多种蛋白、酶的参与,蛋白、酶中的多肽链具有弯曲折叠的三维结构,受其三维结构的影响,凝血过程中产生的电子难以传递,凝血过程中产生的电信号强度低,限制了对凝血酶原时间检测的灵敏度。
技术实现要素:
因此,本发明要解决的技术问题在于克服现有技术中基于电化学检测凝血酶原时间的设备存在电子难以传递、电信号强度低的缺陷。
为此,本发明提供如下技术方案:
第一方面,本发明提供了一种电化学检测芯片,包括电极层,所述电极层的工作电极包括依次层叠设置的导电层、纳米材料层和凝血反应层;所述凝血反应层产生用于检测凝血酶原时间的电信号,所述纳米材料层传递和放大所述电信号。
优选地,上述的电化学检测芯片,所述纳米材料层由碳纳米管、石墨烯和氧化锌中的任一种形成;优选地,所述纳米材料层由碳纳米管形成;优选地,所述碳纳米管为多壁碳纳米管。
优选地,上述的电化学检测芯片,所述凝血反应层包含若干凝血反应单元;每个所述凝血反应单元包括凝血酶识别区、与所述凝血酶识别区相连接的电信号区,和使凝血酶原转化为凝血酶的转化区;所述凝血酶识别区在凝血酶作用下与所述电信号区分离。
进一步优选地,上述的电化学检测芯片,所述凝血酶识别区由多肽材料形成,所述电信号区由电信号材料形成,所述转化区域由含有凝血活酶的组织材料形成。
进一步优选地,上述的电化学检测芯片,所述电信号材料为对苯二胺。
优选地,上述的电化学检测芯片,所述工作电极为丝网印刷电极。
优选地,上述的电化学检测芯片,所述电极层还包括参比电极和对电极;优选地,所述参比电极为丝网印刷电极,和/或所述对电极为丝网印刷电极。
第二方面,本发明提供了一种电化学传感器,包括:
上述的电化学检测芯片,所述电化学检测芯片的电极层设置于基底层上;
封装层,设置于所述电极层远离所述基底层的一侧面上。
优选地,上述的电化学传感器,所述电极层与所述封装层之间还设置有绝缘层,所述绝缘层具有开口,所述电极层在所述开口的位置露出形成所述电化学传感器的反应区。
第三方面,本发明提供了上述的电化学检测芯片,或上述的电化学传感器在凝血酶原时间检测中的应用。
第四方面,本发明提供了一种电化学检测芯片的工作电极的修饰方法,包括以下步骤:
将纳米材料粉末均匀分散于全氟磺酸树脂溶液中,得到纳米材料分散液;将纳米材料分散液涂覆于工作电极的导电层的表面,干燥,在导电层表面形成纳米材料层;
在纳米材料层上涂覆凝血酶底物溶液,凝血酶底物溶液包括含有凝血酶切割位点的多肽,与所述多肽相连接的电信号分子,和含有凝血活酶的组织因子;干燥,在纳米材料层上形成凝血反应层,制得表面修饰的工作电极;
优选地,所述纳米材料为纯化的碳纳米管材料。
第五方面,本发明提供了一种电化学传感器的制备方法,包括以下步骤:
在基底层上制备工作电极的导电层、对电极和参比电极;
以上述的工作电极的修饰方法,得到表面修饰的工作电极;
在电极层远离基底层的一侧面上设置封装层,即得所述电化学检测传感器。
本发明技术方案,具有如下优点:
1.一种电化学检测芯片,包括电极层,所述电极层的工作电极包括依次层叠设置的导电层、纳米材料层和凝血反应层;所述凝血反应层产生用于检测凝血酶原时间的电信号,所述纳米材料层传递和放大所述电信号。
上述的电化学检测芯片,在用于检测凝血酶原时间时,待检测的缺乏血小板和钙离子的血液与凝血反应层接触,使凝血酶原转化为凝血酶,触发凝血酶原时间检测的凝血过程。同时,凝血反应层产生用于检测凝血酶原时间的电信号,通过采集电信号的变化,能够对凝血酶作用下的凝血过程的发生进行监测,实现检测凝血酶原时间的目的。利用纳米材料的导电性能高、比表面积大、负载量高和生物相容性好等优点,纳米材料能够加快电子的传递,提高电流响应信号,实现对电信号分子产生电信号的传递和放大。通过纳米材料对电信号的传递和放大,使电化学检测芯片对凝血酶原时间检测的灵敏度提高、检测时间缩短、检测所需样本量减少。电化学检测芯片对凝血酶原时间的检测不依赖于血液中纤维蛋白等物质与芯片表面的结合,因此对芯片表面环境一致性的要求低,具有良好的检测重复性。
2.本发明提供的电化学检测芯片,所述纳米材料层由碳纳米管、石墨烯和氧化锌中的任一种形成;优选地,所述纳米材料层由碳纳米管形成。碳纳米管具有力学特性好、机械强度高、导电性高,比表面积大,电化学稳定性高、较高的纵横比和孔径大小在一定范围内可控制等优点,为担载凝血反应层且发生有效的电信号的传递和传递提供了可能性。碳纳米管的化学稳定性好,有利于减少由于血液中复杂成分造成的信号波动,减少无关物质的干扰,提高检测重复性与稳定性。
3.本发明提供的电化学检测芯片,所所述凝血反应层包含若干凝血反应单元;每个所述凝血反应单元包括凝血酶识别区、与所述凝血酶识别区相连接的电信号区,和使凝血酶原转化为凝血酶的转化区;所述凝血酶识别区在凝血酶作用下与所述电信号区分离。凝血反应层与缺乏血小板和钙离子的血液接触后,血液中的凝血酶原在转化区上转化为凝血酶,凝血酶作用于凝血酶识别区,使与凝血酶识别区相连接的电信号区分离。电信号区在外界电压作用下,产生电子移动,形成可被记录的电流,通过记录电流响应信号的变化,实现对凝血酶原时间的检测。
4.本发明提供的电化学检测芯片,所述凝血酶识别区由多肽材料形成,所述电信号区由电信号材料形成,所述转化区域由含有凝血活酶的组织材料形成。
待检测的缺乏血小板和钙离子的血液,在形成转化区的组织材料存在下,组织材料中的凝血活酶将血液中的凝血酶原转化为凝血酶,在凝血酶作用下,血液中可溶性的纤维蛋白原转化为不可溶的纤维蛋白,使血液由液体的流动状态转变为不可流动的凝胶状态,发生凝血反应,上述凝血反应的时间即为凝血酶原时间(pt),是检测ⅱ、ⅴ、ⅶ、x等凝血因子以及纤维蛋白原活性的指标。
多肽材料中含有凝血酶切割位点,在凝血酶作用下被切割为肽残基,释放与多肽连接的电信号材料。在外界电压作用下,电信号材料产生电子移动,形成可被记录的电流。电信号材料担载于纳米材料层上,纳米材料能够促进电信号分子的氧化/还原反应,加快电子的传递,提高电流响应信号,实现对电信号材料产生电信号的传递和放大。纳米材料的生物相容性好,适于担载多肽、蛋白、酶等生物材料;其比表面积大,能够提高对生物材料的担载量,扩大了凝血酶切割多肽后产生的电信号,实现纳米材料层对电信号的传递和放大,使电化学检测芯片对凝血酶原时间检测的灵敏度提高、检测时间缩短、检测所需样本量减少,并且具有良好的检测稳定性和重复性。
5.本发明提供的电化学检测芯片,所述电信号材料为对苯二胺。当形成凝血酶识别区的多肽材料被凝血酶切割后,产生肽残基,同时释放对苯二胺,在工作电极上施加电压,对苯二胺被氧化,并丢失电子,电子移动形成可被记录的电流。
6.本发明提供的电化学检测芯片,所述工作电极为丝网印刷电极,丝网印刷制备的电极具有制备简单、检测灵敏度高以及检测时间短等优势。
电极层还包括参比电极和对电极,电化学检测芯片采用三电极体系,利用参比电极的参比信号以减少来自仪器设备、检测环境以及检测样品的干扰因素,由于血液成分复杂,采用三电极体系有利于减少无关物质的干扰,提高检测稳定性和检测结果准确性。进一步的,参比电极和/或对电极为丝网印刷电极,以进一步提高电化学检测芯片对凝血酶原时间检测的灵敏度、缩短检测时间。
7.本发明提供一种电化学传感器,包括上述的电化学检测芯片。通过电化学检测芯片有效增强在检测血液凝血酶原时间过程中的电流响应,增强电极的信号强度,以达到高的检测灵敏度、短的响应时间和少的检测样本量,使电化学传感器能够实现对凝血酶原时间的快速、高灵敏度和特异性的检测,提高了凝血酶原时间检测的准确性。凝血酶原时间作为判断机体止血和凝血系统疾病、诊断和观察血栓形成,以及提示机体是否患有肝炎、肝硬化、肝癌等相关疾病的诊断和预后指标,利用电化学传感器实现对凝血酶原时间的快速、灵敏检测,适于为临床疾病的诊断、治疗,以及药物疗效监测提供有效的指导依据。
此外,利用电化学传感器检测凝血酶原时间的操作简单、对操作人员的技术水平要求不高,适于凝血酶原检测的大规模普及、应用。
6.本发明提供的电化学传感器的制备方法,制备过程简单,可操作性高,能够制备得到上述具有放大电流响应信号、灵敏度高、稳定性好、检测快速的电化学检测芯片。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例1提供的电化学检测芯片的结构示意图;
图2为本发明实施例1提供的电化学检测芯片用于凝血酶原时间检测的工作原理图;
图3为本发明实施例2提供的一种电化学传感器的结构示意图;
图4为本发明实施例2提供的一种电化学传感器的结构示意图;
图5为图4所示的电化学传感器的俯视图;
图6为本发明实施例3提供的电化学检测芯片的结构示意图;
图7为本发明实施例4提供的电化学传感器的结构示意图;
图8显示实施例5中提供的电化学传感器的制备方法的流程图;
图9显示实施例5中提供的电化学传感器的制备方法的流程图;
图10显示对工作电极进行表面修饰的修饰过程图;
图11显示实验例1中电化学传感器检测三组血液样本的凝血酶原时间的结果图;
图12显示实验例1中电化学传感器与临床sysmexcs5100光学凝血仪检测凝血原酶时间的拟合曲线图;
图13显示实验例2中mwcnts型电化学传感器与未修饰mwcnts的电化学传感器对凝血酶原时间检测的比对结果图;
图14显示实验例3中5组电化学传感器的重复性检测结果图;
附图标记说明:
1-封装层,11-进样区,12-进样检测区,13-反应区,14-进满区,15-接口区;
2-电极层,21-工作电极,22-对电极,23-参比电极,24-导电轨道;
3-基底层;
4-绝缘层。
具体实施方式
下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
在本发明的描述中,需要说明的是,术语“中心”、“上”、“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”、“第三”仅用于描述目的,而不能理解为指示或暗示相对重要性。
在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
此外,下面所描述的本发明不同实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互结合。
实施例1
本实施例提供一种电化学检测芯片,包括基底层3和成型于基底层3上的电极层2,如图1所示,电极层2工作电极21、对电极22和参比电极23。其中,工作电极21包括依次层叠设置的导电层、纳米材料层和凝血反应层。凝血反应层产生用于检测凝血酶原时间的电信号,纳米材料层传递和放大电信号。电化学检测芯片在用于检测凝血酶原时间,缺乏血小板和钙离子的血液与凝血反应层接触,使凝血酶原转化为凝血酶,触发凝血酶原时间检测的凝血过程。同时,凝血反应层产生用于检测凝血酶原时间的电信号,电信号经纳米材料层向导电层传递,由于纳米材料层具有导电性高、比表面积大等优势,纳米材料层能够加快电子传递,实现对电信号的放大,使电化学检测芯片的检测灵敏度提高、检测时间缩短。
凝血反应层包括若干凝血反应单元,凝血反应单元包括凝血酶识别区、与凝血酶识别区相连接的电信号区,和使凝血酶原转化为凝血酶的转化区,凝血酶识别区在凝血酶作用下与电信号区分离。具体地,凝血酶识别区采用凝血酶切割位点的多肽(序列:tos-gly-pro-arg)材料形成,电信号区由对苯二胺形成,多肽与对苯二胺以酰胺键相连,形成多肽-对苯二胺(tos-gly-pro-arg-p-phenylenediamine)。转化区由含有凝血活酶的组织材料形成,组织材料选用凝血酶原时间检测试剂,检测试剂中含有外源性凝血所需的组织因子以及钙离子等物质。纳米材料层由多壁碳纳米管(multi-walledcarbonnanotubes,mwcnts)材料形成。导电层的材料选择金浆、银浆等导电金属材料,或石墨烯、碳纳米管等导电碳浆材料,以实现电化学检测芯片与检测设备(例如:生物界面分子分析仪)的电信号连接。
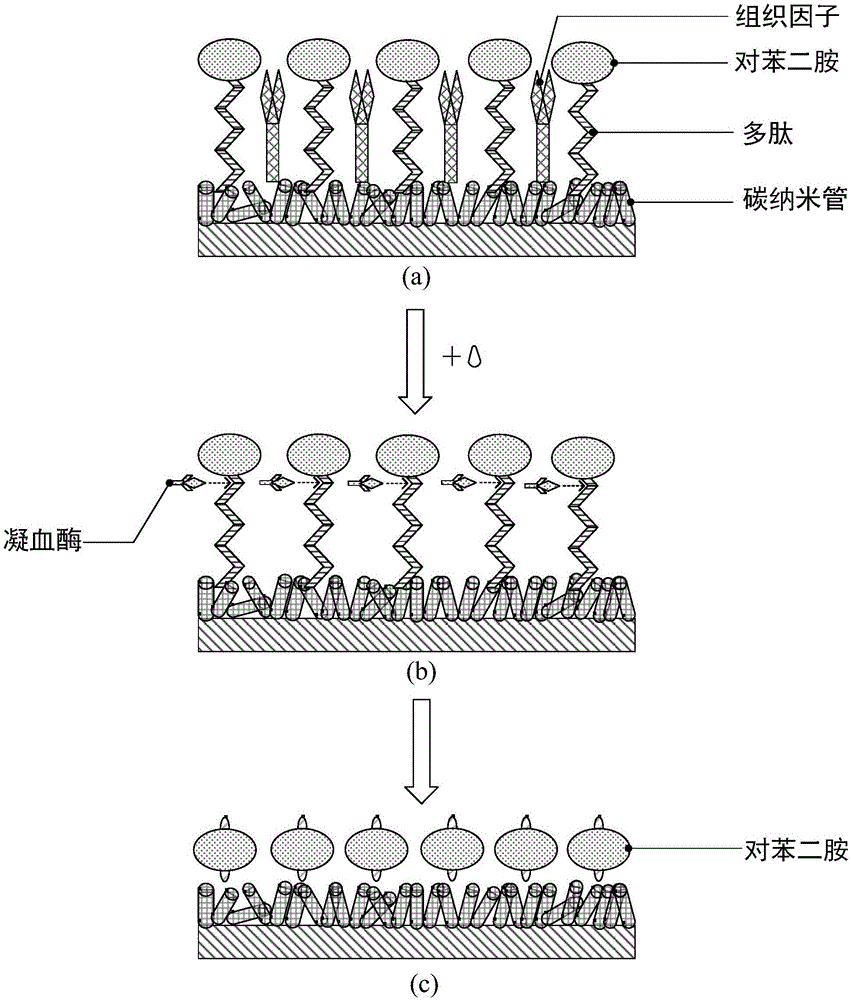
电化学检测芯片用于凝血酶原检测的工作原理如图2所示:工作电极21的凝血反应层与不含有血小板、钙离子的血液接触后,在转化区的组织因子存在下,转化区组织材料中的凝血活酶将血液中的凝血酶原转化为凝血酶(图2a→图2b)。在凝血酶作用下,血液中可溶性的纤维蛋白原转化为不可溶的纤维蛋白,使血液由液体的流动状态转变为不可流动的凝胶状态,发生凝血反应。与此同时,在产生凝血酶后,凝血酶切割凝血酶识别区的多肽,产生肽残基,与多肽相连的对苯二胺被释放(图2b→图2c),发生如下反应:
在工作电极21上施加电压,电信号区的对苯二胺被氧化,并丢失电子,电子移动形成可被记录的电流响应信号。凝血反应层设置于多壁碳纳米管形成的纳米材料层上上,利用碳纳米管高的导电性可加快电子传递,增强电流响应。碳纳米管的生物相容性好,适于负载多肽、蛋白等生物材料,其比表面积大、负载量高,能够增加对多肽材料、组织材料的但在量,以促进电子的产生和传递,放大电流响应信号。通过生物界面分子分析仪采集电流信号的变化,能够对凝血酶作用下的凝血过程的发生进行监测,实现检测凝血酶原时间的目的。由于碳纳米管对电流响应信号的增强与放大,电化学检测芯片用于凝血酶原时间检测的时间缩短、检测灵敏度提高、检测所需的血液样本量减少。电化学检测芯片对凝血酶原时间的检测不依赖于血液中纤维蛋白等物质与芯片表面的结合,对芯片表面环境一致性的要求低。同时,由于碳纳米管良好的电化学稳定性,能够减少血液中复杂的无关成分对凝血酶原时间检测的干扰,使电化学检测芯片具有良好的检测稳定性和重复性。
进一步的,如图1所示,电极层2还包括铺设于基底层3表面的导电轨道24,用于传输由工作电极21、对电极22和参比电极23产生的检测信号。工作电极21、对电极22和参比电极23可以采用真空沉积、丝网印刷、电镀等工艺制备得到,基于丝网印刷工艺的制备简单、检测灵敏度高和检测时间短的优势,工作电极21、对电极22和参比电极23具体地采用丝网印刷的方法形成。制备对电极22和参比电极23的电极浆料分别可以选择金浆、银浆等导电金属材料,或石墨烯、碳纳米管等导电碳浆材料,以实现电化学检测芯片与生物界面分子分析仪的电信号连接。
实施例2
本实施例还提供一种电化学传感器,如图3所示,电化学传感器包括上述的实施例1提供的电化学检测芯片,和设置于电极层2远离基底层3一侧面上的封装层1。封装层1材料选用聚甲基丙烯酸甲酯(pmma)、聚对苯二甲酸类塑料(pet)、聚醚醚酮(peek)、聚四氟乙烯(ptfe)、聚氯乙烯(pvc)、聚丙烯(pp)聚合物等等,使封装层1兼具稳定性、抗氧化性、防腐蚀性、生物兼容性,并具有一定的亲水性。封装层1采用环氧ab胶类物质、单双面胶层带、等离子体、紫外光及热压键合等方法覆盖于电极层2上,使封装层1与电极层2之间紧密贴合,减少外界环境对电化学传感器检测性能的影响。为加强封装层1与电极层2之间的贴合性,还可以在封装层1与电极层2之间印刷一层绝缘层4(图4),绝缘层4采用具有一定亲水性的绝缘油墨形成。绝缘层4设置于封装层1与电极层2之间,以改善封装层1的封装效果,同时在绝缘层4上预留出电极层2的工作区域,使电极层2与血液完成接触反应。
在封装完成后,得到如图5所示的电化学检测芯片的表面结构示意图:在封装层1上形成进样区11、进样检测区12、反应区13、进满区14和接口区15。在进样区11开设有进样孔,在进满区14开设有出样孔,待检测的血液样本由进样区11的进样孔流入,在电化学检测芯片的的亲水材料的毛细作用下,流向进满区14的出样孔。在流经进样检测区12时,进样检测区12的参比电极23产生进样信号,指示样品流入。随后留至反应区13,待测的血液样本与工作电极21中凝血反应层接触、发生反应,产生电信号,电信号经由纳米材料层的放大后继续向工作电极21的导电层传递,通过记录电信号的变化,完成对待测样本凝血酶原时间的检测。在待测血液样本流过反应区13后,待测样本流至进满区14,提示样品检测完成。接口区15能够实现与电流信号采集仪器(例如:生物分子界面分析仪)的电信号连接,通过接口区15实现由电化学传感器向电流信号采集仪器输出凝血酶原时间检测过程中产生的电流信号。
通过在电化学传感器中设置上述具有放大电流响应信号功能的电化学检测芯片,使电化学传感器具有灵敏度高、响应时间短、所需样本量少等优势,能够时间对凝血酶原时间的快速、灵敏检测,并且具有重复性好、稳定性高等优势,为临床疾病的诊断、治疗,以及药物疗效监测提供有效的指导依据。此外,利用电化学传感器检测凝血酶原时间的操作简单、对操作人员的技术水平要求不高,适于凝血酶原检测的大规模普及、应用。
实施例3
本实施例提供一种电化学检测芯片,其电极层2的结构如图6所示,包括设置于基底层3上的导电轨道24,导电轨道24具体地由导电银层形成,导电轨道24的起始端靠近基底层3的在宽度方向的一个侧边设置,并且沿基底层3的长度方向进行延伸,最终形成导电轨道24在基底层3上的终止端。导电轨道24的终止端接触连接有工作电极21的导电层和对电极22,工作电极21的导电层具体地呈圆盘状,工作电极21的导电层为导电碳墨电极。对电极22呈与工作电极21间隔设置并且环绕工作电极21的环形结构,对电极22为导电碳墨电极。在导电轨道24未连接工作电极21和对电极22的终止端部分上覆盖一层agcl,形成参比电极23。在工作电极21的导电层沿远离基底层3的方向上依次层叠设置的导电层、纳米材料层和凝血反应层。纳米材料层由纳米材料形成,例如,碳纳米管。纳米材料层上设置的凝血反应层包括若干凝血反应单元,每个凝血反应单元包括凝血酶识别区、与凝血酶识别区相连接的电信号区,和使凝血酶原转化为凝血酶的转化区。其中,凝血酶识别区由含有凝血活酶的组织材料形成,凝血酶识别区由含有凝血酶切割位点的多肽材料形成,电信号区由与多肽相连接的电信号材料(例如,对苯二胺)形成。在凝血过程中,通过碳纳米管传递和放大由对苯二胺产生的电流信号,以实现对凝血酶原时间的灵敏度高、重复性好的快速检测。
作为本实施例的第一种可替代实施方式,电极层2中工作电极21、对电极22和参比电极23的结构还可以选择其他任意结构,只要通过工作电极21表面修饰的纳米材料,实现对电信号的传递和放大,以提高对凝血酶原时间的检测效果即可。
作为本实施例的第二种可替代实施方式,工作电极21的导电层、对电极22和参比电极23的材料还可以分别选择其他具有导电性质的材料,例如,ag、au金属材料等等。
作为本实施例的第三种可替代实施方式,工作电极21的纳米材料层还可以选择其他导电性高、比表面积大、生物兼容性高的纳米材料,例如,石墨烯,zno等等,均能实现对电信号的传递与放大。
作为本实施例的第四种可替代实施方式,电信号材料还可以选择其他能够产生电子移动,形成被记录电流的材料,例如,邻苯二胺等等。
实施例4
本实施例还提供一种电化学传感器,包括实施例3提供的电化学检测芯片。如图7所示,在电化学检测芯片的电极层2的表面覆盖有一层绝缘层4,绝缘层4由绝缘油墨形成。在绝缘层4上设置有开口,电极层2由绝缘层4的开口处漏出,形成电化学传感器的反应区13。
在绝缘层4的上方覆盖一层亲水膜,作为电化学传感器的封装层1,封装层1覆盖反应区13裸露的电极层2,在封装层1对应反应区13的位置开设有进样孔和出样孔,使待测血液样本在流经反应区13流入电极层2,发生凝血反应,通过电极层2输出的电流信号进行凝血酶原时间检测。
实施例5
本实施例提供一种实施例4中电化学传感器的制备方法,电化学传感器的制备过程如图8和图9所示,制备方法具体包括以下步骤:
s1,制备导电轨道24:
s11,选择聚对苯二甲酸乙二醇酯(pet)作为基底层3材料,印刷之前,将pet基材用去离子水冲洗去除表面杂质,并用氮气吹干;
s12,首先印刷导电银层,以提高丝网印刷电极的导电性并作为丝网印刷电极的导电轨道24;
s2,在基底层3上制备工作电极21的导电层、对电极22和参比电极23
s21,在导电银层的端部印刷氯化银浆料,形成参比电极23;
s22,在基底层3上继续印刷导电碳墨浆料,分别形成工作电极21的导电层和对电极22。其中工作电极21的导电层为圆盘状,对电极22呈与工作电极21间隔设置并且环绕工作电极21的环形结构;
s3,在电极层2远离基底层3的一侧面上覆盖绝缘层4:
绝缘层4采用绝缘油墨固定在电极层2上,留下用于固定试剂和发生反应的工作区域,并在75℃干燥恒温箱中再次烘烤30分钟,制备好的电化学检测芯片在室温下老化2d,期间保存在避光干燥的环境中;
s4,对工作电极21进行表面修饰,修饰过程如图8所示:
s41,用0.8-1.2ml的nafion膜(全氟磺酸树脂)溶液溶解0.8-1.2mg的纯化的mwcnts(多壁碳纳米管)粉末,并放置于kq-400kde型高功率数控超声波清洗器(昆山市超声仪器有限公司)中振荡20分钟左右至mwcnts均匀分散,制成0.8-1.2mg/ml的mwcnts均匀分散液。在修饰mwcnts分散液之前,使用pbs缓冲液清洗制作完成的电化学检测芯片,并用烘干机烘干5分钟。然后称取4-6μlmwcnts均匀分散液涂覆修饰于制作好的丝印电极的工作电极21表面,并放置于恒温箱中70℃下烘干30分钟,干燥后即制成设置于工作电极21导电层上的纳米材料层;
s42,用0.1mol/l的pbs缓冲液与牛血清白蛋白粉末配制0.5%的bsa溶液,然后用bsa溶液溶解多肽-对苯二胺(tos-gly-pro-arg-p-phenylenediamine)冻干粉末(p14993,上海生工生物工程股份有限公司)制成300μmol/l的多肽-对苯二胺的底物溶液;
将备用的pt试剂(凝血酶原时间测定试剂)与0.9%的生理盐水进行1:4稀释,在搅拌机中搅拌2分钟,待凝血酶试剂均匀混合后置于37℃水浴中3分钟。pt试剂用于检测人血浆的凝血酶原时间,是外源性凝血所需的含有组织因子等的混合试剂,以使血液发生凝固反应产生凝血酶。
将含有多肽-对苯二胺的底物溶液与用pt试剂按1:2的体积比例混合,并在搅拌机上搅拌3分钟至混合均匀,配置成凝血酶底物溶液。
在步骤s41制备的电化学检测芯片的工作电极21的导电层表面涂覆修饰6μl的凝血酶底物溶液。之后放于恒温箱中36℃下干燥20分钟,使凝血酶底物担载于碳纳米管上,形成位于纳米材料层上的凝血反应层,得到修饰后的工作电极21。
s5,在电极层2远离基底层3的一侧面上设置封装层1:
在电极表面贴上一层亲水膜作为封装层1,形成一个5μl的反应区13,封装层1上开设有进样孔和出样孔,制成用于pt检测的电化学传感器,并放置于真空密封袋中以待实验所需。
作为本实施例的第一种可替代实施方式,电化学检测芯片还可以选择实施例1中提供的任一芯片,同样能够利用上述的制备方法得到电流信号增强、检测灵敏度提高的电化学传感器。
实验例1
1、实验目的:检验电化学传感器用于检测凝血原煤时间的有效性。
2、实验方法:
(1)从三甲医院检验科选取了3例病人的血液样本,以实施例2提供的电化学电化学传感器检测血浆样本的凝血酶原时间进行检测,每次测试都使用医院当天采集病人的新鲜血液。用电化学工作站连接电化学传感器的三个电极,并将电极放置于平稳的实验台上,在进行凝血实验前,先从血液样本中抽取一定量的血浆,将血浆样本放到37℃水浴中3分钟,使用移液器将5μl样本通过电化学传感器的进样孔注入反应区13,由于亲水膜的作用,样本会在0.1s左右注满反应区13,采用计时电流法记录样本凝固的反应过程。同时使用无修饰凝血酶底物的电化学传感器加血浆进行阴性对照实验。
(2)从医院选取了10例捐献者的血液样本,以实施例4提供的电化学传感器,采用上述的检测方法对血液样本的凝血酶原时间进行检测,同时采用sysmexcs5100光学凝血仪测试凝血酶原时间进行验证。
3、实验结果:
图11分别显示电化学传感器检测三组血液样本的凝血酶原时间分别为42.75s、58.94s、82.86s。血液样本注入电化学传感器的进样孔后,首先与形成在工作电极21凝血反应层中的转化区材料进行溶解,溶解过程中凝血反应被激活,生成凝血酶切割的凝血底物,在电极的氧化作用下产生电流信号。此过程中凝血酶产量达到最大值时,凝血酶切割反应也最迅速,进而使反应电流也达到峰值;随着切割反应的进行,凝血酶含量逐渐减少,电流上也随之逐渐减小并趋于平缓。由图11可知,3组样本所采集到的信号曲线清晰,不同的血液样本产生凝血酶的速度和剂量不同,从而使电极表面采集到电流峰值的时间也不同,也正因此达到检测凝血时间的目的,本实验例中使用传感器进液开始反应到电流达到峰值的时间作为凝血反应的pt值。图11还显示了向无修饰凝血酶底物的传感器上滴加血浆的阴性对照实验结果,可以看出添加血浆后,仅有因进样而产生的进样峰,后快速下降并在零值附近渐趋于平缓,实验中血浆凝血反应未被激活,反应出该原理切实可用于pt检测。
图12显示以实施例4提供的电化学传感器与临床sysmexcs5100光学凝血仪检测凝血原酶时间的拟合曲线。由图12中直线显示测量结果的线性拟合曲线,决定系数r2为0.991。结果显示,本发明提供的电化学传感器可以较好的应用于临床检测凝血参数pt。
实验例2
1、实验目的:检测电化学传感器用于检测凝血原煤时间的灵敏度。
2、实验方法:以实验例1中的检测方法,对实施例4提供的电化学传感器,以及未进行碳纳米管修饰的电化学传感器的电流响应强度进行检测。
3、实验结果:
图13显示实施例4提供的mwcnts型电化学传感器与未修饰mwcnts的电化学传感器对凝血酶原时间检测的比对结果。由图13可知,与未修饰mwcnts的电化学传感器相比,mwcnts型电化学传感器的电流响应强度增加了36±1%,mwcnts型电化学传感器的检测灵敏度提升。图13中也显示了不设置凝血反应层的mwcnts型传感器添加凝血酶底物的阴性对照实验,可以看到进液后,没有出现凝血酶信号的反应峰,仅有进液时引起的进样峰,进样峰是向传感器进样时引起的传感器瞬间电流变化,之后迅速下降并趋于平缓。
实验例3
1、实验目的:检测电化学传感器的重复性。
2、检测方法:检测实验例1中的凝血原酶测试方法,进行如下重复性测试:
(1)选取实施例2提供的3组电化学传感器(1th,2th,3th),以及实施例4提供的2组电化学传感器(4th,5th),对同一血液样本进行重复试验。
(2)选取实施例2提供的电化学传统器,对3组血浆样本分别作了5次重复测量。
3、实验结果:
图14显示5组电化学传感器的重复性检测结果,由图5中明显看到曲线变化趋势相同,具有较好的检测稳定性;其出峰时间cv值(变异系数)为1.36%,峰值电流cv值为3.02%,因此具有较优秀的重复性。
表1
表1显示3组血液样本的重复性检测结果,3组实验结果的cv值分别为2.26%、2.07%和1.29%,由此可以判断本发明提供的的传感器用以测量pt具有良好一致性和重复性。本实验方法记录了凝血过程中凝血酶作用于凝血反应层产生电流的变化时间,于其他测量方式不同的是不依赖于血液中纤维蛋白等物质中与传感器表面的结合,因此pt测试对mwcnts电化学传感器表面环境的一致性等有较为宽松的限制。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!