具有糖链的物质与凝集素的复合物形成方法与流程
本发明涉及一种具有糖链的物质与凝集素的复合物形成方法。
背景技术:
糖链是相同的单糖分子或两种以上的单糖分子经由糖苷键结合成链状的化合物。生物体内,糖链以与蛋白质或脂质结合的复合糖质的形态主要存在于细胞表面,并参与细胞的增殖、细菌或病毒的感染、神经的伸长、炎症、免疫等生物体内重要的生理活动。
生物体内存在的糖蛋白等具有糖链的物质中附带的糖链的种类及其数量通常是一定的。但会有糖链疾病特异性变化的情形,这种糖链被用作为诊断的生物标志物。例如,已知有糖链随着细胞的癌变及癌的进展变化的糖链或糖蛋白,这些被用作为肿瘤标志物。
作为具有糖链的肿瘤标志物,已知有α-甲胎蛋白(afp:肝癌标志物)、前列腺特异性抗原(prostatespecificantigen,psa:前列腺癌标志物)、癌胚抗原(carcinoembryonicantigen,cea:结肠癌等标志物)、ca19-9(carbohydrateantigen19-9,ca19-9:胰腺癌标志物、消化官癌标志物)及足细胞标志蛋白等。
作为检测、分析糖链的方法,通常是采用凝集素的方法。凝集素是指植物、动物及微生物等中存在的蛋白质或糖蛋白中具有如特异性识别并结合糖链的性质的物质,为酶或抗体以外物质的总称。凝集素对于糖链的特异性高,用凝集素可以特异性地检测具有糖链的物质。
作为用凝集素检测糖链或具有糖链的物质的方法,已知有表面等离子共振法、凝集素电泳法(例如,毛细管电泳)、凝集素层析柱法(例如,凝集素亲和层析法)、凝集素微阵列法、及使用在不溶性载体固定的凝集素或生物素标记的凝集素的夹心法等免疫学测定方法。
现有技术文献
专利文献
专利文献1:日本专利第4862093号公报
技术实现要素:
发明要解决的问题
已知凝集素对于糖链的识别特异性高,但与抗体对于糖链的结合力相比,对于糖链的结合力非常弱。例如,抗原抗体反应的解离常数在10-9~10-7左右,但凝集素与糖链的解离常数在10-7~10-3左右(junhirabayashi,etal,chem.soc.rev.,vol.442,pp.4443-4458,2013等)。因此,凝集素与糖链难以如抗原抗体反应般形成牢固的复合物。再者,通过形成凝集素与具有糖链的物质的复合物,测定该复合物的量来实施测定具有糖链的物质的测定法时,由于得到的复合物的量不足,会产生如无法获得所期待的测定灵敏度的问题。
此外,专利第4862093号公报(专利文献1)中公开了在聚阴离子性聚合物的存在下,形成对于抗体或凝集素等待分析物具有亲和性的亲和分子与带电载体分子的复合物的方法。该文献中记载了在聚阴离子性聚合物的存在下进行抗原抗体反应的事项,但对于具有糖链的物质与凝集素的反应则没有具体的描述。因此,基于专利文献1的公开内容,无法知晓聚阴离子性聚合物对于糖链与凝集素的相互作用产生何种影响的问题。
鉴于这些问题,本发明的目的是提供一种使具有糖链的物质与凝集素的复合物的量增加的方法。
解决问题的方法
为了解决上述问题,本发明人进行了潜心研究,结果发现在不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物的存在下进行糖链与凝集素的复合物形成反应时,具有糖链的物质与凝集素的复合物的量增加,可以解决上述的问题,从而完成了本发明。
具体地说,本发明的构成如下。
1)一种具有糖链的物质与凝集素的复合物形成方法,其特征在于,在不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物的存在下,使含有具有糖链的物质的试样与对于该具有糖链的物质的糖链具有亲和性的凝集素接触。
2)如上述1)所述的复合物形成方法,其中,不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物不带有该凝集素具有亲和性的糖链。
3)如上述1)或2)所述的复合物形成方法,其中,不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物为硫酸葡聚糖或其盐、或硫酸软骨素c或其盐。
4)选自下述i)~ii)的上述1)、2)、3)中任意一项所述的复合物形成方法,其中,i)不具有n-乙酰葡糖胺的水溶性多糖为硫酸葡聚糖或其盐,具有糖链的物质为α甲胎蛋白-l3(afp-l3),凝集素为小扁豆凝集素,
ii)不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物为硫酸葡聚糖或其盐、或硫酸软骨素c或其盐,具有糖链的物质为α(2,3)糖链游离型前列腺特异性抗原,凝集素为怀槐凝集素。
5)一种具有糖链的物质与对于该具有糖链的物质的糖链具有亲和性的凝集素的复合物形成促进剂,其特征在于,该复合物形成促进剂中含有水溶性多糖或水溶性化合物,所述水溶性多糖为不具有n-乙酰葡糖胺的水溶性多糖,所述水溶性化合物为含有不具有n-乙酰葡糖胺的多糖的水溶性化合物。
6)如上述5)所述的复合物形成促进剂,其中,不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物不带有该凝集素具有亲和性的糖链。
7)如上述5)或6)所述的复合物形成促进剂,其中,不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物为硫酸葡聚糖或其盐、或硫酸软骨素c或其盐。
8)选自下述i)~ii)的上述5)、6)、7)中任意一项所述的复合物形成促进剂,其中,i)不具有n-乙酰葡糖胺的水溶性多糖为硫酸葡聚糖或其盐,具有糖链的物质为α甲胎蛋白-l3(afp-l3),凝集素为小扁豆凝集素,
ii)不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物为硫酸葡聚糖或其盐、或硫酸软骨素c或其盐,具有糖链的物质为α(2,3)糖链游离型前列腺特异性抗原,凝集素为怀槐凝集素。
9)一种具有糖链的物质的测定方法,其特征在于,用上述1)所述的复合物形成方法形成具有糖链的物质与凝集素的复合物后,测定该复合物的量。
发明的效果
通过实施本发明的复合物形成方法,具有糖链的物质与凝集素的复合物的量增加。因此,通过利用本发明的复合物形成方法,在不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物的存在下测定具有糖链的物质,能够以高灵敏度测定具有糖链的物质。
并且,本发明的复合物形成方法适用于利用凝集素对于糖链的亲和性的所有反应、检测、测定、糖链的分析等,具有提高检测或测定的灵敏度、使高精度的糖链分析成为可能、且能够高效地分离具有糖链的物质等的效果。
附图说明
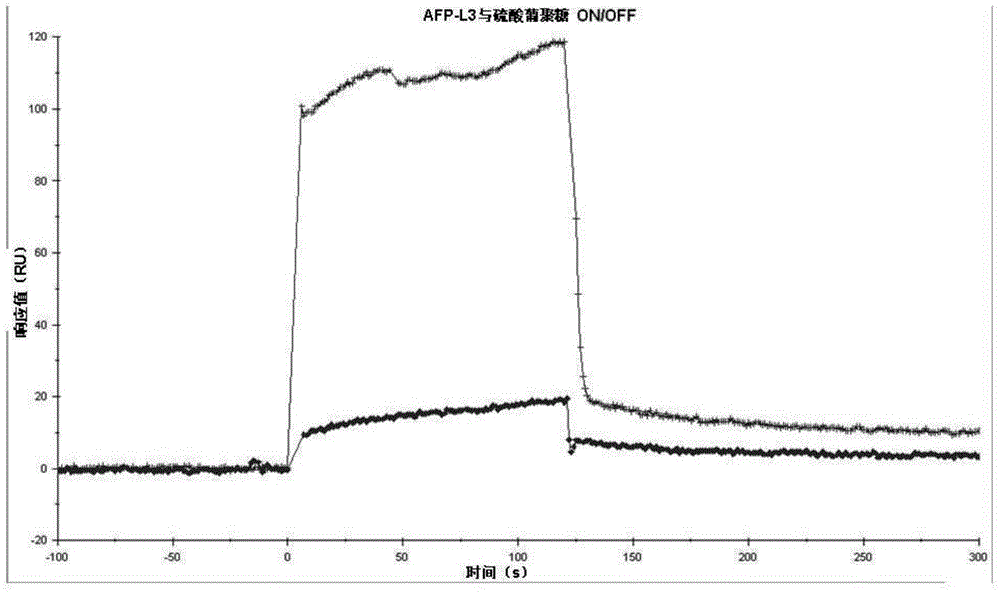
图1为用实施例1得到的含有硫酸葡聚糖钠盐的afp-l3溶液,利用表面等离子共振法(biacore)测定得到的传感图谱(+),及用不含有硫酸葡聚糖钠盐的afp-l3溶液,利用表面等离子共振法(biacore)测定得到的传感图谱(◆)。
图2为用实施例1得到的含有硫酸软骨素c钠盐的afp-l3溶液,利用表面等离子共振法(biacore)测定得到的传感图谱(□),及用不含有硫酸软骨素c钠盐的afp-l3溶液,利用表面等离子共振法(biacore)测定得到的传感图谱(◆)。
图3为实施例2及实施例3中使用的微芯片的示意图。
图4为实施例2及实施例3中使用的微芯片的芯片内流路的示意图。
图5为表示实施例2得到的硫酸软骨素c钠盐的浓度与复合物1组分的峰面积的关系的曲线图。
图6为表示实施例3得到的硫酸葡聚糖钠盐的浓度与复合物1组分的峰面积的关系的曲线图。
具体实施方式
1、本发明的复合物形成方法
本发明的复合物形成方法为“一种具有糖链的物质与凝集素的复合物形成方法,其特征在于,在不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物的存在下,使含有具有糖链的物质的试样与对于该具有糖链的物质的糖链具有亲和性的凝集素接触”。
以下,有将“对于具有糖链的物质的糖链具有亲和性的凝集素”简称为“凝集素”的情形。
不具有n-乙酰葡糖胺的水溶性多糖
作为本发明的不具有n-乙酰葡糖胺的水溶性多糖,通常为多糖,可以列举作为成分糖不具有n-乙酰葡糖胺的水溶性多糖。
例如,可以列举一种单糖通过糖苷键多次聚合了的同多糖(简单多糖)、多种单糖通过糖苷键多次聚合了的杂多糖(复合多糖)、或糖醇等,作为成分糖不具有n-乙酰葡糖胺的水溶性多糖。
就水溶性的同多糖(简单多糖)且作为成分糖不具有n-乙酰葡糖胺的水溶性多糖而言,可以列举葡聚糖、琼脂糖、卡拉胶、硫酸葡聚糖、羧甲基葡聚糖、岩藻多糖、海萝胶、壳聚糖及这些的衍生物等。
就水溶性的杂多糖(复合多糖)且作为成分糖不具有n-乙酰葡糖胺的水溶性多糖而言,可以列举紫菜胶、葡甘聚糖、海藻酸、黄原胶及这些的衍生物等。
就水溶性的糖醇且作为成分糖不具有n-乙酰葡糖胺的水溶性多糖,可以列举赤藓糖醇、木糖醇及这些的衍生物等。
这些不具有n-乙酰葡糖胺的水溶性多糖中,优选水溶性同多糖,更优选硫酸葡聚糖及其衍生物,特别优选硫酸葡聚糖。
作为本发明的不具有n-乙酰葡糖胺的水溶性多糖,例如,也可以为锂盐、钠盐、钾盐等碱金属盐,钙盐、镁盐等碱土金属盐,铵盐、三乙胺盐、二甲胺盐等有机胺盐。
优选的盐会根据多糖或具有多糖的化合物的种类有所不同,但优选为钠盐,更优选为硫酸葡聚糖钠盐。
并且,本发明的不具有n-乙酰葡糖胺的水溶性多糖的分子量为数百~数百万,优选为约1,000~1,000,000,更优选为约5,000~500,000。
含有不具有n-乙酰葡糖胺的多糖的水溶性化合物
作为本发明的含有不具有n-乙酰葡糖胺的多糖的水溶性化合物,为多糖结合了蛋白质或脂质的所谓的复合糖质,作为其多糖部分的成分糖,可以列举不具有n-乙酰葡糖胺的水溶性多糖。
例如,可以是粘多糖结合了蛋白质的蛋白多糖等复合糖质,作为其粘多糖部分的成分糖,可以列举不具有n-乙酰葡糖胺的水溶性多糖。
作为这种水溶性的蛋白多糖,可以列举硫酸软骨素a、硫酸软骨素b、硫酸软骨素c、硫酸软骨素d、硫酸软骨素e等硫酸软骨素及这些的衍生物等。其中,优选硫酸软骨素c及其衍生物,特别优选硫酸软骨素c。
就本发明的含有不具有n-乙酰葡糖胺的多糖的水溶性化合物而言,例如,也可以是锂盐、钠盐、钾盐等碱金属盐,钙盐、镁盐等碱土金属盐,铵盐、三乙胺盐、二甲胺盐等有机胺盐。
优选的盐会根据多糖或具有多糖的化合物的种类有所不同,但优选为钠盐。例如,优选为硫酸软骨素纳盐,更优选为硫酸软骨素c钠盐。
并且,本发明的含有不具有n-乙酰葡糖胺的多糖的水溶性化合物的分子量为数百~数百万,优选为约1,000~1,000,000,更优选为约5,000~500,000。
作为本发明的不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物,选自“在其存在下使具有糖链的物质与凝集素接触并反应时,在该反应时的条件下,显示在该反应液中呈均匀的溶解状态的、充分的水溶性的化合物”。优选的具体例子,如上所述。
此外,以下有将“不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物”统称为“本发明的多糖类”的情形。
具有糖链的物质
本发明的具有糖链的物质为具有“具有凝集素具有亲和性(结合)的糖链结构的糖链”的物质即可,没有特别的限定。
作为具有糖链的物质的具体例子,例如,可以列举afp、psa、ca19-9、ca125、pivka-ii、足细胞标志蛋白等肿瘤标志物,α1-球蛋白、α2-球蛋白、β-球蛋白、γ-球蛋白、胎球蛋白等血清蛋白,胶原等纤维蛋白,促性腺激素、甲状腺刺激激素、人绒毛膜促性腺激素(hcg)、促黄体激素(lh)、卵泡刺激素(fsh)、甲状腺刺激激素(tsh)等激素类,核糖核酸酶、高峰淀粉酶、γ-谷氨酰转移酶(γ-gtp)、碱性磷酸酶、胆碱酯酶、溶菌酶等酶类,纤维连接蛋白、蛋白多糖等细胞间质,α1-酸性糖蛋白、α1-抗胰蛋白酶、α2-巨球蛋白、α2-hs糖蛋白、转铁蛋白、结合珠蛋白、铜蓝蛋白、癌胚抗原(cea)、免疫球蛋白(igg、igm、iga、igd、ige)、补体成分(c1、c1q、c1r、c1s、c4、c2、c3、c5、c6、c7、c8、c9)、干扰素、凝血因子(纤维蛋白原、凝血酶原、v因子、vii因子、ix因子、x因子、xi因子、xii因子、xiii因子等)、抗凝血酶iii、促红细胞生成素、多能干细胞(es细胞、ips细胞等)的未分化标志物(sseq-1、ssea-3/4、足细胞标志蛋白等)等。
作为本发明的具有糖链的物质,优选为afp、psa、足细胞标志蛋白,更优选为afp及psa。
本发明的具有糖链的物质中,也包括具有凝集素具有亲和性的糖链结构的“糖链”。例如,可以列举直链淀粉、支链淀粉、纤维素、糖原等。已确认在小鼠es细胞等未分化干细胞中表达的lewisx(galβ1-4[fucα1-3]glcnac)、或从糖蛋白等游离的糖链的片段等也包括在本发明的具有糖链的物质中。优选的是lewisx(galβ1-4[fucα1-3]glcnac)。
作为本发明的具有糖链的物质中的糖链,可以列举凝集素具有亲和性的糖链结构。
例如,可以列举上述具有糖链的物质所具有的的糖链。作为一个例子,例如,可以列举在癌症患者的血液等中观察到的糖链。
作为具体的例子,例如,可以列举
1)附加了岩藻糖的糖链:在肝癌患者观察到的apf-l3的糖链、即fucα1→6glcnac(核心岩藻糖,kobayashiy.etal.,j.biol.chem.,vol.287,no.41,pp.33973-33982,october5,2012)等,
2)末端附加了唾液酸的糖链:在肝癌患者观察到的psa的糖链、即siaα2→3gal(chikaraoyamaetal.,glycobiology,vol.14,no.8,pp.671-679,2004,yoneyamat.etal.,biochem.biophys.res.commun.,vol.448,no.4,pp.390-396,2014,tomokazuishikawaetal.,j.urology,vol.196,p.e331)等,
3)附加了n-乙酰半乳糖胺的糖链:在肝癌患者观察到的psa的糖链、即galnacβ1-r(日本专利第5630757号,takatoshikaya,etal.,anal.chem.,vol.87,no.3,pp.1797-1803,2015)等。
例如,afp为肝细胞癌标志物,但不局限于肝细胞癌,在慢性肝炎或肝硬化中血液浓度也呈现高的数值。但在肝细胞癌症患者的血清中高频度地观察到带有在糖链中附加了α-l-岩藻糖残基、或n-乙酰葡糖胺残基(平分型n-乙酰葡糖胺)的糖链(fucα1→6glcnac)的afp(afp-l3)。
并且,已知psa为前列腺癌标志物。就在正常人的血清中观察到的psa而言,大部分为具有糖链的末端唾液酸残基以α(2,6)的形式结合在糖链末端的第2个半乳糖残基上的n型糖链的psa。然而,已知在前列腺癌患者的血清中,带有糖链的末端唾液酸残基以α(2,3)的形式结合在糖链末端的第2个半乳糖残基上的糖链(siaα2→3gal)的psa(以下,称之为“α(2,3)糖链psa”)有所增加(tajirim.etal.,2008,vol.18,pp.2-8)。
具体地说,糖链的末端唾液酸残基以α(2,3)的形式结合在糖链末端的第2个半乳糖残基上的糖链(siaα2→3gal)是指以下的结构。
下述式(i)为α(2,3)糖链psa的糖链结构的一个例子。
并且,作为本发明的具有糖链的物质,也可以列举已知为细胞的未分化标志物或分化标志物的糖蛋白的糖链。例如,可以列举近年来已知在es细胞、ips细胞等多能干细胞的细胞表面存在的糖链结构(fucα1-2galβ1-3glcnac)或(fucα1-2galβ1-3galnac)。并且,作为具有该糖链结构的未分化糖链标志物,已鉴定的有复合糖质、即足细胞标志蛋白(podocalyxin)(wo2013/065302号)。
含有具有糖链的物质的试样
作为本发明的含有具有糖链的物质的试样,例如,可以列举血液、血清、血浆、尿、精液、脑脊液、唾液、汗、腹水、粪便悬浮液、腹水、组织提取液、组织切片、组织活检试样、器官等源自人类或动物等生物体的试样,或由源自这些生物体的试样制备的病毒、细菌、细胞等微生物,或由这些微生物制备的试样。
其中,优选为血液、血清或血浆,更优选为血清。
细胞提取液、源自上述微生物的提取液、或由该提取液制备的试样也可以用作为本发明的含有具有糖链的物质的试样。
并且,上述细菌、细胞等中有分泌糖蛋白的情形。并且,会有糖链从在细胞膜等存在的糖蛋白游离的情形。因此,上述源自生物体的试样或微生物的培养液也能够用作为本发明的含有具有糖链的物质的试样。
本发明的含有具有糖链的物质的试样可以稀释在水或适宜的缓冲液中后进行使用。作为此时使用的水,例如,可以列举蒸馏水,去离子水等纯化水等。作为缓冲液,例如,可以列举盐酸三羟甲基氨基甲烷(tris)缓冲液、磷酸缓冲液、佛罗那缓冲液、硼酸缓冲液、古德氏缓冲液、tris-hcl缓冲液、mes缓冲液、hepes缓冲液、硼酸缓冲液、磷酸缓冲液、佛罗那缓冲液、古德氏缓冲液等。就这些缓冲液中的缓冲剂浓度而言,通常为5~1,000mm,优选在5~300mm的范围内适宜选择。对于其ph没有特别的限定,例如,可以在5~9的范围。
此外,本说明书中会有不加以区分地使用“含有具有糖链的物质的试样”和“具有糖链的物质”的情况。即,本说明书中描述为“含有具有糖链的物质的试样”时也会包括“具有糖链的物质”。
凝集素
本发明中使用的凝集素为对于具有复合物形成对象的糖链的物质的糖链具有亲和性、且识别该糖链后与该糖链结合的凝集素即可,从已知的凝集素中可以任意选用具有上述性质的凝集素。其中,优选为与该糖链特异性结合的凝集素。
对于凝集素的来源没有特别的限定,可以是源自动物、植物、真菌细菌、病毒等的凝集素。并且,可以是天然的凝集素,也可以是重组物,也可以是市售的凝集素。
作为凝集素的具体例子,例如,可以列举莲花豆凝集素(ltl)、豌豆凝集素(psa)、小扁豆凝集素(lensculinarisagglutinin,lca)、金雀花凝集素(uea-1)、曲霉凝集素(aol)、橙黄网孢盘菌凝集素(aal)、蘑菇凝集素(aba)、木菠萝凝集素(jacalin)、花生凝集素(pna)、紫藤凝集素(wfa)、尾穗苋凝集素(aca)、桑橙凝集素(mpa)、食用蜗牛凝集素(hpa)、毛苕子凝集素(vva)、双花小扁豆凝集素(dba)、大豆凝集素(sba)、黑豆凝集素(gsl-i、gsl-ia4、gsl-ii、gsl-ib4)、四棱豆凝集素(ptl-i)、芸豆凝集素(pha-e,pha-l)、紫荆花菊凝集素(bpl)、黑接骨木凝集素(sna)、日本接骨木凝集素(ssa)、栝楼凝集素(tja-ii,tja-i)、怀槐凝集素(maackiaamurensislectin,maa,mah)、小麦胚芽凝集素(wga)、曼陀罗牵牛花凝集素(dsa)、番茄凝集素(lel)、马铃薯凝集素(stl)、荨麻凝集素(uda)、美洲商陆凝集素(pwm)、鸡冠刺桐凝集素(eca)、蓖麻凝集素(rca120)、喇叭水仙凝集素(npa)、刀豆凝集素(cona)、雪花莲外源凝集素(gna)、朱顶红凝集素(hhl)及大叶黄杨凝集素(eel)等。
并且,可以列举识别多能干细胞的未分化标志物所具有的糖链的凝集素。例如,识别已知为多能干细胞的未分化标志物的足细胞标志蛋白所具有的糖链(fucα1-2galβ1-3glcnac)或(fucα1-2galβ1-3galnac)的凝集素、即bc2lcn(tatenoh,etal.,j.biol.chem.,vol.286,no.23,pp.20345-20353,2011)。bc2lcn是与源自革兰氏阴性细菌(burkholderiacenocepacia)的bc2l-c蛋白的n末端区域对应的凝集素(genbankaccessionno.yp_002232818)。作为本发明中使用的凝集素,优选为lca、maa或bc2lcn,更优选为lca或maa。
以下的表1中示出了本发明中使用的凝集素的例子、各凝集素的来源(origin)、该凝集素具有亲和性的糖链结构(specificity)的例子。
表1
凝集素可以用可检测的标记物进行标记。作为用于标记凝集素的标记物,例如,可以列举荧光色素(异硫氰酸荧光素(fitc)、cy5、alexafluor647等)、酶(辣根过氧化物酶)、辅酶、化学发光物质、放射性物质(32p、14c、125i、3h、131i等)、生物素等标记物。并且,标记物可以直接结合在凝集素上,也可以通过适宜的中介分子来结合。凝集素可以用与标记物的种类相匹配的本身已知的标记方法进行标记。
进而,也可以将凝集素固定在不溶性载体等固定相上。作为用作为固定相的不溶性载体,为在本领域通常使用的载体即可。作为其形状,例如,可以是粒子(乳胶粒子、珠子、磁珠等)、管、碳纳米管、芯片、圆盘状片、微粒子、薄膜、微管、板、微孔板、过滤器等在本领域经常使用的形状,对于其材质也没有特别的限定。
并且,本发明中也可以使用将凝集素固定在基板上来制作的微芯片、微阵列、宏阵列、微量滴定板。作为将凝集素固定在不溶性载体上的方法,可以列举与所使用的不溶性载体的种类相匹配的本身已知的固定方法。
本发明的复合物形成方法
本发明的复合物形成方法为最终能够得到“含有本发明的多糖类的、具有糖链的物质与凝集素的复合物”的方法即可。优选为在本发明的多糖类的存在下,使含有具有糖链的物质的试样与对于该具有糖链的物质的糖链具有亲和性的凝集素接触,从而最终能够得到“含有本发明的多糖类的、具有糖链的物质与凝集素的复合物的溶液”的方法。
具体地说,本发明的复合物形成方法可以是,
i)混合含有具有糖链的物质的试样与本发明的多糖类或含有本发明的多糖类的溶液来得到混合液后,将得到的混合液与对于该具有糖链的物质的糖链具有亲和性的凝集素或含有该凝集素的溶液混合,使之反应的方法,
ii)混合对于具有糖链的物质的糖链具有亲和性的凝集素或含有该凝集素的溶液与本发明的多糖类或含有本发明的多糖类的溶液来得到混合液后,将得到的混合液与含有具有糖链的物质的试样混合,使之反应的方法,
iii)混合含有具有糖链的物质的试样与本发明的多糖类或含有本发明的多糖类的溶液来得到混合液后,将得到的混合液、与含有对于该具有糖链的物质的糖链具有亲和性的凝集素和本发明的多糖类的溶液混合,使之反应的方法,
iv)混合含有具有糖链的物质的试样与对于该具有糖链的物质的糖链具有亲和性的凝集素或含有该凝集素的溶液并使之反应后,将得到的反应液与本发明的多糖类或含有本发明的多糖类的溶液混合,从而得到混合液的方法等。
本发明的复合物形成方法中,在本发明的多糖类的存在下,使具有糖链的物质的糖链与凝集素反应,形成具有糖链的物质与凝集素的复合物。即,在上述方法中的“反应”是指具有糖链的物质与凝集素的复合物形成反应。上述方法中,优选为i)~iii)的方法,更优选为i)或iii)的方法。
用自动分析仪实施本发明的复合物形成方法时,可以在所使用的任意试液中含有本发明的多糖类。也可以将含有本发明的多糖类的溶液设置在自动分析仪的添加试剂的一个单元中。再者,在采用自动分析仪的测定中,在本发明的多糖类的存在下使具有糖链的物质与凝集素接触,从而使具有糖链的物质的糖链与凝集反应即可。
作为含有本发明的多糖类的溶液所使用的溶剂,例如,可以列举水或缓冲液等。作为含有凝集素的溶液所使用的溶剂,例如,可以列举缓冲液。作为含有本发明的多糖类和凝集素的溶液所使用的溶剂,例如,可以列举缓冲液。作为含有本发明的多糖类的溶液所使用的水,例如,可以列举蒸馏水、去离子水等纯化水等。
作为在含有本发明的多糖类的溶液、含有凝集素的溶液及含有凝集素和本发明的多糖类的溶液中使用的缓冲液的具体例子,例如,可以列举盐酸三羟甲基氨基甲烷(tris)缓冲液、磷酸缓冲液、佛罗那缓冲液、硼酸缓冲液、古德氏缓冲液、tris-hcl缓冲液、mes缓冲液、hepes缓冲液、硼酸缓冲液、磷酸缓冲液、佛罗那缓冲液、古德氏缓冲液等。用市售的试剂盒或自动分析仪等测定设备进行具有糖链的物质与凝集素的复合物形成反应时,也可以使用试剂盒中附带的缓冲液、自动分析仪专用的缓冲液等(例如,后述的biacoretm用的hbs-ep缓冲液等)。
并且,作为这些缓冲液的缓冲剂浓度,通常为5~1,000mm,优选在5~300mm的范围内适宜选择。对于其ph也没有特别的限定,例如,可以在5~9的范围。
并且,这些缓冲液中也可以含有在本领域通常使用的缓冲剂、反应促进剂、蛋白质、盐类、表面活性剂等稳定剂、防腐剂等不影响共存的试剂等的稳定性,不妨碍糖链与凝集素的反应的试剂。并且,其浓度也可以在本领域通常使用的浓度范围内适宜选择。
在含有具有糖链的物质的溶液中使用的溶剂的具体例子及其条件等如上所述。
就含有本发明的多糖类的溶液中的本发明的多糖类的浓度、含有凝集素的溶液中的凝集素的浓度、及含有具有糖链的物质的试样中的具有糖链的物质的浓度而言,为可以使在本发明的多糖类的存在下使具有糖链的物质与凝集素接触、反应时的反应液中的浓度处于各使用目的的浓度范围内即可。
例如,含有本发明的多糖类的溶液中的本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为0.5(w/v)%~15(w/v)%,进一步优选为0.5~10(w/v)%。含有凝集素的溶液中的凝集素的浓度为1μg/ml~30mg/ml,优选为10μg/ml~20mg/ml,更优选为1~10mg/ml。含有具有糖链的物质的试样中的具有糖链的物质的浓度为1pg/ml~1mg/ml,优选为10pg/ml~100μg/ml,更优选为1ng~50μg/ml。
本发明的复合物形成方法中,在本发明的多糖类的存在下使具有糖链的物质与凝集素接触并反应时的、反应液中的本发明的多糖类的浓度根据所使用的本发明的多糖类的种类、或随后进行的测定方法、分析方法等而有所不同,但为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为0.5(w/v)%~15(w/v)%,进一步优选为0.5~10(w/v)%。
在后述的毛细管电泳仪的微流路内使具有糖链的物质与凝集素反应时,微流路内的本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为1(w/v)%~15(w/v)%,进一步优选为4~10(w/v)%。该反应液中的凝集素的浓度为1μg/ml~30mg/ml,优选为10μg/ml~20mg/ml,更优选为1~10mg/ml。该反应液中的具有糖链的物质的浓度为1pg/ml~1mg/ml,优选为10pg/ml~100μg/ml,更优选为1ng~50μg/ml。
此外,在上述方法iii)的情形,最终得到的“含有本发明的多糖类的、具有糖链的物质与凝集素的复合物的溶液”中的本发明的多糖类的浓度、凝集素的浓度、及具有糖链的物质的浓度分别在上述使用目的的浓度范围内即可。
作为使含有具有糖链的物质的试样与凝集素接触并反应的条件、及在本发明的多糖类的存在下使含有具有糖链的物质的试样与凝集素接触并反应的条件,为具有糖链的物质的糖链与凝集素充分反应,可以形成具有糖链的物质与凝集素的复合物的条件即可。
例如,含有具有糖链的物质的试样与凝集素的反应时的温度在不抑制具有糖链的物质的糖链与凝集素的反应的范围内即可,对于此没有特别的限定,例如,可以为10~50℃,优选为20~40℃。并且,其反应时间根据所使用的凝集素、ph、温度等的反应条件而有所不同。例如,可以为1~60分钟,优选在1~15分钟左右使之反应。
以下,说明本发明的复合物形成方法中使用的、本发明的多糖类与凝集素的选择方法。
即,就本发明的复合物形成方法中使用的本发明的多糖类而言,选用不带有本发明的复合物形成方法中使用的凝集素具有亲和性的糖链结构的多糖类。即,选用形成某具有糖链的物质与凝集素的复合物时,对于该具有糖链的物质的糖链具有亲和性,识别并结合该糖链的凝集素。再者,作为本发明的多糖类,选用不带有所选用的该凝集素具有亲和性的糖链结构的多糖类。
例如,在形成某具有糖链的物质与凝集素的复合物的情形,选用上述表1中记载的凝集素时,作为本发明的多糖类,选用不带有表1中记载的该凝集素具有亲和性的糖链结构(specificity)的本发明的糖链。
作为具体的例子,例如,在形成带有变异糖链(fucα1→6glcnac)的afp(afp-l3)与凝集素的复合物的情形,作为与该变异糖链(fucα1→6glcnac)具有亲和性的凝集素,可以使用lca。此时,作为afp-l3与lca接触时(反应时)共存的本发明的多糖类,选用不带有lca具有亲和性的糖链(fucα1→6glcnac、α-man)的多糖类。作为这种本发明的多糖类,例如,可以列举硫酸葡聚糖、硫酸软骨素、或这些的盐(例如,硫酸葡聚糖钠盐、硫酸软骨素c钠盐)等。
硫酸葡聚糖具有葡萄糖经由1,6键聚合的葡聚糖的一部分被硫酸化了的结构。硫酸软骨素具有在d-葡萄糖醛酸(glcua)与n-乙酰-d-半乳糖胺(galnac)两种糖重复的糖链上结合了硫酸的结构。但硫酸葡聚糖、硫酸软骨素均不具有lca具有亲和性的糖链(fucα1→6glcnac、α-man)。
例如,在形成带有变异糖链(siaα2→3gal)的psa与凝集素的复合物的情形,作为与糖链(siaα2→3gal)具有亲和性的凝集素,可以使用maa。此时,就psa与maa的反应时共存的本发明的多糖类而言,选用不带有maa具有亲和性的糖链(siaα2→3galβ1→4glcnac)的多糖类。作为这种本发明的多糖类,例如,可以列举硫酸葡聚糖、硫酸软骨素或这些的盐(例如,硫酸葡聚糖钠盐、硫酸软骨素c钠盐等)。
在形成带有细胞表面未分化标志物(fucα1-2galβ1-3glcnac)和/或(fucα1-2galβ1-3galnac)的多能干细胞与凝集素的复合物的情形,作为与该糖链具有亲和性的凝集素,可以使用bc2lcn。此时,就多能干细胞与bc2lcn接触时(反应时)共存的本发明的多糖类而言,选用不带有bc2lcn具有亲和性的糖链(fucα1-2galβ1-3glcnac)的、也不带有(fucα1-2galβ1-3galnac)的多糖类。作为这种本发明的多糖类,例如,可以列举硫酸葡聚糖、硫酸软骨素或这些的盐(例如,硫酸葡聚糖钠盐、硫酸软骨素c钠盐等)。
以下,说明本发明的复合物形成方法的具体例子,但本发明并不局限于以下的复合物形成方法。
i)混合含有1pg/ml~1mg/ml的afp-l3的血清等试样与含有0.01(w/v)%~50(w/v)%的硫酸葡聚糖钠盐的5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液,得到混合液。混合所得到的混合液与含有1μg/ml~30mg/ml的lca和0.01(w/v)%~50(w/v)%的硫酸葡聚糖钠盐的5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液后,在10~50℃反应1~60分钟。该反应液中的afp-l3的浓度为1pg/ml~1mg/ml,硫酸葡聚糖钠盐的浓度为0.01(w/v)%~50(w/v)%,lca的浓度为1μg/ml~30mg/ml。
ii)混合含有1pg/ml~1mg/ml的afp-l3的血清等试样与含有0.01(w/v)%~50(w/v)%的硫酸软骨素c钠盐的5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液,得到混合液。混合所得到混合液与含有1μg/ml~30mg/ml的lca和0.01(w/v)%~50(w/v)%的硫酸软骨素c钠盐的5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液后,在10~50℃反应1~60分钟。该反应液中的afp-l3の浓度为1pg/ml~1mg/ml,硫酸软骨素c钠盐的浓度为0.01(w/v)%~50(w/v)%,lca的浓度为1μg/ml~30mg/ml。
iii)混合含有1pg/ml~1mg/ml的α(2,3)糖链游离型psa的血清等试样与含有0.01(w/v)%~50(w/v)%的硫酸葡聚糖钠盐的5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液,得到混合液。混合所得到的混合液与含有1μg/ml~30mg/ml的maa和0.01(w/v)%~50(w/v)%的硫酸葡聚糖钠盐的5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液后,在10~50℃下反应1~60分钟。该反应液中的α(2,3)糖链游离型psa的浓度为1pg/ml~1mg/ml,硫酸葡聚糖钠盐的浓度为0.01(w/v)%~50(w/v)%,maa的浓度为1μg/ml~30mg/ml。
iv)混合含有1pg/ml~1mg/ml的α(2,3)糖链游离型psa的血清等试样与含有0.01(w/v)%~50(w/v)%的硫酸软骨素c钠盐的5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液,得到混合液。混合所得到的混合液与含有1μg/ml~30mg/ml的maa和0.01(w/v)%~50(w/v)%的硫酸软骨素c钠盐的5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液后,在10~50℃下反应1~60分钟。该反应液中的α(2,3)糖链游离型psa的浓度为1pg/ml~1mg/ml,硫酸软骨素c钠盐的浓度为0.01(w/v)%~50(w/v)%,maa的浓度为1μg/ml~30mg/ml。
v)混合含有1pg/ml~1mg/ml的afp-l3的血清等试样与含有1μg/ml~30mg/ml的lca和0.01(w/v)%~50(w/v)%的硫酸葡聚糖钠盐或硫酸软骨素c钠盐的5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液后,在10~50℃反应1~60分钟。该反应液中的afp-l3的浓度为1pg/ml~1mg/ml,硫酸葡聚糖钠盐或硫酸软骨素c钠盐的浓度为0.01(w/v)%~50(w/v)%,lca的浓度为1μg/ml~30mg/ml。
vi)混合含有1pg/ml~1mg/ml的α(2,3)糖链游离型psa的血清等试样与含有1μg/ml~30mg/ml的maa和0.01(w/v)%~50(w/v)%的硫酸葡聚糖钠盐或硫酸软骨素c钠盐的5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液后,在10~50℃反应1~60分钟。该反应液中的α(2,3)糖链游离型psa的浓度为1pg/ml~1mg/ml,硫酸葡聚糖钠盐或硫酸软骨素c钠盐的浓度为0.01(w/v)%~50(w/v)%,maa的浓度为1μg/ml~30mg/ml。
vii)混合含有1pg/ml~1mg/ml的afp-l3的血清等试样与含有0.01(w/v)%~50(w/v)%的硫酸葡聚糖钠盐或硫酸软骨素c钠盐的5~1000mmhbs-ep缓冲液(ph5~9)等缓冲液,得到混合液。使所得到的混合液与在传感芯片等固定相上固定的lca接触,在10~50℃反应1~60分钟。该反应液中的afp-l3的浓度为1pg/ml~1mg/ml,硫酸葡聚糖钠盐或硫酸软骨素c钠盐的浓度为0.01(w/v)%~50(w/v)%,lca的浓度为1μg/ml~30mg/ml。
viii)混合含有1pg/ml~1mg/ml的α(2,3)糖链游离型psa的血清等试样与含有0.01(w/v)%~50(w/v)%的硫酸葡聚糖钠盐或硫酸软骨素c钠盐的5~1000mmhbs-ep缓冲液(ph5~9)等缓冲液,得到混合液。使所得到的混合液与在传感芯片等固定相上固定的maa接触,在10~50℃反应1~60分钟。该反应液中的α(2,3)糖链游离型psa的浓度为1pg/ml~1mg/ml,硫酸葡聚糖钠盐或硫酸软骨素c钠盐的浓度为0.01(w/v)%~50(w/v)%,maa的浓度为1μg/ml~30mg/ml。
此外,就本发明的复合物形成方法而言,具有糖链的物质与凝集素的复合物的量增加的理由不是很明确,但可以认为是在本发明的多糖类的存在下使具有糖链的物质与凝集素反应,从而使生成的复合物稳定化时,具有糖链的物质与凝集素不会再次分离、或分离的量減少,其结果与在没有本发明的多糖类的情形下进行反应时相比该复合物的量增加的缘故。或者,可以认为是由于本发明的多糖类的存在,凝集素对于具有糖链的物质的糖链的亲和性变高,因而与没有本发明的多糖类的情形下使具有糖链的物质与凝集素接触时相比,在本发明的多糖类的存在下使具有糖链的物质与凝集素接触时该复合物的量增加的缘故。
2、本发明的复合物形成方法的应用
本发明的复合物形成方法能够应用在利用凝集素对于糖链的亲和性的所有测定方法、分析方法、检测方法等。
作为上述利用凝集素对于糖链的亲和性的测定方法、分析方法、或检测方法,例如,可以列举表面等离子共振法、毛细管电泳、凝集素亲和层析、凝集素微阵列法、elisa、组织染色,电泳法,流式细胞术等。这些方法中,优选为表面等离子共振法或毛细管电泳。
以下,举出在上述各方法应用的例子来说明本发明的复合物形成方法。
就在各方法中使用的本发明的多糖类、具有糖链的物质、含有具有糖链的物质的试样及凝集素等的、各成分的具体例子、各成分的溶液中使用的溶剂、该溶液中的各成分的浓度、反应条件等而言,与在上述本发明的复合物形成方法相关说明中描述的相同。
并且,在以下说明的各应用方法中使用的本发明的多糖类和凝集素的选用条件也与以上描述的相同。
此外,实施本发明的复合物形成方法后,实施具有糖链的物质的测定、糖链的检测、糖链结构的解析等时,优选在本发明的多糖类的存在下实施测定、检测等。也就是说,复合物形成后至目的反应或目的测定、检测结束为止(例如,以复合物的测定、检测作为目的时,直至测定、检测结束为止),优选在含有复合物的溶液中使本发明的多糖类共存。该溶液的种类及溶液中的多糖类的浓度如上所述。
例如,后述的免疫学测定方法等中,通过洗涤处理等去除没有形成复合物的游离的、具有糖链的物质或凝集素时,优选用含有本发明的多糖类的洗涤液进行洗涤処理。并且,优选在本发明的多糖类的存在下测定该复合物的量。
应用于表面等离子共振法
表面等离子共振法是利用表面等离子在金属、液体界面激发时产生的、所谓表面等离子共振(surfaceplasmonresonance,spr)的光学现象来解析(测定)生物体分子间的相互作用的、分子间相互作用解析系统。
作为将本发明的复合物形成方法应用在表面等离子共振法的方法,例如,可以列举以下的方法。
在传感芯片上固定作为测定对象的、对于具有糖链的物质的糖链具有亲和性的凝集素。制备含有测定对象的试样与本发明的多糖类的溶液后,使其经由表面等离子共振分光装置的流路在固定有凝集素的传感芯片的表面流动即可。
作为得到在以上使用的含有测定对象的试样与本发明的多糖类的溶液的方法,为最终能够得到该溶液的方法即可。例如,可以列举在该试样中添加本发明的多糖类或其溶液的方法、或将该试样与本发明的多糖类溶解在水或适宜的缓冲液中的方法。后述的其他测定方法中的“含有测定对象的试样与本发明的多糖类的溶液”也可以用相同的方法获得。
就表面等离子共振法的测定而言,依据表面等离子共振分光装置附带的使用说明书,在该测定最佳的条件进行即可。
在装置的流路流出的、含有具有糖链的物质的试样与本发明的多糖类的溶液中的本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为0.5(w/v)%~15(w/v)%,进一步优选为0.5~10(w/v)%。
与现有的表面等离子共振法相比,实施本发明的复合物形成方法时可以更多地得到具有糖链的物质与凝集素的复合物。因此,通过在现有的表面等离子共振法中应用本发明的复合物形成方法,进而确认或解析具有糖链的物质结合的凝集素,可以精确且高灵敏度地得到该物质具有的糖链的结构信息。
并且,近年来开始实施用表面等离子共振法检测、测定具有作为疾病标志物的变异糖链的糖蛋白的方法(takatoshikaya,etal.,anal.chem.,vol.87,no.3,pp.1797-1803,2015)。实施采用本发明的复合物形成方法的表面等离子共振法,可以高灵敏度地检测具有该变异糖链的糖蛋白,因而本发明的方法在疾病等的判断等临床检查领域极为有用。
作为表面等离子共振法的代表性分析系统,可以列举biacoretm法。通常,将biacore表面等离子共振法简称为biacore法。并且,提及到“biacore”时,也指在biacore法的分析系统中使用的biacore表面等离子共振设备。
以下,说明将硫酸葡聚糖钠盐用作为本发明的多糖类、将lca用作为凝集素,利用基于本发明的复合物形成方法的biacore法来检测afp-l3的一个例子。
用常规方法将lca固定在biacore专用芯片(传感芯片)上,并制备含有测定对象的试样与硫酸葡聚糖钠盐(0.01(w/v)%~50(w/v)%)的缓冲液(例如,biacore专用运行缓冲液hbs-ep)。将该溶液以10~50℃、优选为20~40℃、流速10~50μl/分钟的条件输送至传感芯片上并使之反应。由此,试样中含有afp时,在传感芯片上形成afp-l3与lca的复合物。输送开始60~180秒后,进行基于biacore的测定。用其他缓冲液、含有afp的缓冲液、含有afp和本发明的多糖类的缓冲液等进行相同的测定,基于得到的数值调整背景值。基于得到的biacore测定结果,通过常规方法可以得到afp-l3的量。
也可以用已知浓度的afp-l3同样地进行biacore测定,基于得到的标准曲线来确定afp-l3的量。
应用于毛细管电泳
用本发明的复合物形成方法形成具有糖链的物质与对于具有糖链的物质的糖链具有亲和性的凝集素的复合物,利用毛细管电泳分离所得到的复合物,测定该复合物的量即可以测定具有糖链的物质的量。
作为将本发明的复合物形成方法应用于毛细管电泳的方法,例如,可以列举以下的方法1及方法2。
(方法1)
方法1为“使作为测定对象的试样与特异性地结合具有作为测定对象的糖链的物质的抗体反应,得到具有糖链的物质与抗体的抗原抗体复合物。在本发明的多糖类及对于该具有糖链的物质的糖链具有亲和性的凝集素的存在下,将得到的抗原抗体复合物上样到毛细管电泳,基于该凝集素的对于糖链的亲和性的程度来分离并测定该具有糖链的物质”。
作为特异性地结合具有糖链的物质的抗体,可以使用与具有糖链的物质特异性结合的一种抗体,也可以使用与具有糖链的物质特异性结合,但识别彼此表位不同的两种以上的抗体。
具有糖链的物质为糖蛋白时,作为与具有糖链的物质特异性结合的抗体,可以列举与糖蛋白的蛋白质部分(核心蛋白质)特异性结合的抗体。
并且,抗体也可以用可检测的标记物进行标记。
使用一种抗体或两种抗体时,其中任意一个抗体可以用阴离子性物质等带电载体分子进行标记。作为带电载体分子,可以列举dna等核酸链。
作为用于这种目的的核酸链的种类,为毛细管电泳常用的即可,且作为该核酸结合到抗体的方法,可以列举本身已知的方法。
此外,抗体可以在带电载体分子和可检测的标记物两者进行标记。
毛细管电泳也可以是用毛细管芯片进行的电泳((微)芯片毛细管电泳)。
就在本发明的毛细管电泳使用的电泳溶液、电泳条件、操作方法、反应条件等而言,除了在本发明的多糖类的存在下进行以外,毛细管电泳可以按照本身已知的方法进行。
用市售的全自动测定装置进行毛细管电泳时,可以预先在作为流动相的电泳溶液中含有本发明的多糖类和凝集素。随后,使具有糖链的物质与抗体的抗原抗体复合物和凝集素在全自动测定装置的流路内、在本发明的多糖类的存在下反应,随后实施毛细管电泳即可。此外,在该装置附带的操作说明书记载的条件,根据该操作说明书记载的方法实施毛细管电泳即可。
作为毛细管电泳的全自动测定装置,例如,可以列举μtaswakoi30(和光纯药工业株式会社制)等。
进行毛细管电泳时,电泳溶液中的本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为1(w/v)%~15(w/v)%,进一步优选为4~10(w/v)%。
进行毛细管电泳时,电泳溶液中的凝集素的浓度优选为比用毛细管电泳进行分离的期间,具有糖链的物质的糖链与凝集素可以完全结合的量更高的浓度。即,凝集素的浓度为1μg/ml~30mg/ml,优选为10μg/ml~20mg/ml,更优选为1~10mg/ml。
就在本发明的多糖类的存在下使抗原抗体复合物与凝集素接触并反应时的、反应液中的本发明的多糖类的浓度而言,即分离并检测复合物时的溶液中的本发明的多糖类的浓度(微流路内的浓度)为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为1(w/v)%~15(w/v)%,进一步优选为4~10(w/v)%。
就在本发明的多糖类的存在下使抗原抗体复合物与凝集素接触并反应时的、凝集素的浓度而言,即分离并检测复合物时的溶液中的凝集素的浓度(微流路内的浓度)为1μg/ml~30mg/ml,优选为10μg/ml~20mg/ml,更优选为1~10mg/ml。
(方法2)
按照上述本发明的复合物形成方法,在本发明的多糖类的存在下使测定对象的试样、与将对于该具有糖链的物质的糖链具有亲和性的凝集素用标记物标记了的标记凝集素接触、反应。随后,进行毛细管电泳来分离所得到的反应液中的“标记凝集素-具有糖链的物质”的复合物。进行毛细管电泳时,可以使用溶解有本发明的多糖类的电泳溶液。随后,通过测定源自“标记凝集素-具有糖链的物质”的复合物的标记物的量,可以测定试样中的具有糖链的物质的量。
就电泳溶液中的本发明的多糖类及凝集素的浓度而言,具体地说,在本发明的多糖类的存在下使具有糖链的物质与标记凝集素接触并反应时的反应液中的本发明的多糖类的浓度、即分离并检测复合物时的溶液中的本发明的多糖类的浓度(微流路内的浓度),及凝集素的浓度、即分离并检测复合物时的溶液中的凝集素的浓度(微流路内的浓度)等均可以参照上述(方法1)。
通过实施本发明的复合物形成方法和毛细管电泳法,例如,可以基于其糖链的差异来分离并测定psa。
上述方法中,优选为方法1。
与现有的方法相比,将本发明的复合物形成方法应用在毛细管电泳法时可以得到更多的具有糖链的物质与凝集素的复合物,因而用毛细管电泳检测到的复合物的峰的信号值(峰面积等)增大。其结果,能够以更高的灵敏度测定具有糖链的物质。
以下,具体说明用maa作为凝集素、用硫酸葡聚糖钠盐或硫酸软骨素c钠盐作为本发明的多糖类,通过上述方法1分离并测定α(2,3)糖链游离型psa的方法的一个例子。
此外,α(2,3)糖链psa等psa中有分别与α1-抗胰凝乳蛋白酶或α2-巨球蛋白等结合蛋白结合了的结合型、及没有与结合蛋白结合的游离型。
首先,在液相中使测定对象的试样、与将特异性结合游离型psa的抗psa抗体(抗psa抗体1)用可检测的标记物(例如,荧光物质)标记了的标记抗psa抗体1反应。试样中含有psa时,psa与荧光标记抗psa抗体1结合后,形成以下两种的复合物。
[标记抗psa抗体1-α(2,3)糖链游离型psa]复合物
[标记抗psa抗体1-α(2,3)糖链游离型psa以外的游离型psa]复合物通过1~10psi、30~60秒的加圧法,将得到的含有上述复合物的反应液,含有0.001~10μm、优选为0.01~1μm的将特异性结合psa的抗psa抗体(抗psa抗体2)用dna标记了的dna标记抗psa抗体2的试液2~50μl,电泳缓冲液及内标物质(例如,anaspec公司制hilyte647等荧光物质)导入到毛细管中,此时,毛细管的内径为5~500μm,优选为50~200μm,更优选为50~100μm,长度为1~10cm,在20~40℃的保温条件下反应5秒~30分钟,优选反应10秒~15分钟。通过该反应,可以得到以下的复合物1及复合物2。
复合物1:[标记抗psa抗体1-α(2,3)糖链游离型psa-dna标记抗psa抗体2]复合物,
复合物2:[标记抗psa抗体1-α(2,3)糖链游离型psa以外的游离型psa-dna标记抗psa抗体2]复合物
随后,在含有maa(1μg/ml~30mg/ml)和硫酸葡聚糖钠盐或硫酸软骨素c钠盐等本发明的多糖类(0.01(w/v)%~50(w/v)%)的电泳缓冲液(流动相)中,将含有复合物1及复合物2的反应液上样到毛细管电泳。复合物1与maa有相互作用,但复合物2不与maa相互作用,因而泳动时复合物1要慢于复合物2。因此,就检测到的源自标记抗psa抗体1的标记物的峰的出现位置而言,复合物1和复合物2有所不同。因此,基于峰的位置,可以分别鉴别复合物1的峰及复合物2的峰。并且,基于复合物1的峰面积或峰的高度,可以求出α(2,3)糖链游离型psa的量。上述方法中,在本发明的多糖类的存在下使复合物1和复合物2与maa反应时,检测到的复合物增大,因而能够以更高的灵敏度测定α(2,3)糖链游离型psa。
以上使用的抗psa抗体1(与游离型psa特异性结合的抗体)、抗psa抗体2(与psa特异性结合的抗体)可以是市售的抗体。作为抗psa抗体1(与游离型psa特异性结合的抗体)的市售品,例如,可以列举抗psa单克隆抗体8a6(hytest公司)、抗psa单克隆抗体ps1(hytest公司)、抗psa单克隆抗体克隆108(anogen公司)、抗前列腺特异性抗原抗体ps2(abcam公司)、抗前列腺特异性抗原抗体2h9(abcam公司)等。
抗psa抗体2(与psa特异性结合的抗体)可以是与游离型psa和结合型psa两者结合的抗体。例如,可以列举与psa的核心蛋白质特异性结合的抗体。作为其市售品,例如,可以列举抗psa单克隆抗体5a6(hytest公司)、抗psa单克隆抗体5g6(hytest公司)、抗psa单克隆抗体ps6(hytest公司)、抗前列腺特异性抗原抗体ep1588y(abcam公司)、抗前列腺特异性抗原抗体a67-b/e3(abcam公司)、抗前列腺特异性抗原抗体35h9(abcam公司)、抗前列腺特异性抗原抗体klk3/801(abcam公司)、抗前列腺特异性抗原抗体3e6(abcam公司)、抗前列腺特异性抗原抗体8301(abcam公司)、抗前列腺特异性抗原抗体a5d5(abcam公司)、抗前列腺特异性抗原抗体psa28/a4(abcam公司)、抗前列腺特异性抗原抗体1h12(abcam公司)等。
应用于凝集素亲和层析
作为纯化糖蛋白、糖肽、糖链等的方法,多是采用凝集素亲和层析。
凝集素亲和层析中,将试样注入到填充有填充剂的柱中,所述填充剂是将对于作为测定对象的具有糖链的物质的糖链具有亲和性的凝集素固定在琼脂糖等固定相上而成。试样中含有具有测定对象的糖链的物质时,基于该糖链与凝集素的相互作用导致的具有糖链的物质的洗脱延迟,可以分离并测定具有目的糖链的物质。
作为将本发明的复合物形成方法应用在凝集素亲和层析的方法,例如,可以列举用含有本发明的多糖类的流动相,进行常规的凝集素亲和层析的方法。
流动相中的本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为0.5(w/v)%~15(w/v)%,进一步优选为0.5~10(w/v)%。
将本发明的复合物形成方法应用在凝集素亲和层析时,与现有技术相比,可以更为高效地分离具有糖链的物质。
应用于凝集素微阵列法
本发明的复合物形成方法可以适用在国立研究开发法人产业技术综合研究所糖链医工学研究中心等开发的凝集素微阵列法。凝集素阵列(凝集素微阵列)是指在载玻片上斑点状排列固定了特异性(亲和性)不同的数十种凝集素的阵列。作为将本发明的复合物形成方法应用在凝集素微阵列法的方法,例如,可以列举以下的方法1及方法2。
(方法1)
使含有具有糖链的物质和本发明的多糖类的溶液与凝集素微阵列相互作用后,使该微阵列与用荧光标记了特异性结合具有糖链的物质的抗体的荧光标记抗体反应。随后,用与以上相同的方法检测源自荧光标记抗体的荧光即可以鉴别具有糖链的物质所结合的凝集素,基于该结果,可以解析具有糖链的物质的糖链。
(方法2)
使含有将具有糖链的物质用荧光物质等可检测的标记物标记了的具有糖链的物质的标记物和本发明的多糖类的溶液与凝集素微阵列相互作用后,照射激发光来生成消逝波。随后,通过检测源自具有糖链的物质的标记物的信号即可以鉴别具有糖链的物质所结合的凝集素,基于该结果,可以解析具有糖链的物质的糖链。
含有具有糖链的物质与本发明的多糖类的溶液中的、本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为0.5(w/v)%~15(w/v)%,进一步优选为0.5~10(w/v)%。
就利用凝集素微阵列的测定而言,例如,依据microarraymethodsandprotocols(crcpress),editedbyroberts.matson,“chapter9:lectinmicroarrays”,masaoyamada,p.141,2009中记载的方案实施即可。
上述方法中,优选为方法1。
凝集素微阵列法为无需洗涤操作即可以检测凝集素阵列的荧光的方法,但将本发明的复合物形成方法应用在凝集素微阵列法时,即便是对于凝集素亲和性弱的糖链,大量的糖链-凝集素复合物也可以保持在微阵列上。因此,可以更为高精度地获得该糖链的信息。
应用于免疫学测定方法(夹心法)
将本发明的复合物形成方法应用在免疫学测定方法(夹心法)时,除了在本发明的多糖类的存在下使具有糖链的物质与凝集素反应以外,按照公知的免疫学测定方法(夹心法)进行测定即可。
作为将本发明的复合物形成方法应用在采用了固定相的夹心法的方法,例如,可以列举以下的方法1及方法2。
(方法1)
将与作为测定对象的具有糖链的物质的糖链具有亲和性的凝集素固定在固定相。使含有测定对象的试样与本发明的多糖类的溶液与上述固定相接触并反应。或者,可以使含有本发明的多糖类的溶液、测定对象的试样依次与上述固定相接触并反应,也可以使测定对象的试样、含有本发明的多糖类的溶液依次与上述固定相接触并反应。
洗涤处理固定相后,使标记抗体的溶液与固定相接触并反应,其中,标记抗体是将与测定对象的具有糖链的物质特异性结合的抗体用可检测的标记物标记了的抗体。具有糖链的物质为糖蛋白时,可以使用其核心蛋白质特异性的抗体。随后,洗涤处理固定相来去除未反应的标记抗体。
用与标记抗体的标记物相匹配的测定方法,测定源自该固定相上形成的[凝集素-具有糖链的物质-标记抗体]复合物的标记物的量。随后,基于该结果,测定具有糖链的物质。
(方法2)
将与测定对象的具有糖链的物质特异性结合的抗体固定在固定相。具有糖链的物质为糖蛋白时,可以使用其核心蛋白质特异性的抗体。
使测定对象的试样与上述固定相接触并反应。随后,洗涤处理固定相,使含有本发明的多糖类和标记凝集素的溶液与上述固定相接触并反应,其中,标记凝集素是将与作为测定对象的具有糖链的物质的糖链具有亲和性的凝集素用可检测的标记物标记了的凝集素。或者,可以使含有本发明的多糖类的溶液、含有标记凝集素的溶液依次与上述固定相接触并反应,其中,标记凝集素是将与具有糖链的物质的糖链具有亲和性的凝集素用可检测的标记物标记了的凝集素,也可以使含有该标记凝集素的溶液、含有本发明的多糖类的溶液依次与上述固定相接触并反应。随后,洗涤处理固定相来去除未反应的标记凝集素等。
用与标记凝集素的标记物相匹配的方法,测定源自该固定相上形成的[抗体-具有糖链的物质-标记凝集素]复合物的标记物的量。基于该结果,测定具有糖链的物质。
方法1及方法2中,使测定对象的试样与凝集素反应时的反应液中的本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为0.5(w/v)%~15(w/v)%,进一步优选为0.5~10(w/v)%。
方法1及方法2中使用的在各反应后洗涤处理固定相的洗涤液、及方法1中使用的标记抗体的溶液优选含有本发明的多糖类。洗涤液中的本发明的多糖类的浓度如上所述。并且,优选在本发明的多糖类的存在下测定源自[抗体-具有糖链的物质-标记凝集素]复合物的标记物的量。测定时的本发明的多糖类的浓度可以与上述反应液中的浓度相同。
上述方法中,更优选为方法2。
将本发明的复合物形成方法应用在免疫学测定方法时,可以更多地得到具有糖链的物质与凝集素的复合物,因而能够以更高的灵敏度测定具有糖链的物质。
应用于电泳法
将测定对象的试样用常规方法进行凝胶电泳后,转印到pvdf膜等薄膜上。随后,薄膜进行适宜的封闭处理后,将得到的薄膜浸渍在含有标记凝集素和本发明的多糖类的溶液中,在薄膜上形成具有糖链的物质与标记凝集素的复合物其中,其中,标记凝集素是将与具有糖链的物质的糖链具有亲和性的凝集素用可检测的标记物标记了的凝集素。随后,用与标记物相匹配的测定方法检测标记物,从而能够以高的灵敏度检测并测定具有糖链的物质。
将与具有糖链的物质的糖链具有亲和性的凝集素用生物素标记了的生物素标记凝集素用作为标记凝集素时,进行以下处理。首先,将含有具有糖链的物质的试样进行凝胶电泳后,转印到薄膜上。将该薄膜浸渍在含有生物素标记凝集素和本发明的多糖类的溶液中,在薄膜上形成具有糖链的物质与生物素标记凝集素的复合物。随后,将薄膜浸渍在hrp标记亲和素溶液(可以含有本发明的多糖类)中。随后,将该薄膜浸渍在发色液中来使之显色。通过检测该显色,检测并测定具有糖链的物质。
以上使用的含有标记凝集素和本发明的多糖类的溶液或含有生物素标记凝集素和本发明的多糖类的溶液中的、本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为0.5(w/v)%~15(w/v)%,进一步优选为0.5~10(w/v)%。
将本发明的复合物形成方法应用在电泳法时,薄膜上形成的具有糖链的物质与标记凝集素的复合物的量增加,因而源自该复合物的标记凝集素的信号值增大。其结果,能够以更高的灵敏度地检测、测定具有糖链的物质。
应用于组织染色
将常规方法制作的组织切片浸渍在含有标记凝集素和本发明的多糖类的溶液中,在组织切片上形成糖链与标记凝集素的复合物,从而可以更为高效地标记组织切片,其中,标记凝集素是将与作为检测对象的糖链具有亲和性的凝集素用荧光物质或放射性物质等可检测的标记物标记了的凝集素。
上述组织染色中使用的含有标记凝集素和本发明的多糖类的溶液中的、本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为0.5(w/v)%~15(w/v)%,进一步优选为0.5~10(w/v)%。
应用于流式细胞术
使标记凝集素与细胞结合后,用细胞分离装置(细胞分选器)实施常规的流式细胞术时,利用凝集素的糖链特异性即可以根据位于细胞表面(细胞膜上)的糖链的种类来区分细胞的亚群,其中,标记凝集素是将与细胞膜上存在的检测对象(目的)的糖链具有亲和性的凝集素用可检测的标记物标记了的凝集素。
作为在该方法中应用本发明的复合物形成方法的方法,例如,可以列举以下的方法。使细胞与含有荧光标记凝集素和本发明的多糖类的溶液接触后,在细胞膜上形成糖链与荧光标记凝集素的复合物,其中,荧光标记凝集素是将与目的糖链(被认为是存在于细胞膜上的糖链)具有亲和性的凝集素用荧光物质标记了的凝集素。随后,通过利用常规的细胞分选器来检测荧光的方法,分离结合了标记凝集素的细胞及未结合的细胞。这里,用细胞分选器分离细胞时的分离液中可以含有本发明的多糖类。
使细胞与含有荧光标记凝集素和本发明的多糖类的溶液接触时的本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为0.5(w/v)%~15(w/v)%,进一步优选为0.5~10(w/v)%。并且,用溶解有本发明的多糖类的分离液在细胞分选器分离细胞时,分离液中的本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为0.5(w/v)%~15(w/v)%,进一步优选为0.5~10(w/v)%。
将本发明的复合物形成方法用在流式细胞术时,得到的带有具有糖链的物质的细胞与凝集素的复合物的量增加,因而分离得到的结合有凝集素的细胞的量增加。即,能够高效地回收具有目的糖链的细胞。
并且,再生医学中,所使用的细胞的质量控制不可或缺。近年来,已知可以通过解析细胞表面的糖链来识别es细胞、ips细胞的分化、未分化。并且,也发现了特异性识别未分化细胞的糖链的凝集素(tatenoh,etal.,j.biol.chem.,vol.286,no.23,pp.20345-20353,2011)。基于这些认知,开发了控制未分化细胞或分化细胞的质量的技术(国际公开wo2013/065302号公报、国际公开wo2013/128914号公报)。
例如,用标记凝集素,通过本发明的复合物形成方法来形成未分化细胞与标记凝集素的复合物,其中,标记凝集素是将特异性识别未分化细胞的糖链的凝集素用可检测的标记物标记了的凝集素。随后,通过用细胞分选器分离未分化细胞与分化细胞分离,可以高效地分选未分化细胞与分化细胞。
作为其他的可应用本发明的复合物形成反应的技术,例如,可以列举使用凝集素的血型(亚型)的判断方法。此时,将本发明的多糖类添加在任意一个血型判断试剂中,进行判断即可。
以上列举的方法中,优选应用在等离子共振法及毛细管电泳,特别优选应用在等离子共振法。
3、本发明的具有糖链的物质的测定方法
本发明的具有糖链的物质的测定方法为“用本发明的复合物形成方法形成具有糖链的物质与凝集素的复合物后,测定该复合物的量的具有糖链的物质的测定方法”。
本发明的具有糖链的物质的测定方法中,本发明的复合物形成方法的细节如在以上“本发明的复合物形成方法”中所述。
用本发明的复合物形成方法形成具有糖链的物质与凝集素的复合物后,测定该复合物的量即可以测定具有糖链的物质。作为该复合物的具体的测定方法,例如,可以列举上述的表面等离子共振法、毛细管电泳、凝集素亲和层析、凝集素微阵列法、夹心法等免疫学测定方法、及电泳法等。具体的条件或方法等与在以上说明的相同。
4、本发明的复合物形成促进剂
本发明的复合物形成促进剂是“含有本发明的多糖类的、具有糖链的物质与对于该具有糖链的物质的糖链具有亲和性的凝集素的复合物形成促进剂”。
作为本发明的复合物形成促进剂中含有的本发明的多糖类,例如,可以列举上述本发明的复合物形成方法的相关说明中提到的、不具有n-乙酰葡糖胺的水溶性多糖或含有不具有n-乙酰葡糖胺的多糖的水溶性化合物。其优选方式及具体例子也如上所述。
具体地说,例如,硫酸葡聚糖或其盐、硫酸软骨素c钠盐或其盐等。
本发明的复合物形成促进剂为溶液时,本发明的复合物形成促进剂的溶液中的本发明的多糖类的浓度为0.01(w/v)%~50(w/v)%,优选为0.1(w/v)%~25(w/v)%,更优选为0.5(w/v)%~15(w/v)%,进一步优选为0.5~10(w/v)%。本发明的复合物形成促进剂为溶液时,作为该溶液使用的溶剂的具体例子,例如,可以列举水或缓冲液。
作为用作为溶剂的水,为在该领域使用的水即可,没有特别的限定。具体地说,例如,可以列举蒸馏水,去离子水等纯化水等。作为用作为溶剂的缓冲液的具体例子,例如,可以列举盐酸三羟甲基氨基甲烷(tris)缓冲液、磷酸缓冲液、佛罗那缓冲液、硼酸缓冲液、古德氏缓冲液、tris-hcl缓冲液、mes缓冲液、hepes缓冲液、硼酸缓冲液、磷酸缓冲液、佛罗那缓冲液、古德氏缓冲液等。并且,就这些缓冲液的缓冲剂浓度而言,通常为5~1,000mm,优选在5~300mm的范围内适宜选择。对于其ph也没有特别的限定,例如,可以列举5~9的范围。
本发明的复合物形成促进剂可以含有凝集素。作为凝集素的具体例子,如在上述本发明的复合物形成方法的相关说明中所述。例如,可以列举lca、maa、bc2lcn等。并且,本发明的复合物形成促进剂中的凝集素的浓度为1μg/ml~30mg/ml,优选为10μg/ml~20mg/ml,更优选为1~10mg/ml。
本发明的复合物形成促进剂中含有本发明的多糖类与凝集素时,本发明的多糖类如在上述本发明的复合物形成方法中所述,选自不带有该凝集素具有亲和性的糖链的多糖类。
作为含有本发明的多糖类和凝集素的、本发明的复合物形成促进剂的具体例子,例如,可以列举以下的组成。
1)在5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液中溶解了0.01(w/v)%~50(w/v)%的硫酸葡聚糖或其盐和1μg/ml~30mg/ml的lca的复合物形成促进剂,
2)在5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液中溶解了0.01(w/v)%~50(w/v)%的硫酸葡聚糖或其盐和1μg/ml~30mg/ml的maa的复合物形成促进剂,
3)在5~1000mmtris-hcl缓冲液(ph5~9)等缓冲液中溶解了0.01(w/v)%~50(w/v)%的硫酸软骨素c或其盐和1μg/ml~30mg/ml的maa的复合物形成促进剂。
本发明的复合物形成促进剂中,在不妨碍共存的试剂等的稳定性、不妨碍糖链与凝集素的反应的前提下,可以含有该领域通常使用的试剂类,例如,缓冲剂、反应促进剂、蛋白质、盐类、表面活性剂等稳定剂、防腐剂等。并且,可以在该领域通常的浓度范围内适宜选定这些的浓度。
并且,本发明的复合物形成促进剂可以附有该复合物形成促进剂的使用说明书等。该“说明书”是指用文章、图表等更为具体地描述了本发明的复合物形成促进剂的特征、使用方法等的、本发明的复合物形成促进剂的说明书、附件或小册子(宣传册)等。
以下,举出实施例来更为详细地说明本发明,但本发明并不局限于以下的实施例。
实施例
实施例1:afp-l3的检测
1)测定设备等
测定设备:biacorex(gehealthcare英国公司制)
芯片:sensorchipcm5(gehealthcare英国公司制)
运行缓冲液:hbs-ep缓冲液(10mmhepes,0.15mnacl,3mmedta,0.005%surfactantp20,ph7.4,gehealthcare英国公司制)
2)试剂等
作为具有糖链的物质,使用了afp-l3(α-甲胎蛋白的lca结合组分,和光纯药工业株式会社制)。作为本发明的多糖类,使用了硫酸葡聚糖钠盐(分子量36,000~50,000,和光纯药工业株式会社制)及硫酸软骨素c钠盐(分子量40,000~80,000,和光纯药工业株式会社制)。
3)样品溶液
用hbs-ep缓冲液及上述试剂,分别配制了以下的样品溶液。
含有1μm(4w/v%)硫酸葡聚糖钠盐的28μg/mlafp-l3溶液
含有1μm(1w/v%)硫酸软骨素c钠盐的28μg/mlafp-l3溶液
28μg/mlafp-l3溶液
4)传感芯片上的lca固定
用胺偶联试剂盒(gehealthcare英国公司制),将lca(lensculinarisagglutinin)固定在了sensorchipcm5(cm传感芯片,gehealthcare英国公司制)的传感芯片上。
5)基于biacore法的测定
以下的测定用biacorex(gehealthcare英国公司制)来进行。
将在上述3)中配制的样品溶液60μl在温度25℃、流速30μl、结合时间120秒的条件缓缓地进行输送,使之在固定有lca的传感芯片上流动,使afp-l3与lca反应。输送开始后,即时进行biacorex的测定。随后,将hbs-ep缓冲液单独输送180秒(解离时间)。得到的测定结果用biacore专用解析软件biaevaluation(version4.1)进行解析,得到了传感图谱。
6)结果
图1及图2示出了得到的传感图谱。图1及图2中,横轴为时间s(秒),纵轴为响应值(ru,resonanceunit,共振单位)。ru的大小反映afp-l3与lca的复合物的量。
图1中,“+”表示用含有硫酸葡聚糖钠盐的afp-l3溶液得到的结果,“◆”表示用不含有硫酸葡聚糖钠盐的afp-l3溶液得到的结果。图2中,“□”表示用含有硫酸软骨素c钠盐的afp-l3溶液得到的结果,“◆”表示用不含有硫酸软骨素c钠盐的afp-l3溶液得到的结果。
此外,afp-l3与lca的反应进行了120秒,随后使hbs-ep缓冲液单独在固定有lca的传感芯片上流动。因此,图1及图2中,自横轴的120秒的时间点起只有单独的hbs-ep缓冲液在传感芯片上流动(在biacore法中称之为“解离”)。
由图1及图2可以确认,在硫酸葡聚糖钠盐或硫酸软骨素c钠盐的存在下使afp-l3和lca反应时,与在没有硫酸葡聚糖钠盐或硫酸软骨素c钠盐的状态下使afp-l3与lca反应的情形相比,解离时的afp-l3与lca的复合物的量多。即,可以确认在本发明的多糖类的存在下使afp-l3与lca接触并反应时,与在没有本发明的多糖类的情形下使afp-l3与lca接触并反应时相比,afp-l3与lca的复合物的量增加。
实施例2:α(2,3)糖链游离型psa的检测-1
1、试样及试液的制备
a)dna标记抗psa抗体的制备
按照以下的顺序,制备了结合有dna的psa抗体fab’片段。
即,首先,用常规方法纯化在5’末端导入了nh2基的250bp的dna片段(纯化的末端氨基化dna),随后用常规方法使在该dna片段导入的nh2基与磺基琥珀酰亚胺基4-(p-马来酰亚胺基苯基)丁酸酯(sulfo-smpb)连接子(具有琥珀酰亚胺基和马来酰亚胺基的连接子,pierce公司制)的琥珀酰亚胺基反应。随后,进行凝胶过滤处理来去除未反应的连接子,得到了结合有连接子的250bp的dna片段。使得到的结合有连接子的250bp的dna片段、与预先用抗人psa小鼠单克隆抗体(抗psa单克隆抗体5g6,hytest公司制)并利用常规方法制备的抗psa抗体5g6fab’片段反应。得到的反应物用deae层析柱纯化,从而制备了结合有250bp的dna片段的抗psa抗体5g6fab’片段(以下,称之为“dna标记抗psa抗体”)。
此外,所使用的抗psa单克隆抗体5g6是对于人psa具有亲和性的抗体,可以结合结合型psa及游离型psa两者。即,该抗体能够与“α(2,3)糖链游离型psa”和“α(2,3)糖链游离型psa以外的游离型psa”结合。
b)荧光标记抗游离型psa抗体的制备
用常规方法处理识别与抗psa单克隆抗体5g6不同的psa表位、且只与游离型psa特异性结合的抗人psa单克隆抗体(抗psa单克隆抗体8a6,hytest公司制),得到了抗psa抗体8a6fab’片段。用常规方法在得到的片段的氨基上导入荧光物质hilyte647(anaspec公司制),得到了hilyte647标记抗游离型psa抗体8a6fab’片段(以下,称之为“荧光标记抗游离型psa抗体”)。
2、电泳(微芯片毛细管电泳)
用全自动荧光免疫测定装置μtaswakoi30(和光纯药工业株式会社制),按照装置的操作说明书,并按照以下的顺序进行了微芯片毛细管电泳。
a)电泳试样a的配制
按照yoneyamat.etal.,biochem.biophys.res.commun.,vol.448,no.4,pp.390-396,2014的“2.materialsandmethods(2.7forcedexpressionofflag-tag-fuseds2,3psa)”记载的方法,得到了重组游离型psa[以下,简称为“r游离型psa”。r游离型psa含有重组α(2,3)游离型psa(以下,简称为“rα(2,3)游离型psa”)及重组α(2,3)游离型psa以外的游离型psa]。测定得到的r游离型psa溶液中的psa浓度,用pbs(-)(和光纯药工业株式会社制)进行稀释,得到了psa蛋白浓度为1ng/ml的样品溶液。将得到的样品溶液2μl、上述1的b)中制备的1μm荧光标记抗游离型psa抗体1μl、及电泳缓冲液1[含有5%(w/v)聚乙二醇(peg20000)、3%(w/v)甘油、150mmnacl、0.01%bsa、75mmtris-hcl、10mmmes,ph7.5]7μl加入到0.5ml试验管中进行混合,从而配制了10μl的反应液。此外,该反应液中的荧光标记抗游离型psa抗体的终浓度为100nm。
将含有上述反应中得到的[荧光标记抗游离型psa抗体-r游离型psa]复合物的溶液、即含有[荧光标记抗游离型psa抗体-rα(2,3)糖链游离型psa]复合物和[荧光标记抗游离型psa抗体-rα(2,3)糖链游离型psa以外的游离型psa]复合物的溶液10μl设为了电泳试样a。
b)电泳试液的配制
配制了以下的各试液。
电泳缓冲液2(含有maa和硫酸软骨素c钠盐):配制了含有5.0%(w/v)聚乙二醇(peg8000)、3%(w/v)甘油、10mmnacl、0.01%bsa的75mmtris-hcl缓冲液(ph7.5)。向其中添加maa(vector公司制)使其终浓度(电泳缓冲液2中的浓度)达到4mg/ml,并添加本发明的多糖类、即硫酸软骨素c钠盐(和光纯药工业株式会社制)使其终浓度(w/v,电泳缓冲液2中的浓度)分别达到0%、2.8%、3.4%、3.5%、3.6%、3.8%、4.1%、4.3%、4.5%,混合后得到了电泳缓冲液2。
电泳缓冲液3:将含有2%(w/v)聚乙二醇(peg20000)、3%(w/v)甘油、0.01%bsa、125mmhepes、75mmtris-hcl的缓冲液(没有调节ph)用作为电泳缓冲液3。
电泳缓冲液4:将含有2%(w/v)聚乙二醇(peg20000)、3%(w/v)甘油、0.01%bsa的75mmtris-hcl缓冲液(ph7.5)用作为电泳缓冲液4。
dna标记抗体液(含有dna标记抗psa抗体):配制含有上述1的a)中得到的dna标记抗psa抗体100nm的缓冲液[含有2%(w/v)聚乙二醇(peg20000)、0.5mmedta(2na)、3%(w/v)甘油、50mmnacl、0.01%bsa、75mmbistris,ph6.0],将该缓冲液用作为dna标记抗体液。
荧光液:将含有30nmhilyte647、20%(w/v)甘油的50mmbistris(ph6.0)用作为荧光液。荧光液用于在测定设备μtaswakoi30的检测部的位置确认等的调节。
c)电泳步骤i)电泳试样a及电泳试液的导入
将上述2的a)中配制的电泳试样a5.4μl注入到μtaswakoi30专用芯片的指定孔(sp孔)中。随后,如下所述,将上述2的b)中配制的各试液注入到了该微芯片的各孔中。
r2孔(r2(flb)孔、r2(lb)孔):电泳缓冲液2(含有maa和硫酸软骨素c钠盐)各10.0μl,
r3孔:电泳缓冲液310.0μl,
r4孔:电泳缓冲液45.4μl,
c1孔:dna标记抗体液3.0μl,
fd孔:荧光液7.0μl。
图3为所使用的微芯片的示意图。图3中,waste孔为各孔(r2、r3、r4、c1)的试液及电泳试样a导入到分析用流路时的废液蓄积孔(排液孔)。
随后,在各四个waste孔(排液孔)之间施加30秒、-5psi的圧力,将电泳试样a及各试液导入到芯片的分析用流路。
ii)itp(反应、浓缩、分离)及检测
图4为所使用的微芯片的芯片内流路的示意图。图4中,w表示waste孔。r3孔侧为阴极,r2(lb)孔侧为阳极。并且,图4中,电泳试样a及各试液的配置部分用点部分和空白部分(没有点的部分)的形式加以颜色区分来表示。
在芯片的分析用流路导入电泳试样a及各试液后,用以下的方法进行了psa的分离及检测。在图4的r3孔~r2(lb)孔之间施加4000v的电压,在30℃的条件下使试液中的dna标记抗psa抗体与电泳试样a中的[荧光标记抗游离型psa抗体-r游离型psa]复合物接触,形成[荧光标记抗游离型psa抗体-r游离型psa-dna标记抗psa抗体]复合物后,用等速电泳(itp)浓缩该复合物。等速电泳的电泳方向在图4中用“itp”和虚线示出。这里,用于捕获游离型psa的各标记抗体的免疫反应时间为约200秒。
具体地说,所形成的复合物为[荧光标记抗游离型psa抗体-rα(2,3)糖链游离型psa-dna标记抗psa抗体]复合物(复合物1)、及[荧光标记抗游离型psa抗体-rα(2,3)糖链游离型psa以外的游离型psa-dna标记抗psa抗体]复合物(复合物2)。
等速电泳至r2(flb)与r2(lb)的通道交叉部分,通过电压的变化来判断复合物通过了该通道交叉部分的情形后,将阴电极从r3切换到了r2(flb)。随后,直至在检测部分(自r2(flb)与r2(lb)的通道交叉部分起至下游2cm的毛细管部分)检测到[荧光标记抗游离型psa抗体-r游离型psa-dna标记抗psa抗体]复合物的峰,在maa和硫酸软骨素c钠盐的存在下进行了细管凝胶电泳(ce)。实施ce的位置及电泳方向在图4中用“ce”和虚线来表示。
在maa和硫酸软骨素c钠盐的存在下进行毛细管凝胶电泳的期间,在硫酸软骨素c钠盐存在下,复合物1及复合物2与maa接触并反应。反应时的反应液中的maa的浓度为4mg/ml,硫酸软骨素c钠盐的浓度(w/v%)为0%、2.8%、3.4%、3.5%、3.6%、3.8%、4.1%、4.3%或4.5%。
检测是用光电二极管(富士胶片株式会社制)实时测定635nm激光激发产生的自r2(flb)与r2(lb)的通道交叉部分起至2cm的毛细管部分的荧光強度来进行。
3、结果
基于得到的电泳图像(电泳图谱),用i30装置附带的解析软件求出了与maa反应的[荧光标记抗游离型psa抗体-rα(2,3)糖链游离型psa-dna标记抗psa抗体]复合物(复合物1)组分的峰面积。结果示于图5中。图5中,纵轴为复合物1组分的峰面积,横轴为maa与复合物1及复合物2反应时的硫酸软骨素c钠盐的浓度(%(w/v%))。
如图5所示,复合物1的峰面积依赖于硫酸软骨素c钠盐的浓度而增大。由此可知,在硫酸软骨素c钠盐的存在下进行糖链与凝集素的反应时,与在没有硫酸软骨素c钠盐的情形下进行相同反应时相比,复合物1的量增加。
此外,电泳试剂2中含有聚乙二醇(peg8000,5%),因而就硫酸软骨素c钠盐的浓度为“0(w/v)%”的条件而言,是在有聚乙二醇、但没有硫酸软骨素c钠盐的情形下进行了具有糖链的物质与凝集素的反应。如图5所示,在有聚乙二醇、但没有硫酸软骨素c钠盐的情形下进行具有糖链的物质与凝集素的反应时,几乎无法检测到复合物1。由以上结果可知,不使用本发明的多糖类时,即便在高分子聚合物聚乙二醇的存在下使具有糖链的物质与凝集素反应,也不会得到其复合物的量增加的效果。
实施例3:α(2,3)糖链游离型psa的检测-2
1、试样及试液的配制及电泳(微芯片毛细管电泳)
除了使用下述的电泳缓冲液2以外,用与实施例2相同的电泳试液、设备等,并用与实施例2相同的方法进行了[荧光标记抗游离型psa抗体-α(2,3)糖链游离型psa-dna标记抗psa抗体]复合物(复合物1)的检测。
电泳缓冲液2(含有本发明的多糖类):配制了含有5.0%(w/v)聚乙二醇(peg8000)、3%(w/v)甘油、10mmnacl、0.01%bsa的75mmtris-hcl缓冲液(ph7.5)。向其中添加maa(vector公司制)使其终浓度(电泳缓冲液2中的浓度)达到4mg/ml,并添加本发明的多糖类硫酸葡聚糖钠盐(分子量6,500~10,000,sigma公司制)使其终浓度(电泳缓冲液2中的浓度)(w/v)分别达到0%、3.0%、5.0%、5.5%、6.0%、6.7%、7.0%、7.7%、8.1%,混合后用作为电泳缓冲液2。
此外,在硫酸葡聚糖钠盐存在下复合物1及复合物2与maa反应时的反应液中maa的浓度为4mg/ml,硫酸葡聚糖钠盐的浓度(w/v%)为0%、3.0%、5.0%、5.5%、6.0%、6.7%、7.0%、7.7%或8.1%。
2、结果
基于得到的电泳图像(电泳图谱),用i30装置附带的解析软件求出了与maa反应的[荧光标记抗游离型psa抗体-α(2,3)糖链游离型psa-dna标记抗psa抗体]复合物(复合物1)组分的峰面积。结果示于图6中。图6中,纵轴为复合物1组分的峰面积,横轴为maa与复合物1及复合物2反应时的本发明的多糖类硫酸葡聚糖的浓度(%(w/v%))。
如图6所示,复合物1的峰面积依赖于硫酸葡聚糖钠盐的浓度而增大。由此可知,在硫酸葡聚糖钠盐的存在下进行糖链与凝集素的反应时,与在没有硫酸葡聚糖钠盐的情形下进行相同反应时相比,复合物1的量增加。
此外,电泳试剂2中含有聚乙二醇(peg8000,5%),因而就硫酸葡聚糖钠盐的浓度为0(w/v)%的条件而言,是在有聚乙二醇、但没有硫酸葡聚糖钠盐的情形下进行了糖链与凝集素的反应。如图6所示,在有聚乙二醇、但没有硫酸葡聚糖钠盐的情形下进行具有糖链的物质与凝集素的反应时,几乎无法检测到复合物1。由以上结果可知,不使用本发明的多糖类时,即便在高分子聚合物聚乙二醇的存在下使具有糖链的物质与凝集素反应,也不会得到其复合物的量增加的效果。
产业实用性
根据本发明的复合物形成方法,具有糖链的物质与凝集素的复合物的量增加。因此,通过在具有糖链的物质的测定中采用本发明的复合物形成方法,能够以高灵敏度测定具有糖链的物质。并且,本发明的复合物形成方法适用于利用凝集素对于糖链的亲和性的所有反应、检测、测定、糖链的分析等。再者,可以提高检测或测定的灵敏度,并可以进行高精度的糖链分析。
- 还没有人留言评论。精彩留言会获得点赞!