用于免疫组织化学的合成对照的制作方法
相关申请的交叉引用
本申请要求2017年12月6日提交的美国临时申请序列号62/595,434和2018年9月12日提交的美国临时申请序列号62/730,422的优先权益,这些临时申请各自借此以全文引用的方式并入。
提交ascii文本文件上的序列表
以下ascii文本文件提交内容的全部内容以引用的方式并入本文中:序列表的计算机可读形式(crf)(文件名:146392040440seqlist.txt,记录日期:2018年12月5日,大小:3kb)。
本公开涉及例如可用于免疫组织化学(ihc)的合成对照,以及与其相关的制造方法和用途。在一些实施方案中,合成对照包括固体凝胶,所述固体凝胶包含交联至载体蛋白,例如血清白蛋白、蛋清蛋白或蛋清蛋白混合物或明胶的纯化抗原(例如,以已知量)。
背景技术:
ihc代表一种用于研究和临床应用的重要工具。在用于表征蛋白质表达的许多技术中,ihc是提供关于表达水平以及定位的信息(例如,在细胞和/或组织水平上)的少数技术之一。因此,ihc是在研究中用于表征所关注蛋白质的关键工具。ihc也已经成为临床中的重要诊断工具,例如,对患者进行分类以供多种个性化医学应用。举例来说,herceptesttm(dakodenmarka/s)半定量her2ihc测定已经获得fda批准,用于评估her2蛋白状态已近20年。这种测试允许临床医生鉴定出肿瘤过度表达her2的患者。虽然her2在许多类型的癌症中过度表达,但已经显示25-30%的乳癌过度表达her2,并且这种标志物与无病存活期和总存活期缩短相关联。在这些患者中靶向her2的疗法(例如,抗her2抗体治疗)提供显著改善的总存活期、反应率、反应持续时间和疾病进展时间。参见例如slamon,d.j.等(2001)nengljmed344:783-792。
建立用于特定标靶的可靠的ihc测定面临多重挑战。首先,必须鉴定对所关注的标靶具有特异性并且不与其他标靶交叉反应的抗体。这需要以已知的水平表达标靶的适当阳性和阴性对照,这些对照在标靶的表达未表征时难以鉴定。
其次,即使抗体是可用的,也可能难以鉴定可靠、容易获得并且易于大量生产的阳性和阴性对照。组织样品和细胞系(例如,细胞团块)均已经用作ihc对照;然而,两者均具有显著的局限性。对于许多标靶来说,适当的组织是不可用的。对于其它标靶来说,组织中的表达可能是可变的,未表征的或太弱而无法检测到。细胞系比组织样品更容易获得(尽管可能难以在工业规模上生长某些细胞系),但如同组织样品中的表达一样,细胞系中的表达可能是可变的,未表征的或太弱而无法检测到。可对细胞系进行工程改造以过度表达所关注的标靶,但过度表达可能显著高于实际组织中的表达,并且可能导致人为亚细胞定位。在培养的细胞群体内,过度表达也可能是异质的。可分批生产细胞系,但这些细胞系可能快速耗尽,需要生产可具有不同特征的新批次。
已经尝试了旨在建立标准化方法以产生ihc对照的多种方法。在45年前,brandtzaeg描述了一种方法以创建“人造组织”样品:戊二醛固定的兔血清的毫米大小的块,允许人类免疫球蛋白部分或全血清扩散至所述块中(brandtzaeg,p.(1972)immunology;22(1):177-183)。在接下来的十二年中,对这种通用技术进行了重新研究并取得了明显的成功(millar和williams(1982)histochemj.14(4):609-620;schipper和tilders(1983)jhistochemcytochem.31(1):12-18;valnes等(1984)jhistochemcytochem.33(8):755-61;valnes和brandtzaeg(1985)histochemistry.81(4):313-9),但也已经被描述为易于发生非均质和非特异性的染色(shi等(2005)jhistochemcytochem.53(9):1167-1170),并且在最近的实践中已经很少使用。具有可变充分表征的标靶蛋白质丰度的克隆细胞系得到更广泛的使用(mohdomar等(2010)actahistochem.112(6):519-28)。这些克隆细胞系在许多情形中是无价的,但细胞系对照可在单独的亚克隆体、一个克隆体的不同传代中或甚至一个培养群体内显示特异性标靶的明显异质表达,从而阻碍了创建均质和可再现的标准品的目标。
sompuram,s.r.等(2002)clinchem48:410-420描述了将肽直接点渍于玻璃载片上或将肽偶联至玻璃珠(还参见sompuram等(2015)j.histochemcytochem63:681-690)。然而,这种方法的实施带来了技术挑战。举例来说,由于技术人员难以观察到将肽施加于玻璃上的斑点(在染色之前它们是不可见的),因此许多载片被不足以覆盖所有对照的量的试剂染色,从而导致染色中的伪影(参见bogen,s.a.等(2009)applimmunohistochemmolmorphol17:239-246)。这些肽斑点也比实际组织切片薄得多,并且因此难以达成强烈的阳性对照染色。其他小组已经尝试将所关注的标靶混合于溶菌酶溶液中,所述溶菌酶溶液可如同福尔马林固定的石蜡包埋组织切片一样制备(参见fowler,c.b.等(2007)labinvest87:836-846)。他们指出,凝胶形成取决于蛋白质浓度和等电点(fowler等,(2007)labinvest.87(8):836-46)。然而,这种方法对可能会从溶菌酶明胶中漏出的许多标靶(例如肽)不起作用。还测试了作为潜在组织替代物的琼脂糖。然而,分散于琼脂糖中的肽不是均质的。另外,对这些基于琼脂糖的肽凝胶进行抗原修复(通常包括煮沸)使琼脂糖熔化并导致其在玻璃载片上分离。
因此,需要一种提供灵敏的、特异性的并且可适于大范围标靶的可靠的阳性和阴性ihc对照的方法,所述标靶包括不存在适合的生物对照的标靶。这种方法还将提供可用于确定抗体特异性的测定,当筛选大量抗体以鉴定和验证对所关注的标靶具有特异性的新抗体时这种测定特别有利;以及可用于优化ihc染色方案的测定。
本文所引用的所有参考文献,包括专利申请、专利公布、非专利文献和uniprotkb/swiss-prot寄存编号以全文引用的方式并入本文中,如同每个个别参考文献特定地和个别地指示为以引用的方式并入一样。
技术实现要素:
为了满足这些和其它需求,本文提供了用于产生固体抗原/载体蛋白凝胶的方法。这些固体凝胶可根据标准ihc或电子显微术(em)处理方法(包括固定、切片、抗原修复等)如同组织样品或其它生物样品一样处理。由于凝胶含有已知量的所关注的抗原,因此所述凝胶可用于例如创建一系列具有已知抗原浓度的凝胶,以将使用特定抗体的染色标准化,或筛选特异性识别所关注的抗原并且适用于ihc/em分析的抗体。这些方法被认为提供了一个通用平台,所述平台允许任何所关注抗原的对照染色,从而使用已知浓度的抗原模拟多种表达水平。
本公开的某些方面涉及产生固体抗原/载体蛋白凝胶(例如,用于ihc或em分析)的方法,所述方法包括:(a)将纯化抗原与包含选自由白蛋白(例如,血清白蛋白)、蛋清蛋白或蛋清蛋白混合物和明胶组成的组的载体蛋白的液体溶液混合,以产生抗原/载体蛋白液体溶液;以及(b)加热抗原/载体蛋白液体溶液以形成固体抗原/载体蛋白凝胶。在一些实施方案中,所述方法包括:(a)将纯化抗原与包含选自由白蛋白(例如,血清白蛋白)、蛋清蛋白或蛋清蛋白混合物、明胶和聚赖氨酸组成的组的载体蛋白的液体溶液混合,以产生抗原/载体蛋白液体溶液;以及(b)加热抗原/载体蛋白液体溶液以形成固体抗原/载体蛋白凝胶。在一些实施方案中,所述方法在(b)之后还包括:使固体抗原/载体蛋白凝胶脱水以及将脱水的固体抗原/载体蛋白凝胶包埋于石蜡块中。在一些实施方案中,所述方法在将脱水的固体抗原/载体蛋白凝胶包埋于石蜡块中之后还包括:将包含抗原/载体蛋白凝胶的核心从石蜡块转移至接受体组织微阵列(tma)块。在一些实施方案中,所述方法在(b)之后还包括:在液体包埋介质中孵育固体抗原/载体蛋白凝胶以及在包埋介质中冷冻固体抗原/载体蛋白凝胶。在一些实施方案中,所述方法在(b)之后还包括:将固体抗原/载体蛋白凝胶包埋于塑料树脂中。在一些实施方案中,所述方法在(b)之后还包括:将固体抗原/载体蛋白凝胶切成一个或多个厚度在约30nm与约50μm之间的固体抗原/载体蛋白凝胶切片。在一些实施方案中,将固体抗原/载体蛋白凝胶切成一个或多个厚度在约2μm与约30μm之间的固体抗原/载体蛋白凝胶切片。在一些实施方案中,将固体抗原/载体蛋白凝胶切成一个或多个厚度在约30nm与约100nm之间的固体抗原/载体蛋白凝胶切片。在一些实施方案中,所述方法在(b)之前还包括在抗原/载体蛋白液体溶液中包括固定剂。在一些实施方案中,固定剂包括甲醛。在一些实施方案中,抗原/载体蛋白液体溶液包含最终浓度为至少约1%的甲醛。在一些实施方案中,固定剂包括戊二醛、戴维森氏固定剂(davidson'sfixative)、布安氏固定剂(bouin'sfixative)、1/2强度卡诺夫斯基氏固定剂(1/2strengthkarnovski'sfixative)或锌盐。在一些实施方案中,所述方法还包括对固体抗原/载体蛋白凝胶进行抗原修复。在一些实施方案中,对固体抗原/载体蛋白凝胶进行抗原修复包括加热液体溶液中的固体抗原/载体蛋白凝胶。在一些实施方案中,所述方法还包括:在(b)之前,在抗原/载体蛋白液体溶液中包括固定剂;在(b)之后,使固体抗原/载体蛋白凝胶脱水;将脱水的固体抗原/载体蛋白凝胶包埋于石蜡块中;将具有包埋的抗原/载体蛋白凝胶的石蜡块切成一个或多个厚度在约30nm与约50μm之间的切片;对包埋的固体抗原/载体蛋白凝胶的一个或多个切片进行抗原修复;以及在抗原修复之后,封闭包埋的固体抗原/载体蛋白凝胶的一个或多个切片。在一些实施方案中,所述方法还包括:在(b)之后,在液体包埋介质中孵育固体抗原/载体蛋白凝胶;在包埋介质中冷冻固体抗原/载体蛋白凝胶;将冷冻的抗原/载体蛋白凝胶切成一个或多个厚度在约30nm与约50μm之间的切片;以及封闭冷冻的抗原/载体蛋白凝胶的一个或多个切片。在一些实施方案中,抗原是多肽抗原。在一些实施方案中,抗原包含n端酪氨酸、c端半胱氨酸或两者。在一些实施方案中,所述方法还包括在(b)之前,使用半胱氨酸反应试剂使抗原与载体蛋白(例如,白蛋白、蛋清蛋白或蛋清蛋白混合物或明胶)交联。在一些实施方案中,抗原包括非多肽抗原。在一些实施方案中,载体蛋白是白蛋白,例如牛、山羊、马或人血清白蛋白。在一些实施方案中,载体蛋白是蛋清蛋白或蛋清蛋白混合物。在一些实施方案中,(a)中产生的抗原/载体蛋白液体溶液包含浓度大于或等于2%(w/v)的载体蛋白。在一些实施方案中,(a)中产生的抗原/载体蛋白液体溶液包含最终浓度小于或等于约25%(w/v)的载体蛋白。在一些实施方案中,载体蛋白是明胶,并且所述方法在(b)之后还包括冷却经过加热的抗原/载体蛋白液体溶液以形成固体抗原/载体蛋白凝胶。在一些实施方案中,所述方法在冷却经过加热的抗原/载体蛋白液体溶液之后还包括:将固体抗原/载体蛋白凝胶与固定剂一起孵育以形成固定的抗原/载体蛋白凝胶;以及使固定的抗原/载体蛋白凝胶脱水。在一些实施方案中,(a)中产生的抗原/载体蛋白液体溶液包含浓度大于或等于约0.5%(w/v)的载体蛋白。在一些实施方案中,在(b)中将抗原/载体蛋白液体溶液加热至至少约65℃。在一些实施方案中,在(b)中将抗原/载体蛋白液体溶液加热至至少约65℃持续至少6分钟。在一些实施方案中,聚赖氨酸以约14mg/ml的浓度存在于(a)中产生的抗原/载体蛋白液体溶液中。
本文还提供了通过根据上述实施方案中任一项的方法产生的固体抗原/载体蛋白凝胶。
本文还提供了组织微阵列(tma),所述组织微阵列至少包含通过根据上述实施方案中任一项的方法产生的第一固体抗原/载体蛋白凝胶和通过根据上述实施方案中任一项的方法产生的第二固体抗原/载体蛋白凝胶。
本公开的某些方面涉及用于抗原的免疫组织化学(ihc)染色的方法,所述方法包括:提供通过上述实施方案中任一项的方法产生的固体抗原/载体蛋白凝胶,其中所述固体抗原/载体蛋白凝胶含有抗原;提供样品;使固体抗原/载体蛋白凝胶和样品与特异性结合抗原的一级抗体接触;在使固体抗原/载体蛋白凝胶和样品与一级抗体接触之后,使固体抗原/载体蛋白凝胶和样品与特异性结合一级抗体的二级抗体接触,其中可检测部分缀合至二级抗体;从固体抗原/载体蛋白凝胶中检测可检测部分的信号;以及从样品中检测可检测部分的信号,其中与从固体抗原/载体蛋白凝胶中检测到的信号相比,从样品中检测到信号指示样品中存在抗原。在一些实施方案中,可检测部分包括酶,并且其中检测可检测部分的信号包括将可检测部分暴露于酶的显色、荧光或化学发光底物并且在与酶反应后检测来自底物的信号。在一些实施方案中,可检测部分包括荧光团、金属颗粒、金属离子、放射性同位素、核酸、电化学发光报告子或“量子点”(固态的基于半导体或碳的荧光纳米颗粒)。在一些实施方案中,样品是组织样品。
本公开的某些方面涉及用于抗原的对照免疫组织化学(ihc)染色的方法,所述方法包括:提供第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶,其中第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶中的每一者是通过上述实施方案中任一项的方法产生,其中第一固体抗原/载体蛋白凝胶含有处于第一浓度的抗原,并且其中第二固体抗原/载体蛋白凝胶含有处于高于第一浓度的第二浓度的抗原;使第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶与特异性结合抗原的一级抗体接触;在使第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶与一级抗体接触之后,使第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶与特异性结合一级抗体的二级抗体接触,其中可检测部分缀合至二级抗体;从第一固体抗原/载体蛋白凝胶中检测可检测部分的第一信号;以及从第二固体抗原/载体蛋白凝胶中检测可检测部分的第二信号,其中检测到高于第一信号的第二信号指示抗原的对照ihc染色。在一些实施方案中,可检测部分包括酶,并且其中检测可检测部分的信号包括将可检测部分暴露于酶的显色、荧光或化学发光底物并且在与酶反应后检测来自底物的信号。在一些实施方案中,可检测部分包括荧光团、金属颗粒、金属离子、放射性同位素、核酸、电化学发光报告子或“量子点”(固态的基于半导体或碳的荧光纳米颗粒)。在一些实施方案中,第一浓度为0nm,并且其中检测到第一信号的缺失指示抗原的对照ihc染色。在一些实施方案中,所述方法还包括:提供样品;使样品与一级抗体接触;在使样品与一级抗体接触之后,使样品与二级抗体接触,其中可检测部分缀合至二级抗体;从样品中检测可检测部分的第三信号;以及将第三信号与第一信号和第二信号进行比较,其中相对于第一信号和第二信号的量,第三信号的量指示相对于第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶中抗原的量,样品中抗原的丰度。
本公开的某些方面涉及用于使用二级抗体的对照免疫组织化学(ihc)染色的方法,所述方法包括:提供第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶,其中第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶中的每一者是通过上述实施方案中任一项的方法产生,其中第一固体抗原/载体蛋白凝胶包含具有第一同型的第一抗体,并且其中第二固体抗原/载体蛋白凝胶包含具有不同于第一同型的第二同型的第二抗体;使第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶与特异性结合第一同型的二级抗体接触,其中可检测部分缀合至二级抗体;从第一固体抗原/载体蛋白凝胶中检测可检测部分的信号;以及从第二固体抗原/载体蛋白凝胶中检测可检测部分的信号缺失,其中检测到与第一固体抗原/载体蛋白凝胶相关的信号和与第二固体抗原/载体蛋白凝胶相关的信号缺失指示使用二级抗体的对照染色。在一些实施方案中,可检测部分包括酶,并且其中检测可检测部分的信号包括将可检测部分暴露于酶的显色、荧光或化学发光底物并且在与酶反应后检测来自底物的信号。在一些实施方案中,可检测部分包括荧光团、金属颗粒、金属离子、放射性同位素、核酸、电化学发光报告子或“量子点”(固态的基于半导体或碳的荧光纳米颗粒)。
本公开的某些方面涉及固体抗原/载体蛋白凝胶(例如,用于免疫组织化学(ihc)染色),所述固体抗原/载体蛋白凝胶包含交联至选自由白蛋白(例如,血清白蛋白)、蛋清蛋白或蛋清蛋白混合物和明胶组成的组的载体蛋白的纯化抗原。在一些实施方案中,本公开涉及固体抗原/载体蛋白凝胶(例如,用于免疫组织化学(ihc)染色),所述固体抗原/载体蛋白凝胶包含交联至选自由白蛋白(例如,血清白蛋白)、蛋清蛋白或蛋清蛋白混合物、明胶和聚赖氨酸组成的组的载体蛋白的纯化抗原。在一些实施方案中,固体凝胶的厚度在约30nm与约50μm之间。在一些实施方案中,固体凝胶的厚度在约2μm与约30μm之间。在一些实施方案中,固体凝胶的厚度在约30nm与约100nm之间。在一些实施方案中,在包埋介质中冷冻固体凝胶。在一些实施方案中,将固体凝胶包埋于石蜡中。在一些实施方案中,将固体凝胶包埋于塑料树脂中。在一些实施方案中,使固体凝胶附着至固体基底。在一些实施方案中,已将固体凝胶固定于固定剂中。在一些实施方案中,固定剂包括甲醛。在一些实施方案中,固定剂包括浓度为至少约1%的甲醛。在一些实施方案中,固定剂包括戊二醛、戴维森氏固定剂、布安氏固定剂、1/2强度卡诺夫斯基氏固定剂或锌盐。在一些实施方案中,已对固体凝胶进行抗原修复。在一些实施方案中,抗原是多肽抗原。在一些实施方案中,抗原包含n端酪氨酸、c端半胱氨酸或两者。在一些实施方案中,n端酪氨酸和/或c端半胱氨酸交联至载体蛋白。在一些实施方案中,抗原包括非多肽抗原。在一些实施方案中,载体蛋白是白蛋白,例如牛、山羊、马或人血清白蛋白。在一些实施方案中,载体蛋白是蛋清蛋白或蛋清蛋白混合物。在一些实施方案中,固体凝胶包含浓度大于或等于2%的载体蛋白。在一些实施方案中,固体凝胶包含浓度小于或等于约25%的载体蛋白。在一些实施方案中,载体蛋白是明胶。在一些实施方案中,固体凝胶包含浓度大于或等于0.5%的载体蛋白。在一些实施方案中,固体凝胶含有浓度为至少约25nm的抗原。在一些实施方案中,固体凝胶包含浓度为约14mg/ml的聚赖氨酸。
本公开的某些方面涉及至少包含第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶的组织微阵列(tma),其中第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶均包含交联至选自由白蛋白、蛋清蛋白或蛋清蛋白混合物和明胶组成的组的载体蛋白的纯化抗原。在一些实施方案中,本公开涉及至少包含第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶的组织微阵列(tma),其中第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶均包含交联至选自由白蛋白、蛋清蛋白或蛋清蛋白混合物、明胶和聚赖氨酸组成的组的载体蛋白的纯化抗原。在一些实施方案中,第一固体抗原/载体蛋白凝胶包含第一纯化抗原,并且第二固体抗原/载体蛋白凝胶包含不同于第一纯化抗原的第二纯化抗原。在一些实施方案中,第一固体抗原/载体蛋白凝胶包含处于第一浓度的第一纯化抗原,并且第二固体抗原/载体蛋白凝胶包含处于不同于第一浓度的第二浓度的第一纯化抗原。
本公开的某些方面涉及用于抗原的免疫组织化学(ihc)染色的方法,所述方法包括:提供根据上述实施方案中任一项的固体抗原/载体蛋白凝胶,其中所述固体抗原/载体蛋白凝胶含有抗原;提供样品;使固体抗原/载体蛋白凝胶和样品与特异性结合抗原的一级抗体接触;在使固体抗原/载体蛋白凝胶和样品与一级抗体接触之后,使固体抗原/载体蛋白凝胶和样品与特异性结合一级抗体的二级抗体接触,其中可检测部分缀合至二级抗体;从固体抗原/载体蛋白凝胶中检测可检测部分的信号;以及从样品中检测可检测部分的信号,其中与从固体抗原/载体蛋白凝胶中检测到的信号相比,从样品中检测到信号指示样品中存在抗原。在一些实施方案中,可检测部分包括酶,并且其中检测可检测部分的信号包括将可检测部分暴露于酶的显色、荧光或化学发光底物并且在与酶反应后检测来自底物的信号。在一些实施方案中,可检测部分包括荧光团、金属颗粒、金属离子、放射性同位素、核酸、电化学发光报告子或“量子点”(固态的基于半导体或碳的荧光纳米颗粒)。在一些实施方案中,样品是组织样品。
本公开的某些方面涉及用于抗原的对照免疫组织化学(ihc)染色的方法,所述方法包括:提供根据上述实施方案中任一项的第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶,其中第一固体抗原/载体蛋白凝胶含有处于第一浓度的抗原,并且其中第二固体抗原/载体蛋白凝胶含有处于高于第一浓度的第二浓度的抗原;使第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶与特异性结合抗原的一级抗体接触;在使第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶与一级抗体接触之后,使第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶与特异性结合一级抗体的二级抗体接触,其中可检测部分缀合至二级抗体;从第一固体抗原/载体蛋白凝胶中检测可检测部分的第一信号;以及从第二固体抗原/载体蛋白凝胶中检测可检测部分的第二信号,其中检测到高于第一信号的第二信号指示抗原的对照ihc染色。在一些实施方案中,可检测部分包括酶,并且其中检测可检测部分的信号包括将可检测部分暴露于酶的显色、荧光或化学发光底物并且在与酶反应后检测来自底物的信号。在一些实施方案中,可检测部分包括荧光团、金属颗粒、金属离子、放射性同位素、核酸、电化学发光报告子或“量子点”(固态的基于半导体或碳的荧光纳米颗粒)。在一些实施方案中,第一浓度为0nm,并且其中检测到第一信号的缺失指示抗原的对照ihc染色。在一些实施方案中,所述方法还包括:提供样品;使样品与一级抗体接触;在使样品与一级抗体接触后,使样品与二级抗体接触;从样品中检测可检测部分的第三信号;以及将第三信号与第一信号和第二信号进行比较,其中相对于第一信号和第二信号的量,第三信号的量指示相对于第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶中抗原的量,样品中抗原的丰度。
本公开的某些方面涉及用于使用二级抗体的对照免疫组织化学(ihc)染色的方法,所述方法包括:提供根据上述实施方案中任一项的第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶,其中第一固体抗原/载体蛋白凝胶包含具有第一同型的第一抗体,并且其中第二固体抗原/载体蛋白凝胶包含具有不同于第一同型的第二同型的第二抗体;使第一固体抗原/载体蛋白凝胶和第二固体抗原/载体蛋白凝胶与特异性结合第一同型的二级抗体接触,其中可检测部分缀合至二级抗体;从第一固体抗原/载体蛋白凝胶中检测可检测部分的信号;以及从第二固体抗原/载体蛋白凝胶中检测可检测部分的信号缺失,其中检测到与第一固体抗原/载体蛋白凝胶相关的信号和与第二固体抗原/载体蛋白凝胶相关的信号缺失指示使用二级抗体的对照染色。在一些实施方案中,可检测部分包括酶,并且其中检测可检测部分的信号包括将可检测部分暴露于酶的显色、荧光或化学发光底物并且在与酶反应后检测来自底物的信号。在一些实施方案中,可检测部分包括荧光团、金属颗粒、金属离子、放射性同位素、核酸、电化学发光报告子或“量子点”(固态的基于半导体或碳的荧光纳米颗粒)。
本公开的某些方面涉及试剂盒(例如,用于抗原的对照免疫组织化学(ihc)染色),所述试剂盒包括:第一固体凝胶,所述第一固体凝胶包含交联至选自由白蛋白(例如,血清白蛋白)、蛋清蛋白或蛋清蛋白混合物和明胶组成的组的载体蛋白的纯化抗原,其中纯化抗原以第一浓度存在于第一固体凝胶中;以及第二固体凝胶,所述第二固体凝胶包含交联至载体蛋白的纯化抗原,其中纯化抗原以不同于第一浓度的第二浓度存在于第二固体凝胶中。在一些实施方案中,试剂盒包括:第一固体凝胶,所述第一固体凝胶包含交联至选自由白蛋白(例如,血清白蛋白)、蛋清蛋白或蛋清蛋白混合物、明胶和聚赖氨酸组成的组的载体蛋白的纯化抗原,其中纯化抗原以第一浓度存在于第一固体凝胶中;以及第二固体凝胶,所述第二固体凝胶包含交联至载体蛋白的纯化抗原,其中纯化抗原以不同于第一浓度的第二浓度存在于第二固体凝胶中。在一些实施方案中,将第一固体凝胶和第二固体凝胶各自切成在约30nm与约50μm之间的厚度。在一些实施方案中,使第一固体凝胶和第二固体凝胶附着至一个或多个固体基底。在一些实施方案中,试剂盒还包括:包含载体蛋白的第三固体凝胶,其中第三固体凝胶不包含纯化抗原。在一些实施方案中,将第三固体凝胶切成在约30nm与约50μm之间的厚度。在一些实施方案中,使第三固体凝胶附着至固体基底。
应了解,本文所描述的各种实施方案的一种、一些或所有特性可组合形成本发明的其它实施方案。本发明的这些和其它方面对于本领域技术人员将变得显而易见。通过以下详细描述来进一步描述本发明的这些和其它实施方案。
附图说明
专利或申请文件含有至少一幅彩色绘图。在提出请求并支付必要的费用后,专利局将提供带有一幅或多幅彩图的本专利或专利申请公布的拷贝。
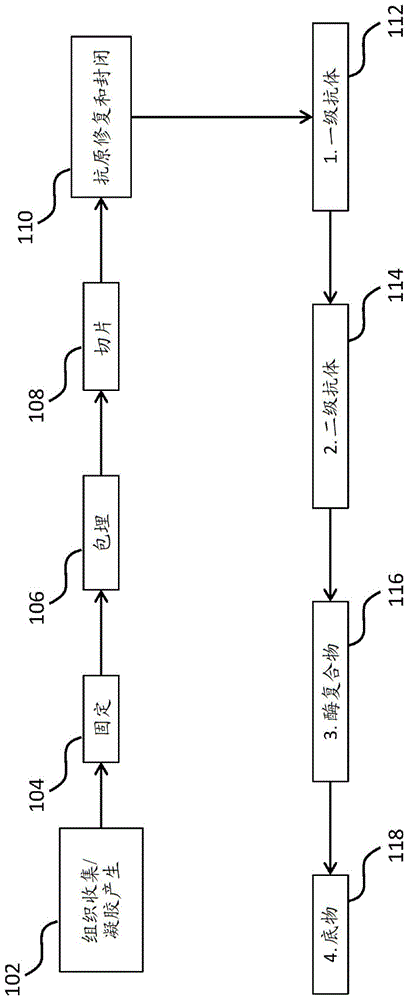
图1示出了使用从组织样品获得的载片进行ihc染色的示例性工作流程。
图2a示出了在1.5ml微量离心管中产生,然后从其中移出的牛血清白蛋白(bsa)凝胶。
图2b和2c示出了在1.5ml微量离心管中产生,然后从其中移出的bsa凝胶的不同截面视图。
图2d示出了准备用于脱水和石蜡处理的切片凝胶部分。
图2e示出了包埋于石蜡“供体块”中的切片凝胶部分。比例尺:1cm。
图2f示出了从各种石蜡凝胶供体块产生的组织微阵列(tma)。最暗的核心是含有黑色和绿色颜料的定向参考。
图3a示出了包埋于石蜡块中的bcl2肽/bsa凝胶圆柱体的4微米厚切片的ihc染色结果。插图示出了使用从bcl2肽/bsa凝胶获得的切片进行bcl2ihc染色的40x放大,所述bcl2肽/bsa凝胶含有(从左至右):无肽、5x10-5mg/ml(2.5e-8m)bcl2肽、5x10-4mg/ml(2.5e-7m)bcl2肽、5x10-3mg/ml(2.5e-6m)bcl2肽、5x10-2mg/ml(2.5e-5m)bcl2肽,或0.5mg/ml(2.5e-4m)bcl2肽。将对应于0、1+、2+或3+(在0至3+定性标度上)bcl2染色的切片作标记。
图3b示出了分析图3a中所示的切片的光密度(od)对比bcl2肽浓度的六个独立实验的结果。
图3c示出了分析图3a中所示的切片的图像强度对比bcl2肽浓度的六个独立实验的结果。
图3d和3e示出了包埋于石蜡块中,用抗bcl2一级抗体染色,并且用荧光报告子(使用ventanamedicalsystemsomnimap抗小鼠hrp检测系统,继之以ventanadiscoveryred610检测系统)检测的bcl2肽/bsa凝胶圆柱体的4微米厚切片的定量免疫荧光(if)染色结果。测试样品包括野生型(未突变)bcl2肽、具有六个不同单氨基酸取代的bcl2肽以及来自mcl1蛋白质的肽(预期不会结合抗bcl2抗体的阴性对照样品)。图3d示出了报告子的红色荧光。图3e示出了在dapi过滤器通道中成像的相同tma的荧光(检测bsa核心中的蓝色自发荧光)。
图3f和3g示出了包埋于石蜡块中,用天然对照一级抗体染色的bcl2肽/bsa凝胶圆柱体的4微米厚切片的定量免疫荧光(if)染色结果。图3f示出了报告子的荧光。图3g示出了在dapi过滤器通道中成像的相同tma的荧光(检测bsa核心中的自发荧光)。
图3h示出了图3d中所示的结果的定量(报告为平均光学发射率)。野生型bcl2肽在每种浓度下均显示最强信号;正如预期,阴性对照mcl1肽显示最小信号。具有单氨基酸取代的六个bcl2肽显示可变信号,一般介于野生型bcl2与阴性对照mcl1肽之间。
图3i示出了图3f中所示的结果的定量(报告为平均光学发射率)。正如预期,天然对照抗体显示几乎检测不到的信号。
图3j示出了图3d中所示的结果的定量(报告为平均信号强度)。野生型bcl2肽在每种浓度下均显示最强信号;正如预期,阴性对照mcl1肽显示最小信号。具有单氨基酸取代的六个bcl2肽显示可变信号,一般介于野生型bcl2与阴性对照mcl1肽之间。
图3k示出了图3f中所示的结果的定量(报告为平均信号强度)。正如预期,天然对照抗体显示几乎检测不到的信号。
图4a示出了在含有小鼠igg(左)或大鼠igg(右)的bsa凝胶切片上使用驴抗小鼠二级抗体进行的对照ihc染色。
图4b示出了在含有小鼠igg(左)或大鼠igg(右)的bsa凝胶切片上使用驴抗大鼠二级抗体进行的对照ihc染色。
图4c示出了引入人类bcl2的抗bcl2克隆体124抗体表位(如uniprot寄存编号p10415中所列的人类bcl2序列的氨基酸41-54)中的氨基酸取代(如所指示)对ihc染色的影响。这个图像为4微米厚切片的图像,所述切片从使用bcl2肽/bsa凝胶圆柱体(每个直径1mm)构建的石蜡包埋的组织微阵列切下,用抗bcl2抗体克隆体124染色并且用显色试剂和方法检测。
图4d示出了图4c中所示的结果的定量(报告为光密度(o.d.))。
图5a-5d示出了使用蛋白质/bsa凝胶通过ihc筛选从经过人类ksr2免疫的小鼠获得的二十七种不同抗体的结果(与图5d中用天然小鼠igg染色相比较)。每个图的上面一行示出了在不含蛋白质的bsa凝胶上使用每种抗体进行的ihc染色的结果。下面一行示出了在嵌有用于使小鼠免疫的人类ksr2蛋白质的bsa凝胶上使用每种抗体进行的ihc染色的结果。对于每个相应的列指示了小鼠抗体克隆体。核对标记指示最高性能的克隆体,如标靶蛋白质样品(下面一行)中的强信号连同阴性对照样品(上面一行)中的最小信号所证明。
图6示出了评价温度和加热时间对bsa凝胶形成的影响的结果。温度指示加热液体25%bsa溶液的温度。时间指示加热bsa溶液,然后在冷却至室温之前测试固相/液相的持续时间。s=固体;l=液体;semi-s=半固体。
图7示出了评价时间、温度和bsa浓度对bsa凝胶形成的影响的结果。温度指示加热液体bsa溶液的温度。时间指示加热bsa溶液,然后在冷却至室温之前测试固相/液相的持续时间。百分比指示bsa/pbs液体溶液中bsa的浓度。s=固体;l=液体;o/n=过夜。
图8示出了使用抗兔igg二级抗体检测的由bsa、蛋清蛋白或明胶与(下面一行)或不与(上面一行)兔igg制成的凝胶的ihc染色。
图9示出了由乳白蛋白、肝蛋白粉或大豆粉与(下面一行)或不与(上面一行)兔igg制成的非均质凝胶。
图10示出了由酪蛋白或脱脂奶粉与(下面一行)或不与(上面一行)兔igg制成的凝胶不粘附至用于ihc染色的玻璃载片。
图11a-11d示出了使用显色测定以检查凝胶中的抗原分布的两个单独实验的结果。将含有5x10-5mbcl2肽(图11a和11c中的上面一行)或不含肽(图11a和11c中的下面一行)的bsa凝胶的四微米厚“供体块”切片在两个单独实验(实验1:图11a和11c中的左列;实验2:图11a和11c中的右列)中用抗bcl2克隆体124染色。使用imagej中的plotprofile功能,沿着水平(图11a)和垂直(图11c)轴来定量染色切片的数字图像。结果分别在(图11b)和(图11d)中示出。实验1和2分别以黑色和灰色指示。仅bcl2肽和仅bsa的对照切片的数据分别以实线和虚线指示。
图12a-12e示出了使用bcl2肽tma对bcl2进行ihc分析的结果。(图12a)用抗bcl2克隆体124染色的组织微阵列切片包括不含添加肽(bsa)、含有处于所指示浓度的编码bcl2蛋白质的氨基酸41-54的肽的稀释系列或来自人类mcl1蛋白质的阴性对照肽的重复tma核心。bcl2和mcl1行的图像是来自同一tma切片的不同视野。tma核心的直径为1mm。使用免疫荧光检测用抗bcl2克隆体124(图12b)或使用显色检测用抗bcl2克隆体epr17509(图12c)对来自(图12a)中所描述的同一tma的连续切片进行染色。(图12d)如图12a-12c中所示的含有bcl2肽(圆圈)或mcl1肽(正方形)的个别核心中的信号定量。(图12e)(图12d)中所示的曲线的相关参数。希尔斜率(hillslope)参数传达曲线的陡度。achm是半最大信号处的抗原浓度。
图13a示出了单一组织微阵列的连续切片含有不具有添加肽(bsa)、具有编码bcl2蛋白质的氨基酸41-54的肽或人类mcl1蛋白质的阴性对照肽的bsa凝胶核心。使用抗bcl2克隆体sp66或克隆体e17对两个载片以显色方式进行bcl2抗原染色。
图13b示出了(图13a)中所示的图像的定量。
图14a-14c示出了重复切片的可再现性。(图14a)来自单一组织微阵列的六个连续切片的图像,所述六个连续切片含有不具有添加肽(bsa)或具有编码bcl2蛋白质的氨基酸41-54的肽的重复tma核心。由两名操作员在六个不同的天内使用克隆体124对每个载片进行bcl2染色。操作员1染色操作1;操作员2染色操作2-6。(图14b)图14a中所示的图像的定量。示出了在六个tma中的每一者上来自每种肽浓度的重复核心的平均信号。(图14c)表格汇总了图14b中所示的曲线的相关参数。
图15a-15c示出了在存在和不存在抗原修复的情况下bcl2肽的ihc染色。(图15a)tma含有不具有添加肽(bsa)或具有处于所指示浓度的编码bcl2蛋白质的氨基酸41-54的肽的bsa凝胶核心。将切片在存在(ar)下或在抗原修复之前不存在(无ar)下染色。(图15b)图15a中所示的图像的定量。实心正方形:存在抗原修复;空心正方形:不存在抗原修复。示出了来自每种肽浓度的重复核心的平均信号。(图15c)表格汇总了图15b中所示的曲线的相关参数。
图16a-16c示出了替代性bcl2肽n端和c端影响信号强度。(图16a)来自含有重复bsa凝胶核心的单一tma切片的图像,所述重复bsa凝胶核心不具有添加肽(bsa)或具有编码侧接有三氨基酸序列gsg的bcl2蛋白质的氨基酸41-54(行i-v)的22个氨基酸的肽,其中替代性n端和c端氨基酸(乙酰基-n,c-酰胺)如所指示。(图16b)图16a中所示的图像的定量。示出了来自每种肽浓度的重复核心的平均信号。(图16c)表格汇总了图16b中所示的曲线的相关参数。
图17a-17e示出了bcl2和myc肽的ihc染色。(图17a)如所指示含有来自人类myc的2.5×10-4m肽的供体块的切片。比例尺为1mm。(图17b和17c)用抗bcl2克隆体124(图17b)或抗myc克隆体y69(图17c)染色的单一tma切片包括配制成不含肽(bsa)或含有编码bcl2氨基酸41-54和myc氨基酸9-24的肽的重复核心。(图17d)图17b和17c中所示的图像的定量。示出了来自每种肽浓度的重复核心的平均信号。(图17e)图17d中所示的曲线的相关参数。
图18a-18c示出了双重myc/bcl2免疫荧光(if)图像分析。(图18a)来自包括核心的tma的单一部分,所述核心不具有肽(bsa)或具有处于所指示浓度的编码bcl2氨基酸41-54和myc氨基酸9-24的肽。依次用抗bcl2克隆体124和抗myc克隆体y69对切片进行染色,用ventanadiscoveryfam(bcl2;绿色)或discoverycy5(myc;红色)试剂盒检测,然后在每种荧光染料的适当波长下成像。(图18b)图18a中所示的图像的定量。示出了来自每种肽浓度的重复核心的平均信号。误差条指示±1标准偏差。(图18c)表格汇总了图18b中所示的曲线的相关参数。
图19a和19b示出了综合抗bcl2克隆体124数据。(图19a)将来自图12a-12e和14a-17e(n=10个独立ihc测定,每个测定具有每种肽浓度的重复核心)分组并绘图。误差条代表1个标准偏差(n=10)。(图19b)图19a中的数据的相关参数。
图20a和20b测试了在图5a-5d中针对人类ksr2筛选的抗体在存在和不存在抗原修复的情况下的染色。图20a中的图像示出了不含蛋白质(bsa)或含有6.3×10-6m所关注蛋白质的bsa凝胶的切片,所述切片在存在(ar)下或在抗原修复之前不存在(无ar)下用精选的小鼠抗体进行染色。图20b提供了图20a中所示的结果的定量。
图21a和21b示出了具有小鼠、大鼠和兔igg的bsa凝胶。(图21a)将由含有天然兔、大鼠或小鼠igg(0.1毫克/毫升;6.7×10-7m)的重复bsa凝胶核心组成的tma的连续切片用对来自所指示物种的igg具有特异性的驴二级抗体进行染色。tma核心的直径为1mm。(图21b)图21a中所示的图像的定量:兔igg抗原(实心条);大鼠igg(散列条);小鼠igg(空心条)。对于每种物种特异性抗体,含有标靶igg的核心中的信号显著高于含有非标靶igg的核心(p<0.0001)。误差条为1sd。注意,这些数据也在图3c中示出。
图22a-22c示出了使用替代性固定剂产生肽凝胶的结果。(图22a)通过在18.5%甲醛或50%锌固定剂存在下于85c下加热10分钟,用bcl2或myc肽制备供体核心。将供体块配制成不含肽(bsa),或含有编码bcl2氨基酸41-54和myc氨基酸9-24的肽。适当时用抗bcl2克隆体124或抗myc克隆体y69对切片进行染色。(图22b)图22a中所示的图像的定量。(图22c)图22b中所示的曲线的相关参数。
图23a和23b示出了测试替代性固定剂的结果。(图23a)通过在含锌固定剂(zn和热)或浓甲醛(37%甲醛和热)存在下加热至85c来制备含有bcl2肽的bsa凝胶,或在不存在固定剂的情况下加热至85c,然后在室温下于含锌固定剂(热,zn)、4%pfa(热,4%pfa)或中性缓冲福尔马林(热,nbf)中固定。(图23b)图23a中的图像的定量。
图24a-24c示出了bcl2肽tma的成像质谱流式细胞分析。(图24a)用缀合至146nd质谱标签的抗bcl2克隆体epr17509染色的tma切片的代表性视野(约150微米见方)并且在fluidigmhyperion扫描质谱仪中成像。重复tma核心不含添加肽(bsa),含有处于所指示浓度的编码bcl2蛋白质的氨基酸41-54的肽或来自人类mcl1蛋白质的阴性对照肽。(图24b)图24a中所示的图像的定量。误差条指示1个标准偏差。(图24c)表格汇总了图24b中所示的曲线的相关参数。希尔斜率参数传达曲线的陡度。achm是半最大信号处的抗原浓度。
具体实施方式
i.定义
所有专利、申请、公布的申请和其它出版物以全文引用的方式并入。除非另有定义,否则本文中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的含义相同的含义。
术语“多肽”或“蛋白质”在本文中可互换使用以指代任何长度的氨基酸聚合物。聚合物可为线性或分支的,其可包含经过修饰的氨基酸,并且其可间插有非氨基酸。这些术语还涵盖已被天然修饰或通过介入修饰的氨基酸聚合物;例如,二硫键形成、糖基化、脂质化、乙酰化、磷酸化或任何其它操作或修饰,例如与标记组分或毒素缀合。在定义内还包括例如含有氨基酸(包括例如非天然氨基酸等)的一种或多种类似物以及本领域中已知的其它修饰的多肽。如本文所用的术语“多肽”和“蛋白质”特定地涵盖抗体。
本文中的术语“抗原”以最广义使用并且涵盖多肽和非多肽抗原两者的各种形式,包括但不限于小肽抗原、全长蛋白抗原、碳水化合物抗原、脂质抗原和核酸抗原。
本文中的术语“抗体”以最广义使用并且涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要所述抗体片段展现所需抗原结合活性即可。术语“免疫球蛋白”(ig)在本文中与抗体可互换使用。
“纯化”抗原是指纯度已经提高的抗原,使得所述抗原以比其在天然环境中和/或在实验室条件下最初产生和/或合成和/或扩增时存在的形式更纯的形式存在。纯度是相对术语并且不一定意指绝对纯度。在一些实施方案中,将抗原纯化至至少90%、至少95%或至少99%的纯度。
ii.固体抗原/载体蛋白凝胶及其产生方法
本公开的某些方面涉及固体抗原/载体蛋白凝胶,以及用于产生固体抗原/载体蛋白凝胶的方法。
在一些实施方案中,本公开提供了一种包含纯化抗原和载体蛋白的固体抗原/载体蛋白凝胶。在一些实施方案中,载体蛋白选自白蛋白(例如,血清白蛋白)、蛋清蛋白或蛋清蛋白混合物、明胶和聚赖氨酸。在一些实施方案中,纯化抗原交联至载体蛋白。如下文所描述,这些凝胶可用作例如ihc染色或em成像分析的对照。
本公开证实了多种类型的载体蛋白可用于固体抗原/载体蛋白凝胶中。在一些实施方案中,载体蛋白是白蛋白。在一些实施方案中,载体蛋白是血清白蛋白。在一些实施方案中,血清白蛋白是哺乳动物血清白蛋白。血清白蛋白的实例包括但不限于小鼠、大鼠、豚鼠、兔、猪、牛、山羊、绵羊、马和人血清白蛋白。在一些实施方案中,载体蛋白是蛋清蛋白。在一些实施方案中,载体蛋白是两种或更多种蛋清蛋白的混合物。在一些实施方案中,载体蛋白是明胶。在一些实施方案中,载体蛋白是聚赖氨酸。
在一些实施方案中,固体抗原/载体蛋白凝胶包含浓度大于或等于0.5%、1%、2%、5%、7%、10%、15%或20%(w/v)的载体蛋白。在一些实施方案中,固体抗原/载体蛋白凝胶包含浓度小于或等于25%、20%、15%、10%、7%、5%、2%或1%(w/v)的载体蛋白。也就是说,固体抗原/载体蛋白凝胶可包含处于一定浓度范围的任何浓度下的载体蛋白,所述范围具有25%、20%、15%、10%、7%、5%、2%或1%(w/v)的上限和0.5%、1%、2%、5%、7%、10%、15%或20%(w/v)的独立选择的下限,其中下限小于上限。在一些实施方案中,载体蛋白包含白蛋白(例如,血清白蛋白),并且固体抗原/载体蛋白凝胶包含大于2%(w/v),例如在2%与25%(w/v)之间的载体蛋白。在一些实施方案中,载体蛋白包含蛋清蛋白或蛋清蛋白混合物,并且固体抗原/载体蛋白凝胶包含大于2%(w/v),例如在2%与25%(w/v)之间的载体蛋白。在一些实施方案中,载体蛋白包含明胶,并且固体抗原/载体蛋白凝胶包含大于0.5%(w/v),例如在0.5%与25%(w/v)或约10%(w/v)之间的载体蛋白。
在一些实施方案中,固体抗原/载体蛋白凝胶含有浓度为至少约25nm的抗原。在另一个实施方案中,固体抗原/载体蛋白凝胶含有浓度为约25nm的抗原。在又一个实施方案中,固体抗原/载体蛋白凝胶含有浓度为约15、20、25、30、35、40、50、60、75、80、90或100nm或更高的抗原。在另一个实施方案中,固体抗原/载体蛋白凝胶含有浓度为至少约10nm、15nm、20nm或25nm至约100nm的抗原。如本文所描述,本公开的固体抗原/载体蛋白凝胶可包含处于宽浓度范围内的抗原,这取决于例如检测方法的灵敏度、凝胶的所需应用等。
在一个实施方案中,方法包括两种或更多种抗原/载体蛋白凝胶。在一个实施方案中,使用两种凝胶,其中每种凝胶任选地具有不同浓度的抗原。在另一个实施方案中,使用三种凝胶,其中每种凝胶任选地具有不同浓度的抗原。实际上,包含不同浓度的抗原的多种凝胶可用作例如ihc染色的对照以代表一系列抗原浓度。
在一些实施方案中,抗原包括多肽抗原(例如,肽抗原或全长蛋白抗原)。在一些实施方案中,多肽抗原包含n端酪氨酸、c端半胱氨酸或两者(例如,用于使抗原化学交联至载体蛋白)。在一些实施方案中,n端酪氨酸和/或c端半胱氨酸交联至载体蛋白。举例来说,c端半胱氨酸可用于使抗原与载体蛋白交联。多种半胱氨酸反应性试剂在本领域是已知的,并且包括但不限于巯基反应性交联剂反应性基团,例如卤乙酰基、马来酰亚胺(例如,磺基-smcc和它的类似物)、氮丙啶、丙烯酰基、芳基化剂、乙烯基砜、吡啶基二硫化物、tnb-硫醇和二硫化物还原剂。
在一些实施方案中,固体抗原/载体蛋白凝胶已经用固定剂固定,例如,如下文所描述。在一些实施方案中,固定剂是交联固定剂(例如,基于醛的固定剂)。在一些实施方案中,固定剂不是交联固定剂(例如,沉淀固定剂,如卡诺氏固定剂(carnoy's))。如本文所描述,可通过加热使载体蛋白和/或抗原变性和沉淀,或通过向混合物中添加沉淀固定剂,从而使抗原固定于蛋白凝胶中,来制备含有载体蛋白和抗原的固体凝胶。对于一些抗原(尤其是小分子尺寸的那些抗原),认为使抗原交联至载体蛋白(在通过使载体蛋白变性而形成凝胶的过程期间或之后)有助于例如在包埋、切片和/或染色过程期间将抗原保留在凝胶中和所得切片中。
在一些实施方案中,抗原包括非多肽抗原。非多肽抗原的实例包括但不限于碳水化合物、脂质和核酸。
在一些实施方案中,固体抗原/载体蛋白凝胶的厚度在约30nm与约50μm之间。固体抗原/载体蛋白凝胶的适合厚度可取决于例如应用。在一些实施方案中,固体抗原/载体蛋白凝胶的厚度大于或等于约0.03、1、2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46或48μm。在一些实施方案中,固体抗原/载体蛋白凝胶的厚度小于或等于约50、48、46、44、42、40、38、36、34、32、30、28、26、24、22、20、18、16、14、12、10、8、6、4、2或1μm。也就是说,固体抗原/载体蛋白凝胶的厚度可具有50、48、46、44、42、40、38、36、34、32、30、28、26、24、22、20、18、16、14、12、10、8、6、4、2或1μm的上限和0.03、1、2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46或48μm的独立选择的下限,其中下限小于上限。举例来说,用于ihc染色的固体抗原/载体蛋白凝胶的厚度可例如在约2μm与约30μm之间,而用于em的固体抗原/载体蛋白凝胶的厚度可例如在约30nm与约50μm之间或约30nm与约100nm之间。下文描述了用于将本公开的固体抗原/载体蛋白凝胶切片的方法。
在一些实施方案中,已经对固体抗原/载体蛋白凝胶进行抗原修复。用于抗原修复的示例性方法在下文更详细地描述。
在一些实施方案中,将固体抗原/载体蛋白凝胶包埋于本公开的介质中,例如石蜡(例如,包埋于石蜡块中);环氧树脂、丙烯酸树脂或塑料树脂(例如,epontm树脂、甲基丙烯酸酯、lrwhite树脂、
在一些实施方案中,用于产生固体抗原/载体蛋白凝胶的方法包括将纯化抗原与包含载体蛋白的液体溶液混合以产生抗原/载体蛋白液体溶液以及加热抗原/载体蛋白液体溶液以形成固体抗原/载体蛋白凝胶。在一些实施方案中,载体蛋白选自白蛋白(例如,血清白蛋白)、蛋清蛋白或蛋清蛋白混合物和明胶。
在一些实施方案中,抗原/载体蛋白液体溶液包含浓度大于或等于0.5%、1%、2%、5%、7%、10%、15%或20%(w/v)的载体蛋白。在一些实施方案中,抗原/载体蛋白液体溶液包含浓度小于或等于25%、20%、15%、10%、7%、5%、2%或1%(w/v)的载体蛋白。也就是说,抗原/载体蛋白液体溶液可包含处于一定浓度范围的任何浓度下的载体蛋白,所述范围具有25%、20%、15%、10%、7%、5%、2%或1%(w/v)的上限和0.5%、1%、2%、5%、7%、10%、15%或20%(w/v)的独立选择的下限,其中下限小于上限。在一些实施方案中,载体蛋白包含白蛋白(例如,血清白蛋白),并且抗原/载体蛋白液体溶液包含大于2%(w/v),例如在2%与25%(w/v)之间的载体蛋白。在一些实施方案中,载体蛋白包含蛋清蛋白或蛋清蛋白混合物,并且抗原/载体蛋白液体溶液包含大于2%(w/v),例如在2%与25%(w/v)之间的载体蛋白。在一些实施方案中,载体蛋白包含明胶,并且抗原/载体蛋白液体溶液包含大于0.5%(w/v),例如在0.5%与25%(w/v)或约10%(w/v)之间的载体蛋白。
在一些实施方案中,本公开的方法包括(例如,在加热抗原/载体蛋白液体溶液之前)使用半胱氨酸反应性试剂使抗原与载体蛋白交联。多种半胱氨酸反应性试剂在本领域是已知的,并且包括但不限于巯基反应性交联剂反应性基团,例如卤乙酰基、马来酰亚胺(例如,磺基-smcc和它的类似物)、氮丙啶、丙烯酰基、芳基化剂、乙烯基砜、吡啶基二硫化物、tnb-硫醇和二硫化物还原剂。
在一些实施方案中,本公开的方法包括用载体蛋白固定抗原。在一些实施方案中,在抗原/载体蛋白液体溶液中包括固定剂。在一些实施方案中,固定剂是交联固定剂。在一些实施方案中,固定剂是非交联固定剂。适合的固定剂的实例包括但不限于甲醛、福尔马林、多聚甲醛(pfa)、戊二醛、戴维森氏固定剂、布安氏固定剂、卡诺夫斯基氏固定剂(例如,1/2强度卡诺夫斯基氏固定剂)、岑克尔氏溶液(zenker'ssolution)、海利氏溶液(helly'ssolution)、卡诺氏溶液(carnoy'ssolution)、锌福尔马林、中性缓冲福尔马林(nbf)、高碘酸盐-赖氨酸-多聚甲醛(plp)、赞博尼氏固定剂(zamboni'sfixative)、辛二亚氨酸二甲酯(dms)、丙酮、醇(例如,甲醇或乙醇)和锌盐(例如,乙酸锌、氯化锌、三氟乙酸锌等)。在一些实施方案中,固定剂包括甲醛(例如,浓度为至少约1%或至少约2%)。
在一些实施方案中,使用选择性化学,包括但不限于叠氮化物-炔烃加成,使抗原与载体蛋白交联。在一些实施方案中,选择性化学用于使非蛋白抗原与载体蛋白,例如碳水化合物或脂质抗原交联。
在一些实施方案中,本公开的方法包括使固体抗原/载体蛋白凝胶脱水。适用于脱水的化合物在本领域中是已知的,并且可包括例如醇,如乙醇或甲醇。在一些实施方案中,本公开的方法包括包埋固体抗原/载体蛋白凝胶。在一些实施方案中,在脱水后包埋固体抗原/载体蛋白凝胶。举例来说,在一些实施方案中,通过暴露于一系列增加或分级的醇(例如,一系列增加的乙醇浓度),继而将醇与二甲苯交换,以及将二甲苯与石蜡交换来使固体抗原/载体蛋白凝胶脱水。多种介质在本领域中是已知的并且可用于包埋,包括但不限于石蜡(例如,包埋于石蜡块中);环氧树脂、丙烯酸树脂或塑料树脂(例如,epontm树脂、甲基丙烯酸酯、lrwhite树脂、
在一些实施方案中,载体蛋白包括明胶,并且本公开的方法包括冷却经过加热的抗原/载体蛋白液体溶液以形成固体抗原/载体蛋白凝胶。在一些实施方案中,方法还包括孵育固体抗原/载体蛋白凝胶与固定剂以及使固体抗原/载体蛋白凝胶脱水。在一些实施方案中,抗原/载体蛋白液体溶液包含浓度大于或等于约0.5%(w/v)的载体蛋白。在一些实施方案中,将抗原/载体蛋白液体溶液加热至至少约65℃(例如,持续至少约6分钟)。
在一些实施方案中,载体蛋白包括聚赖氨酸,例如,浓度为约14mg/ml。
在一些实施方案中,本公开的方法包括在包埋介质(例如,液体包埋介质)中孵育固体抗原/载体蛋白凝胶。多种包埋介质在本领域中是已知的并且可包括但不限于最佳切割温度(oct)化合物(例如,
在一些实施方案中,本公开的方法包括将固体抗原/载体蛋白凝胶切成一个或多个固体抗原/载体蛋白凝胶切片。在一些实施方案中,一个或多个固体抗原/载体蛋白凝胶切片的厚度在约30nm与约50μm之间。在一些实施方案中,一个或多个固体抗原/载体蛋白凝胶切片的厚度大于或等于约0.03、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46或48μm。在一些实施方案中,一个或多个固体抗原/载体蛋白凝胶的厚度小于或等于约50、48、46、44、42、40、38、36、34、32、30、28、26、24、22、20、18、16、14、12、10、8、6、4、2、1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2或0.1μm。也就是说,一个或多个固体抗原/载体蛋白凝胶切片的厚度可具有50、48、46、44、42、40、38、36、34、32、30、28、26、24、22、20、18、16、14、12、10、8、6、4、2、1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2或0.1μm的上限和0.03、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46或48μm的独立选择的下限,其中下限小于上限。举例来说,用于ihc染色的固体抗原/载体蛋白凝胶切片的厚度可例如在约2μm与约30μm之间,而用于em的固体抗原/载体蛋白凝胶切片的厚度可例如在约30nm与约50μm之间或约30nm与约100nm之间。用于将本公开的固体抗原/载体蛋白凝胶切片的仪器在本领域中是已知的并且可包括但不限于切片机、低温恒温器(用于冷冻凝胶)、刀(例如,金刚石、玻璃或蓝宝石)等。在一些实施方案中,在切片之前对固体抗原/载体蛋白凝胶进行脱水、包埋、固定、冷冻或它们的组合。
在一些实施方案中,本公开的方法包括对固体抗原/载体蛋白凝胶进行抗原修复。多种抗原修复方法在本领域中是已知的。在一些实施方案中,对固体抗原/载体蛋白凝胶进行抗原修复包括加热液体溶液中的固体抗原/载体蛋白凝胶(例如,热诱导的表位修复),例如通过煮沸。在一些实施方案中,液体溶液包含缓冲液,例如tris/edta或柠檬酸钠缓冲液。在一些实施方案中,对固体抗原/载体蛋白凝胶进行抗原修复包括用一种或多种蛋白水解酶(例如,胰蛋白酶、蛋白酶k、胃蛋白酶、无花果蛋白酶或链霉蛋白酶)或抗原修复试剂(例如,盐酸、甲酸、十二烷基硫酸钠(sds)、柠檬酸盐缓冲液、edta、柠檬酸盐-edta、tris、tris-edta、tris-hcl、tris缓冲盐水或柠康酸酐)处理。对于抗原修复的额外描述,参见例如shi,s.r.等(2011)j.histochem.cytochem.59:13-32。
在一些实施方案中,本公开的方法包括封闭固体抗原/载体蛋白凝胶。如本领域中已知,封闭(例如,在ihc染色之前)通过防止结合至与特异性抗原:抗体相互作用无关的位点来减少与抗原的非特异性相互作用。多种适合的封闭试剂在本领域中是已知的并且可包括但不限于血清或蛋白质溶液(例如,包含血清白蛋白、明胶、脱脂奶粉等)。
在一些实施方案中,本公开的方法包括固定固体抗原/载体蛋白凝胶(例如,通过在抗原/载体蛋白液体溶液中包括固定剂),使固体抗原/载体蛋白凝胶脱水,包埋脱水的固体抗原/载体蛋白凝胶,将具有包埋的固体抗原/载体蛋白凝胶的石蜡块切成一个或多个切片,对一个或多个切片进行抗原修复,以及在抗原修复之后封闭一个或多个切片。在其它实施方案中,本公开的方法包括在液体包埋介质中孵育固体抗原/载体蛋白凝胶,在包埋介质中冷冻固体抗原/载体蛋白凝胶,将冷冻的抗原/载体蛋白凝胶切成一个或多个切片,以及封闭一个或多个切片。
本公开的其它方面涉及组织微阵列(tma),所述组织微阵列包括本公开的一种、两种或更多种固体抗原/载体蛋白凝胶。举例来说,本公开的tma可通过以下方式制备:制备本公开的固体抗原/载体蛋白凝胶(例如,如上文所描述包埋于石蜡块中),冲孔而成包含固体抗原/载体蛋白凝胶的核心,以及将核心转移至接受体tma。在一些实施方案中,核心的直径为约1mm。下文描述了用于制备tma的示例性方法,例如,通过将一个或多个核心从供体石蜡块转移至接受体tma块,然后加热(例如,在37c下过夜,然后在70c下10分钟),冷却并且将接受体tma块切片。在一些实施方案中,tma包括具有不同抗原的本公开的两种或更多种固体抗原/载体蛋白凝胶。在一些实施方案中,tma包括具有不同浓度的相同抗原的本公开的两种或更多种固体抗原/载体蛋白凝胶。在一些实施方案中,tma还包含一种或多种定向参考,例如,包含用于鉴别的着色颜料。在一些实施方案中,tma是组织学载片上的tma切片。不希望受理论束缚,认为本公开的固体抗原/载体蛋白凝胶特别有利地用于tma中,例如,用于提供一定范围的表位浓度和/或类型。这种范围也可邻近组织切片设置,从而为定量分析提供方便的参考。
iii.固体抗原/载体蛋白凝胶的用途
固体抗原/载体蛋白凝胶(例如,如上文章节ii中所描述和/或下文实施例中所例示)可用于多种应用,包括但不限于用于ihc或em分析的对照。
在一些实施方案中,用于抗原的对照免疫组织化学(ihc)染色的方法包括提供代表不同浓度的所关注抗原的本公开的多种固体抗原/载体蛋白凝胶(例如,两种或更多种、三种或更多种、四种或更多种、五种或更多种等)。举例来说,所述方法可包括提供由不同浓度的纯化抗原制成的两种固体抗原/载体蛋白凝胶。在一些实施方案中,所述方法包括使固体抗原/载体蛋白凝胶与特异性结合抗原并偶联至可检测部分的一级抗体接触。在其它实施方案中,所述方法包括使固体抗原/载体蛋白凝胶与特异性结合抗原的一级抗体接触,然后使固体抗原/载体蛋白凝胶与特异性结合一级抗原并偶联至可检测部分的二级抗体接触。在一些实施方案中,所述方法还包括从多种固体抗原/载体蛋白凝胶中的一者或多者中检测可检测部分的一个或多个信号。然后可检测从多种固体抗原/载体蛋白凝胶中检测到的信号量,并且任选地与多种固体抗原/载体蛋白凝胶中的每一者中所存在的抗原量或浓度进行比较,以提供在各种水平下抗原的对照ihc染色。
在一些实施方案中,抗原/载体蛋白凝胶中的一者不含抗原(例如,0nm),并且来自这种凝胶的ihc染色的可检测信号的缺失指示样品的阴性对照或背景ihc染色。在一些实施方案中,所述方法还包括使样品与特异性结合抗原并偶联至可检测部分的一级抗体接触,或与特异性结合抗原的一级抗体和特异性结合一级抗原并偶联至可检测部分的二级抗体接触,以及从样品中检测可检测部分的信号。然后可将从样品中检测到的信号量与从一种或多种固体抗原/载体蛋白凝胶中检测到的一个或多个信号的量进行比较,例如,以比较样品中所存在的抗原量与一种或多种固体抗原/载体蛋白凝胶中所存在的抗原的已知浓度或量。
在一些实施方案中,用于使用二级抗体的对照免疫组织化学(ihc)染色的方法包括提供代表不同抗体同型的本公开的多种固体抗原/载体蛋白凝胶(例如,两种或更多种、三种或更多种、四种或更多种、五种或更多种等)。举例来说,所述方法可包括提供由代表不同抗体同型的抗体制成的两种固体抗原/载体蛋白凝胶。在一些实施方案中,所述方法包括使固体抗原/载体蛋白凝胶与特异性结合抗体同型之一并缀合至可检测部分的二级抗体接触。对于二级抗体的对照染色,可从多种固体抗原/载体蛋白凝胶中检测信号。在这个实例中,二级抗体特异性结合同源抗体同型,并且从缺乏同源抗体同型的凝胶中检测到的任何信号均指示背景染色。因此,检测到与含有同源抗体同型的固体抗原/载体蛋白凝胶相关的信号以及与缺乏同源抗体同型的固体抗原/载体蛋白凝胶相关的信号缺失指示使用二级抗体的对照染色。
在一些实施方案中,用于抗原的免疫组织化学(ihc)染色的方法包括提供一种或多种含有抗原的固体抗原/载体蛋白凝胶和样品;使固体抗原/载体蛋白凝胶和样品与特异性结合抗原并偶联至可检测部分的一级抗体接触,或使固体抗原/载体蛋白凝胶和样品与特异性结合抗原的一级抗体接触并且使固体抗原/载体蛋白凝胶和样品与特异性结合一级抗体并偶联至可检测部分的二级抗体接触;从固体抗原/载体蛋白凝胶中检测可检测部分的信号;以及从样品中检测可检测部分的信号。因此,一种或多种固体抗原/载体蛋白凝胶可用作样品的ihc染色的阳性对照。
图1中示出了用于抗原的ihc染色的过程100的示例性流程图,所述抗原如样品中和本公开的固体抗原/载体蛋白凝胶中的抗原(用作样品的抗原染色的对照)。在框102处,收集组织以提供用于分析的样品,和/或产生本公开的固体抗原/载体蛋白凝胶(例如,如上文章节ii中所描述)。在一些实施方案中,固体抗原/载体蛋白凝胶含有所关注的抗原(例如,纯化抗原),所述抗原也可能存在或可能不存在于样品中。任选地,在框104处,固定样品和/或固体抗原/载体蛋白凝胶(例如,如上文章节ii中所描述)。在一些实施方案中,将固体抗原/载体蛋白凝胶与固定剂一起孵育。在其它实施方案中,用于制造固体凝胶的抗原/载体蛋白液体溶液包含固定剂。任选地,在框106处,包埋样品和/或固体抗原/载体蛋白凝胶(例如,如上文章节ii中所描述)。作为框104的任选替代方案,在框106处,可在包埋介质中冷冻样品和/或固体抗原/载体蛋白凝胶。任选地,在框108处,将样品和/或固体抗原/载体蛋白凝胶切片(例如,如上文章节ii中所描述)。任选地,在框110处,对样品和/或固体抗原/载体蛋白凝胶进行抗原修复和封闭(例如,如上文章节ii中所描述)。
在一些实施方案中,如框112处所示,使样品和固体抗原/载体蛋白凝胶与特异性结合抗原的一级抗体接触。在一些实施方案中,一级抗体包含可检测部分。在其它实施方案中,如框114处所示,使样品和固体抗原/载体蛋白凝胶与特异性结合一级抗体的二级抗体接触。在一些实施方案中,二级抗体包含缀合至二级抗体的可检测部分(在这个实例中是生物素)。
在一些实施方案中,从固体抗原/载体蛋白凝胶和/或样品中检测可检测部分的信号。如下文所描述,预期多种可检测部分。在这个实例中,使用显色检测方法。在框116处,使样品和固体抗原/载体蛋白凝胶与结合至二级抗体的酶复合物(例如,结合至生物素化二级抗体的与抗生物素蛋白链菌素缀合的酶复合物)接触。在框118处,使样品和固体抗原/载体蛋白凝胶与显色底物或色原体溶液接触,所述显色底物或色原体溶液在与酶复合物一起孵育后促使形成有色沉淀物,指示固体抗原/载体蛋白凝胶和样品(如果有抗原存在的话)中抗原的存在。
在一些实施方案中,本公开的固体抗原/载体蛋白凝胶中抗原的存在通过直接检测来检测,例如,通过将凝胶与特异性结合抗原并偶联至可检测部分的抗体或其它抗原结合部分一起孵育。在其它实施方案中,本公开的固体抗原/载体蛋白凝胶中抗原的存在通过间接检测来检测,例如,通过将凝胶与特异性结合抗原的一级抗体或其它抗原结合部分以及特异性结合一级抗体或其它抗原结合部分的二级抗体或其它抗原结合部分一起孵育,其中二级抗体或其它抗原结合部分偶联至可检测部分。
预期多种可检测部分与本公开的固体抗原/载体蛋白凝胶一起使用。在一些实施方案中,可检测部分包括酶,例如,辣根过氧化物酶(hrp)或碱性磷酸酶(ap)。然后通过将可检测部分暴露于酶的显色底物并且在与酶反应后检测来自显色底物的信号来检测信号(例如,如上文针对框116和118所描述)。显色底物的实例包括但不限于3,3'-二氨基联苯胺(dab),其由hrp转化为棕色产物;和3-氨基-9-乙基咔唑(aec),其由ap转化为红色产物。或者,过氧化物酶可化学上活化缀合至几种报告子之一(例如荧光分子)的酪酰胺部分;活化的酪酰胺缀合物然后可共价偶联至样品中的邻近分子,从而在过氧化物酶的位置处产生可检测信号。间接检测也可与显色染色一起使用。举例来说,可将生物素化二级抗体与抗生物素蛋白或抗生物素蛋白链菌素标记的酶复合物一起孵育,可将例如葡聚糖的聚合物与一种或多种二级抗体和一种或多种酶复合物偶联,或可使酶复合物直接聚合至二级抗体上。在一些实施方案中,可检测部分包括荧光团,例如荧光素(fitc)、若丹明(rhodamine)或它的衍生物、tritc、花青(cy3)、藻红蛋白(r-pe)和cftm等。举例来说,荧光团可缀合至一级或二级抗体,或缀合至在由过氧化物酶活化后可共价偶联至样品的酪酰胺部分。在一些实施方案中,可检测部分包括金属颗粒,例如金。举例来说,金颗粒可缀合至一级或二级抗体并且例如通过免疫em成像。在一些实施方案中,可检测部分包括放射性同位素,例如35s、125i或131i,并且通过例如放射免疫检测来成像。举例来说,放射性同位素可缀合至一级或二级抗体。在一些实施方案中,可检测部分包括核酸,例如dna或rna。举例来说,核酸可缀合至一级或二级抗体。可将一级或二级抗体偶联至用质谱仪或质谱流式细胞仪可检测的金属离子[依照cytof和mibi;参见giesen等natmethods.2014年4月;11(4):417-22以及angelo等,natmed.2014年4月;20(4):436-42]。可将一级或二级抗体偶联至通过荧光成像可检测的固态的基于半导体或碳的纳米颗粒(例如“量子点”)[参见wu等,natbiotechnol.2003年1月;21(1):41-6]。可将一级或二级抗体偶联至过氧化物酶,例如辣根过氧化物酶,然后通过与化学发光底物一起孵育来检测。可将一级或二级抗体偶联至电化学发光报告子(例如,钌;参见valenti等,jamchemsoc.2017年11月8日)。
iv.试剂盒和制品
本公开的某些方面涉及包含固体抗原/载体蛋白凝胶的试剂盒或制品。
在一些实施方案中,本公开的试剂盒包括包含纯化抗原的本公开的第一固体抗原/载体蛋白凝胶以及包含不同于第一固体抗原/载体蛋白凝胶的浓度的纯化抗原的本公开的第二固体抗原/载体蛋白凝胶。
在一些实施方案中,将第一固体抗原/载体蛋白凝胶和/或第二固体抗原/载体蛋白凝胶切片,例如,如上文章节ii中所描述。在一些实施方案中,使第一固体抗原/载体蛋白凝胶和/或第二固体抗原/载体蛋白凝胶附着至固体基底,例如,如上文章节ii中所描述。
在一些实施方案中,本公开的试剂盒还包括不含纯化抗原的本公开的第三固体抗原/载体蛋白凝胶(例如,用作阴性对照)。在一些实施方案中,将第三固体抗原/载体蛋白凝胶切片,例如,如上文章节ii中所描述。在一些实施方案中,使第三固体抗原/载体蛋白凝胶附着至固体基底,例如,如上文章节ii中所描述。
在一些实施方案中,试剂盒还可包括例如根据上文章节iii中所描述的方法中的任一者使用试剂盒的说明书。
实施例
通过参考以下实施例将更充分地理解本公开。然而,实施例不应当被视作限制本公开的范围。应了解,本文所描述的实施例和实施方案仅为了说明的目的,并且本领域技术人员将想到根据本公开的各种修改或变化,并且这些修改或变化均包括在本申请的精神和权限以及所附权利要求书的范围内。
实施例1:验证bsa凝胶作为ihc对照的平台方法
图1示出了用于组织样品中的ihc染色的例示性工作流程100。重要的是,ihc染色不仅展示了标靶的表达水平,而且展示了其亚细胞和组织分布。
以下实施例描述了一种用于产生可适用于大范围标靶的ihc对照的新平台方法。这种方法已使用人类bcl2验证,所述人类bcl2是可鉴定3+阳性对照组织的标靶(例如,人类慢性淋巴细胞性白血病肿瘤样品在这个测定中常常评定为3+),但这些组织难以获得,或出于道德考虑对于常规用作染色对照受限制。使用小鼠和大鼠igg以及所关注的人类蛋白质也展示了方法的通用性。
方法
在1.5ml微量离心管中,将含有约0至10-4m标靶表位的约0-0.5mg抗原与含0.5ml25%bsa的pbs混合。将0.5ml37%甲醛添加至管中。将管在85℃下加热10分钟,然后如果含有固定剂(例如,福尔马林)的话,那么在室温下放置过夜以固化。从管中移出所得凝胶,并且放入10%中性缓冲福尔马林(nbf)中。随后,使凝胶通过分级醇脱水成二甲苯,用温热的石蜡浸润,包埋于石蜡块中,在切片机上切片,并且使用一级小鼠单克隆抗bcl2抗体124和辣根过氧化物酶(hrp)/3,3'-二氨基联苯胺(dab)显色酶/底物系统根据标准ihc方法进行染色。
if检测测定是在ventanadiscoveryultra自动染色仪上开发的。切下含有标靶bsa/肽样品的四微米切片,脱石蜡并且用cc1细胞调节溶液预处理。将一级小鼠单克隆抗bcl2抗体124在37℃下孵育16分钟,并且用omnimap抗小鼠hrp检测系统检测8分钟,继而用ventanadiscoveryred610检测系统检测16分钟。
使用配备有20x0.75na物镜和荧光模块的hamamatsunanozoomer-xr数字幻灯片扫描仪,以0.46微米/像素的扫描分辨率采集全幻灯片明场和免疫荧光图像。进行明场成像并且用于聚焦。适用时,使用tritc滤光片以1x曝光(3.4ms光子收集)和1x增益采集免疫荧光信号。使用dapi(2x曝光、6.8ms光子收集、2x增益)和cfp滤光片(4x曝光、13.6ms光子收集、2x增益)捕获自发荧光。用于所有免疫荧光采集的照明功率均设置为50%。使用matlab版本9.3进行图像分析。手动标记(仅用于明场扫描)或在自发荧光通道上使用阈值过滤和形态过滤而产生所关注区域(roi)并且转移至tritc通道上用于强度测量。平均灰度强度以8位深度计算。通过将roi内所有像素的吸光度或发射率值相加(如由下面的相应自然对数公式计算)来计算出平均光学吸光度(明场dab标记)或发射率(荧光标记),并且归一化为总roi像素计数。所有零像素灰度强度值均使用值1近似。明场像素吸光度=log(255/像素灰度强度)。荧光像素发射率=log(像素灰度强度)。
对于验证实验,如上文所描述在微量离心管中产生bsa凝胶样品,包埋于石蜡块中,然后用于创建从石蜡块切下的600微米直径圆柱体的组织微阵列,并且使用标准组织微阵列技术重新包埋于阵列中。
对于bcl2实验,使用包含序列ac-ygsggaapapgifssqpggsgc-酰胺(seqidno:1)的肽。带下划线的氨基酸对应于uniprot寄存编号p10415中所列的人类bcl2序列的野生型(未突变)氨基酸41-54。肽还包括带有允许与醛(例如,甲醛)偶联的乙酰基-y(酪氨酸)的氨基端连接子序列(ac-ygsg)(seqidno:6),以及带有与多种交联试剂反应的c(半胱氨酸)-酰胺的羧基端连接子序列(gsgc-酰胺)(seqidno:7),所述交联试剂例如含马来酰亚胺、卤乙酰基或吡啶基二硫化物的化合物。
结果
bsa/肽凝胶如上文所述而制备。在产生凝胶之前将抗原(例如,肽)与bsa在液体溶液中混合可使肽均匀混合。可将所得凝胶(图2a)构造成任何所需形状(在这个实施例中,以1.5ml微量离心管的形状产生凝胶)。还可将凝胶切片(图2b和2c),并且进行典型的ihc处理步骤,例如抗原修复、封闭、一级/二级抗体孵育和检测(例如,使用酶/底物方法)。举例来说,图2d示出了准备用于脱水和石蜡处理的切片凝胶部分,并且图2e示出了包埋于石蜡供体块中的切片凝胶部分。图2f示出了由各种石蜡凝胶供体块产生的tma,以及含有黑色和绿色颜料用于定向参考的核心。肽抗原相比溶菌酶能够更有效地交联至bsa,从而在ihc处理和检测期间将抗原保留在bsa凝胶中。
为了检查肽/bsa凝胶作为ihc对照的可行性,将不同浓度的bcl2肽混合至bsa凝胶中,然后根据标准ihc技术进行切片和制备。使用针对人类bcl2蛋白质的bcl2一级抗体(来自ventanamedicalsystems的“confirm抗bcl-2(124)小鼠单克隆一级抗体”bcl2)、生物素化二级抗体、抗生物素蛋白缀合的hrp作为显色报告子和dab作为显色底物来检测bcl2。如图3a中所示,将bcl2水平从0连续增加至0.5mg/ml(2.5*10-4m)引起ihc染色强度的逐步增加。缺少肽的阴性对照不会引起染色,而bcl2肽在5x10-5mg/ml(对应于25nm肽浓度)至0.5mg/ml(对应于2.5*10-4m肽浓度)的整个测试范围内是可解析的。重要的是,在不同肽浓度下各自达到1+、2+和3+的bcl2染色水平。由于通常难以在容易获得的组织样品中发现一致和均匀的3+bcl2染色,因此这种替代性方法提供了一种比测定不同类型的组织更容易且更标准化的方式来获得bcl2表达对照的梯度。
为了检查染色的一致性,通过如上文所描述将bcl2肽/bsa凝胶染色并且使用matlab分析所得图像来进行六个独立实验。随肽浓度而变的光密度(od;图3b)和图像强度(图3c)的分析指示染色在实验之间是一致的。
还对bcl2肽/bsa凝胶进行定量免疫荧光染色。如同使用显色染色所获得的结果一样,if分析显示随肽浓度而变的染色强度的逐步增加(图3d)。光学发射率(图3h)和信号强度(图3j)的分析再次展示了染色的一致逐步增加。正如预期,使用天然对照一级抗体的阴性对照染色(图3f、3i和3k)或凝胶的自发荧光(图3e和3g)未显示强度的增加。
还检查了二级抗体对照。如图4a中所示,使用驴抗小鼠二级抗体,容易检测到包埋于bsa凝胶中的小鼠igg,而大鼠igg未产生可检测信号。类似地,使用驴抗大鼠二级抗体,容易检测到包埋于bsa凝胶中的大鼠igg,而小鼠igg未产生可检测信号(图4b)。这确认了bsa凝胶方法的特异性,从而证实二级抗体不会非特异性结合至缺乏抗体标靶的肽/bsa凝胶。
为了检查染色的特异性,合成在抗bcl2克隆体124抗体表位中具有临床相关的单氨基酸取代的六个肽,如上文所描述包埋于bsa中,并且进行染色。如图4c中所示(以及图3d、3h和3j中所见),这些突变显示出对ihc染色的明显影响(即,信号强度的不同程度的降低,这取决于特异性氨基酸取代),从而证实定量特异性氨基酸取代对染色强度的影响的实用性。
接下来,通过筛选几种未表征的抗体用于特异性检测所关注的标靶来检查肽/bsa凝胶平台的通用性。通过ihc筛选从经过人类ksr2免疫的小鼠中分离的二十七(27)个抗体克隆体用于检测阳性和阴性对照(图5a-5d)。对于阴性对照,使用未添加其它蛋白质或肽的bsa凝胶。对于阳性对照,使用已经用于使小鼠免疫的人类ksr2蛋白质产生bsa凝胶。正如预期,因为已经在结合未固定的人类标靶蛋白质的单独过程中选择候选抗体克隆体,所以大多数抗体克隆体能够检测蛋白质/bsa凝胶中的人类蛋白质(如dab信号高于背景一定强度所证明)。然而,最适合用于ihc测定中的抗体对于阴性对照应显示极少甚至没有可检测信号,而同时对于阳性对照则显示强染色。在所测试的抗体当中,克隆体5、6、7、11、12、15和23最有前景,因为这些克隆体产生靶抗原的特异性染色与阴性对照样品中的非特异性染色的最高比率。相比之下,克隆体4、13、26和27显示出靶抗原的无效染色,而抗体10和20显示出阴性对照样品的微弱但显著的非特异性染色。这些结果用于说明并非所有能够以未固定状态结合所关注标靶的抗体都适合用于ihc染色的问题。此处所描述的肽对照试剂和过程可帮助鉴定最适合用于ihc应用中的抗体。
总之,这些结果证实,抗原/bsa凝胶方法提供了用于产生适用于许多靶抗原的ihc对照的稳固平台。所述方法产生的对照代表了与一定范围的标靶浓度相关的ihc染色梯度,由此证实了标靶/bsa凝胶的定量潜力。与来自组织或细胞系的ihc对照不同,肽/bsa凝胶根据需要以一致、可再现、不昂贵、通用和抗原特异性方式在实验室中容易地产生。二级抗体对照展示了所述方法的特异性。此外,所述方法理想地适于鉴定适用于所关注标靶的ihc分析的抗体,在这个过程中通常筛选数百至数千种候选抗体以鉴定少量(例如,2-5种)首选抗体用于进一步表征。
实施例2:检查凝胶形成的条件
以下实施例描述了测试一系列条件对凝胶形成的影响。
方法
为了评价bsa凝胶形成,在25-85℃的温度范围内加热1mlbsa于pbs中的溶液。bsa/pbs溶液中不包括甲醛。连续加热溶液,并且在加热条件下于各个时间点观测液相/固相。在下列bsa浓度下测试溶液:25%、20%、15%、10%、5%和2%。
为了评价用于制造凝胶的其它蛋白质来源,在pbs中产生25%的以下溶液:酪蛋白、乳白蛋白、大豆粉和脱脂奶粉。将500μl37%甲醛与500μl相应25%蛋白质/pbs溶液混合,并且在85℃孵育10分钟。
为了评价固定剂,将500μl固定剂与500μl25%bsa于pbs中的溶液混合,并且在85℃下孵育10分钟。所测试的固定剂包括:10%中性缓冲福尔马林(nbf)、1/2强度卡诺夫斯基氏液(戊二醛/多聚甲醛)、甲氧基乙酰苯胺(methacarn)、卡诺氏液(carnoy'sfluid)和布安氏液(bouin's)。
为了评价甲醛浓度,将500μl甲醛溶液与500μl25%bsa于pbs中的溶液混合,并且在85℃下孵育10分钟。在下列浓度下测试甲醛溶液:(浓度是指在用bsa溶液稀释之前的原始浓度):1%、2%、4.5%、9%和18%。具体地,将37%甲醛储备溶液与蒸馏水混合以制成含有1%、2%、4.5%、9%或18%甲醛的500微升最终体积;然后将这些溶液与等体积(500微升)的25%bsa溶液混合(各自在单独的微量离心管中)并且如上文所描述进行加热。
结果
图6示出了加热温度和时间对25%bsa凝胶形成的影响。即使在加热过夜后,在25℃或45℃下加热也不会引起任何凝胶形成。在55℃下,仅在加热过夜后才观测到凝胶形成。然而,在65℃或85℃下加热后,分别在6分钟和2分钟内观测到固体凝胶形成。这些结果展示了加热温度和时间对bsa凝胶形成的影响。
接下来,测试了bsa浓度对凝胶形成的影响。在下列浓度下将bsa溶解于pbs中:25%、20%、15%、10%、5%和2%。如图7中所示(25%bsa的结果在图6中示出),在85℃下加热后对于所有浓度均观测到凝胶形成。对于5%和更高的bsa浓度,在10分钟内观测到凝胶形成,而2%bsa溶液在20分钟后形成凝胶。在45℃或55℃下加热后的任何时间都没有观测到凝胶形成。这些结果证实,大范围的bsa浓度在适合的加热条件下可产生bsa凝胶。
接下来,测试酪蛋白、乳白蛋白、大豆粉和脱脂奶粉形成凝胶的能力。如上文所描述,将它们各自与甲醛(最终浓度:18.5%)混合后以12.5%的最终浓度在pbs中测试。在这些条件下,仅观测到大豆粉形成凝胶,但所得固体不均匀。这些数据展示了血清白蛋白在促进凝胶形成中的独特特性。
接下来,测试各种固定剂形成bsa凝胶的能力,所述固定剂包括10%nbf、1/2强度卡诺夫斯基氏液(戊二醛/多聚甲醛)、甲氧基乙酰苯胺、卡诺氏液和布安氏液。在这些固定剂中,10%nbf和甲氧基乙酰苯胺无法形成固体。卡诺氏液在可混合之前就形成固体。1/2卡诺夫斯基氏固定剂和布安氏固定剂形成透明固体。
还测试了甲醛浓度对凝胶形成的影响。除1%外,所有浓度的甲醛都能够促进固体凝胶形成。这些结果显示了固定剂对凝胶形成的影响。
实施例3:评价用于凝胶形成的其它底物
以下实施例描述了评价额外蛋白质形成适用于ihc染色的凝胶的能力。
方法
评价bsa(以25%最终浓度使用)、蛋清蛋白或蛋清蛋白混合物(以25%最终浓度使用)、明胶(以10%最终浓度使用)、乳白蛋白(以25%最终浓度使用)、肝蛋白粉、大豆粉(以25%最终浓度使用)、酪蛋白(以10%最终浓度使用)和脱脂奶粉(以25%最终浓度使用)产生适用于ihc染色的固体凝胶的能力。将蛋白质溶液与37%甲醛混合,并且加热至85℃持续10分钟。
在存在或不存在0.1mg/ml正常兔igg(da1e)的情况下产生每种类型的凝胶。将切片用5μg/ml驴抗兔生物素化二级抗体染色,继而进行abc-hrp检测。
对于明胶凝胶,将10%熔融明胶与0.1mg/ml正常兔igg(da1e)混合,然后在4℃下冷却1小时,转移至10%nbf中过夜,转移至70%乙醇中2天,然后处理用于像组织一样进行ihc染色。对于乳白蛋白和肝蛋白粉凝胶,添加histogeltm以使凝胶固化。对于酪蛋白凝胶,逐滴添加100mmnaoh以使ph值达到8.0,视需要伴有搅动以形成溶液。
为使凝胶成像,在hamamatsunanozoomer上扫描载片,并且使用图像查看软件捕获数字图像。
结果
测试额外底物蛋白质形成适用于ihc染色的凝胶的能力,例如,通过形成允许ihc染色并粘附至玻璃ihc载片的均质凝胶。如图8中所示,除了bsa之外,蛋清蛋白或蛋清蛋白混合物和明胶形成凝胶,所述凝胶展现特异性ihc染色(在这种情况下,在用抗兔二级抗体将含有兔igg抗体样品的凝胶染色之后)与较低非特异性染色(如在用抗兔二级抗体将缺乏兔igg的凝胶染色之后所见)。相比之下,由乳白蛋白、肝蛋白粉或大豆粉产生的凝胶无法产生均质凝胶(图9)。由酪蛋白或脱脂奶粉产生的凝胶无法粘附至ihc载片(图10)。表a中提供了每种凝胶基底和由所尝试的凝胶形成而产生的材料的描述。
表a.由各种底物制成的蛋白凝胶。
s=固体凝胶
l=液体
总之,bsa、一种或多种蛋清蛋白和明胶提供了可用于特异性ihc染色的凝胶。在ihc处理期间,其它蛋白质底物无法形成均质凝胶或无法粘附至载片。
实施例4:凝胶中抗原的检测
使用与研究和临床使用相关的概念验证应用(包括ihc测定校准和质量控制)来进一步分析上文所描述的合成的ihc对照概念。
方法
肽和蛋白质
由newenglandpeptide(gardner,ma)以>95%的纯度合成肽。人类bcl2蛋白质(uniprotp10415)的氨基酸41-54在n端延伸四个氨基酸,包括乙酰化酪氨酸,以促进与甲醛和间隔子序列gsg的交联。c端包括gsg间隔子序列,继之以半胱氨酸-酰胺以促进与甲醛(metz,b.等(2004)j.biol.chem.279:6235-6243);toews,j.等,(2008)anal.chim.acta618:168-183)或巯基反应试剂的交联。完整的22个氨基酸的肽序列是ac-ygsggaapapgifssqpggsgc-酰胺(seqidno:1)。合成额外的肽,其含有来自人类myc蛋白质(uniprotp01106)的序列:ac-ygsgnrnydldydsvqpyfygsgc-酰胺(氨基酸9-24;seqidno:2);ac-ygsgdsvqpyfycdeeenfygsgc-酰胺(氨基酸17-32;seqidno;3);ac-ygsgqqqselqppapsediwgsgc-酰胺(氨基酸35-50;seqidno:4);ac-ygsgfellptpplspsrrsggsgc-酰胺(氨基酸53-68:seqidno:5)。合成含有来自人类mcl1(uniprotq07820)的第一外显子的13个氨基酸的阴性对照肽,其具有上文所描述的相同n端和c端序列延伸。对于一些实验,精氨酸、丝氨酸或酪氨酸置换上文所描述的肽中的n端和c端氨基酸。将冻干的肽溶解于最少体积的蒸馏水、dmso或二甲基甲酰胺中。ras2(ksr2;uniprotq6vab6)蛋白质的激酶抑制因子的c端301个氨基酸(氨基酸650至950)表达为701个氨基酸的n端[his]6标记的麦芽糖结合蛋白(氨基酸9-399)融合构建体。融合蛋白在粉纹夜蛾(trichoplusiani)tnipro昆虫细胞(expressionsystems;davis,ca)中表达为杆状病毒构建体,然后通过连续的镍-次氮基三乙酸亲和力、直链淀粉亲和力和琼脂糖s200尺寸排阻色谱法进行纯化。商业上获得纯化的小鼠igg1克隆体mopc-31c(bdpharmingen,sanjose,ca)、大鼠igg1克隆体r3-34(bdpharmingen,sanjose,ca)和兔igg克隆体da1e(cellsignallingtechnology,danvers,ma)。牛血清白蛋白(bsa;超纯)购自cellsignalingtechnology(danvers,ma)。食品级明胶和干蛋清分别来自knox(oakbrook,il)和judeesglutenfree(columbus,oh)。
蛋白质基质凝胶
除非另有注明,否则将0.5ml含有25%(w/v)bsa/磷酸盐缓冲盐水(pbs)中的所需抗原的溶液在1.5ml微量离心管中与等体积的37%甲醛(electronmicroscopysciences;hatfield,pa)混合,在85c下加热10分钟以使溶液凝结,然后在室温下固定过夜。最终试剂浓度为12.5%(1.8mm)bsa和18.5%(6.2m)甲醛。固定的凝胶中肽抗原的最终浓度为2.5x10-8m至2.5x10-4m。含有天然小鼠、大鼠和兔igg的凝胶的最终浓度为0.1mg/ml(6.7x10-7m)igg。人类[his]6-mbp-ksr2融合蛋白的最终凝胶浓度为0.5mg/ml(6.3x10-6m)。
在替代性固定方案的测试中,在上述方案中使用无福尔马林的锌固定剂(目录号552658,bdpharmingen;sanjose,ca)代替37%甲醛和nbf。在其它实验中,通过在不存在甲醛的情况下在85c下加热10分钟使pbs中25%bsa中的抗原固化。然后将固化的凝胶转移至10%中性缓冲福尔马林(nbf;vwrinternational,llc,radnor,pa)、4%多聚甲醛(pfa;vwrinternational,llc,radnor,pa)或锌固定剂中,用于在室温下过夜固定。
组织微阵列(tma)构建
使用tmagrandmaster组织微阵列点样器(3dhistech,budapest,hungary)构建组织微阵列(tma)。从含有所需蛋白凝胶的供体石蜡块冲孔而成1mm直径的重复核心,然后转移至接受体石蜡块。将完成的接受体tma块在37c下加热过夜,然后在70c下加热10分钟,随后冷却并切片。
ihc染色
所使用的一级抗体是小鼠抗人bcl2克隆体124(ventanamedicalsystems;tucson,az)、兔抗人bcl2克隆体epr17509(abcam;cambridge,ma)、兔抗人bcl2克隆体sp66(ventanamedicalsystems,tucson,az)、兔抗人bcl2克隆体e17(abcam,cambridge,ma)、兔抗人myc克隆体y69(ventanamedicalsystems,tucson,az)和兔抗人mcl1克隆体sp143(ventanamedicalsystems,tucson,az)。从fluidigm(southsanfrancisco,ca)购得fluidigmepr17509-146nd抗体。chempartner(shanghai,china)产生一组针对[his]6-mbp-人类融合蛋白的27种小鼠杂交瘤抗体。生物素化驴抗兔、大鼠和小鼠二级抗体购自jacksonlaboratories。表1中汇总了染色方案的细节。
表b.ihc方案。
rtu=即用型(抗体浓度未由供应商公开)。
将四微米石蜡切片脱石蜡并且在二甲苯和分级醇中再水合。在ventanabenchmarkxt、ventanadiscoveryxt、ventanabenchmarkultraxt仪器(ventanamedicalsystems,tucson,az)或dako通用自动染色机(agilent,santaclara,ca)上进行染色。取决于优化的抗体方案,用细胞调节溶液1(cc1)(ventanamedicalsystems,tucson,az)或ph6(即用型)标靶修复溶液(dako-agilenttechnologies,santaclara,ca)对切片进行预处理。将ventana仪器上染色的载片用ventana苏木精和上蓝试剂(ventanamedicalsystems,tucson,az)各自复染4分钟。将dako通用自动染色机上染色的载片在梅耶氏苏木精(mayer'shematoxylin)(rowleybiochemical,danvers,ma)和richard-allenscientific上蓝试剂(thermofisherscientific,waltham,ma)中各自复染1分钟。在盖片之前,将染色的切片在分级醇中脱水成二甲苯。将免疫荧光载片用prolonggold封固剂(lifetechnologies,carlsbad,ca)盖片。
fluidigm染色程序
将切片在70c下烘烤30分钟,脱石蜡,在递减的etoh系列中再水合,并且用ph6标靶修复溶液(dako-agilenttechnologies,santaclara,ca)预处理,在10%驴血清、含3%bsa的pbs中封闭30分钟,然后在封闭缓冲液中与146nd-epr17509一起孵育。将载片在无盖片的情况下于加湿的密闭容器中在4℃下孵育过夜,然后在pbs中冲洗3次,在20c载片下于2%戊二醛/pbs中后固定5分钟,在ddh20中冲洗,在递增的etoh系列中脱水,空气干燥并且在20c下保存直至成像。
成像质谱分析
在fluidigmhyperion成像质谱仪(southsanfrancisco,ca)中通过在每个tma核心中界定150微米见方的所关注消融区域(roi)来分析经过146nd标记的epr17509染色的tma核心。如下文所描述,使用抗体标准数据将每个roi的积分离子计数转换为抗体质量。
在含3%bsa的pbs中的10%驴血清中制备1、5和10微克/毫升146nd标记的epr17509的对照等分试样。将一微升的每种抗体样品点渍于玻璃载片上并且空气干燥,随后在hyperion机器中消融(紫外激光强度=3)。每个抗体斑点的积分离子计数用于校准来自染色的tma核心的roi中测量的离子计数。
数字图像采集与分析
使用配备有20x0.75na物镜的hamamatsu(bridgewater,nj)nanozoomer-xr数字幻灯片扫描仪,以0.46微米/像素的扫描分辨率采集全幻灯片明场图像。明场成像以半自动批处理模式进行。在自动高分辨率全幻灯片成像之前,为每个幻灯片手动创建扫描区域和焦点。使用nanozoomer-xr或3dhistechpannoramic250扫描仪(使用分辨率为0.33微米/像素的20x0.8na物镜)采集免疫荧光全幻灯片图像。在nanozoomer-xr系统上,将荧光模块的照明功率设置为50%,并且使用tritc(1x曝光、3.4ms光子收集、1x增益下的抗体信号)、dapi(2x曝光、6.8ms光子收集、2x增益下的自发荧光)和cfp滤光片(4x曝光、13.6ms光子收集、2x增益下的自发荧光)捕获免疫荧光信号。使用cy5(10ms曝光下的抗体信号)、fitc(2ms曝光下的抗体信号)、dapi(40ms曝光下的自发荧光)和cfp滤光片(200ms曝光下的自发荧光)在pannoramic250系统上进行采集。使用matlab版本9.3进行图像分析。手动创建并编辑明场图像上的所关注区域(roi),以排除凝胶中具有伪影或撕裂的区域。使用手动颜色阈值排除roi内的小孔或裂缝。当通过阈值过滤(在dapi或cfp通道上)和形态过滤从自发荧光图像可获得高于凝胶背景的足够信号时,手动创建或自动生成免疫荧光图像的roi。将roi转移至抗体-荧光染料通道中采集的图像上用于强度测量。对于明场和荧光图像均以8位深度计算平均灰度强度。平均明场像素强度的绘制的y轴值代表255减去平均像素灰度强度。在不改变原始强度或对比度的情况下呈现数字幻灯片扫描图像。使用imagej(版本1.52a;waynerasband,imagej.nih.gov/ij)中的analyze/plotprofile功能来评估跨越供体块截面绘制的线上的染色强度轮廓定量。
统计分析
使用prismgraphpad(版本7)进行制图。将针对玻璃载片背景校正的信号强度数据对比配制的抗原浓度的log10绘图。曲线拟合使用受限的可变斜率4参数模型,以使拟合曲线的底部等于每种测定的非抗原核心的平均强度,在与每幅图相关的表格中以“底部”报告。表格中所报告的其它参数[信号最大值、跨度、半最大信号处的抗原浓度(achm)和希尔斜率]由软件计算。
结果
如实施例1-3中所展示,当并入蛋白凝胶中时,可使用常规免疫组织化学和免疫荧光程序来检测编码抗体靶表位的合成肽。当通过显色测定评估时,含有标靶肽的供体块具有相对均匀的抗原分布(图11a-11d)。可构建组织微阵列(tma),所述组织微阵列含有处于一定范围的抗原浓度的所需抗原。图12a-12e示出了由不含添加肽、含有来自人类mcl1蛋白质的阴性对照肽的系列稀释液或编码bcl2蛋白质的氨基酸41-54的肽的稀释液的重复核心组成的tma。用以下四种抗bcl2抗体对这种tma的平行切片进行染色:克隆体124,针对标靶肽中使用的相同肽序列产生;sp66和e17,均针对试剂中序列的c端肽抗原产生(adam,p.等(2013)humanpathology44:1817-1826;www.abcam.com/bcl2-alpha-antibody-sp66-n-terminal-ab93884.html);以及epr17509,针对未公开的bcl2肽抗原产生(www.abcam.com/bcl2-antibody-epr17509-hrp-ab209039.html)。使用显色(所有抗体)和免疫荧光(仅对于克隆体124)方法对单独的载片进行染色。
正如预期,sp66和e17不与来自这种tma的切片中的任何核心发生可检测的反应(图13a和b)。对于克隆体124和epr17509,tma核心中的信号随着bcl2肽浓度的增加而增加(图12a-12c),这与核心中抗体和抗原之间的特异性相互作用一致。
数字图像定量允许对数据进行更精确的评价(图12d)。图12e中报告的拟合曲线和相关参数定量了最小和最大信号强度、动态范围、信号为半最大信号时的抗原浓度(achm),以及这个范围内抗原浓度对比信号强度曲线的陡度(希尔斜率)。在此处测试的条件下,不含添加肽的核心中的非特异性信号为克隆体124显色测定中最大可检测信号的2.7%,比荧光克隆体124测定中的最大可检测信号低1000倍,并且在epr17509测定中为23%。另一方面,对于epr17509,反映测定的相对灵敏度的achm值比显色克隆体124测定的achm约低8倍(即,更灵敏),并且比荧光克隆体124测定低50倍以上。免疫荧光克隆体124测定的斜率比任一种显色测定的斜率高50-75%,这反映了在检测阈值与最大信号之间的抗原浓度范围更窄。
为了在重复测定中评估肽对照的可再现性,使用新的供体石蜡块构建第二bcl2肽tma,所述新的供体石蜡块被配制为具有与用于构造图12a-12e中的tma相同的标靶bcl2肽浓度。由两名操作员在6个月时间间隔中的六个单独的天内使用图12a-12e中使用的相同的抗bcl2克隆体124显色ihc方案对这个第二tma的重复切片进行染色。染色切片的定量数字图像分析显示每个核心的信号强度是高度可再现的(图14a-14c;还参见图3b和3c)。
在平行实验中,使用克隆体124在存在或不存在先前抗原修复的情况下对含有bcl2肽的tma进行染色。结果显示,抗原修复使信号强度提高约6倍,但对于染色不是必需的(图15a-15c)。
实施例5:凝胶基质中肽交联的稳定性
不希望受理论束缚,认为通过以下三个参数将可用于结合抗体的肽的浓度从制定值降低:肽与蛋白质基质的交联效率、肽的生物化学完整性和交联肽对抗体的可及性。甲醛意图通过与肽序列中所包含的n端酪氨酸和c端半胱氨酸反应而使bsa侧链交联至标靶肽。在bcl2肽内部的氨基酸(a、f、g、i、p、q、s)中,已报道只有谷氨酰胺与甲醛反应(metz,b.等(2004)j.biol.chem.279:6235-6243)。
为了评估替代性n端和c端氨基酸对信号强度的影响,测试了bcl2肽的四种变体。n端酪氨酸被预期与福尔马林反应最小的丝氨酸置换;或被据报道比酪氨酸反应性高50%的精氨酸置换(metz,b.等(2004)j.biol.chem.279:6235-6243)。其它变体在n端和c端均包含酪氨酸或精氨酸。如上文所描述制备含有每种肽的系列稀释液的tma核心并进行染色。
结果显示具有n端精氨酸的肽的信号显著更高(“r-c”,图16a-16c)。这种变体的achm为4.43x10-7m肽,比原始y-c变体的对应值低6倍。其它变体显示类似于(s-c)或弱于(r-r、y-y)原始y-c变体的强度范围。值得注意的是,在n端含有精氨酸或酪氨酸并且在c端具有半胱氨酸的变体比在两端具有精氨酸或酪氨酸的肽反应更强烈。
实施例6:合成的ihc对照的通用性
接下来,进行实验以确定含有除bcl2以外的蛋白质的表位的肽是否将以类似的方式反应。据报道抗myc抗体y69结合人类myc蛋白质的n端100个氨基酸中的表位(www.abcam.com/c-myc-antibody-y69-ab32072.html)。如上文所描述将来自这个区域的候选表位并入bsa凝胶中并且测试y69结合。
含有myc氨基酸9-24的肽与抗体强烈反应,而其它肽仅弱反应(aa17-32)或根本不反应(aa35-50和aa53-68)(图17a)。构建了tma,所述tma含有mycaa9-24肽和bcl2肽的重复核心,处于先前所描述的浓度范围内。使用抗bcl2克隆体124和抗myc克隆体y69的显色检测显示信号强度范围,与非标靶肽没有交叉反应性(图17b和17c)。所得数据的定量(图17d)显示,myc方案的achm比bcl2方案低4倍,具有类似的动态范围和希尔斜率参数(图17e)。
使用抗bcl2和抗myc一级抗体两者与适当检测试剂的系列孵育(图18a-18c)在图17a-17e中使用的相同tma上完成双重免疫荧光检测。定性结果(图18a和18b)显示了预期的特异性并且在任一种抗体与非标靶肽之间没有交叉反应性。用于代替抗原特异性一级抗体的同型对照不产生信号。相对于显色方案,所得荧光数据的定量显示在所测试的条件下增加的希尔斜率参数和增加的重复可变性。
这些结果确认了使用多种表位和检测方案,肽抗原作为ihc对照的广泛适用性。
实施例7:检测限(lod)和可再现性
所获得的定量数据允许确定克隆体124bcl2ihc测定的检测限(lod)和可再现性。
图12a、14a-14c、15a和17b中所示的实验代表10个独立的分析,每个分析具有不含标靶肽(空白)和含有6种浓度的bcl2肽的重复tma核心。图19a和19b以及表c将数据汇总。对于每个实验,在计算中使用处于每种肽浓度的重复tma核心的平均值。值是针对玻璃载片的背景强度校正的tma核心的像素强度(19.2+/-0.5单位)。
表c.bcl2克隆体124ihc测定综合数据
根据公认的临床实验室惯例(armbruster和pry,2008),这些数据的空白限(lob;=平均值空白+1.645xsd空白)为8.0单位,并且检测限((lod;=lob+1.645xsd低阳性样品)为16单位,对应于2.3x10-7m肽。这种浓度等于每立方微米凝胶约140个分子的制定抗原密度。
与这些计算一致,具有渐增bcl2肽浓度的核心的数据的双尾t检验比较结果(表c)显示,具有2.5x10-8m肽(低于计算的lod)的核心与缺乏肽的核心无显著不同,而具有2.5x10-7m肽和更高(高于计算的lod)的核心是统计上不同的相邻核心。值得注意的是,尽管含有两种最高肽浓度的核心的主观强度相似,但这些核心中的信号在统计上是不同的。
实施例8:使用合成的ihc对照用于抗体验证
如上述实施例1中所描述(参见图5a-5d),将另一种蛋白质并入bsa凝胶中并且用于评价从杂交瘤克隆产生的抗体。在这种情况下,使用包含人类ksr2的c端301个氨基酸(即,氨基酸650-950)的肽。上文所描述的结果证实,合成的ihc对照方法提供了鉴定适用于所关注标靶的ihc分析的抗体的可用方法,在这个过程中通常筛选数百至数千种候选抗体以鉴定少量(例如,2-5种)首选抗体用于进一步表征。
在不存在先前抗原修复的情况下进一步测试候选抗体对抗原的反应性。对于每种抗体,需要抗原修复以用于可检测的反应性(图20a和20b)。这与实施例4中所描述的bcl2肽的结果成对比,对于所述bcl2肽,抗原修复使信号强度提高约6倍,但对于可检测的反应性不是必需的(图15a-15c)。
作为全长蛋白质的测试,制备并入bsa凝胶中的兔、大鼠和小鼠全长免疫球蛋白(igg;(0.1mg/ml;6.7x10-7m),并且用作检测步骤中采用生物素化驴抗兔、抗大鼠和抗小鼠二级抗体的ihc测定的技术对照。结果显示抗兔、抗小鼠和抗大鼠二级抗体的预期信号和特异性(图21a和21b)。如图21a和21b中所示,用驴抗兔igg二级抗体检测的所并入的兔igg显示136单位的像素强度。假设所添加的兔igg的定量保留,1立方微米(10-15l)的这种样品含有6.7x10-22摩尔或约400个可检测分子的兔igg。
实施例9:测试用于制造凝胶的替代性固定剂
由于含福尔马林的固定剂促使一些表位变为非反应性的,因此测试了可商购的无福尔马林的锌固定剂作为先前实验中使用的37%甲醛的替代物。
将bsa凝胶中含有bcl2和myc肽的供体块在加热至85c下用福尔马林或基于锌的固定剂固定(图22a-22c)。对于bcl2和myc肽,在加热期间甲醛固定的信号比锌固定强约10倍。信号强度的损失与锌存在下的加热相关联。
在不存在固定剂的情况下将bsa-抗原混合物加热至85c,继而在室温下固定于多种固定剂(4%多聚甲醛、中性缓冲福尔马林、含锌的无福尔马林固定剂)中的替代性程序产生与上文所描述的标准方案可比的信号(图23a和23b)。这证实所述技术可适应多种固定剂,从而潜在地扩大了可使用的表位和抗体的范围。
实施例10:成像质谱流式细胞分析
在上文所报道的实验中,对于每个结合的抗体分子所沉积的发色团或荧光染料分子的数目是未知的,因此无法计算出检测到的表位的绝对浓度。为了避免这种限制,测试了使用基于hyperion质谱法的成像仪进行的更定量的直接检测程序。
将bcl2肽tma的切片用146nd标记的抗bcl2抗体epr17509染色,然后通过紫外激光消融和定量质谱法进行分析。所定量的tma样品通常为150平方微米面积乘以4微米厚,含有9x104立方微米。结果显示随着标靶中bcl2肽浓度的增加而增加的分级信号(图24a-24c)。不含肽的核心中或含有阴性对照mcl1肽的核心中的epr17509抗体信号小于最大信号的3%。
通过分析直接点渍于玻璃载片上的146nd标记的抗体的已知量来确定所测量的离子计数与抗体浓度之间的相关性。所得校准数据(表d)显示每个所检测的146nd离子约340个抗体分子。
表d.抗体离子定量
通过将每个tma核心样品中配制的bcl2肽的量与所测量的146nd标记的抗bcl2抗体的量进行比较,确定了tma核心中可检测的bcl2肽的分数。结果(表e)显示,正如预期,可检测的bcl2肽的量随着肽浓度的增加而增加。
表e.由含bcl2肽的核心结合的抗体。
结果还显示,可检测的所添加的bcl2肽的比例随着抗原浓度的增加而降低;在2.5x10-7m下可检测到1.4%的添加肽,而在2.5x10-4m下可检测到约0.14%的添加肽。
结论
总之,实施例1-10的结果证实,可使用任何组织学实验室中可用的材料和方法创建含抗原的凝胶,并且可将其包埋和切片以产生均匀染色的样品。这些实施例证实,所述方法与多种固定剂相容,并且与使用显色、免疫荧光和基于质谱法的方法的检测相容。可能抗原的选择仅受标靶蛋白质的可用性或线性表位序列的知识所限制。创建已知组成的合成对照的能力提供了更精确地表征和控制常规使用的免疫组织化学方案的机会,而与异质组织样品和主观人类解译中固有的复杂因素无关。
这些结果提供了使用对每种蛋白质具有特异性的抗体从bcl2、myc和mcl1检测线性肽表位的概念验证,并且进一步展示了全长igg和301个氨基酸的人类蛋白质的检测。此处制定和测试的标靶表位浓度跨越四个数量级,从2.5x10-8m至2.5x10-4m,延伸至组织中所发现的蛋白质浓度范围的上限。在这个范围的上限处,平均分子间距离小于20nm,接近全长igg分子两臂之间的距离(约14nm)。只有非常丰富的蛋白质才达到这种密度。这种程序中使用的蛋白质浓度在许多组织中所发现的范围(7-25%)内(cole,j.(2017)scientificreports7:44707),并且因此再现了一些机械和生物化学组织特性。
这些结果进一步证实,与组织中的ihc测定性能相关的定量参数-非特异性背景、检测限、动态范围、半最大信号处的抗原浓度和希尔斜率-可在任何实验室中借助于数字幻灯片扫描仪和基本图像分析能力以客观可定义的精度进行评估。结果证实,这些参数可随着当使用一个抗原-抗体对时不同的实验条件、随着检测相同抗原的不同抗体以及随着不同抗体/抗原对而变化。举例来说,在图12a-12e中所示的三种测定中,所测量的achm值相差超过50倍。在用克隆体124bcl2测定进行的一系列10个重复实验中,最大信号、动态范围、log(achm)和希尔斜率的计算数据参数的变异系数小于10%,但更高的精度是可能的。这些实验使用了跨越生理范围(2.5x10-8至2.5x10-4m)的抗原的连续10倍稀释液,但通过包括介于测定动态范围的10%与90%之间的更多样品可潜在地改善achm和斜率定量的精度。由于与通过组织或细胞团块的主观人为评价可能达成的相比可更客观和精确地评估测定性能,因此可根据临床需要更精确地调整测定性能并且进行更严格的控制。
具有一定抗原浓度范围的合成对照允许使用可再现的标准品随时间对ihc染色方案进行优化、定量和控制。此处所描述的概念允许将ihc测定的质量控制在两个极端之间的中间水平,这两个极端是在受控的体外条件下评估纯化抗体与抗原之间的相互作用以及通过经验优化来评估组织样品中的抗体反应性。
预期将这种方法应用于正在进行的定量免疫组织化学分析。合成抗原凝胶样品是均质的,具有均匀的厚度,并且含有已知数量的表位分子,从而允许信号强度与抗原浓度相关联。包括可用范围的表位浓度的载片上tma切片可容易地与诊断组织切片相邻放置,从而允许在任何载片上评估检测技术充分性或定量图像分析。由于完全定义了这种方法中使用的组分和程序,因此原则上在不同实验室中创建的试剂在功能上应相似。这种方法可允许研究人员比较和校准不同实验室中使用的方案,以在描述定性染色终点时更清楚地交流,并且最终更精确地控制研究和患者护理决策中使用的ihc测定。
实施例11:用聚赖氨酸制成的合成抗原凝胶
上述实施例(参见例如实施例3)描述了测试底物蛋白质形成适用于ihc染色的凝胶的能力,例如,通过形成允许ihc染色并粘附至玻璃ihc载片的均质凝胶。这个实施例描述了测试聚赖氨酸的抗原/凝胶基质形成。
聚赖氨酸提供多个甲醛反应性侧链,并且以1-4kda至大于300kda的多种分子量商购可得。聚赖氨酸单体的化学式量为128da(假定没有盐抗衡离子),因此可商购的聚赖氨酸分子包括8-30个赖氨酸单体至大于2300个赖氨酸单体的范围内的聚合物。
如上文所证实,12.5%(最终浓度)的bsa在热变性以及与甲醛反应后会产生可用的基质,靶抗原可包埋于所述基质中并与之交联。假定化学式量为69,293da,那么12.5%bsa的浓度为1.8mm。每个bsa分子含有60个赖氨酸侧链。除了赖氨酸以外,每个bsa分子还含有26个精氨酸和21个酪氨酸侧链,每个侧链可与甲醛以一定效率反应。因此,在12.5%bsa凝胶中,存在60x1.8mm或108mm赖氨酸侧链。
基于类似计算的聚赖氨酸凝胶基质的样品因此在最终凝胶中含有约108mm赖氨酸侧链。假定聚赖氨酸聚合物中单一赖氨酸侧链的化学式量为128da,那么凝胶中聚赖氨酸的最终浓度约为14mg/ml。如果商业聚赖氨酸含有抗衡离子盐,那么使用更高的每体积重量。举例来说,聚赖氨酸*hbr盐的化学式量为209g/mol。通过将等体积的216mm聚赖氨酸溶液(约28mg/ml纯的,45mg/ml呈hbr盐形式)与浓缩的甲醛储备液(37%)混合来达成所需的聚赖氨酸最终浓度。不希望受理论束缚,认为样品中的赖氨酸侧链在聚赖氨酸链内和/或之间彼此交联以形成凝胶。
将处于上文所描述的一种或多种浓度的聚赖氨酸溶液与37%甲醛(和任选的所关注抗原)混合,并且加热至85℃持续10分钟,然后如上文所描述测试凝胶形成和抗原结合。测试了甲醛处理后不同聚合物长度的聚赖氨酸的凝胶形成。在一些实施方案中,聚赖氨酸包括l-对映异构体、r-对映异构体或l-对映异构体和r-对映异构体的混合物。将含有各种浓度的抗原的聚赖氨酸凝胶与阴性对照(例如不具有抗原的聚赖氨酸凝胶,或具有非特异性蛋白质或其它抗原的聚赖氨酸凝胶)和/或阳性对照(例如实施例1-10中所描述的凝胶(例如,含有相同抗原的12.5%bsa凝胶)进行比较。如实施例1-10中所描述,通过显色或免疫荧光结合测定来测定这些凝胶的抗原结合,例如,在所测定的ihc载片或tma上。
尽管出于清楚理解的目的已经通过说明和实施例相当详细地描述了前述公开内容,但这些描述和实施例不应当被解释为限制本公开的范围。本文引用的所有专利和科学文献的公开内容以全文引用的方式明确并入。
序列表
<110>基因泰克公司
k·霍泽尔
小富兰克林·v·皮尔
c·哈弗德
l·兰赫尔
d·y·邓拉普
<120>用于免疫组织化学的合成对照
<130>14639-20404.40
<140>尚未分配
<141>同时随同提交
<150>us62/730,422
<151>2018-09-12
<150>us62/595,434
<151>2017-12-06
<160>7
<170>fastseqforwindowsversion4.0
<210>1
<211>22
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>合成构建体
<400>1
tyrglyserglyglyalaalaproalaproglyilephesersergln
151015
proglyglyserglycys
20
<210>2
<211>24
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>合成构建体
<400>2
tyrglyserglyasnargasntyraspleuasptyraspservalgln
151015
protyrphetyrglyserglycys
20
<210>3
<211>24
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>合成构建体
<400>3
tyrglyserglyaspservalglnprotyrphetyrcysaspgluglu
151015
gluasnphetyrglyserglycys
20
<210>4
<211>24
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>合成构建体
<400>4
tyrglyserglyglnglnglnsergluleuglnproproalaproser
151015
gluaspiletrpglyserglycys
20
<210>5
<211>24
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>合成构建体
<400>5
tyrglyserglyphegluleuleuprothrproproleuserproser
151015
argargserglyglyserglycys
20
<210>6
<211>4
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>合成构建体
<400>6
tyrglysergly
1
<210>7
<211>4
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>合成构建体
<400>7
glyserglycys
1
- 还没有人留言评论。精彩留言会获得点赞!