一种同时定量检测多个肝癌标志物的抗体芯片试剂盒的制作方法
本发明属于生物医学技术领域。更具体地,涉及一种同时定量检测多个肝癌标志物的抗体芯片试剂盒。
背景技术:
肝癌是临床上最常见的恶性肿瘤之一,位居肿瘤相关死亡的第3位。目前,我国发病人数约占全球的55%;在肿瘤相关死亡中仅次于肺癌,位居第二。因此,肝癌严重威胁我国人民健康和生命。肝脏是人体最大的实质性器官,承担人体的各类重要代谢功能,因此,肝脏一旦出现恶性肿瘤将导致未及生命的严重后果。又由于肝脏具有丰富的血流供应,与人体的重要结构如下腔静脉、门静脉、胆道系统等关系密切;肝脏恶性肿瘤发病隐匿,侵袭性生长快速,其治疗甚为困难。因此,早期发现、早期诊断对肝癌的治疗及其重要。
目前,肝癌的早期诊断主要依靠血清肿瘤标志物检测,在肝癌患者的早期,血清中有数种分子水平已经发生了明显的变化,通过对血清中这些分子水平的定量检查可以作为肝癌预测的一个有效手段。目前肝癌的早期发现率低,主要与早期肝癌的症状不明显以及目前市场上缺乏有效的检测手段有关。目前临床上用于检测肝癌的方法包括影像学方法如pet-ct、病理活检来验证。pet-ct检查费用昂贵,而侵入性活检对患者来讲是极其痛苦的。因此,有必要开发能检测到早期肝癌的免疫检测试剂盒。
目前,常用的肿瘤标志物的检测方法主要包括:酶联免疫吸附法(elisa),放射免疫分析(radioimmunoassay,ria),免疫印绩法(westernblot),流式细胞仪(flow-cytometry)等。其中,酶联免疫吸附法是最普遍的方法,具灵敏度高、特异性较好、操作简便等优点。但一次试验只能检测单一指标,通量低、成本高,在多肿瘤标志物的检测中,该方法存在明显的不足;放射免疫分析(ria)虽然灵敏度高,是由于具有放射性污染,现在已很少采用;免疫印绩法能测定分子的大小,且无非特异的反应,但操作繁琐,灵敏度低,且只能检测单一指标;流式细胞仪能在细胞水平上检测肿瘤标志物的水平,但却存在低灵敏、低通量、高成本等缺点,且此方法中采用的设备结构复杂,不易推广。
技术实现要素:
本发明要解决的技术问题是克服现有肝癌早期检测诊断技术的缺陷和不足,提供一种高通量、高灵敏度、高特异性和低成本的多肿瘤标志物的联合检测试剂盒。采用抗体芯片技术,检测早期肝癌的6个标志物组合,克服了现有技术操作繁琐、检测指标单一、需有费仪器、灵敏度低等缺陷,具有廉价、便利、灵敏、准确、高通量、标本用量少、能在普通实验室推广和规模化等优点。
本发明的目的是提供一种用于肝癌早期检测的标志物组合。
本发明另一目的提供一种同时定量检测多个肝癌标志物的抗体芯片试剂盒。
本发明上述目的通过以下技术方案实现:
一种用于肝癌早期检测的标志物组合,包括如下6钟标志物:b2m(β2-微球蛋白)、igfbp3(胰岛素样生长因子结合蛋白3)、gp73(高尔基体73)、gdf-15(生长分化因子-15)、opn(骨桥蛋白)、afp(甲胎蛋白)。
一种用于肝癌早期检测的标志物特异性抗体组合,包括如下6钟标志物的特异性抗体:b2m、igfbp3、gp73、gdf-15、opn、afp。
所述标志物组合或所述标志物特异性抗体组合在制备肝癌诊断的抗体芯片试剂盒方面的应用,也在本发明的保护范围之内。
一种同时定量检测多个肝癌标志物的抗体芯片试剂盒,包括特异性抗体:选自针对如下肝癌标志物的抗体:b2m、igfbp3、gp73、gdf-15、opn、afp。
优选地,所述抗体芯片试剂盒还包括固相载体:用活性氨基包被的标准组织玻片;所述特异性抗体分别固定于所述固相载体上,形成若干个独立识别位点。
更优选地,所述抗体芯片试剂盒还包括如下组分:
反应剂和检测剂:包括抗体混合液,所述抗体混合液为所述若干种特异性抗体的混合溶液,抗体混合液中的特异性抗体上标记有生物素;
链霉亲和素:用于识别特异性抗体上的生物素标记;所述链霉亲和素标记有荧光染料,所述荧光染料为cy3或具有类似吸收波长的荧光染料;
肿瘤标志物标准品:为具有梯级浓度的所述若干种肿瘤标志物的混合物。
优选地,所述肿瘤标志物标准品包括:200000pg/mligfbp-3,10000pg/mlb2m,10000pg/mlgp73,2000pg/mlgdf-15,1000000pg/mlopn,10000pg/mlafp。
优选地,所述抗体芯片试剂盒还包括对照品:包括对照血清和确诊肝癌病人血清。
上述试剂盒中抗体芯片的组建方法为:在一张玻片表面用非接触性点样仪将多种抗原特异性抗体通过微阵列的方式点有2×8个相同的抗体微阵列,将点有2×8个抗体微阵列的标准组织玻片用可拆装的2×8孔框架结构把玻片分割成16个互不干扰的小区,每个小区含有一个抗体微阵列;玻片和框架之间通过两侧的边框夹紧扣形成抗体芯片。
本发明的肝癌早期诊断的标志物组合及基于此构建的同时定量检测多个肝癌标志物的抗体芯片试剂盒,非常适合于早期诊断肝癌,具有廉价、便利、灵敏、准确、高通量、标本用量少、能在普通实验室推广和规模化等优点,可用于肝癌的诊断,尤其是早期诊断,以及肝癌治疗和预后评价方面。
本发明具有以下有益效果:
本发明找到了一组能够组合用于肝癌早期诊断的标志物组合,为b2m、igfbp3、gp73、gdf-15、opn、afp这6种标志物,是从274种标志物中经过发明人的创新方法筛选出来的,检测系统相近能够实现同时检测,非常适合于早期诊断肝癌,这6种标志物的抗体组合是首次报道,其检测效果是高特异性和高灵敏度的。可用于肝癌的诊断、治疗或预后评价,提高了肝癌诊断的敏感性和特异性,提高肝癌患者的生存率。
本发明同时采用抗体联合检测芯片技术构建试剂盒,不仅填补了抗体芯片检测早期肝癌的空白,而且克服了现有技术操作繁琐、检测指标单一、需有费仪器、灵敏度低等缺陷,具有廉价、便利、灵敏、准确、高通量、标本用量少、能在普通实验室推广和规模化等优点。可用于人群普查,有利于建立基线资料。尤其是对于肝癌的早期检测诊断,及时治疗,将大大提高治愈率,减低医疗费用。在肝癌的诊断,尤其是早期诊断,以及肝癌治疗和预后评价方面,都具有很好的应用前景。
附图说明
图1为实施例1中肝癌标志物的筛选流程图;
图2为实施例1中训练组的17种因子的roc曲线图;
图3为实施例1中17种因子的交叉验证示意图;
图4为实施例1中训练组的6种因子的roc曲线图;
图5为实施例1中6种因子的交叉验证示意图;
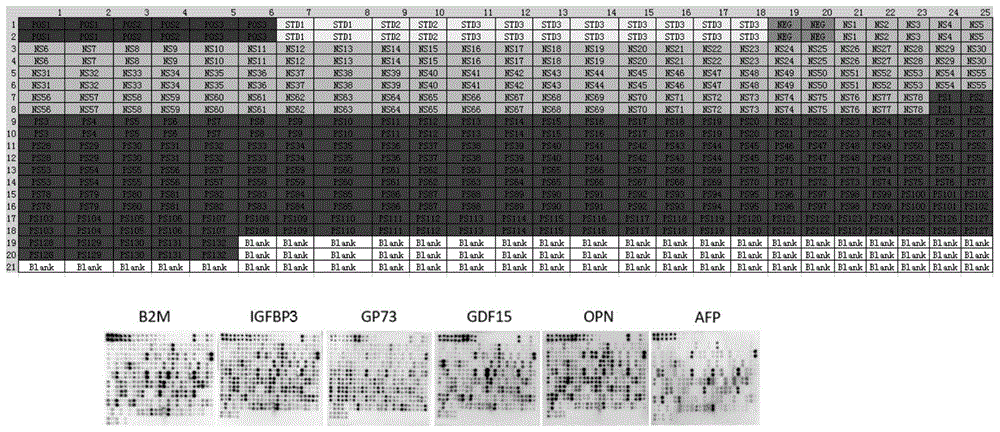
图6为实施例2中反向蛋白芯片分别检测β2微球蛋白、igfbp3蛋白、gp73蛋白、gdf15蛋白、opn蛋白和afp蛋白的结果扫描图;
图7为实施例2的肝癌样品和健康样品中的β2微球蛋白、igfbp3蛋白、gp73蛋白、gdf15蛋白、opn蛋白和afp蛋白含量对比图。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1用于检测早期肝癌的血清标记物的确定
本实施例的实验志愿者包括癌症患者、其他癌症患者和健康人群,肝癌标志物的筛选流程参照图1所示。基于elisa法,使来自实验志愿者提供的血清样品充分接触包被有针对274个血清标记物的抗体的抗体芯片,对抗体芯片测试结果进行人工神经网络分析。设置78个肝癌样本、40个其它癌症样本以及80个健康样本,对抗体芯片提供的数据进行归一化处理。采用相关标准品得出目标因子的标准品曲线,根据标准品曲线测定蛋白浓度。由此发现,有21种因子在肝癌样本中的含量明显有别于在其他癌症样本和健康样本中的含量。根据p值<0.01的要求,从中选择符合该要求的17种因子进行统计建模。这17个因子是afp,gdf15,ceacam1,mmp9,gp73,b2m,igfbp3,acrp30,ferritin,axl,lyve-1,fas,dkk-1,hgf,il8,fgf9,nidogen1。综合筛选出的17个因子,分别采用逻辑回归(lr)、线性判别分析(lda)、随机森林(rf)和支持向量机(svm)4组模型评价选中因子的灵敏度,特异度及准确率。
本实施例采用了留一交叉验证筛选方法(leave-one-outcross-validationapproach):每一回合把样本n分成训练组n-1和预测组1,就会得到n个模型,用n个模型最终的预测组的分类准确率的平均数作为此下分类样本的性能指标。此筛选方法的优点是每一回合中几乎所有的样本皆用于训练模型,因此最接近原始样本的分布,这样评估所得的结果比较可靠;实验过程中没有随机因素会影响实验数据,确保实验过程是可以被复制的。从训练组得出模型,再采用预测组进行验证。从图2可以看出根据上述4种模型采集关于训练组的17种因子的受试者工作特征曲线(roc曲线)下的面积接近1,准确率高。我们继续减少模型的因子数量来测试,从16种因子到2种因子,观察到β2微球蛋白、igfbp3蛋白、gp73蛋白、gdf15蛋白、opn蛋白和afp蛋白这6种因子的准确率与17种因子相当,6种因子的roc曲线(如图4所示)下的面积也接近1,17种因子和6种因子交叉验证的精确度和kappa值如图3、5所示。对比表1和表2提供的数据,表格中的灵敏度、特异度和精确度都很接近1,说明受试样本中17种因子和6种因子的检测结果能够正确地识别区分肝癌的患者与非患者,据此对实验者进行肝癌状态的诊断具有较高的可靠性。
表117种因子模型的性能评估
表26种因子模型的性能评估
实施例2采用反向蛋白芯片法验证6个抗体
反向蛋白芯片的操作步骤如下:
样品处理:对实验者提供的血清样品采用适当缓冲液及连续稀释处理。
标准品制备:将6个因子重组蛋白配制成浓度为100g/ml(原液),按照各个因子标准曲线的起始浓度按照不同1/3倍数稀释5次,设置空白对照。
膜片制备:将稀释的血清样品,标准品,阳性对照及空白对照点样到膜片。800cw-streptavidin作为阳对照,含有1%bsa的pbs缓冲液作为阴性对照。点样后,将膜片自然干燥并储存于-80℃。膜片检测:将玻片平衡至室温后,用封闭缓冲液孵育30分钟;加入生物素标记抗体溶液孵育2个小时;加入1×800cw-conjugatedstreptavidin(用blockingbuffer稀释8000倍),室温孵育2h;洗涤后由genepix4000b激光扫描仪在532nm下进行扫描。
采用imagequantlas4000化学发光成像分析系统扫描
1)扫描仪器:imagequantlas4000scanner
2)品牌:美国ge公司(gehealthcarecorporate)
3)产地:usa
4)扫描参数:highresolution
采用仪器自带分析软件提取数据,采用ibmspss分析软件来进行数据分析。
通过数据分析如图6,得知6个因子具有显著性差异(p<0.05)。
另外肝癌样品和健康样品中的β2微球蛋白、igfbp3蛋白、gp73蛋白、gdf15蛋白、opn蛋白和afp蛋白含量对比图如图7。
实施例3多个肝癌标志物的抗体芯片试剂盒
一种同时定量检测多个肝癌标志物的抗体芯片试剂盒,包括如下组分:
特异性抗体:选自针对如下肝癌标志物的抗体:b2m、igfbp3、gp73、gdf-15、opn、afp;
固相载体:用活性氨基包被的标准组织玻片;
所述特异性抗体分别固定于所述固相载体上,形成若干个独立识别位点。
反应剂和检测剂:包括抗体混合液,所述抗体混合液为所述若干种特异性抗体的混合溶液,抗体混合液中的特异性抗体上标记有生物素;
链霉亲和素:用于识别特异性抗体上的生物素标记;所述链霉亲和素标记有荧光染料,所述荧光染料为cy3或具有类似吸收波长的荧光染料;
肿瘤标志物标准品:为具有梯级浓度的所述若干种肿瘤标志物的混合物;
具体地,所述肿瘤标志物标准品如下:
还包括对照品:包括对照血清和确诊肝癌病人血清。
上述试剂盒的组建方法为:在一张玻片表面用非接触性点样仪将多种抗原特异性抗体通过微阵列的方式点有2×8个相同的抗体微阵列,将点有2×8个抗体微阵列的标准组织玻片用可拆装的2×8孔框架结构把玻片分割成16个互不干扰的小区,每个小区含有一个抗体微阵列;玻片和框架之间通过两侧的边框夹紧扣形成抗体芯片。
实施例4用本发明的试剂盒定量检测肿瘤标志物的实验
1、玻片芯片的完全干燥
将玻片芯片从盒子中取出来,在室温平衡20~30min后,将包装袋打开,揭开密封条,然后将芯片放在真空干燥器或者室温干燥1~2小时。
2、对肿瘤标志物标准品梯度进行梯度稀释
(1)添加500μl的样品稀释液到肿瘤标志物标准混合物的小管中,重新溶解标准品。打开小管前,先快速的离心,轻轻的上下抽打溶解粉末,标记这个小管为std1。
(2)分别标记6个干净的离心管为std2、std3到std7,添加200μl的样品稀释液到每个小管中。
(3)抽取100μl的std1加入到std2中轻轻混合,然后从std2中抽取100μl加入到std3中,如此梯度稀释至std7。
(4)抽取100μl的样品稀释液到另一个新的离心管中,标记为cntrl,作为阴性对照。
注:因为每种肿瘤标志物的起始浓度是不同的,所以std1到std7的梯度稀释后,每个肿瘤标志物的系列浓度是不同的。
3、芯片操作流程
(1)每个孔中加100μl的样品稀释液,室温摇床上孵育30分钟,封闭定量抗体芯片。
(2)抽去每个孔中的缓冲液,添加100μl的标准液和样品到孔中,在摇床上4℃过夜孵育。样本为静脉采血后自然析出的血清,使用前用样品用稀释液1:1稀释;
(3)清洗
抽去每个孔中的标准品或样品,1×洗液i清洗5次,每次5min室温摇床震荡,每孔150μl的1×洗液i,每次清洗要抽干净洗液,用去离子水稀释20×洗液i。
抽去每个孔中的1×洗液i,加入1×洗液ii清洗2次,每次5min室温摇床震荡,每孔150μl的1×洗液ii,每次清洗要抽干净洗液,用去离子水稀释20×洗液ii。
(4)检测抗体混合物的孵育
离心检测抗体混合物小管,然后加入1.4ml的样品稀释液,混合均匀后再次快速离心。添加80μl的检测抗体到每个孔中,室温摇床上孵育2小时。
(5)清洗
抽去每个孔中的检测抗体,1×洗液i清洗5次,每次5min室温摇床震荡,每孔150μl的1×洗液i,每次清洗要抽干净洗液,然后加入1×洗液ii清洗2次,每次5min室温摇床震荡,每孔150μl的1×洗液ii,每次清洗要抽干净洗液。
(6)cy3-链霉亲和素的孵育
离心cy3-链霉亲和素小管,然后加入1.4ml的样品稀释液,混合均匀后再次快速离心。添加80μl的cy3-链霉亲和素到每个孔中,用铝箔纸包住玻片避光孵育,室温摇床上孵育1个小时。
(7)清洗
抽去每个孔中的cy3-链霉亲和素,1×洗液i清洗5次,每次5min室温摇床震荡,每孔150μl的1×洗液i,每次清洗要抽干净洗液。
(8)荧光检测
1)将玻片框架拆掉,小心不要用手接触到玻片印制抗体的一面。
2)将玻片放置在玻片清洗管中,添加约30ml的1×洗液i,能整个覆盖住玻片,在室温摇床上震荡15min,弃去1×洗液i,添加约30ml的1×洗液ii,在室温摇床上震荡5min。
3)去除玻片的残留洗液。将玻片放置在玻片清洗管/干燥管中,不盖盖子,在1000rpm离心3min。
4)采用激光扫描仪例如axongenepix扫描信号,采用cy3或者绿色通道(激发频率=532nm)。
(9)芯片的数据提取以及用分析软件来进行数据分析。
1)用genepix软件来读取生物芯片的荧光值。芯片的微阵列参数用6(行)x8(列),点的直径用120um。
2)读数后选用的数值为除掉地方背景的中间值读数(f532median-localbackground)。
4、结果
为了检测癌症及对照样本中的蛋白质表达差异,使用ssps统计软件做校正后的t检验分析。为了进一步的分类研究,每个标志物的统计显著性阈值被设为p<0.05。正态分布用柯尔莫哥洛夫-斯米尔诺夫检验和夏皮罗-威尔克检验(ssps统计软件)分析。正态分布被定为p>0.05。抗体芯片上的高度相关的标志物被筛选用于层序聚类分析。回归分析被用于检验抗体芯片和其它方法(westernblot和elisa)所得的数据的相关性和显著性。表达水平高于背景加上2xsd的蛋白用于校正的t检验分析。为了分析样品是否符合正态分布,柯尔莫哥洛夫-斯米尔诺夫(kolmogorov-smirnova)检验和夏皮罗-威尔克(shapiro-wilk)检验均用于分析癌症组及对照组。根据结果显示,此试剂盒能在早期肝癌血清样本中检测出异常指标升高,且能与其它肿瘤区分开,具有较高的特异性。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!