全局肿瘤标志物表达水平的检测方法与流程
本发明涉及生物医学检测领域,具体而言,涉及一种全局肿瘤标志物表达水平的检测方法。
背景技术:
单核-巨噬细胞包括骨髓中的前单核细胞、外周血中的单核细胞、以及组织内的巨噬细胞。人类外周血细胞主要分为无核细胞(主要为血红细胞)和有核细胞(白细胞等)。单核细胞约占有核细胞总数的5%左右,由髓系造血祖细胞分化而来,是免疫系统中抗原递呈细胞(apc细胞)的重要组分。
在人体外周循环血液中,白细胞分布在两个地方,即循环池和储存池,循环池就是流动血液中的白细胞,储存池就是附着在血管壁,淋巴结,骨髓等处的白细胞,暂时不参与血液循环,但储存池中的白细胞与循环池中的白细胞保持动态平衡。白细胞在人体循环系统内成熟分化并实现免疫学功能可以大致分为以下步骤:毛细血管中的单核细胞→透过血管壁进入血管外组织→发现异源性物质(细菌、病原体、肿瘤细胞等)→分化为成熟的巨噬细胞→吞噬并消化→将抗原递呈到特定的细胞表面分子上→经由淋巴管回流到外周血→完成抗原递呈激活杀伤性免疫细胞。
作为机体抗击外来病原侵袭和清楚自身非正常细胞机制的哨兵,巨噬细胞是免疫系统形成免疫应答的重要环节,作用重大。在正常人体内每时每刻都有向着肿瘤化(永生化、非正常凋亡)发展的细胞产生,正常的机体免疫机制可以通过上述过程,将其及时清除。由此可见无论健康人群还是癌症患者体内巨噬细胞对于肿瘤化细胞的吞噬作用,都是无时无刻不在进行的,针对单核-巨噬细胞内肿瘤来源物质(包括蛋白质、核算、脂类等)的观测,可以为我们提供一个监控体内肿瘤发生、发展的崭新视角,其应用前景必然非常广泛。
单核-巨噬细胞作为有核细胞的重要组分,实验室一般是通过其表面抗原分子cd14和cd16进行检测的,目前可以买到成熟的抗体。主要的临床应用集中在血细胞组成检测和造血系统肿瘤(如:粒/单核细胞性白血病)方面的检测中,为临床诊断提供重要参考。但将其与实体肿瘤的监控相联系,就目前专利和文献检索来看,仍然缺少足够多的系统性的相关研究,且尚未形成成熟产品,在中国大陆地区也没有相关专利授权。
有鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供一种全局肿瘤标志物表达水平的检测方法以解决上述问题。
一种全局肿瘤标志物表达水平的检测方法,包括以下步骤:
用cd14和cd16的抗体标记出待检测对象外周血中的cd14+cd16+细胞,去除除白细胞之外的大部分杂质后用待检测的抗肿瘤标志物x的抗体标记该肿瘤标志物;
检测x+cd14+cd16+细胞与cd14+cd16+的细胞数量并统计前者与后者细胞数量的比值。
目前已经确定人类外周血中存在不同亚型的单核细胞。已知的主要根据cd14和cd16抗原的表达分为4个亚型:cd14++cd16-(g1亚型),cd14++cd16+(g2亚型),cd14+cd16-(g3亚型),cd14+cd16+(g4亚型)。cd14+cd16+是其中最主要的亚型之一,其比其他亚型的单核细胞具有更强的吞噬能力,因而从本发明的原理角度来讲,检测cd14+cd16+亚型的单核细胞更有意义。
肿瘤标志物(tm),是指特征性存在于恶性肿瘤细胞,或由恶性肿瘤细胞异常产生的物质,或是宿主对肿瘤的刺激反应而产生的物质,并能反映肿瘤发生、发展,监测肿瘤对治疗反应的一类物质。当cd14+cd16+细胞吞噬肿瘤细胞时,肿瘤标志物便会在cd14+cd16+细胞富集,而cd14+cd16+细胞是在人体内循环运动的,因而可通过检测cd14+cd16+细胞中肿瘤标志物含量来方便的表征人体内的肿瘤标志物水平。
人体每天大约产生一万个癌细胞,所以肿瘤标志物的检测结果不会是“零”,而是有个正常范围。体内有癌细胞,不意味着就会得癌症,因为人体正常的免疫功能可以及时将癌细胞吞噬。另外,并不是所有的肿瘤标志物升高都是有临床意义的,通常只有升高2倍以上才被医生认为有意义。所以说肿瘤标志物的升高不一定意味着机体长了肿瘤。
此外,除了肿瘤,机体的某些非肿瘤疾病也会造成肿瘤标志物的升高。例如,肝炎、肝硬化或者怀孕可导致甲胎蛋白(afp)的升高;前列腺炎和前列腺增生可引起前列腺特异性抗原(psa)的升高;肝功能异常会造成癌胚抗原(cea)等标志物升高;肾功能不良会引起细胞角蛋白片段19(cyfra21-1)和鳞状细胞癌抗原(scc)升高。
总而言之,本发明的目的在于提供一种检测肿瘤标志物的含量指标的方法,但是根据现有技术中的医学知识,无法推导出这种检测的直接目的是用于检测肿瘤,只能说肿瘤标志物的含量指标是检测肿瘤的一个中间参数,是肿瘤的控制检测中众多参数中的一个,与疾病的诊断或健康状况无直接必然联系。
本领域技术人员可知,根据本发明提供的方法的原理,还可使用不同的抗体用来检测寄生虫、细菌或真菌感染及其他可被单核-巨噬细胞吞噬的抗原的全身水平的检测。
优选的,如上所述的全局肿瘤标志物表达水平的检测方法,所述肿瘤标志物x为tktl1和/或dnase1l1。
tktl1(transketolase1)为转酮醇酶1,它、主要调节糖代谢途径中的非氧化途径,在多种肿瘤中高表达,其表达量与肿瘤的发展阶段,侵袭和转移,以及预后有密切关系。对肿瘤患者的营养搭配及后续的治疗等方面有着重要的提示作用。
dnase1l1(deoxyribonucleasei-linke1)在细胞凋亡过程中起重要作用,但在肿瘤细胞中,正常的凋亡机制失效,dnase1l1活性受到抑制,但其大量表达并在肿瘤细胞中积累。其表达量可作为鉴别肿瘤细胞或凋亡机制异常细胞的指标。
优选的,如上所述的全局肿瘤标志物表达水平的检测方法,所述去除除白细胞之外的大部分杂质的方法为:
用裂解液裂解所述外周血中的红细胞,并通过离心去上清的方法去除除白细胞之外的大部分杂质。
进一步优选的,所述裂解液含有8mm~12mmtris-hcl、8mm~12mmnah2po4和/或nahpo4、120mm~140mmnacl、体积百分数为0.7%~1.3%的tritonx-100、8mm~12mmna4p2o7·10h2o,ph=7.2~7.7;
进一步优选的,所述裂解的温度为0℃~4℃,时间为15min~25min。
进一步优选的,所述离心的条件为700g~900g,4min~6min。
红细胞由于没有细胞核,在较为温和的裂解条件下即可被裂解,在本发明优选的裂解条件下,白细胞不被裂解或极少被裂解。裂解后的红细胞随其它杂蛋白溶于上清中被一起离心除去。
优选的,如上所述的全局肿瘤标志物表达水平的检测方法,所述抗cd14和cd16的抗体为具有不同荧光颜色的荧光抗体;
当所述抗肿瘤标志物x的抗体为荧光抗体时,其荧光颜色与所述抗cd14和cd16的抗体的荧光颜色不同;
当所述所述抗肿瘤标志物x的抗体为非荧光抗体时,其对应的荧光二抗的荧光颜色与所述抗cd14和cd16的抗体的荧光颜色不同。
由于在分析结果时,需要分析x+cd14+cd16+细胞与cd14+cd16+的细胞数量的比值,所以三种蛋白的荧光颜色必然是不同的。
优选的,所述荧光二抗为f(ab')2抗体。本发明需要标记cd14+cd16+细胞胞浆内部的tktl1和/或dnase1l1抗原,由于f(ab')2抗体没有fc段,穿透细胞膜的能力更强,特异性更好,因而优选f(ab')2抗体用作荧光二抗。
优选的,如上所述的全局肿瘤标志物表达水平的检测方法,所述用抗cd14和cd16的抗体标记出所述外周血中的cd14+cd16+细胞的具体方法为:
向所述外周血中加入抗cd14和cd16的荧光抗体,避光孵育10min~20min后加入固定剂进行固定;
优选的,所述固定剂为甲醛和甲醇的混合溶液;且以体积百分数计,加入固定剂后反应体系中所述甲醛的终浓度为0.4%~0.6%,所述甲醛的终浓度为0.15%~0.19%。
优选的,如上所述的全局肿瘤标志物表达水平的检测方法,所述用抗肿瘤标志物x的抗体标记肿瘤标志物x的具体方法为:
将抗体标记肿瘤标志物x的抗体与封闭打孔试剂一起加入去除除白细胞之外的大部分杂质后的反应体系中;
所述封闭打孔试剂为0.008g/ml~0.012g/ml的bsa和体积百分数为0.7%~1.3%的tritonx-100溶液;所述封闭打孔试剂的添加量为每100μl外周血样本添加40μl~60μl封闭打孔试剂。
优选的,如上所述的全局肿瘤标志物表达水平的检测方法,在步骤3)中,所述检测x+cd14+cd16+细胞与cd14+cd16+的细胞数量的方法为流式细胞仪检测法或荧光细胞计数仪检测法。
流式细胞术(flowcytometry,fcm)是一种在功能水平上对单细胞或其他生物粒子进行定量分析和分选的检测手段,它可以高速分析上万个细胞,并能同时从一个细胞中测得多个参数。通过使用流式细胞术对cd14+cd16+及x+cd14+cd16+阳性细胞的数量进行检测,可以快速、精度地评价全局肿瘤标志物表达水平。
荧光细胞计数仪检测法可以快速、精确地识别并计数细胞群之中的细胞。在插入玻片之后,荧光细胞计数仪即可自动对细胞进行对焦并计数。
与现有技术相比,本发明的有益效果为:
1)、本发明提供的全局肿瘤标志物表达水平的检测方法利用单核-巨噬细胞的特性,可方便快速的实现全身范围的肿瘤标志物表达水平监控。
2)、通过对红细胞裂解液及裂解时间、离心力大小、封闭打孔时间参数的确定,建立了稳定规范的技术流程。
3)、利用流式细胞仪检测法或荧光细胞计数仪检测法对结果进行计算统计,操作快速、精确。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
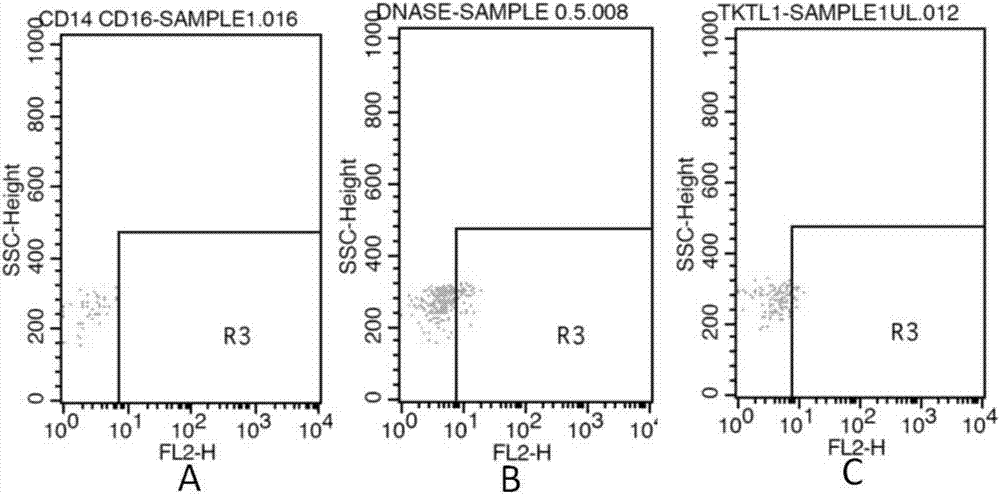
图1为流式细胞术的部分结果图;图1a为总体单核细胞,图1br2框出的范围为cd14+cd16+细胞;
图2为实施例1的部分检测结果图;图2a为对照组,图2b为dnase1l1,图2c为tktl1;
图3为实施例2的部分检测结果图;图3a为对照组,图3b为dnase1l1,图3c为tktl1。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
1、取外周血血液样本2,吸取200ul,加入抗体anti-cd14-fitc(bd公司,货号555397)40ul,anti-cd16-apc(bd公司,货号561304)10ul,室温避光孵育15min;
2、加入200ul固定剂室温避光孵育8min;所述固定剂的成分为:体积百分数为0.8%的甲醛,体积百分数为的0.30%甲醇;
3、加裂解液3ml到样品中,涡旋震荡混匀,避光孵育15min,裂解红细胞;所述裂解液含有8mmtris-hcl、8mmnah2po4和/或nahpo4、140mmnacl、体积百分数为1.3%的tritonx-100、8mmna4p2o7·10h2o,ph=7.2;
4、700g离心6min,去除上清;缓慢倒掉上清,用纸吸取残留液体,涡旋震荡重悬细胞;
5、加入80ul封闭打孔试剂,指弹混匀;
所述封闭打孔试剂为0.012g/ml的bsa和体积百分数为1.3%的tritonx-100溶液;
6、将上述溶液体系平分为两份,分别加入anti-tktl1(rabbitpolyclonal,sigma,货号hpa000505)和anti-dnase1l1抗体(rabbitpolyclonal,sigma,货号hpa072635),指弹混匀,避光孵育20min;抗体的添加比例均为1:1000;
7、分别加入2mlpbs(8g/lnacl、0.2g/lkcl、1.4g/lna2hpo4、0.27g/lkh2po4)洗,涡旋混匀,800g离心5min,去上清,洗2~3次,洗完后重悬细胞;
8、分别加入2ulanti-rabbit-peantibody(donkeypolyclonal,abcam公司,货号ab7007),避光孵育10min;
9、分别加入2mlpbs洗,涡旋混匀,800g离心5min,去上清,洗2~3次,洗完后重悬细胞;
10、分别用500ulpbs重悬细胞,流式细胞仪检测。
实施例2
1、取外周血血液样本2,吸取200ul,加入抗体anti-cd14-fitc(bd公司,货号555397)40ul,anti-cd16-apc(bd公司,货号561304)10ul,室温避光孵育15min;
2、加入200ul固定剂室温避光孵育6min;所述固定剂的成分为:体积百分数为1.2%的甲醛,体积百分数为的0.38%甲醇;
3、加裂解液3ml到样品中,涡旋震荡混匀,避光孵育15min,裂解红细胞;所述裂解液含有12mmtris-hcl、12mmnah2po4和/或nahpo4、120mmnacl、体积百分数为0.7%的tritonx-100、12mmna4p2o7·10h2o,ph=7.7;
4、900g离心4min,去除上清;缓慢倒掉上清,用纸吸取残留液体,涡旋震荡重悬细胞;
5、加入120ul封闭打孔试剂,指弹混匀;
所述封闭打孔试剂为0.008g/ml的bsa和体积百分数为0.7%的tritonx-100溶液;
6、将上述溶液体系平分为两份,分别加入anti-tktl1(rabbitpolyclonal,sigma,货号hpa000505)和anti-dnase1l1抗体(rabbitpolyclonal,sigma,货号hpa072635),指弹混匀,避光孵育15min;抗体的添加比例均为1:1000;
7、分别加入2mlpbs(8g/lnacl、0.2g/lkcl、1.4g/lna2hpo4、0.27g/lkh2po4)洗,涡旋混匀,800g离心5min,去上清,洗2~3次,洗完后重悬细胞;
8、分别加入2ulanti-rabbit-peantibody(donkeypolyclonal,abcam公司,货号ab7007),避光孵育10min;
9、分别加入2mlpbs洗,涡旋混匀,800g离心5min,去上清,洗2~3次,洗完后重悬细胞;
10、分别用500ulpbs重悬细胞,流式细胞仪检测。
对实施例1~2的结果进行检测。统计时,先从所有的单核细胞(图1a)中框出cd14+cd16+的细胞(图1b,r2框出的范围);再从r2框中框出cd14+cd16+dnase1l1+或cd14+cd16+tktl1+的细胞(图2和图3);其中,对照组(图2a和图3a)的做法为,将anti-tktl1或anti-dnase1l1抗体替换为同种属来源的igg抗体;其余步骤与实验组一致。
表1实施例1和实施例2检测结果(gci值)
其中,表格中检测值分别为:
对照组:(cd14+cd16+igg+÷cd14+cd16+)×1000;
dnase1l1组:(cd14+cd16+dnase1l1+÷cd14+cd16+)×1000;
tktl1组:(cd14+cd16+tktl1+÷cd14+cd16+)×1000;
最终值即gci(globlecancerationindex,全局癌变指数)值,其算法为各组的检测值减去对照组的检测值。
正常和疾病的分界线值是通过大量的临床数据确定的,前期的数据是
tktl1:小于119正常,大于119分有肿瘤风险;
dnase1l1:0-100正常,100-130建议全面检测,130以上有肿瘤风险;
最终结果综合tktl1与dnase1l1两组的综合gci值进行考量。
实施例3
1、取待测对象外周血血液样本200ul,加入抗体anti-cd14-fitc(bd公司,货号555397)40ul,anti-cd16-apc(bd公司,货号561304)10ul,室温避光孵育15min;
2、加入200ul固定剂室温避光孵育5min;所述固定剂的成分为:体积百分数为1%的甲醛,体积百分数为的0.35%甲醇;
3、加裂解液3ml到样品中,涡旋震荡混匀,避光孵育15min,裂解红细胞;所述裂解液含有10mmtris-hcl、10mmnah2po4和/或nahpo4、130mmnacl、体积百分数为1%的tritonx-100、10mmna4p2o7·10h2o,ph=7.5;
4、800g离心5min,去除上清;缓慢倒掉上清,用纸吸取残留液体,涡旋震荡重悬细胞;
5、加入100ul封闭打孔试剂,指弹混匀;
所述封闭打孔试剂为0.01g/ml的bsa和体积百分数为1%的tritonx-100溶液;
6、将上述溶液体系平分为两份,加入荧光标记的anti-tktl1(抗体购自rabbitpolyclonal,sigma,货号hpa000505,自己加荧光标记)和荧光标记的anti-dnase1l1抗体(抗体购自rabbitpolyclonal,sigma,货号hpa072635,自己加荧光标记),指弹混匀,避光孵育15~20min;抗体的添加比例均为1:1000;注意荧光标记的anti-tktl1和荧光标记的anti-dnase1l1抗体的应该颜色与anti-cd14-fitc和anti-cd16-apc(bd公司,货号561304)的荧光颜色不同。
7、加入2mlpbs(8g/lnacl、0.2g/lkcl、1.4g/lna2hpo4、0.27g/lkh2po4)洗,涡旋混匀,800g离心5min,去上清,洗2~3次,洗完后重悬细胞;
8、用500ulpbs重悬细胞,取30ul样品滴在载玻片上,用另一张双凹片进行涂片,荧光细胞计数仪检测。
实施例3的统计原理与实施例1和2一样,对照组为将荧光标记的anti-tktl1或荧光标记的anti-dnase1l1抗体替换为同种属来源的荧光标记的igg抗体。
表2实施例3检测结果(gci值)
实验例
取外周血血液样本4平分为四组,每组3份,用实施例1~3及对比例中记载的方法进行检测,每组重复三次;其中对比例的设置方式为:在实施例3的基础上去除加裂解液裂解红细胞并离心去除杂质的步骤,其余操作同实施例3(即用全血进行检测)。
表3检测结果(gci值)
从上表可知,实施例1~3中记载的方法检测稳定性较好,且重复性好,而对比例三次检测的浮动较大,且最终值远低于实施例,推测可能的原因是由于没有去除杂质,抗体非特异性结合较多,导致cd14+cd16+值上升,而肿瘤标志物的抗体配合f(ab')2抗体特异性更好一些,所以cd14+cd16+x+变化不大,进而使得gci值整体下降,造成假阴性。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 普适型用于同时检测多种肿瘤标志物的微流控芯片装置的制造方法
- 男性适用的典型肿瘤标志物联合检测用微流控芯片装置的制造方法
- 女性适用的典型肿瘤标志物联合检测用微流控芯片装置的制造方法
- 一种检测口腔癌的标志物及其试剂盒的制造方法与工艺
- microRNA 标志物组及其在制备检测胃癌淋巴结转移试剂盒中的应用的制造方法与工艺
- 基于弹性蛋白酶荧光底物检测乳腺癌肿瘤标志物CA153的酶联免疫试剂盒制备方法与制造工艺
- 检测和评价力量训练效果的miRNA标志物或其组合及其应用的制造方法与工艺
- 一种最优超平面的构建方法、动态优化系统和构建装置与制造工艺
- 癌症标志物及癌症的判定方法与制造工艺
- 检测尿液中单羟酚类代谢物的试剂盒及其制备方法与制造工艺