一种双通道输出检测食源性致病菌的适体传感器的制备方法及其应用与流程
本发明涉及一种适体传感器,尤其是涉及一种双通道输出检测食源性致病菌的适体传感器的制备方法及其应用。
背景技术:
食源性致病菌是指可以引起食物中毒或以食品为传播媒介的致病性细菌。食品在采集、加工、运输等环节中很容易受到食源性致病菌的污染,因之而起的食物中毒和疾病爆发事件频频发生,我国每年因食源性致病菌造成的经济损失高达170亿美元。常见的食源性致病菌有:副溶血性弧菌、创伤弧菌、金黄色葡萄球菌、大肠杆菌、沙门氏菌等。
现有的用于检测食源性致病菌的各种方法,如:酶联免疫、dna探针和环介导等温扩增法等,这些方法大多因为步骤繁琐存在耗时长的问题。为了有效地缩短分析时间,提高检测效率,聚合酶链式反应(pcr)得到发展,通过检测食源性致病菌的特定基因来达到分析目的。但是在实际应用中,pcr方法对设备和操作要求较高,很大程度上限制了它的进一步发展。电化学发光(ecl)和差分脉冲伏安法(dpv)具有简单、快速、高灵敏度、易于使用、高可控性和低背景信号等显著特征,已广泛应用于生物分析。然而采用单一方法的检测结果容易出现假阳性或假阴性,造成不必要的麻烦。因此,开发一种基于ecl和dpv两种方法同时检测一种目标物的免疫传感器至关重要。
目前,大多数的免疫传感器都是基于抗体-抗原的免疫反应,然而,这些免疫检测严重依赖于所用抗体的质量,通过动物免疫制备抗体是耗时的(几个月),并且抗体可能变得易受稳定性或修饰问题的影响。为了解决抗体的这些缺陷,具有高效率和选择性的适体开始出现。适体是短的单链dna或rna分子,通过体外选择或通过指数富集(selex)系统进化配体来选择。适体比抗体具有许多竞争优势,适体可以通过化学合成常规生产,具有纯度高、成本低的优点。适体可以用各种化学标签进行灵活修饰,这些标签不会影响它的效果。此外,适体的分子量小,稳定性优异,并且可以承受重复的变性和复性。总之,这些独特的特性使适体成为生物传感器的理想识别元件。目前,国内外还没有公开任何关于法拉第笼式ecl和dpv双通道输出检测食源性致病菌适体传感器的制备方法及其应用。
技术实现要素:
本发明所要解决的技术问题是提供一种高灵敏度、高精确性以及操作简单快速的双通道输出检测食源性致病菌的适体传感器的制备方法及其应用。
本发明解决上述技术问题所采用的技术方案为:一种双通道输出检测食源性致病菌的适体传感器的制备方法,包括以下步骤:
(1)发光功能化ru-mof的合成
将18mg的[ru(dcbpy)3]2+溶解在10ml的正丙醇(npa)和去离子水的混合溶液中;然后,将54mg的zn(no3)2溶解在以上制备的溶液中并超声处理1小时后,在室温下反应24小时,于8000rpm,4℃温度下离心5min获得所得的复合物,并用去离子水洗涤三次得到发光功能化ru-mof纳米颗粒产物,最后将产物分散在去离子水中;其中正丙醇和去离子水混合溶液中正丙醇和去离子水体积比为3:1;
(2)信号单元ru-mof@pb2+-apt2的合成
将1.5ml2.0mg/mlru-mof纳米颗粒分散在3ml10mmpb(no3)2溶液中,并在室温下反应24小时,于12000rpm离心5分钟后,将得到的沉淀用去离子水洗涤三次得到ru-mof@pb2+复合物,然后取200μl100μg/mlru-mof@pb2+复合物和400μledc/nhs复合物于玻璃瓶中,混合均匀后,采用1.0mol/lhcl溶液调溶液ph为5,震荡孵育1h,于8000r离心15min,去离子水洗涤3次,去除偶联试剂;向玻璃瓶内加入50μl10µmol/l的第二适体apt2,混合均匀后采用1.0mol/lnaoh溶液调溶液ph为9,震荡孵育4小时,于8000rpm离心15min,去离子水洗三次,洗涤至中性,取出上清液,将沉淀分散在50μldna杂交缓冲溶液中即得到信号单元ru-mof@pb2+-apt2溶液;
(3)双通道适配体传感器的制备
a.将直径为3mm的金电极依次用1.0、0.3和0.05μm的al2o3抛光粉在麂皮上抛光至镜面,用水冲洗干净,再依次在乙醇、水中超声洗涤,清洗后的电极放入由浓h2so4和h2o2按体积比7:3混合成的混合溶液中浸泡5~10min,取出洗净,然后在0.5mol/l硫酸溶液中用循环伏安扫描处理,扫描速度为50mv/s,电压范围为0~1.6v,持续扫描得到稳定的循环伏安图后,取出用水洗净待用;
b.在上述处理好的金电极上滴入10μl第一适体apt1,于37℃条件下孵育16h,随后加入10μl2mm6-巯基-1-己醇,以封闭金电极表面非特异性活性位点,37℃条件下继续孵育1h,用去离子水洗涤,洗掉未结合的6-巯基-1-己醇;接着将10μl食源性致病菌目标物溶液滴涂在上述修饰有apt1的金电极上,37℃条件下扣帽孵育1h,使apt1和食源性致病菌充分反应,随后用去离子水充分洗涤除去多余的食源性致病菌;向反应区域滴加10µl上述步骤(2)制备的信号单元ru-mof@pb2+-apt2溶液,在37℃条件下静置60min,利用食源性致病菌和apt2的特异性结合,将ru-mof@pb2+引入到整个传感器中分别作为电化学发光和电化学的信号物,反应完成后用去离子水洗涤2~3次,除去未被食源性致病菌捕获的信号单元ru-mof@pb2+-apt2,即制备得到双通道输出检测食源性致病菌的适体传感器。
所述的食源性致病菌包括副溶血弧菌、沙门氏菌和金黄色葡萄球菌。
所述的副溶血弧菌的第一适体apt1的序列为:5′-sh-tctaaaaatgggcaaagaaacagtgactcgttgagatact-3′,第二适体apt2的序列为5′-nh2-tctaaaaatgggcaaagaaacagtgactcgttgagatact-3′。
所述的沙门氏菌第一适体apt1的序列为:5′-sh-tatggcggcgtcacccgacggggacttgacattatgacag-3′,第二适体apt2的序列为5′-nh2-sh-tatggcggcgtcacccgacggggacttgacattatgacag-3′。
所述的金黄色葡萄球菌第一适体apt1的序列为:5'-sh-tcggcacgttctcagtagcgctcgctggtcatcccacagctacgtc-3',第二适体apt2的序列为:5'-nh2-tcggcacgttctcagtagcgctcgctggtcatcccacagctacgtc-3。
步骤(2)中所述的edc/nhs复合物中edc浓度为100mg/ml、nhs浓度为10mg/ml。
上述双通道输出检测食源性致病菌的适体传感器检测食源性致病菌的方法,包括以下步骤:
(1)ecl法检测食源性致病菌:将制备好的双通道输出检测食源性致病菌的适体传感器作为工作电极,ag/agcl电极作为参比电极,铂丝电极作为对电极,组成三电极体系放在电化学发光测试中进行测试,根据食源性致病菌不同浓度下对应的电化学发光强度值得到电化学发光法的工作曲线,从而对待测溶液中食源性致病菌浓度进行定量检测;当加入的食源性致病菌浓度越高,其捕获的信号单元越多,被负载的ru-mof含量越多,而ru-mof本身具有电化学发光,因此电化学发光强度也越大;
(2)dpv法检测食源性致病菌:dpv的测试液为ph=4.5的hac-naac缓冲溶液,电压范围0.3v~0.8v,扫速为0.1v/s,根据食源性致病菌不同浓度下的电流值得到差分脉冲伏安法的工作曲线,从而对待测溶液中食源性致病菌浓度进行定量检测。检测原理同ecl法:当加入的食源性致病菌浓度越高,其捕获的信号单元越多,被负载的ru-mof@pb2+含量越多,而ru-mof具有大的比表面积,吸附的pb2+含量也会越多,电化学还原电流强度越大,
步骤(1)中电化学发光测试采用计时电流法作为激发信号,电压范围0~1.5v,脉冲宽度为0.25s,脉冲周期为30s,微弱发光仪的光电倍增管的高压值800v。
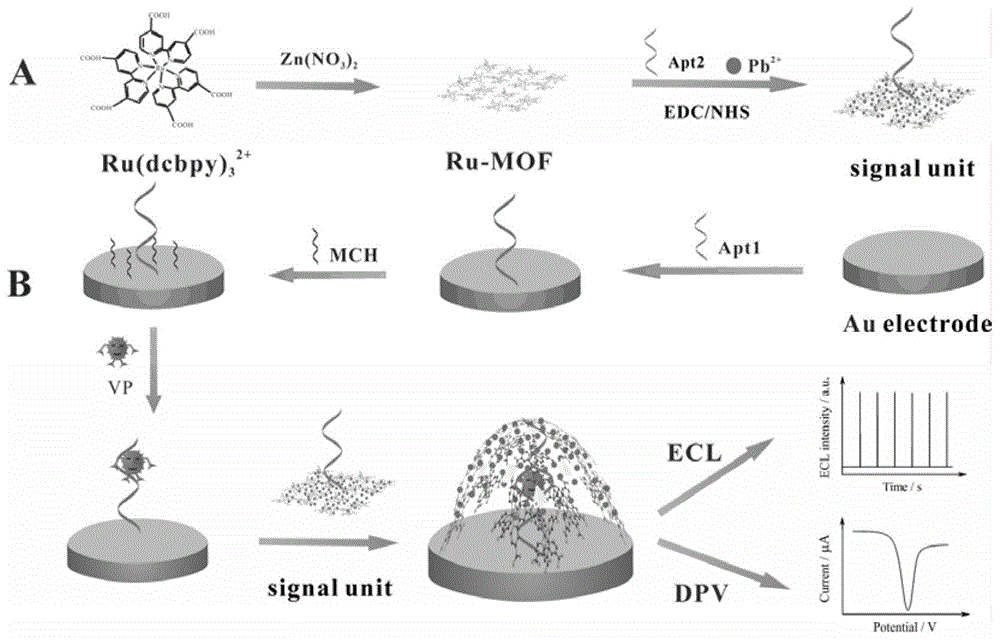
发明原理:本发明利用法拉第笼式结构,结合超大比表面积的纳米材料ru-mof,构建了一种检测食源性致病菌的ecl/dpv双通道输出适体传感器。将食源性致病菌的适体apt1标记在活化后的金电极表面,作为捕获单元,通过au-s键固载在金电极上的捕获单元适体apt1具有特异性捕获食源性致病菌的功能;食源性致病菌的适体apt2标记在ru-mof@pb2+上作为传感器的信号单元,信号单元中的适体apt2可以通过适配体特异性结合,被食源性致病菌捕获,从而使ru-mof@pb2+信号标签成功地负载在传感器上。ru-mof@pb2+不仅可以自身产生很强的电化学发光信号,还可以作为dpv的信号标签,并且ru-mof具有较大的比表面积,可以吸附更多pb2+,使dpv信号强度更明显,得益于法拉第笼式的分析模式,二维纳米材料像一张网一样搭接到电极表面,使所有的信号标签都能有效,进一步提高了两种方法的灵敏度。当食源性致病菌不存在时,信号单元ru-mof@pb2+-apt2无法被连接到电极表面;当体系中存在食源性致病菌时,apt2可以利用核酸适配体的特异性结合被食源性致病菌捕获,调整食源性致病菌的用量大小,可以实现ru-mof@pb2+负载量大小的调控,由此控制电化学发光的强度大小和电流信号的强弱。电化学发光强度及电流强度与食源性致病菌浓度呈现一定的关系,在特定的工作曲线下,可以实现样品中食源性致病菌的未知浓度的检验。
与现有技术相比,本发明的优点在于:
(1)dpv法提高灵敏度:ru-mof是一种二维纳米材料,具有更大的比表面积,可以吸附更多的信号标记物pb2+,使电流信号强度增强,进而在一定程度上降低其检测限。
(2)ecl测试步骤简单、提高灵敏度:ru-mof本身可以产生电化学发光信号,不用额外标记发光体,进一步简化了操作步骤,并且ecl本身就是一种非常灵敏的分析方法,利用法拉第笼模式,可以有效地拓宽电极的外亥姆霍兹层(ohp),使信号单元中的所有电化学发光体都可以参与电极反应,信号单元成为电极表面的一部分,从而大大提高了检测灵敏度。
(3)双通道输出避免假阳性出现:通过海水的加标回收实验,验证双通道免疫传感器的可行性。可以发现ecl法检测vp的回收率在92.8%~109.6%之间,相对标准偏差为4.8%~8.3%,dpv法检测vp的回收率在93.5%~110.2%之间,相对标准偏差为4.9%~8.6%,证明两者单独检测的准确性较好;利用t检验进行ecl和dpv两种方法的显著性差异的比较,所得p值0.12大于0.05,证明两种方法之间不存在显著性差异,也就是可以实现相互佐证检验vp的目的,有效地避免假阳性的出现。
综上所述,本发明首次制备了一种ecl和dpv双通道输出检测食源性致病菌传感器的制备方法及其应用,该传感器中ru-mof@pb2+不仅能够产生电化学发光,而且还能作为dpv还原的信号物。利用两种方法的双通道适体传感器检测食源性致病菌,检测结果的相互佐证可以有效地避免假阳性的出现,达到精确检测食源性致病菌的目的,因而具有高灵敏度、简单、快速、易于操作、实验成本低等优点,可以实现对超低浓度食源性致病菌的检测,具有良好的应用前景。
附图说明
图1为本发明ecl和dpv双通道输出检测vp传感器的制备流程和检测原理图;
图2为电化学发光法ecl检测不同vp浓度下的电化学发光强度值关系图;
图3为不同vp浓度与电化学发光强度的线性关系图;
图4为dpv检测不同vp浓度下的电流强度关系图;
图5为不同vp浓度与电流强度线性关系图((a)5cfu/ml,(b)10cfu/ml,(c)102cfu/ml,(d)103cfu/ml,(e)104cfu/ml,(f)105cfu/ml,(g)106cfu/ml,(h)107cfu/ml,(i)108cfu/ml);
图6为表1中8种海水样品,用ecl法检测vp浓度对数(y)-dpv法检测vp浓度对数(x)线形图;
图7为vp传感器分别对空白、105cfu/ml哈维氏弧菌、105cfu/ml阴沟肠杆菌、105cfu/ml希瓦氏菌、105cfu/ml创伤弧菌和102cfu/ml副溶血弧菌进行电化学发光检测的强度值;
图8为vp传感器分别对空白、105cfu/ml哈维氏弧菌、105cfu/ml阴沟肠杆菌、105cfu/ml希瓦氏菌、105cfu/ml创伤弧菌和102cfu/ml副溶血弧菌进行dpv检测的电流强度值。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
具体实施例一
一种ecl和dpv双通道输出检测副溶血弧菌(vp)的适体传感器的制备方法,如图1所示,包括以下步骤:
(1)发光功能化ru-mof的合成
将18mg的[ru(dcbpy)3]2+溶解在10ml的npa/h2o混合溶液中,然后将54mg的zn(no3)2溶解在以上制备的溶液中并超声处理1小时后,在室温下反应24小时,于8000rpm,4℃温度下离心5min,取沉淀并用去离子水洗涤三次得到ru-mof纳米颗粒,最好将ru-mof纳米颗粒分散在2ml的去离子水中,其中npa/h2o混合溶液中npa和h2o体积比为3:1;
(2)信号单元(ru-mof@pb2+-apt2)的合成
将1.5ml2.0mg/mlru-mof纳米颗粒分散在3ml10mmpb(no3)2溶液中,并在室温下反应24小时,于12000rpm离心5分钟后,将得到的沉淀用去离子水洗涤三次得到ru-mof@pb2+复合物,然后取200μl100μg/mlru-mof@pb2+复合物和400μledc/nhs复合物(edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),n-羟基琥珀酰亚胺(nhs),edc/nhs复合物中edc浓度为100mg/ml、nhs浓度为10mg/ml)于玻璃瓶中,混合均匀后,采用1.0mol/lhcl溶液调溶液ph为5,震荡孵育1h,于8000r离心15min,去离子水洗涤3次,去除偶联试剂;向玻璃瓶内加入50μl10µmol/l的第二适体apt2,混合均匀后采用1.0mol/lnaoh溶液调溶液ph为9,震荡孵育4小时,于8000rpm离心15min,去离子水洗三次,洗涤至中性,取出上清液,将沉淀分散在50μldna杂交缓冲溶液中即得到信号单元ru-mof@pb2+-apt2溶液;
(3)双通道适配体传感器的制备
a.将直径为3mm的金电极依次用1.0、0.3和0.05μm的al2o3抛光粉在麂皮上抛光至镜面,用水冲洗干净,再依次在乙醇、水中超声洗涤,清洗后的电极放入由浓h2so4和h2o2按体积比7:3混合成的混合溶液中浸泡5~10min,取出洗净,然后在0.5mol/l硫酸溶液中用循环伏安扫描处理,扫描速度为50mv/s,电压范围为0~1.6v,持续扫描得到稳定的循环伏安图后,取出用水洗净待用;
b.在上述处理好的金电极上滴入10μl第一适体apt1,于37℃条件下孵育16h,随后加入10μl2mm6-巯基-1-己醇,以封闭金电极表面非特异性活性位点,37℃条件下继续孵育1h,用去离子水洗涤,洗掉未结合的6-巯基-1-己醇;接着将10μlvp目标物溶液滴涂在上述修饰有apt1的金电极上,37℃条件下扣帽孵育1h,使apt1和vp充分反应,随后用去离子水充分洗涤除去多余的vp;向反应区域滴加10µl上述步骤(2)制备的信号单元ru-mof@pb2+-apt2溶液,在37℃条件下静置60min,利用vp和apt2的特异性结合,将ru-mof@pb2+引入到整个传感器中分别作为电化学发光和电化学的信号物,反应完成后用去离子水洗涤2~3次,除去未被vp捕获的信号单元ru-mof@pb2+-apt2,即制备得到双通道输出检测vp的适体传感器。
上述apt1是vp的第一适体序列为:5′-sh-tctaaaaatgggcaaagaaacagtgactcgttgagatact-3′
apt2是vp的第二适体序列为:5′-nh2-tctaaaaatgggcaaagaaacagtgactcgttgagatact-3′
不同的致病菌具有与之对应的不同的核酸适配体,例如:沙门氏菌的特异性适体序列为:5′-tatggcggcgtcacccgacggggacttgacattatgacag-3′;金黄色葡萄球菌序列适体是:5'-sh-tcggcacgttctcagtagcgctcgctggtcatcccacagctacgtc-3'。第一适体序列为序列5′端修饰巯基,第二适体为序列5′端修饰氨基。
具体实施例二
上述由ecl和dpv双通道输出信号检测vp的电化学传感器用于vp检测的方法,如图1所示,包括以下步骤:
(1)ecl法检测vp:将制备好的双通道输出检测vp的适体传感器作为工作电极,ag/agcl电极作为参比电极,铂丝电极作为对电极,组成三电极体系放在电化学发光测试中进行测试,根据vp不同浓度下对应的电化学发光强度值得到电化学发光法的工作曲线,从而对待测溶液中vp浓度进行定量检测;当加入的vp浓度越高,其捕获的信号单元越多,被负载的ru-mof含量越多,而ru-mof本身具有电化学发光,因此电化学发光强度也越大;由图2可知,检测不同浓度(1~108cfu/ml)的vp存在时适体传感器的电化学发光强度值,随着vp浓度增大,电化学发光强度值依次增大。
由图3可知,不同浓度vp的电化学发光强度(y)—vp浓度(x)对数线性关系,线性方程为y=817.30+1226.01*lgx,相关系数r=0.995,线性关系良好,可以用于未知样品中vp检测。
(2)dpv法检测vp:dpv的测试液为ph=4.5的hac-naac缓冲溶液,电压范围0.3v~0.8v,扫速为0.1v/s,根据vp不同浓度下的电流值得到差分脉冲伏安法的工作曲线,从而对待测溶液中vp浓度进行定量检测。检测原理同ecl法:当加入的vp浓度越高,其捕获的信号单元越多,被负载的ru-mof@pb2+含量越多,而ru-mof具有大的比表面积,吸附的pb2+含量也会越多,电化学还原电流强度越大,
由图4可知,检测不同浓度vp的电流强度-vp浓度关系,随着vp浓度增大,电流强度依次增大。
由图5可知,对不同浓度vp的电流强度(y)—vp浓度(x)对数线性关系,线性方程为y=-1.19-2.52*lgx,相关系数r=-0.993,线性关系良好,可以用于未知样品中vp检测。
实际上,在传统的夹心式免疫传感器中,限制灵敏度提高的主要原因是第二抗体上标记的信号标签的数量少和信号标签的有效率比较低。一般检测抗体上的信号标签与电极表面之间的距离在约0至几微米之间,与免疫复合物和标记位点的大小有关。这意味着大多数标记的信号标签都位于外亥姆霍兹层(ohp)之外。ohp被认为是溶剂化物可以与电极发生电子交换最近位置。在电极动力学中,ohp是电化学活性物质必须达到的位置,只有当电化学活性材料接近ohp时,才发生电化学反应。因此为了提高灵敏度,必须增加尽可能多的信号标签处于ohp以内,增加信号标签的有效率。
由于多孔金属有机骨架材料(mof)具有结构新颖,比表面积大,导电率高以及优异的吸附特性和各种接枝基团(如nh2或cooh),可促进金属离子和生物配体的共固定化,在生物医药领域已经受到人们的广泛关注。而ru-mof作为一种具有ecl性能的二维纳米材料,其孔隙表面的丰富羧基官能团可在孔隙内吸收大量的金属离子(如pb2+、cd2+、cu2+等),此外,氨基封端的dna也可以通过偶联剂例如edc/nhs在ru-mof上标记。利用这些优异的性能,在这项工作中,我们尝试引入适体和金属离子pb2+固定的纳米ru-mof作为生物信号标签以实现两种方法检测同一目标物。此外,我们还提出了基于多功能二维纳米材料的法拉第笼式的新概念,二维纳米材料像一张巨大的网直接搭接到电极表面,使所有的信号标签都处于电极内,成为电极的一部分,通过扩展所提出的生物传感器的外部亥姆霍兹层(ohp),可以克服低电极反应效率,更好地增加了灵敏度,增加结果的准确性,而且两种方法达到相互校验的作用。
具体实施例三
为验证本发明双通道适体传感器在实际应用中的价值,在海水中加入vp标准溶液作为实际样品,采用加标回收的方法对海水中不同浓度的vp进行了检测,结果如表1所示;
表1海水和海产品中vp的检测(
由表1可知,ecl法检测vp的回收率在92.8%~109.6%之间,相对标准偏差为4.8%~8.3%,dpv法检测vp的回收率在93.5%~110.2%之间,相对标准偏差为4.9%~8.6%,证明两者单独检测的准确性较好。
图6为表1中8种海水样品,用ecl法检测vp浓度对数(y)-dpv法检测vp浓度对数(x)线形图;线性方程为:y=0.984x+0.151,相关系数r=0.998,表明两种方法测试结果基本一致。利用t检验进行ecl和dpv两种方法的显著性差异的比较,所得p值0.12大于0.05,证明两种方法之间不存在显著性差异,也就是可以实现相互佐证检验vp的目的,有效地避免假阳性的出现。
具体实施例四
图7为vp传感器分别对空白、105cfu/ml哈维氏弧菌、105cfu/ml阴沟肠杆菌、105cfu/ml希瓦氏菌、105cfu/ml创伤弧菌和102cfu/ml副溶血弧菌进行电化学发光检测的强度值;由图可知,当副溶血弧菌存在时,检测的电化学发光强度远远大于干扰食源性致病菌电化学发光强度,表明该传感器对副溶血弧菌具有特异性检测。
图8为vp传感器分别对空白、105cfu/ml哈维氏弧菌、105cfu/ml阴沟肠杆菌、105cfu/ml希瓦氏菌、105cfu/ml创伤弧菌和102cfu/ml副溶血弧菌进行dpv检测的电流强度值;由图可知,当副溶血弧菌存在时,检测的电流强度值远远大于干扰食源性致病菌电流强度值,表明该传感器对副溶血弧菌具有特异性检测。
以上结果说明,本发明研究出一种高灵敏度、高选择性的双通道检测vp的方法,该方法具有简单、快速、易于操作等优点,且双通道信号之间互相比对,结果准确可靠,具有良好的应用前景。
当然,上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!