一种传染性法氏囊病病毒抗体竞争ELISA检测方法及试剂盒与流程
一、技术领域
本发明涉及一种传染性法氏囊病病毒抗体竞争elisa检测方法及试剂盒,属于生物技术领域。
二、
背景技术:
传染性法氏囊病(ibd)是由传染性法氏囊病病毒(ibdv)引起的以侵害幼禽法氏囊为主要特征的传染病,该病是引起我国及世界养禽业经济损失严重的主要传染病之一。该病不仅引起患病动物死亡,而且还导致机体免疫抑制,使机体的免疫防御能力降低和对多种疫苗免疫接种失败。对易感鸡群实施疫苗接种是预防该病最有效的方法,但由于各地流行的ibdv毒株的毒力与抗原性的差异,每年由于ibd免疫失败或免疫抑制造成的经济损失巨大。鉴于此,进一步分析当前ibdv的分子流行病学,研制经济快捷的检测方法仍是当前ibd防控工作中亟待解决的重要课题。
检测鸡ibdv抗体的主要方法有:中和试验、琼扩、间接免疫荧光(ifa)及间接elisa(现有商品化试剂盒包被抗原为全病毒)。中和试验虽然是评价鸡群抗体的金标准,但因其操作繁琐,耗时较长,且需要培养细胞,不适合普通养殖场的使用。琼扩实验虽然操作不复杂,但不够灵敏且耗时较长,达不到快速和灵敏的目的。ifa操作也比较繁琐,需要培养细胞,且观察需要用的荧光显微镜价格昂贵。而elisa具备特异、简便、快速的特点。因此,目前普遍使用间接eilsa来评价鸡群内的ibdv抗体水平。但现有的商品化ibdv抗体elisa检测试剂盒均采用的是间接elisa,检测样品需要两步,耗时近2个小时,且价格昂贵。针对此,本研究采用竞争elisa来检测ibdv抗体。该方法只需一步就可以对血清样品进行检测,且耗时只需30min,相比间接elisa,更加快速高效。
三、
技术实现要素:
技术问题
传染性法氏囊病(ibd)是由传染性法氏囊病病毒(ibdv)引起的鸡和火鸡的一种急性、热性、高度接触性传染病,是引起我国及世界养禽业经济损失严重的主要传染病之一。
目前普遍使用间接eilsa来评价鸡群内的ibdv抗体水平。但现有的进口的商品化ibdv抗体间接elisa检测试剂盒价格昂贵,不利于推广应用;而国产的ibdv抗体间接elisa检测试剂盒其包被抗原为纯化的ibdv全病毒,而ibdv全病毒的培养需要细胞或者鸡,培养成本较高,且ibdv纯化需要比较昂贵的超速离心机,耗时较长。而本研究研制的ibdv抗体竞争elisa检测试剂盒,采用原核表达的重组vp2蛋白(rvp2)作为包被抗原,hrp-标记的vp2单抗为竞争抗体,可在30min内检测出样品的结果。比国内外现有的ibdv抗体间接elisa检测试剂盒有4大优点:耗时更短、特异性更好、检测样品范围更广、成本更低廉和生产更方便等优势,具有巨大的生产应用价值。
技术方案
一种传染性法氏囊病病毒抗体竞争elisa检测方法,其特征在于,以保藏编号为cctccno:c201966的抗传染性法氏囊病毒vp2蛋白的单克隆抗体杂交瘤细胞株1h6单克隆抗体为竞争抗体。
以rvp2重组vp2蛋白为包被抗原,其制备方法为:将ibdvvp2基因优化设计,根据genbank已登录的ibdvvp2序列eu417824.1和大肠杆菌密码子的偏爱性优化设计vp2基因,将vp2基因的atg去掉,全基因合成,定向克隆入原核表达载体pet-28a(+)中,构建原核表达质粒pet28+vp2,转化大肠杆菌rosetta(de3);经iptg诱导后,离心收集细菌,然后按照histraphp说明书纯化rvp2。
该检测方法的具体步骤为,将纯化的rvp2重组蛋白用ph9.6的碳酸盐缓冲液稀释至5μg/l,加入到酶标板,每孔100μl,4℃包被过夜,用含10%fbs的pbst封闭液满孔封闭,37℃,2h,pbst洗涤3次,每次3min,拍干;加入1:500稀释的临床样本50μl/孔96份,同时加入hrp-vp2单抗50μl/孔,hrp-vp2单抗1:20000稀释,37℃,1h,pbst洗涤5次,每次3min,拍干;加入tmb显色剂100μl/孔,暗盒显色;2mh2so4终止,测a450值,判定结果。判定标准:pi=100-样品od值/阴性平均od值x100,当pi>50时,判为阳性;当pi≤50时,判为阴性。
所述的传染性法氏囊病病毒抗体竞争elisa检测方法可以直接应用。用所述的传染性法氏囊病病毒抗体竞争elisa检测方法也可以构建试剂盒应用。
有益效果
本发明建立的传染性法氏囊病病毒抗体竞争elisa检测方法,与现有的商品化的ibdv抗体检测试剂盒相比:耗时更短、特异性更好、检测样品范围更广、成本更低廉和生产更方便等优势,具有巨大的生产应用价值。
本发明的特点和优点如下:
本发明采用原核表达的重组vp2蛋白(rvp2)作为包被抗原,hrp-标记的vp2单抗为竞争抗体,可在30min内检测出样品的结果。比国内外现有的ibdv抗体间接elisa检测试剂盒有4大优点;
1、特异性更好:本试剂盒采用hrp-标记的vp2单抗为竞争抗体,而现有的间接elisa试剂盒采用ibdv多克隆抗体,众所周知,单抗比多抗具有更好的特异性。
2、检测样品范围更广:本试剂盒采用hrp-标记的vp2单抗为竞争抗体,可以不受检测样品来源的限制,可以检测各种动物来源或非动物来源的样品;而现有的间接elisa试剂盒其酶标二抗是针对鸡的血清样品,因此,其检测范围只能是来源于鸡的血清样品。
3、耗时更短:本试剂盒在检测样品时,只需将待检样品和hrp-标记的vp2单抗竞争抗体同时加入,只需一步,检测时间在30min左右;而现有的间接elisa试剂盒,需要2步,需要在待检血清与包被抗原反应后(需时:1h左右),然后再加入酶标二抗反应(需时:1h左右),总时间在2h以上。
4、成本更低廉和生产更方便:从包被抗原上来说,本研究研制的ibdv抗体竞争elisa检测试剂盒,采用原核表达的重组vp2蛋白(rvp2)作为包被抗原,只需普通的摇床就可以大量生产我们需要的包被抗原(rvp2),而现有的商品化间接elisa试剂盒包被抗原为ibdv,ibdv的培养需要用到细胞或者鸡,生产成本高,还不方便。此外,本试剂盒使用的竞争抗体为vp2单克隆抗体,只需将杂交瘤细胞通过小鼠制备腹水就可以,1只小鼠可制备15ml左右的腹水,而1ml腹水就可获得4mlhrp-标记的vp2单抗,在检测样品时,还需将hrp-标记的vp2单抗稀释20000以上,综上,1只小鼠制备的腹水可获得hrp-标记的vp2单抗工作液总量为:15ml腹水×4mhrp-标记的vp2单抗×20000=1.2×106ml,1个试剂盒需要的hrp-标记的vp2单抗工作液为100ml左右,所以,1只小鼠制备的腹水就可满足10000个以上试剂盒的需求,其成本远低于多抗的生产成本。
四、附图说明
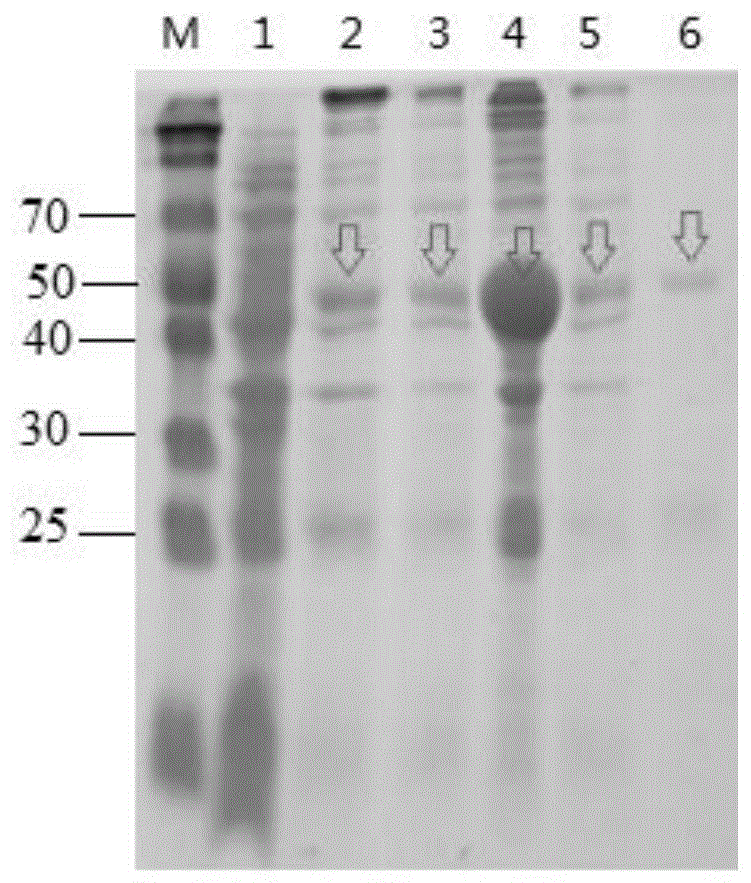
图110%sds-page分析vp2全长在大肠杆菌transsetta(de3)中的表达
图2westernblot分析hrp-vp2单抗与rvp2的反应性
生物保藏
该细胞株1h6于2019年5月9日保藏于中国典型培养物保藏中心,地址:中国武汉武汉大学,保藏编号为cctccno:c201966,分类命名:抗传染性法氏囊病毒vp2蛋白的单克隆抗体杂交瘤细胞株1h6。
五、具体实施方式
1主要实验材料
传染性法氏囊病病毒(ibdv)b87中等毒力弱毒疫苗株购自南京天邦生物科技有限公司;e.colirosetta(de)3感受态细胞购自上海唯地生物科技有限公司;质粒纯化试剂盒购自omega公司;dna凝胶回收试剂盒购自全式金生物科技有限公司;限制性内切酶均购自takara公司。
2实验方法
2.1ibdvvp2基因在大肠杆菌中的表达
2.1.1ibdvvp2基因密码子的优化
根据genbank已登录的ibdvvp2序列(eu417824.1)和大肠杆菌密码子的偏爱性优化设计vp2基因,将vp2基因的atg去掉,使其融合pet28a(+)上的his标签,在大肠杆菌中进行融合表达。
2.1.2ibdvvp2基因重组表达质粒的构建
将优化设计的vp2基因,全基因合成,在其5′端和3′端添加bamhⅰ和xhoⅰ酶切位点,优化设计的vp2基因由通用生物系统(安徽)有限公司合成,并克隆于原核表达载体pet28a(+)中。用xhoi和mlui双酶切鉴定,并进行测序分析。获得的重组质粒命名为pet28-vp2(4-1350)。用含eb的1%琼脂糖凝胶电泳分析,可见2条长度分别约4.0kb和2.5kb的dna片段,与pet28a(+)和vp2基因片段的理论值相符合。
2.1.3ibdvvp2基因在大肠杆菌中的表达
将重组质粒pet28-vp2(4-1350)转化e.colirosetta(de)3感受态细胞,涂布在用lb配制的1.5%琼脂平皿上,37℃培养14h,挑单菌落接种入lb,振摇培养14h。次日以1%的量分别接种lb培养基(含卡拉霉素100μg/ml)中,振荡培养,在a600值为0.8时,分别加入终浓度为1.0mm的iptg,分别诱导4h。取诱导的细菌培养物,5000g离心5min,用12%sds-page分析菌体中vp2片段的表达情况。试验同步设立pet28a(+)空质粒转化的e.colirosetta(de)3为对照。经12%sds-page电泳,在分子量约50kda处有一条目的蛋白带,而pet28a(+)转化的e.colirosetta(de3)则无50kda大小的蛋白带。
2.1.4westernblot分析ibdvvp2蛋白的表达水平
将诱导表达的3ml重组菌5000g离心10min,去除上清液,加入160μl去离子水重悬,再加入40μl5×sds-loadingbuffer,按常规方法进行12%分离胶和5%浓缩胶的sds-page电泳分析,转印到硝酸纤维素膜上,转印完毕后,将硝酸纤维素膜用5%脱脂奶粉4℃封闭过夜,然后用一抗(his单抗或鸡抗ibdv高免血清)、二抗(hrp标记的羊抗鼠igg抗体或hrp标记的兔抗鸡igg抗体)分别与之作用,dab底物显色,观察特异蛋白条带。试验同步设立空质粒pet28a(+)转化的e.colirosetta(de3)为对照。经12%sds-page电泳、转印和dab显色后,重组vp2蛋白可与his单抗或鸡抗ibdv高免血清在分子量约50kda处有一条目的蛋白带,而pet28a(+)转化的e.colirosetta(de3)则无50kda大小的蛋白带。
2.1.5ibdvvp2蛋白的纯化
取200ml诱导表达的培养物,离心收集细菌,用30ml结合缓冲液重悬,并加入20μl100mmol/lpmsf,冰浴条件下超声破碎至细胞悬液清亮,4℃,10000g离心30min去除细胞碎片,取上清用0.45μm孔径滤膜过滤,然后按照histraphp说明书纯化重组vp2蛋白片段。超声沉淀中含有大量的重组vp2蛋白,表明重组vp2蛋白主要以包涵体形式存在。
2.2hrp标记ibdvvp2基因单克隆抗体
2.2.1ibdvvp2基因单克隆抗体的制备
用纯化的ibdv免疫6~8周龄雌性balb/c小鼠,每隔14d免疫1次,第4次免疫后,无菌取免疫balb/c鼠脾细胞,与对数生长期的sp2/0细胞融合。以rvp2蛋白作为包被抗原,用间接elisa法测融合细胞的培养上清,筛选到了8株ibdvvp2单抗。选择阳性的杂交瘤细胞用有限稀释法进行克隆。将克隆化的阳性杂交瘤细胞扩大培养,腹腔注射入8~10周龄balb/c雌性小鼠制备腹水。
2.2.2辣根过氧化物酶(hrp)标记ibdvvp2单抗
取0.5ml腹水加入等量的pbs稀释,3000r/min,10min,取上清用0.45μm孔径滤膜过滤,然后按照hitrapproteinahp说明书纯化vp2单抗。用辣根过氧化物酶(hrp)将纯化的vp2单抗用高碘酸钠法进行标记[1]。
[1]骆加理,沈炳贵,宋光承,陈彩云,薛海筹.辣根过氧化物酶(hrp)标记抗体的简易方法[j].生物化学与生物物理学报,1981(01):1-8.
2.2.3westernblot分析ibdvvp2单抗与rvp2的反应性
将pet28-vp2(4-1350)转化e.colirosetta(de)3和空质粒pet28a(+)转化的e.colirosetta(de3)进行诱导表达,sds-page电泳分析,转印到硝酸纤维素膜上,5%脱脂奶粉4℃封闭过夜,然后以hrp-vp2单克隆抗体作为一抗,dab底物显色,观察特异蛋白条带。
经10%sds-page电泳、转印和dab显色后,hrp-vp2单抗可与原核表达的重组vp2蛋白在分子量约50kda处有一条目的蛋白带,而pet28a(+)转化的e.colirosetta(de3)则无蛋白带。经筛选细胞株1h6的hrp-vp2单抗可与原核表达的重组vp2蛋白在分子量约50kda处有一条目的蛋白带。
2.3ibdv抗体竞争elisa检测方法的建立
将纯化的rvp2重组蛋白用ph9.6的碳酸盐缓冲液稀释至5μg/l,加入到酶标板,每孔100μl,4℃包被过夜,用封闭液(含10%fbs的pbst)满孔封闭,37℃,2h,pbst洗涤3次,每次3min,拍干;加入1:500稀释的临床样本50μl/孔(96份),同时加入hrp-vp2单抗50μl/孔(hrp-vp2单抗1:20000稀释),37℃,1h,pbst洗涤5次,每次3min,拍干;加入tmb显色剂100μl/孔,暗盒显色;2mh2so4终止,测a450值,判定结果。判定标准:pi=100-样品od值/阴性平均od值x100,当pi>50时,判为阳性;当pi≤50时,判为阴性。
2.4ibdv抗体竞争elisa检测方法的初步应用
2.4.1竞争elisa
将纯化的rvp2重组蛋白用ph9.6的碳酸盐缓冲液稀释至5μg/l,加入到酶标板,每孔100μl,4℃包被过夜,用封闭液(含10%fbs的pbst)满孔封闭,37℃,2h,pbst洗涤3次,每次3min,拍干;加入1:500稀释的临床样本50μl/孔(96份),同时加入hrp-vp2单抗50μl/孔(hrp-vp2单抗1:20000稀释),37℃,1h,pbst洗涤5次,每次3min,拍干;加入tmb显色剂100μl/孔,暗盒显色;2mh2so4终止,测a450值,判定结果。同时用idexxibdv抗体间接elisa试剂盒检测临床样品,作为商品化对照组。
2.4.2中和试验
将96份临床样本分别从1∶2开始进行2倍比连续稀释,稀释到1:64;各取100μl,分别与等体积的ibdvb87细胞适应毒稀释物(病毒含量200tcid50/0.1ml)混合,置37℃反应1h,接种于含有df-1单层的96孔培养板中,100μl/孔(病毒含量100tcid50/孔),每份待检血清设4个重复;同时设立病毒对照、阳性血清对照、阴性血清对照、细胞对照。置37℃、5%co2培养,每天观察病变,记录结果,按reed-muench法计算出每个血清样品的病毒中和抗体效价,根据国标gb/t19167-2003,中和效价>1:32则判断为阳性,反之则判断为阴性。
用重组vp2蛋白建立的ibdv抗体竞争elisa、idexx-elisa(ibdv)及中和试验同时检测96份临床样本,结果:重组vp2蛋白建立的ibdv抗体celisa检测方法、idexx-elisa(ibdv)与中和试验比较,相对敏感性分别为94.12%和100%;相对特异性分别为95.16%和25.8%;符合率分别为94.79%和52.08%。具体结果如下(表1和表2)。
表1rvp2-celisa与中和试验的比较
相对敏感性:32/34×100%=94.12%;
相对特异性:59/62×100%=95.16%;
符合率:(32+59)/96×100%=94.79%
表2idexx-elisa与中和试验的比较
相对敏感性:34/34×100%=100%;
相对特异性:16/62×100%=25.8%;
符合率:(34+16)/96×100%=52.08%
- 还没有人留言评论。精彩留言会获得点赞!