基于溶剂诱导蛋白沉淀探测配体与蛋白相互作用或亲和力的方法
本发明属于蛋白组学研究方向药物靶标蛋白筛选领域,尤其涉及一种基于溶剂诱导蛋白沉淀探测配体与蛋白相互作用或亲和力的方法。
背景技术:
药物靶蛋白的鉴定是药物研发中的重要环节,新靶点的发现可为药物筛选提供突破口,为先导化合物的发现和设计提供重要的理论依据。通过蛋白组学或生物技术等手段对药物的潜在靶点进行鉴定与挖掘,对于研究药物发挥其疗效的分子机制、毒副作用和其它医疗用途具有重要意义。目前,已经开发的一系列基于蛋白组学用于鉴定药物靶蛋白的方法,主要分为两类:小分子修饰/固定模式和非标记药物模式。前者包括基于活性探针分析(abpp)(vanesbroeckacm,etal,science,2017,356:1084-1087)和亲和层析方法(hoehenwarterw,etal,molecular&cellularproteomics,2013,12:369-380),该策略中小分子化学修饰的需求成为鉴定药物靶标的主要障碍之一,存在的局限性主要包括:1)药物固定或修饰后改变了药物本身的性质和生物膜通透性,导致鉴定的靶蛋白假阳性高;2)不能应用于弱相互作用的药物靶蛋白的筛选。理想的药物靶蛋白的筛选方法是不对药物进行任何化学修饰,且不依赖亲和力的大小。因此,近年来,基于能量状态差异的化合物无标记策略受到越来越多的关注。
蛋白在结合配体后其构象会发生一定的变化,从而使其功能发生变化。蛋白构象发生变化也预示着蛋白处于不同的能量状态。基于能量状态差异的靶蛋白识别方法是利用蛋白与配体结合所产生的结构稳定性,使其对热变性、氧化变性和酶解等条件的刺激具有更高的耐受性,从而利用定量蛋白组学技术追踪药物结合蛋白和配体未结合蛋白稳定性变化从而实现配体靶蛋白筛选的目的。这种方法不需要任何小分子的标签或固定,有别于传统的基于亲和捕捉方法。这类配体靶蛋白识别技术主要包括氧化速率蛋白稳定性(sprox)(stricklandec,etal,natureprotocols,2013,8:148-161)、药物亲和力反应靶标稳定性(drats)(chinrm,etal,nature,2014,510:397-401;lomenickb,etal,proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,2009,106:21984-21989)和蛋白热转移分析(tpp)(savitskimm,etal,science,2014,346:1255784;huberkvm,etal,naturemethods,2015,12:1055-1057)。以上这些方法为药物靶蛋白的识别提供了新的思路,然而每种技术方法仍具有一定缺陷。sprox方法是基于蛋白中甲硫氨酸氧化速率的不同而实现靶蛋白的识别,是对蛋白中甲硫氨酸的水平进行定量,从而对鉴定蛋白的覆盖率有一定限制性。drats方法中特定蛋白酶对不同蛋白的水解效率不同,有可能对药物亲和力较弱的靶蛋白或低丰度蛋白发生过度酶解,造成变化微弱靶蛋白的丢失。lip方法(fengyh,etal,naturebiotechnology,2014,32:1036-1044)是在drats方法的改进,在非特异性酶切的基础上进行胰蛋白酶酶切,该方法导致样品过于复杂、肽段定量要求高、准确度和高精密度等问题。tpp方法不需要对特殊肽段进行鉴定,蛋白的覆盖率与传统的自下而上的bottom-up方法类似。但是该方法在热稳定性变化数据分析时,由配体引起热稳定性变化程度较小的蛋白很容易造成丢失。
综上所述,虽然近年来开发了一些配体靶蛋白筛选方法,但其适用性和灵敏度仍有待提高。上述方法没有提示利用溶剂沉淀蛋白进行配体靶标的筛选或鉴定。本发明提出一种基于溶剂沉淀蛋白的药靶鉴定和/或筛选的新方法。
技术实现要素:
本发明的目的在于提供一种高通量成本低,特异性高的基于溶剂诱导蛋白沉淀探测配体与蛋白相互作用和亲和力的方法(sip),克服传统通过固定化药物或在药物上连接亲和标签的方法假阳性高、不适合弱相互作用的缺点。
一种基于溶剂诱导蛋白沉淀探测配体与蛋白相互作用的方法,该方法利用配体结合蛋白和配体未结合蛋白对溶剂诱导变性而导致沉淀耐受能力不同的原理而建立。由于靶蛋白结合配体后构象更稳定,对溶剂诱导的蛋白沉淀具有更高的耐受能力。配体组和对照组的蛋白溶液分别加入等量的溶剂使蛋白沉淀,然后利用定量技术对配体组和对照组中保持溶解蛋白或沉淀中各个蛋白的浓度进行监测,通过比较配体组和对照组中蛋白沉淀的差异,筛选出配体结合靶标蛋白。该方法的步骤为:
(a)于待检蛋白溶液中加入配体,作为配体组;不加入配体的待检蛋白溶液,作为对照组;分别孵育;
(b)在上述两组混合物中分别加入等量溶剂诱导蛋白部分沉淀;
(c)检测蛋白混合物上清液和/或沉淀中各个蛋白的丰度;
(d)比较配体组和对照组中蛋白丰度的差异(即同一蛋白在上清液和/或沉淀中丰度的差异)确定配体靶标蛋白。
进行步骤c检测之前,采用离心将可溶性蛋白(上清液)与沉淀蛋白进行分离。
蛋白溶液包括一种蛋白或二种以上蛋白混合物;蛋白混合物包括细胞或组织提取液中的一种或两种以上。细胞或组织提取液来源于人、动物、植物或细菌中的一种或两种以上。蛋白溶液包括血液或血浆中的一种或两种。血液或血浆来源于人或动物中的一种或两种。
蛋白溶液是采用使细胞中提取的蛋白保持天然构象的提取条件,蛋白保持与在活细胞或组织中相同的空间结构是准确筛选配体结合蛋白以及研究蛋白功能的基础和根本。优选,提取条件如:采用磷酸盐缓冲溶液(phosphatebuffersaline,pbs)或加入含有体积百分比0.2-0.4%乙基苯基聚乙二醇(nonidetp40,np-40)的pbs作为缓冲液,并结合2-5次的反复的冻融过程提取,冻融过程为液氮冷冻和10-50℃融化。
配体包括药物,代谢产物,植物提取物或天然产物,食品添加剂,环境污染物,农业杀虫剂或除草剂,环境剂,金属离子,纳米粒子,肽段,蛋白和可能与蛋白相互作用的其他物质中的一种或多种。
步骤a中蛋白溶液分为两组,一组加入配体作为配体组,另外一组不加配体为对照组;或,但不局限于两组,配体组可以使用2组以上不同配体浓度的样品,对照组可以使用结构相似且作用不同靶标蛋白的其它配体或空白(即不含配体)。
用于沉淀的溶剂为一种或两种以上溶剂的混合物。溶剂包括能够使蛋白变性沉淀的有机物或无机物中的一种或二种以上,包括但不局限于有机溶剂、酸性试剂、碱性试剂、金属离子或盐类中的一种或二种以上。优选,溶剂包括丙酮、甲醇、乙醇、乙酸、抗坏血酸(vc)、柠檬酸(ca)和三氟乙酸等溶剂中的一种或二种以上组合,但不局限于这些溶剂;更优选,溶剂混合物包括但不局限丙酮、乙醇和乙酸三种溶剂的混合物(a.e.a.或称之为a.a.a.),其体积比例为丙酮:乙醇:乙酸=50:50:0.1。
用于配体组和对照组蛋白变性沉淀的溶剂剂量范围依据溶剂的不同可进行适当调整,该范围选择的原则为在选用的溶剂能够导致蛋白初始变性沉淀到蛋白沉淀80-90%的范围之内;优选,溶剂为,a.e.a.(或称之为a.a.a.)混合物的系列终体积百分比范围为9%-22%;抗坏血酸终浓度范围为1mm-15mm;或,柠檬酸终浓度范围为1mm-5mm。溶剂混合物的组合包括试剂盒的开发。溶剂处理蛋白混合物反应平衡的条件可适当调整,即在20-30℃震荡20-40min或在30-40℃震荡10-20min以达到蛋白溶液中部分蛋白变性的目的;优选,反应平衡的条件为37℃,800rpm震荡20min。
蛋白丰度的检测包括在可溶性蛋白部分(即上清部分)或沉淀部分进行检测,或者两部分同时检测。步骤c中检测溶剂混合物处理后的配体组与对照组中蛋白丰度的方法包括免疫印迹和定量蛋白组学技术,但不局限于这两种方法;定量蛋白组学技术中肽段的标记方式包括无标记定量和/标记定量;其中标记定量的方法包括二甲基标记、tmt或itraq等多重同位素标记方法中的一种或两种以上。
配体靶标蛋白筛选标准为配体组和对照组中每个蛋白的丰度倍数差异或相对丰度的距离差异大于/等于或小于/等于一定阈值,即为筛选出配体结合靶标蛋白。该阈值根据配体的不同可做适当调整;优选,通过最大化灵敏度和特异度的值来确定最佳阈值(如大于等于2倍差异)。鉴定到的靶标蛋白中配体引起稳定(即上清中配体组蛋白丰度高于对照组或沉淀中配体组蛋白丰度低于对照组)的蛋白为直接靶标蛋白,配体引起去稳定(即上清中配体组蛋白丰度低于对照组或沉淀中配体组蛋白丰度高于对照组)的蛋白为间接靶标蛋白。
一种基于溶剂诱导的蛋白沉淀检测配体与蛋白之间亲和力的方法,该方法包括:
(a)将一系列浓度(通常选择配体5个不同终浓度点或6个以上不同终浓度点,其中一个浓度点为无配体的对照点,即配体终浓度为0的对照组)的同一种配体与待检蛋白溶液分别进行孵育;
(b)在含有蛋白和配体的混合物中加入一定剂量(优选相同终浓度)的溶剂进行沉淀蛋白;
(c)分别检测含有蛋白和配体混合物的上清液和/或沉淀中每个蛋白的丰度;
(d)以横坐标为不同药物浓度,纵坐标为蛋白丰度拟合曲线并通过计算得到ec50,获得配体与靶标蛋白之间的结合强度信息(即亲和力)。依据的计算方程:y=min+(max-min)/(1+10^((logec50-x)*hillslope)),y为纵坐标蛋白丰度,x为不同的药物浓度,min和max分别为y轴对应蛋白丰度的最小值和最大值,hillslope指的是曲线最大斜率的绝对值(即曲线中点)。
进行步骤c检测之前,采用离心将可溶性蛋白(上清液)与沉淀蛋白进行分离。
蛋白溶液包括一种蛋白或二种以上蛋白混合物。蛋白混合物包括细胞或组织提取液中的一种或二种以上。细胞或组织提取液来源于人、动物、植物或细菌中的一种或二种以上。蛋白溶液包括血液或血浆中的一种或二种以上。血液或血浆来源于人或动物中的一种或二种以上。
蛋白溶液是采用使细胞中提取的蛋白保持天然构象的提取条件;优选,温和提取条件如pbs或加入体积浓度0.2%np-40的pbs作为缓冲液、并结合液氮冻融3次。
配体包括药物,代谢产物,植物提取物或天然产物,食品添加剂,环境污染物,农业杀虫剂或除草剂,环境剂,金属离子,纳米粒子,肽段,蛋白和可能与蛋白相互作用的其他物质中的一种或多种。
步骤a中蛋白溶液分为两组,一组加入配体作为配体组,另外一组不加配体为对照组;或,但不局限于两组,配体组可以使用多组不同配体浓度的样品,对照组可以使用结构相似且作用不同靶标蛋白的其它配体或空白(即不含配体)。
用于沉淀的溶剂为一种或两种以上溶剂的混合物。溶剂包括能够使蛋白变性沉淀的有机物或无机物中的一种或二种以上,包括但不局限于有机溶剂、酸性试剂、碱性试剂、金属离子或盐类中的一种或二种以上;优选,溶剂包括丙酮、甲醇、乙醇、乙酸、抗坏血酸(vc)、柠檬酸(ca)和三氟乙酸等溶剂中的一种或二种以上组合,但不局限于这些溶剂;更优选,溶剂混合物包括但不局限丙酮、乙醇和乙酸三种溶剂的混合物(a.e.a.或称之为a.a.a.),其体积比例为丙酮:乙醇:乙酸=50:50:0.1。
用于配体组和对照组蛋白变性沉淀的溶剂剂量范围依据溶剂的不同可进行适当调整,该范围选择的原则为在选用的溶剂能够导致蛋白初始变性沉淀到蛋白沉淀80-90%的范围之内;优选,a.e.a.(或称之为a.a.a.)混合物的剂量选择范围在终体积百分比9%-22%之间;抗坏血酸的剂量选择范围在终浓度1mm-15mm之间;柠檬酸的剂量选择范围在终浓度1mm-5mm之间。溶剂混合物的组合包括试剂盒的开发。溶剂处理蛋白混合物反应平衡的条件可适当调整,即在20-30℃震荡20-40min或在30-40℃震荡10-20min以达到蛋白溶液中部分蛋白变性的目的;优选,反应平衡的条件为37℃,800rpm震荡20min。
蛋白丰度的检测包括在可溶性蛋白部分(上清部分)或沉淀部分进行检测,或者两部分同时检测。检测溶剂混合物处理后的配体组与对照组中蛋白丰度的方法包括免疫印迹和定量蛋白组学技术,但不局限于以上这两种方法。定量蛋白组学技术中肽段的标记方式包括无标记定量和/标记定量;其中标记定量的方法包括二甲基标记、tmt或itraq等多重同位素标记方法中的一种或二种。
本发明具有如下优点:
1.在配体靶标蛋白识别和鉴定方面特异性高,通量高。该方法不需要对配体进行修饰,克服传统化学蛋白组筛选靶蛋白存在的困难,包括药物固定或修饰后改变了药物本身的性质和生物膜通透性,导致鉴定的靶蛋白假阳性高,不能应用于弱相互作用的药物靶蛋白的筛选等问题。在某些实施例中,利用sip方法对mtx的已知靶标蛋白dhfr进行筛选,不仅筛选到dhfr具有显著的稳定性变化,而且该蛋白的稳定性变化具有最高的排名。此外,sip方法的高通量特性不仅可以识别与测试配体结合的理想靶标,还可以在蛋白组规模识别与配体相互作用的脱靶蛋白。在实施例5中,除了鉴定到格尔德霉素的已知热休克90家族蛋白,还鉴定到线粒体呼吸链中复合物i的亚基ndufv1,该蛋白为格尔德霉素的脱靶蛋白。
2.能够评估配体与已知和未知靶标蛋白之间的亲和力。在实施例6、13和14中,利用sip方法准确评估了mtx与已知靶标蛋白dhfr以及格尔德霉素和hsp90ab1之间的亲和力,均与已知的亲和力近似。另外,利用sip方法评估了格尔德霉素和本发明方法筛选出来的脱靶蛋白ndufv1之间的亲和力。sip方法具有评估配体与靶标蛋白相互作用亲和力的能力,为研究配体的作用机理提供了充足的信息。
3.溶剂的选择范围广。溶剂包括能够使蛋白变性沉淀的有机物或无机物,包括但不局限于有机溶剂、酸性试剂、碱性试剂、金属离子或盐类。并且溶剂可以是上述溶剂中的一种或二种以上组合,但不局限于这些溶剂。
4.与热变性tpp方法鉴定的靶标蛋白具有互补性。savitski等人(science,2014,346,1255784)进行了一项全面的研究,即利用tpp方法筛选广谱激酶抑制剂星孢菌素的靶标。在实施例4和12中,比较了利用sip和tpp方法鉴定到的与星孢菌素结合的蛋白激酶靶标。结果发现一些蛋白激酶在sip和tpp方法中均具有显著的稳定性变化。但是,有一些蛋白激酶仅在sip方法中表现出显著的稳定性变化,而在tpp方法中没有观察到。因此,表明通过不同沉淀方法鉴定的靶标蛋白具有一致性和互补性。
5.应用范围广。该方法可扩展至多种配体,以提供用于筛选配体靶标的无偏和互补工具。该方法能够对例如药物,代谢产物,植物提取物或天然产物,食品添加剂,环境污染物,农业杀虫剂或除草剂,环境剂,金属离子,纳米粒子,肽,蛋白和可能与蛋白相互作用的其他物质进行筛选。该方法为配体靶标的筛选和作用机制的研究提供有力的工具。
附图说明
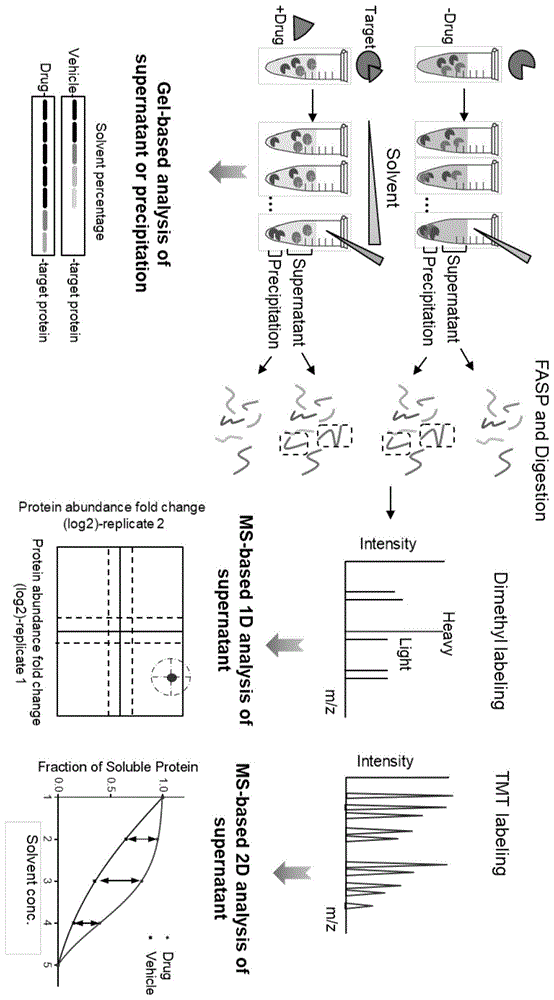
图1为所述基于溶剂诱导蛋白沉淀探测配体与蛋白相互作用或亲和力方法(sip)的流程图。
图2为所述sip方法成功鉴定药物mtx和sns-032的已知靶蛋白。(a)蛋白免疫印迹证实在293t细胞裂解液中mtx稳定dhfr。(b)13%a.e.a.处理样品中dhfr蛋白丰度倍数变化的散点图。(c)15%a.e.a.处理样品中dhfr蛋白丰度倍数变化的散点图。(d)蛋白免疫印迹证实在hela细胞裂解液中sns-032稳定cdk9。(e)12%a.e.a.处理样品中cdk2蛋白丰度倍数变化的散点图。(f)13%a.e.a.处理样品中gsk-3α蛋白丰度倍数变化的散点图。
图3为所述sip方法鉴定广谱激酶抑制剂staurosporine的结合蛋白。(a)15%a.e.a.(b)16%a.e.a.和(c)17%a.e.a.处理星孢菌素样品中蛋白激酶丰度倍数变化的散点图。
图4比较sip与文献中tpp方法(science,2014,346,1255784)鉴定的与星孢菌素直接结合的蛋白激酶。(a)两种方法使用不同的蛋白组学分析流程对总蛋白进行定量。(b)韦恩图显示sip和tpp之间的总蛋白激酶(左)和直接结合蛋白激酶(右)的重叠。(c)比较tip和sip方法共同鉴定到的15个激酶在这两种方法中具有稳定性变化的蛋白激酶。
图5为所述sip方法揭示格尔德霉素潜在脱靶蛋白并通过蛋白免疫印迹技术验证筛选的潜在脱靶蛋白nduvf1。(a)免疫印迹证实在hela细胞裂解液中格尔德霉素稳定hsp90ab1。(b)15%a.e.a.(c)16%a.e.a.(d)17%a.e.a.处理样品中hsp90ab1蛋白丰度倍数变化的散点图。(e)蛋白免疫印迹证实在hela细胞裂解液中格尔德霉素稳定ndufv1蛋白。
图6为所述sip方法评估药物与靶标蛋白相互作用的亲和力。(a)15%a.e.a.处理与不同浓度格尔德霉素孵育的hela裂解液,评估格尔德霉素与靶蛋白hsp90ab1和(b)筛选的脱靶蛋白ndufv1的亲和力。
图7为所述sip方法识别格尔德霉素候选蛋白的go和pathway分析以及格尔德霉素引起肝损伤的原因。(a)格尔德霉素直接和间接结合候选蛋白涉及的生物过程(b)分子功能和(c)细胞组分分析。(d)在线工具reactome分析候选蛋白涉及的通路。(e)格尔德霉素诱导肝毒性的机制可能主要是由于复杂的脱靶,包括线粒体呼吸链病症,ros产生积累,代谢紊乱和肝脏发育受损。叉符号表示sip方法筛选的导致肝损伤相关因素的可能脱靶蛋白。
图8基于酸性试剂的sip方法识别mtx和sns-032的已知靶标。(a)蛋白免疫印迹结果证实vc处理后,在293t细胞裂解液中药物mtx稳定已知靶标蛋白dhfr。基于定量蛋白组学技术在(b)6mm和(c)8mmvc处理的样品中鉴定到mtx能够稳定已知靶标蛋白dhfr。(d)蛋白免疫印迹结果证实ca处理后,在293t细胞裂解液中药物mtx稳定已知靶标蛋白dhfr。基于定量蛋白组学技术在(e)3mm和(f)3.5mmca处理的样品中鉴定到mtx能够稳定已知靶标蛋白dhfr。(g)蛋白免疫印迹结果证实在293t细胞裂解液中药物sns-032稳定已知靶标蛋白cdk9。(h)基于定量蛋白组学技术在3mmca处理的样品中鉴定到sns-032能够稳定另一已知靶标蛋白cdk2。散点图由两次技术重复的lc-ms/ms数据绘制。
图9基于酸性试剂ca的sip方法筛选星孢菌素的靶标蛋白激酶与tpp方法的比较。(a)基于ca的sip方法在293t细胞裂解液中筛选星孢菌素的靶标蛋白激酶,红色圆点代表鉴定到的蛋白激酶。(b)基于酸性试剂ca的sip与tpp方法鉴定星孢菌素诱导的稳定蛋白数量的比较。其中有13个稳定蛋白激酶仅在sip方法中鉴定到而在tpp方法中没有鉴定到。
图10基于酸性试剂ca的sip方法鉴定与星孢菌素结合蛋白激酶的丰度拟合曲线的例子。(a)基于酸性试剂ca的sip和tpp方法共同鉴定星孢菌素诱导的稳定蛋白在5个浓度点丰度曲线变化的例子。(b)仅在基于酸性试剂的sip方法中鉴定而在tpp方法中没有鉴定星孢菌素诱导的稳定蛋白在5个浓度点丰度曲线变化的例子。
图11基于酸性试剂的sip方法评估药物与靶标蛋白之间的亲和力。(a)12mm和15mmvc处理的293t细胞中靶标蛋白dhfr对mtx的剂量依赖分析。(b)12mm和15mmvc处理的293t细胞中靶标蛋白dhfr对mtx的剂量依赖分析。曲线的绘制基于蛋白免疫印迹结果。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
图1表示本发明的实施例提供的基于溶剂诱导蛋白沉淀探测配体与蛋白相互作用或亲和力方法包括以下流程:
将细胞裂解液分别与药物和溶解药物的试剂孵育后,然后加入不同剂量的溶剂诱导蛋白沉淀。以下的实施例1-8采用溶剂混合物a.e.a.(或称之为a.a.a.)(acetone:ethanol:aceticacid/丙酮:乙醇:乙酸=50:50:0.1,v/v/v)作为变性剂沉淀蛋白。实施例9-13采用酸性试剂(抗坏血酸vc和柠檬酸ca)作为变性剂沉淀蛋白。反应平衡的条件为37℃,800rpm震荡20min。蛋白沉淀后,通过离心将可溶性蛋白与聚集的蛋白分离。然后收集加药组与对照组的上清样品用于fasp(基于超滤辅助样品制备)和酶解,肽段标记采用稳定同位素二甲基标记或中子编码的多重标记试剂(tmt10)多重标记。在二甲基标记的样品中,重标标记加药组上清中的肽段,轻标标记对照组上清中的肽段,最后进行蛋白组分析。在二甲基标记的样品中筛选配体结合靶标是通过比较在同一浓度溶剂处理的加药组和对照组中同一蛋白的丰度差异。在一些实施例中,通过lc-ms/ms重复分析所有样品,两次鉴定中定量到蛋白丰度的h/l(重标/轻标)倍数变化比值(log2fc)均大于或等于1定义为配体直接结合蛋白,log2fc均小于或等于-1定义为配体间接结合蛋白。
在tmt10多重标记的样品中,将实验组和对照组的10个标记样品合成为一个样品,然后利用液相进行高ph反相分级成15个馏分进行定量蛋白组学分析。在tmt10多重标记的样品中筛选配体结合靶标是通过比较同一蛋白在加药组和对照组中在5个溶剂浓度点丰度变化的距离之和。无论上述哪一种标记或分析方式,筛选配体靶标蛋白的丰度变化比值或距离之和的阈值不是固定的,理论上阈值卡的越严谨得到候选靶标蛋白的可信度越高。
其中,细胞裂解液的制备方法为:rpmi1640培养基中在加入终体积浓度10%胎牛血清(fbs)(gibco,ny)和终体积浓度1%链霉素(beyond,haimen,china),在37℃,5%co2的条件下培养hela和293t细胞。收获的细胞用0-4℃预冷pbs洗涤3次。随后,加入终体积浓度1%不含edta的蛋白酶抑制剂的pbs(ph7.4),得到细胞悬液。用液氮冷冻细胞悬液,然后用水浴在37℃融化细胞悬液至约融化体积为总体积的60%后,将其转移至冰上继续融化,重复冷冻融化过程三次。在4℃条件下,将细胞悬液以20,000g离心10min,从细胞碎片分离上清液,最终得到293t或hela细胞裂解液。
本发明实施例提供的基于溶剂诱导蛋白沉淀探测配体与蛋白相互作用或亲和力方法具体实施例如下:
实施例1基于溶剂混合物的sip方法对药物甲氨蝶呤(mtx)的已知靶标进行验证
293t细胞裂解液均分为两部分各700μl,一部分加入终浓度100μm的mtx(selleck,houston,tx)作为加药组,另一组加入等体积的dmso作为对照组,室温10rpm旋转孵育20min。将上述加药组和对照组的细胞裂解液分别均分于7个ep管中(每个ep管中100μl),分别向上述加药组和对照组的7个样品中加入新鲜配制的不同百分比的溶剂混合物a.e.a.(终体积浓度9%、11%、13%、15%、16%、17%和18%)沉淀蛋白。在37℃,800rpm反应平衡20min后,细胞裂解液进行离心以分离上清与沉淀蛋白,离心条件为4℃,20,000g离心10min,收集上清液,一部分用于免疫印迹检测,另一部分用于质谱检测。
用于蛋白免疫印记检测的上清液中的蛋白利用凝胶分离,转移到二氟化树脂膜(pvdf)上并利用终体积浓度5%脱脂奶粉封闭后,与一抗dhfr(subway,china)在4℃过夜孵育,然后与山羊抗兔hrp-igg二抗(abcam,uk)于室温孵育1h(一抗和二抗的用量按照生产厂家说明书进行操作)。最后用ecl发光试剂(thermofisherscientific,america)(按照生产厂家说明书进行操作)和fusionfx5化学发光成像系统(vilberinfinit,france)对目标蛋白水平进行检测。另一部分上清液利用过滤辅助样品制备(fasp)技术进行处理。终浓度20mm的二硫苏糖醇(dtt)(sigma-aldrich,usa)和终浓度40mm的碘乙酰胺(iaa)(sigma-aldrich,usa)处理后进行胰酶(sigma-aldrich,usa)酶解(酶/蛋白=1:20,w/w),在37℃条件下酶解16h。用终体积浓度4%ch2o和0.6mnacnbh3(轻标记,l)(sigma-aldrich,usa)标记对照组中的肽段,终体积浓度4%cd2o和0.6mnacnbh3(重标记,h)(sigma-aldrich,usa)标记配体组中的肽段。二甲基标记酶解肽段后,将终体积浓度13%和15%a.e.a.处理的对应加药组和对照组的标记肽段分别对应混合,用c18固相萃取柱(waters,milford,ma)进行除盐。最后,用体积浓度1%fa(甲酸)复溶冻干的样品并利用ultimate3000rslcnano系统和q-exactive-hf质谱仪(thermofisherscientific,america)对酶解肽段进行分析。质量数据由xcalibur软件v2.1.0(thermofisherscientific,waltham,ma,usa)采集处理。数据处理后得到的稳定性变化较大的蛋白认为是药物高可信度的候选靶标蛋白。
基于蛋白免疫印迹表明在高百分比a.e.a.溶液的作用下,与药物mtx结合的已知靶蛋白dhfr相对于配体未结合蛋白表现出更高的稳定性(图2a)。终体积浓度13%和15%a.e.a.处理样品的质谱分析表明在两个标记的样品中均有鉴定到dhfr并且其丰度具有显著的倍数差异,并且最大平均log2fc(h/l标准化比值)几乎达到4(图2b和c),蛋白组学与蛋白免疫印迹结果非常一致。
上述实验结果说明基于溶剂混合物的sip方法成功鉴定药物mtx的已知靶蛋白,能够特异性识别药物的靶标蛋白。
实施例2基于溶剂混合物的sip方法对激酶抑制剂sns-032的已知靶标进行验证
过程和条件同实施例1,与实施例1不同之处在于,用于已知靶标验证的药物是激酶抑制剂sns-032(selleck,houston,tx)。293t细胞裂解液均分为两部分各700μl,一部分加入终浓度100μm的sns-032(selleck,houston,tx)作为加药组,另一组加入等体积的dmso作为对照组,室温10rpm旋转孵育20min。将上述加药组和对照组的细胞裂解液分别均分于7个ep管中(每个ep管中100μl),分别向上述加药组和对照组的7个样品中加入新鲜配制的不同百分比的溶剂混合物a.e.a.(终体积浓度9%、11%、12%、13%、14%、15%和16%)沉淀蛋白。在37℃,800rpm反应平衡20min后,细胞裂解液进行离心以分离上清与沉淀蛋白,离心条件为4℃,20,000g离心10min,收集上清液,一部分用于免疫印迹检测,另一部分用于质谱检测。用于免疫印迹检测的流程与实施例1的不同之处在于一抗抗体为cdk9(subway,china),(抗体的用量按照生产厂家说明书进行操作),用于质谱检测的样品选择终体积浓度12%和13%a.e.a.处理的样品,操作条件同实施例1。
药物sns-032与已知靶蛋白cdk9结合后,在高百分比a.e.a.溶液的作用下,蛋白免疫印迹表明相对于游离cdk9蛋白表现出更高的稳定性(图2d)。终体积浓度12%和13%a.e.a.处理样品的质谱分析表明在两个标记样品中鉴定到sns-032的另外两个已知靶标蛋白cdk2和gsk-3α并且平均log2fc(h/l标准化比值)分别为1.23和1.13(图2e和f),表明已知靶标蛋白的蛋白丰度均大于2倍差异。
上述实验结果说明基于溶剂混合物的sip方法成功鉴定药物sns-032的已知靶蛋白cdk9、cdk2和gsk-3α,能够特异性识别药物的靶标蛋白。
实施例3基于溶剂混合物的sip方法筛选广谱激酶抑制剂星孢菌素(staurosporine)的结合蛋白激酶
基于以上几种药物只对应少数几个已知靶标蛋白,接下来选择了已知具有多个蛋白激酶靶标的抑制剂星孢菌素进行sip方法可行性的验证。293t细胞裂解液均分为两部分各300μl,一部分加入终浓度20μm的星孢菌素(selleck,houston,tx)作为加药组,另一组加入等体积的dmso作为对照组,室温10rpm旋转孵育20min。将上述加药组和对照组的细胞裂解液分别均分于3个ep管中(每个ep管中100μl),分别向上述加药组和对照组的3个样品中加入新鲜配制的不同百分比(终体积浓度15%、16%和17%)的溶剂混合物a.e.a.沉淀蛋白。在37℃,800rpm反应平衡20min后,细胞裂解液进行离心以分离上清与沉淀蛋白,离心条件为4℃,20,000g离心10min,收集上清液用于质谱检测。质谱检测的操作条件同实施例1。
利用蛋白组学技术在终体积浓度15%,16%和17%a.e.a.处理样品中总共鉴定到具有显著稳定性变化的蛋白分别有13、9和5个(直接结合蛋白)。其中,有7,5和4个具有显著稳定性变化的蛋白是激酶,激酶靶标命中率分别为58%,55%和80%(图3a,b和c)。虽然所有定量蛋白中激酶的百分比仅占5.14%,4.92%和4.98%,但鉴定的显著稳定性变化激酶的高百分比表明sip方法的高可靠性。stk4激酶在所有三个不同百分比a.e.a.处理的样品中均有鉴定到。在三个样品中重复鉴定两次的激酶如sik,kcc2d,stk10和phkg2。
上述实验结果说明基于溶剂混合物的sip方法能够在复杂的样品中筛选到星孢菌素广谱激酶抑制剂的靶标蛋白,而且具有较高的激酶靶标命中率。因此,基于溶剂混合物的sip方法在筛选靶标蛋白方面具有较高的特异性。
实施例4基于星孢菌素比较基于溶剂混合物的sip方法和tpp方法的一致性和互补性
本实施例的操作过程和条件同实施例3。savitski等人利用tpp方法对星孢菌素的靶标蛋白进行了系统的研究。在tpp方法中,使用中子编码的多重标记试剂(tmt10)标记10个不同温度的样品,并使用二维(2d)rp-rplcms/ms进行了分析,从而定量了7677种蛋白(图4a)。总体而言,利用tpp方法共鉴定到260个蛋白激酶,根据溶解曲线的热稳定性变化最终确定其中51个(19.62%)是靶标蛋白(图4b)。在本实施例中,分别对三个不同溶剂浓度处理的对应的对照组和加药组样品进行二甲基标记和1drplcms/ms分析,仅对1854种蛋白进行了定量(图4a)。由于较低的蛋白组覆盖率,本实施例仅定量到19个蛋白激酶。其中,发现47.37%(9/19)的蛋白激酶在结合药物后通过了我们的靶标筛选标准(图4b)。由于tpp方法中的蛋白组覆盖率很高,因此在260个蛋白激酶中包含sip方法鉴定的15个蛋白激酶(图4b,左)。由于在这两种方法中均定量了这15个蛋白激酶,因此有兴趣观察在这两种方法中这些蛋白激酶是否均被药物稳定。结果发现只有5个蛋白激酶在tpp和sip中均具有显著的稳定变化(图4c)。sip方法鉴定并筛选到包括sik,kcc2d,stk10和kkcc1在内的4个蛋白激酶,但在tpp方法中这些蛋白没有表现出明显的热稳定性变化。并且仅在tpp方法中没有发现其他具有显著稳定变化的蛋白激酶(图4c)。结果表明不同的沉淀方法,除了鉴定共同的靶标蛋白以外,还有一部分候选蛋白是彼此互补的。
上述结果说明基于溶剂混合物的sip方法和tpp方法在配体靶标蛋白识别方面具有一致性和互补性。
实施例5基于溶剂混合物的sip方法筛选并验证格尔德霉素(geldanamycin)的脱靶蛋白
hela细胞裂解液均分为两部分各700μl,一部分加入终浓度100μm的格尔德霉素(selleck,houston,tx)作为加药组,另一组加入等体积的dmso作为对照组,室温10rpm旋转孵育20min。将上述加药组和对照组的细胞裂解液分别均分于7个ep管中(每个ep管中100μl),分别向上述加药组和对照组的3个样品中加入新鲜配制的不同百分比(终体积浓度9%、12%、13%、14%、15%和16%)的溶剂混合物a.e.a.沉淀蛋白。在37℃,800rpm反应平衡20min后,细胞裂解液进行离心以分离上清与沉淀蛋白,离心条件为4℃,20,000g离心10min,收集上清液用于质谱检测。用于免疫印迹检测的流程与实施例1的不同之处在于抗体为hsp90ab1和ndufv1(proteintech,chicago,il)(抗体的用量按照生产厂家说明书进行操作),用于质谱检测的样品选择终体积浓度15%,16%和17%a.e.a.处理的样品,操作条件同实施例1。
当a.e.a.百分比从终体积浓度15%增加到17%,已知靶蛋白hsp90ab1开始沉淀。与药物结合的hsp90ab1对溶剂诱导的沉淀具有更强的耐受性(图5a)。终体积浓度15%,16%和17%a.e.a.处理的样品质谱分析鉴定到hsp90家族的三个已知靶标蛋白(图5b,5c和5d)。在不同百分比a.e.a.处理的三个样品中重复鉴定到hsp90aa1,并且三种已知蛋白靶标主要集中在16%a.e.a.的样品中(图5c)。此外,重复鉴定到hsp90家族其它蛋白如hsp90ab2p和hsp90ab4p,并首次鉴定了几个潜在的脱靶蛋白,包括nadh脱氢酶亚基ndufv1和ndufab1(图5d)。基于蛋白免疫印迹表明在终体积浓度12%a.e.a.处游离ndufv1蛋白丰度显着降低,然而即使在最高百分比(17%)a.e.a.处,与格尔德霉素结合的ndufv1蛋白丰度依然保持恒定(图5e)。
上述结果表明ndufv1是格尔德霉素的高可信度脱靶蛋白。因此,基于溶剂混合物的sip方法能够筛选高可信度配体未知结合蛋白。
实施例6基于溶剂混合物的sip方法评估格尔德霉素与已知结合蛋白hsp90ab1的亲和力
在药物与靶标蛋白相互作用亲和力检测中,hela裂解液与不同浓度格尔德霉素(101、100、10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8和10-9μm)在室温10rpm旋转孵育20min,然后用终体积浓度15%a.e.a.处理,在37℃,800rpm反应平衡20min后,细胞裂解液进行离心以分离上清与沉淀蛋白,离心条件为4℃,20,000g离心10min,收集上清液,用于蛋白免疫印迹检测。用于免疫印迹检测的操作和条件同实施例1,不同之处在于所用的一抗抗体为hsp90ab1(proteintech,chicago,il)(抗体的用量按照生产厂家说明书进行操作)。
结果表明,hsp90ab1的丰度明显从1μm的浓度开始降低(图6a)。格尔德霉素结合hsp90ab1复合物的半饱和中点在1μm和10μm浓度之间,并且在10μm浓度时格尔德霉素完全占据hsp90ab1蛋白(图6a)。
上述结果表明基于溶剂混合物的sip方法确定了格尔德霉素和已知靶标蛋白hsp90ab1之间的亲和力(结合强度)。因此,基于溶剂混合物的sip方法能够确定配体与已知结合蛋白的亲和力。
实施例7基于溶剂混合物的sip方法用于评估格尔德霉素与候选结合蛋白ndufv1的亲和力
过程和条件同实施例6,与实施例6不同之处在于,格尔德霉素的系列浓度为102、101、100、10-1、10-2、10-3、10-4、10-5、10-6、10-7和10-8μm;所用的一抗抗体为ndufv1(proteintech,chicago,il)(抗体的用量按照生产厂家说明书进行操作)。
蛋白免疫印迹结果证实,格尔德霉素候选靶蛋白ndufv1的半饱和中点在10μm至100μm之间。当格尔德霉素浓度达到100μm时,ndufv1蛋白达到饱和,其亲和力是格尔德霉素与已知靶标蛋白hsp90ab1的10倍(图6b)。
上述结果确定了格尔德霉素和ndufv1之间的亲和力。因此,基于溶剂混合物的sip方法能够确定配体和未知靶蛋白之间的亲和力。
实施例8格尔德霉素脱靶蛋白的go和pathways分析
本实施例的操作过程和条件同实施例5。格尔德霉素是热休克蛋白90(hsp90)的有效抑制剂,然而,由于格尔德霉素导致严重的肝毒性等副作用,其已从临床试验中撤出。基于定量蛋白组学鉴定到的直接和间接靶标蛋白的go和pathway分析(图7a、b、c和d),结果表明格尔德霉素诱导肝毒性的原因可能归结为复杂的脱靶,涉及线粒体呼吸链紊乱,氧化还原过程,ros积累,代谢紊乱和肝脏发育损伤(图7e)。
上述数据表明,格尔德霉素诱导的肝毒性可能是由于复杂的脱靶效应引起的。因此,应用sip构建的药物靶标空间可以揭示预期的靶标蛋白和引起副作用的未知结合蛋白。
实施例9基于酸性试剂vc的sip方法对药物mtx的已知靶标进行验证
293t细胞裂解液均分为两部分各700μl,一部分加入终浓度100μm的mtx(selleck,houston,tx)作为加药组,另一组加入等体积的dmso作为对照组,室温10rpm旋转孵育20min,用系列不同浓度的vc(1mm,2mm,4mm,6mm,8mm,10mm和12mm)进行处理,在37℃,800rpm反应平衡20min后,细胞裂解液通过离心分离上清和沉淀,离心条件为4℃,20,000g离心10min,收集上清液用于蛋白免疫印迹和定量蛋白组学分析。用于免疫印迹检测的流程同实施例1,用于质谱检测的样品选择6mm和8mmvc处理的样品,操作条件同实施例1。
基于蛋白免疫印迹结果表明在上清中相对于对照组,在6mm以上的vc浓度处理后,mtx的靶蛋白dhfr相对于对照组丰度更高,证实与mtx结合的靶蛋白dhfr具有更高的稳定性(图8a)。然后对6mm和8mmvc处理的样品进行酶解、二甲基标记和lc-ms/ms分析,基于一维的蛋白组学结果表明在这两个样品中均鉴定到丰度具有显著差异倍数的靶蛋白dhfr,并且是唯一具有显著性变化的蛋白。随着加入vc浓度的升高,靶蛋白表达水平差异倍数逐渐增大,其平均log2fc分别为1.21和2.76(图8b和8c),表明药物结合诱导了蛋白的稳定。
上述结果表明,基于酸性试剂vc的sip方法成功鉴定药物mtx的已知靶蛋白dhfr。因此,基于酸性试剂vc的sip方法能够鉴定配体与靶标蛋白的相互作用。
实施例10基于酸性试剂ca的sip方法对药物mtx的已知靶标进行验证
293t细胞裂解液均分为两部分各700μl,一部分加入终浓度100μm的mtx(selleck,houston,tx)作为加药组,另一组加入等体积的dmso作为对照组,室温10rpm旋转孵育20min,用系列不同浓度的ca(1mm,2mm,3mm,3.5mm,4mm,4.5mm和5mm)进行处理,在37℃,800rpm反应平衡20min后,细胞裂解液通过离心分离上清和沉淀,离心条件为4℃,20,000g离心10min,收集上清液用于蛋白免疫印迹和定量蛋白组学分析。用于免疫印迹检测的流程同实施例1,用于质谱检测的样品选择3mm和3.5mmca处理的样品,操作条件同实施例1。
基于蛋白免疫印迹结果表明在一系列ca浓度作用下,与mtx结合的靶蛋白dhfr相对于对照组表达量更高,尤其在4mm以上的ca浓度处理后,对照组上清中的蛋白表达量已经检测不到,但在药物组中的dhfr依然保持较高的表达水平(图8d)。然后对3mm和3.5mmca处理的样品进行一维定量蛋白组学检测,结果表明在这两个样品中均鉴定到表达水平具有显著差异倍数的靶蛋白dhfr。随着加入ca浓度的升高,靶蛋白表达水平差异倍数逐渐增大,其平均log2fc(h/l归一化比)分别为1.60和2.80(图8e和8f)。另外,有趣的是,在3.5mmca处理的样品中,发现mtx的另一个已知靶标人胸苷酸合成酶(tyms)也表现出明显的稳定性变化。tyms是细胞中的代谢产物,意味着细胞在体外粗提后,蛋白仍然具有一定活性并存在代谢作用。
上述结果表明,基于酸性试剂ca的sip方法成功鉴定药物mtx的已知靶蛋白dhfr和tyms。因此,基于酸性试剂ca的sip方法能够鉴定配体与靶标蛋白的相互作用。
实施例10基于酸性试剂ca的sip方法筛选广谱激酶抑制剂星孢菌素的结合蛋白激酶
接下来选择了已知具有多个蛋白激酶靶标的抑制剂星孢菌素并结合基于tmt标记的定量蛋白组学技术对基于ca的sip方法进行进一步评估。293t细胞裂解液均分为两部分各700μl,一部分加入终浓度20μm的星孢菌素(selleck,houston,tx)作为加药组,另一组加入等体积的dmso作为对照组,室温旋转孵育20min后,用不同浓度的ca(2.5mm,3mm,3.5mm,4mm和5mm)进行处理,在37℃,800rpm反应平衡20min后,细胞裂解液通过离心分离上清和沉淀,离心条件为4℃,20,000g离心10min,收集上清液。将加药组和对照组5个浓度点处理的样品酶解后,对所得的肽段进行tmt10(thermofisherscientific,america)标记。实验组和对照组的10个样品按照标记肽段:试剂=1:4(w/w)进行标记,于25℃,1000rpm震荡反应1h。然后用5%羟胺(sigma-aldrich,usa)进行终止反应,于25℃,1000rpm震荡反应20min。将实验组或和对照组的10个标记样品各混合成为一个样品,然后利用液相进行高ph反相分级成15个馏分。最后进行定量蛋白组学分析。
每个浓度点对照组和实验组的蛋白丰度采用中值进行归一化后,将每个浓度点加药组和对照组蛋白的丰度除以对照组最低浓度2.5mmca处理样品中的蛋白丰度即得到5个浓度点对应加药组和对照组中蛋白的相对丰度。然后将每个浓度点对应的加药组中蛋白相对丰度减去对照组中蛋白的相对丰度,最后将这5个浓度点得到的蛋白相对丰度差值进行相加即得到在不同剂量溶剂处理下上清或沉淀中结合蛋白和未结合蛋白丰度变化的距离之和。筛选配体靶标蛋白距离之和的阈值是随着配体的不同而调整的。从图9a中可以明显看到具有较大距离之和的蛋白几乎都是蛋白激酶,占有很高的比例。
上述结果表明基于酸性试剂ca的sip方法对星孢菌素靶标的识别具有较高的蛋白激酶命中率。因此,基于酸性试剂ca的sip方法在筛选靶标蛋白方面具有较高的特异性。
实施例11不同的筛选阈值对候选星孢菌素结合蛋白的影响
本实施例的操作过程和条件同实施例10。在本实施例中,首先筛选标准定义为当两次质谱定量到的蛋白距离之和大于或等于0.5时为配体直接结合蛋白,当蛋白的距离之和小于或等于-0.5时为配体间接结合蛋白。直接蛋白和间接蛋白的总和作为星孢菌素总的候选结合蛋白。按照上述筛选标准总共鉴定到53个候选结合蛋白,其中36个是蛋白激酶,17个是非蛋白激酶(图9b)。非蛋白激酶占总的候选结合蛋白的比例为32%。
在本实施例中,筛选标准定义为当两次质谱定量到的蛋白距离之和大于或等于0.7时为配体直接结合蛋白,当蛋白的距离之和小于或等于-0.7时为配体间接结合蛋白。直接蛋白和间接蛋白的总和作为星孢菌素总的候选结合蛋白。按照上述筛选标准总共鉴定到33个候选结合蛋白,其中29个是蛋白激酶,4个是非蛋白激酶(图9b)。非蛋白激酶占总的候选结合蛋白的比例为12%。
上述结果表明阈值卡的越严谨得到候选靶标蛋白的可信度越高。
实施例12基于星孢菌素比较基于酸性试剂ca的sip方法和tpp方法的一致性和互补性
本实施例的操作过程和条件同实施例10。为了比较方法之间在鉴定靶标蛋白方面的差异性,将酸性试剂ca的sip方法筛选激酶抑制剂的蛋白激酶靶标与tpp方法进行了比较。在本实施例中,筛选标准定义为当两次质谱定量到的蛋白距离之和大于或等于0.7时为配体直接结合蛋白,当蛋白的距离之和小于或等于-0.7时为配体间接结合蛋白。直接蛋白和间接蛋白的总和作为星孢菌素总的候选结合蛋白。经过筛选得到33个候选蛋白,而tpp方法鉴定60个蛋白,其原因是鉴定蛋白覆盖率的差异。在sip方法中,两次质谱技术重复中在5个浓度点共同鉴定到3636个蛋白,其中有103个为蛋白激酶,而tpp方法总共鉴定7677个蛋白,其中蛋白激酶为260个。我们基于酸性试剂的sip与tpp方法鉴定型孢菌素诱导的稳定蛋白数量的比较。基于酸性试剂的sip与tpp方法共同鉴定到19个星孢菌素诱导稳定的蛋白,其中17个为蛋白激酶如gsk3-β、cdk2和aak1等(图9c和图10a)。其中有14个蛋白仅在sip方法中鉴定到而在tpp方法中没有鉴定到,其中包括12个蛋白激酶如camk1、cdk1和check1等(图9c和10b)。
上述结果表明基于酸性试剂ca的sip方法和tpp方法鉴定的配体靶标蛋白具有一致性和互补性
实施例13基于酸性试剂vc的sip方法评估mtx与已知结合蛋白dhfr的亲和力
为了评估基于酸性试剂的sip方法是否能应用于药物与靶标蛋白亲和力的测定,我们利用mtx和已知靶标蛋白dhfr进行药物剂量依赖分析实验。首先,利用vc作为变性试剂测定mtx与dhfr的亲和力。将293t细胞裂解液与不同浓度的mtx在室温10rpm旋转孵育20min,然后分别用12mm和15mm的vc变性沉淀蛋白,在37℃,800rpm反应平衡20min后,细胞裂解液进行离心以分离上清与沉淀蛋白,离心条件为4℃,20,000g离心10min,收集上清液,用于蛋白免疫印迹检测。用于免疫印迹检测的操作和条件同实施例1。
结果显示mtx靶蛋白dhfr的相对条带强度随着药物剂量的升高而呈现上升趋势,并且dhfr的丰度明显从10μm(10-8m)浓度开始降低(图11a)。剂量依赖反应曲线表明mtx结合dhfr复合物的半饱和中点位于10μm附近,并且在100μm浓度附近时mtx完全占据dhfr蛋白达到饱和状态(最大稳定状态),该结果与mtx对dhfr的已知ec50基本吻合(图11a)。
上述结果表明,基于酸性试剂vc的sip方法能够评估mtx和dhfr之间的亲和力。因此,基于酸性试剂vc的sip方法能够确定配体与靶标蛋白的亲和力。
实施例14基于酸性ca的sip方法评估mtx与已知结合蛋白dhfr的亲和力
与实施例12不同之处在于采用4mm和5mm的柠檬酸ca作为变性试剂测定mtx与已知靶标蛋白dhfr的亲和力。
基于蛋白免疫印迹的结果表明mtx靶标蛋白dhfr的半饱和中点在10μm附近(图11b)。当mtx浓度达到100μm附近时,dhfr蛋白达到饱和,这与mtx已知的ec50近似。
上述结果表明,基于酸性试剂ca的sip方法能够评估mtx和dhfr之间的亲和力。因此,基于酸性试剂的sip方法能够确定药物与相互作用靶标蛋白的亲和力。
- 还没有人留言评论。精彩留言会获得点赞!