一种细胞原位单个囊泡内含物的检测装置及其检测方法与流程
本发明属于生物技术及医学检测技术领域,具体涉及一种细胞原位单个囊泡内含物的检测装置及其检测方法。
背景技术:
流式细胞术是当今最常见的对单个细胞及其他生物粒子进行多参数、快速定量分析的方法之一,具有速度快、精度高、准确性好等特点,但该技术仅适用于微米级的细胞或者其他待分选颗粒,而无法对纳米级的囊泡(如突触囊泡、外泌体等)进行分离和分析。
目前,针对囊泡内含物进行检测的方法主要基于体外分离和裂解检测原理,并已应用于脂质体、嗜铬细胞、pc12细胞及儿茶酚胺能神经元等的囊泡内含物的定量检测(omiateketal.,2009,2010,2013)。然而,体外分离囊泡的过程容易引起损伤从而导致部分递质的流失,利用化学物质裂解囊泡膜的方法也很容易因为内含物的扩散丢失而导致检测结果被低估。
随后,dunevall等人发现在直径约33μm的圆盘碳电极上施加一定电压,可以吸附和捕捉游离囊泡,并在接触瞬间击破囊泡膜,使得其包裹的递质得以流出并与碳电极发生氧化还原反应,从而记录到电化学电流(dunevalletal.,2015;lietal.,2018)。该方法一定程度上避免了药物裂解过程中囊泡内含物的扩散丢失。但是,这一方法仍无法解决体外分离囊泡的机械损伤致内含物泄露等问题。
在此基础上,li等人又创新性地将直径为50-100nm的超微碳纤电极直接刺入pc12细胞内(lietal.,2015),同样可以记录到单个囊泡破裂后递质与电极间的电化学信号。该方法在一定程度上弥补了上述缺陷,是现有的相关技术中具有更高精确度的重要方法。然而,该方法采用极细的碳纤电极直接刺入细胞,在技术和应用方面仍然存在诸多难题:1,刺入式记录模式主要应用于培养的体积较大的细胞,这就意味着在更接近生理状态的脑片水平或者在体条件下很难实现相关的电化学记录。2,刺入式记录模式要求碳纤尖端极细从而限制了涂层修饰的应用。因此,该方法仅适用于个别可直接与碳纤电极发生反应的(电化学活性较高的)递质的检验,而对于其他神经递质如谷氨酸等,需要对碳纤电极进行特异性酶涂层修饰后才能实现电化学检测的成分,刺入式记录模式是很难实现的。3,刺入式记录模式在检测单个囊泡所含递质量的同时,无法有效检测细胞基质中游离神经递质的浓度。
因此,为了实现在脑片及在体水平上更精准得检验细胞原位单个囊泡内含物的检验,亟需找到更加行之有效的检测装置和检测方法。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种细胞原位单个囊泡内含物的检测装置及其检测方法。所述检测装置用于细胞原位单个囊泡内含物的检测,该检测方法可实现高灵敏度、高特异性的囊泡内含物的检测。
为达此目的,本发明采用以下技术方案:
第一方面,本发明提供一种细胞原位单个囊泡内含物的检测装置,所述检测装置包括:光学显微镜、微操纵仪、计算机工作站、ad/da转换器、膜片钳放大器、红外相机和电化学电极系统;所述电化学电极系统包括:碳纤电极、玻璃微电极、参比电极、电解液和推进器。
本发明所述检测装置,将电生理和电化学技术相结合,该装置可以用于在更接近生理状态的脑片组织上进行单个囊泡所含成分的检验,即利用基本的电生理膜片钳技术,借助玻璃微电极对突触终末进行全细胞钳制,同时以通过玻璃微电极内嵌的碳纤电极为核心的电化学系统对囊泡内的神经递质进行检测。本发明所述装置操作方法简单,应用范围更广,在单个囊泡水平上,为神经递质的定性和定量研究提供了一种直接且高时间、空间分辨率的检测。
其中,显微镜为正置显微镜,用于观察神经元细胞;微操纵仪,用于前后左右上下精确调控放大器探头及其所连接电极的位置;计算机工作站用于收集成像数据和电化学数据的记录;ad/da转换器,用于数字信号和模拟信号之间的转换,并且给予膜片钳放大器信号以及接受来自膜片钳放大器的信号;膜片钳放大器,用于收集电化学实验中的信号;红外相机,用于收集成像结果输入到电脑里。
优选地,所述光学显微镜为正置显微镜,所述光学显微镜的物镜为40×/1.00w水潜镜或60×/1.00w水潜镜。
其中,“40”、“60”指的是物镜的倍率,“1.00”指的是物镜的数值孔径,“w”为water,即为水潜镜。
优选地,所述光学显微镜采用微分干涉对比dic偏振片。
优选地,所述膜片钳放大器为hekaepc10膜片钳放大器。
优选地,所述光学显微镜、所述微操纵仪的机箱、所述膜片钳放大器和所述红外相机的外壳均做接地处理。
优选地,所述碳纤电极的尖端的裸碳长度为1-200μm,例如可以是1μm、5μm、10μm、15μm、20μm、25μm、30μm、40μm、60μm、80μm、100μm、120μm、140μm、160μm、180μm、200μm等。
优选地,所述碳纤电极的尖端的初始直径范围为5-10μm,例如可以是5μm、6μm、7μm、8μm、9μm、10μm等。
优选地,所述碳纤电极的尖端经蚀刻加工后形成锥形或圆柱形后,尖端直径范围为50-1000nm,例如可以是50nm、60nm、80nm、100nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1000nm等。
在本发明中,所述“蚀刻加工”具体步骤参考专利zl201610680442.4。
优选地,所述碳纤电极的尾端与推进器相连接,并固定于所述膜片钳放大器的探头。
优选地,所述玻璃微电极采用具有抗电磁干扰性能的厚壁玻璃材料。
在本发明中,“具有抗电磁干扰性能的厚壁玻璃材料”包括但不限于硼硅酸盐玻璃电极、铝硅酸盐玻璃电极等。
优选地,所述玻璃微电极的外径为2-5mm,例如可以是2mm、2.5mm、3mm、3.5mm、4mm、4.5mm、5mm等,内径为1-4mm,例如可以是1mm、1.5mm、2mm、2.5mm、3mm、3.5mm、4mm等。
优选地,所述玻璃微电极的尖端开口的内径范围为0.1-5μm,例如可以是0.1μm、0.5μm、1μm、1.5μm、2μm、2.5μm、3μm、3.5μm、4μm、4.5μm、5μm等。
优选地,所述参比电极的材质为金属细丝,优选为氯化银-银丝参比电极。
所述电解液的渗透压范围在250-350mosm,例如可以是250mosm、260mosm、270mosm、280mosm、290mosm、300mosm、310mosm、320mosm、330mosm、340mosm、350mosm等。
优选地,所述电解液按质量浓度计包括:120-130mm(例如可以是120mm、122mm、124mm、126mm、128mm、130mm等)葡萄糖酸钾、15-25mm(例如可以是15mm、17mm、20mm、22mm、25mm等)氯化钾、5-15mm(例如可以是5mm、7mm、10mm、12mm、15mm等)hepes,5-15mm(例如可以是5mm、7mm、10mm、12mm、15mm等)磷酸肌酸酐二钠、1-5mm(例如可以是1mm、2mm、3mm、4mm、5mm等)atp-mg、0.1-1mm(例如可以是0.1mm、0.2mm、0.4mm、0.6mm、0.8mm、1mm等)gtp-na和0.1-1mmegta(例如可以是0.1mm、0.2mm、0.4mm、0.6mm、0.8mm、1mm等),溶剂为水。
优选地,所述电解液按质量百分含量计包括:125mm葡萄糖酸钾,20mm氯化钾,10mmhepes,10mm磷酸肌酸酐二钠(na2-creatine),4mmatp-mg,0.3mmgtp-na,0.5mmegta,溶剂为水。
上述配方模仿突触前细胞内液,用于对突触前细胞进行全细胞钳制和电化学记录。
优选地,所述推进器的最大行进距离为1-3cm,例如可以是1cm、1.5cm、2cm、2.5cm、3cm等,行进精度为1-1000nm,例如可以是1nm、10nm、50nm、100nm、200nm、400nm、600nm、800nm、1000nm等。
所述电化学电极系统中推进器的驱动方式为手动或电动式,该推进器中包含一根金属材质驱动杆,用于驱动碳纤电极移动,同时也是电信号导联装置,用于将碳纤电极所测得的电流传输至记录设备。
第二方面,本发明提供一种细胞原位单个囊泡内含物的检测方法,所述检测方法为:采用如第一方面所述的装置对培养细胞和/或脑片中细胞原位单个囊泡内含物进行检测。
优选地,所述细胞原位单个囊泡内含物的检测方法具体包括以下步骤:
(1)培养细胞或制备脑片;
(2)采用如第一方面所述的装置进行细胞贴附式钳制;
(3)采用如第一方面所述的装置进行全细胞钳制;
(4)采用如第一方面所述的装置进行数据记录。
优选地,步骤(1)中所述脑片的制备方法为:将脑干组织粘贴于切片盘,浸入slicing溶液中,采用切片机进行切割得到脑片。
优选地,所述切割得到脑片为包含mntb区域的100-300μm厚的脑片例如可以是100μm、120μm、140μm、160μm、180μm、200μm、220μm、240μm、260μm、280μm、300μm等。
“mntb区域”指的是medialnucleusofthetrapezoidbody,即斜方体内侧核。
优选地,步骤(1)中所述脑片需置于含有木瓜蛋白酶的bath溶液中进行孵育,有利于消化突触间隙中的蛋白成分,降低细胞及周围组织间的黏附作用,易于在后续实验中剥离神经递质释放面。
优选地,所述的木瓜蛋白酶的浓度为2.0-3.0u/ml,例如可以是2.0u/ml、2.2u/ml、2.4u/ml、2.6u/ml、2.8u/ml、3.0u/ml等。
“bath溶液”指的是用于孵育脑片的人工脑脊液,即目标细胞外溶液。
优选地,所述bath溶液按质量浓度计包括:120-130mm(例如可以是120mm、122mm、124mm、126mm、128mm、130mm等)氯化钠,20-30mm(例如可以是20mm、22mm、24mm、26mm、28mm、30mm等)碳酸氢钠,1-5mm(例如可以是1mm、2mm、3mm、4mm、5mm等)肌醇,1-5mm(例如可以是1mm、2mm、3mm、4mm、5mm等)丙酮酸钠,1-5mm(例如可以是1mm、2mm、3mm、4mm、5mm等)氯化钾,120-130mm(例如可以是120mm、122mm、124mm、126mm、128mm、130mm等)磷酸二氢钠,20-30mm(例如可以是20mm、22mm、24mm、26mm、28mm、30mm等)葡萄糖,1-5mm(例如可以是1mm、2mm、3mm、4mm、5mm等)氯化钙,0.5-2mm(例如可以是0.5mm、1mm、1.5mm、2mm等)氯化镁,溶剂为水。
优选地,所述bath溶液的ph为7-8,例如可以7、7.2、7.4、7.6、7.8、8等。
优选地,所述bath溶液通有95%氧气和5%二氧化碳的二元气。
优选地,所述bath溶液按质量浓度计包括:2.5u/ml的木瓜蛋白酶、125mm氯化钠、25mm碳酸氢钠、3mm肌醇、2mm丙酮酸钠、2.5mm氯化钾、125mm磷酸二氢钠、25mm葡萄糖、2mm氯化钙和1mm氯化镁,溶剂为水,ph为7.4,并通有95%氧气和5%二氧化碳的二元气。
优选地,所述孵育的温度为22-25℃,例如可以是22℃、23℃、24℃、25℃等,所述孵育的时间为5-8min,例如可以是5min、5.5min、6min、6.5min、7min、7.5min、8min等。
优选地,步骤(2)具体为:
(a)采用光学显微镜观察孵育后的脑片,确定合适的calyxofheld突触目标细胞后,将碳纤电极的尖端和参比电极的尖端没入存在于玻璃微电极的尖端的电解液中,形成微型电化学反应池;
(b)通过膜片钳放大器对碳纤电极施加钳制电压后,在持续的电化学电流记录过程中,通过玻璃微电极在calyxofheld突触终末的递质释放面上形成巨阻式封接,形成细胞贴附式记录。
在脑片孵育后,将一张脑片迅速放到显微镜的载玻片上,并用铂金质地的u形金属板上缠绕的细尼龙线压住脑片。用显微镜观察脑片目标区域,首先用低倍镜找到mntb区域,然后用高倍镜观察直到找到合适的calyxofheld突触,准备进行电化学检测。确定目标细胞后,将电化学检测用的碳纤电极及参比电极尖端没入存在于玻璃电极尖端的电解液中,形成微型电化学反应池。首先通过膜片钳放大器给碳纤电极施加钳制电压;然后在持续的电化学电流记录过程中,借助玻璃微电极在calyxofheld突触终末的递质释放面上形成巨阻式封接,形成细胞贴附式(cell-attach)记录模式,此时若碳纤电极尖端离突触前膜上的囊泡释放活性带(activezone)足够近,有可能记录到神经递质释放并与碳纤电极发生氧化还原反应的正向电化学信号。
优选地,步骤(a)中所述观察的具体方法为:先采用所述光学显微镜的低倍镜找到脑片中的mntb区域,再采用所述光学显微镜的高倍镜观察直到找到合适的calyxofheld突触。
优选地,所述合适的calyxofheld突触为小鼠出生后7天脑干mntb区内呈花萼状膨大的突触终末。
优选地,步骤(b)中所述钳制电压为600-900mv,例如可以是600mv、620mv、640mv、680mv、700mv、720mv、740mv、780mv、800mv、850mv、900mv、等,优选为700mv。
优选地,步骤(b)中对碳纤电极施加钳制电压后,还需进行细胞外溶液中基线的记录,对该基线进行记录判断碳纤电极的质量,若基线不平稳,则该碳纤电极无法用于本申请的电化学检中。
优选地,步骤(b)中所述持续的电化学电流记录过程为在持续给与细胞+700mv电压过程记录电化学电流信号15分钟左右。
优选地,步骤(b)中碳纤电极尖端距突触前膜上的囊泡释放活性带为1-2μm(例如可以是1μm、1.2μm、1.4μm、1.6μm、1.8μm、2μm等),记录到神经递质释放并与碳纤电极发生氧化还原反应的正向电化学信号。
优选地,步骤(3)具体为:对钳制的细胞膜进行短促的机械性破坏后,形成全细胞钳制记录。
优选地,步骤(3)具体为:对钳制的细胞膜进行短促的机械性破坏后,形成全细胞钳制记录。
优选地,步骤(3)中所述短促的打破细胞膜操作为利用负压和/或电击。
优选地,步骤(3)中所述机械性破坏为负压破坏,气压幅值为0.1-2.0psi,例如可以是0.1psi、0.2psi、0.4psi、0.6psi、0.8psi、1psi、1.2psi、1.4psi、1.6psi、1.8psi、2.0psi等,时程为0.1-1.0s,例如可以是0.1s、0.2s、0.4s、0.6s、0.8s、1.0s等。
优选地,步骤(3)中所述机械性破坏为电击破坏,电压幅值为0.1-1.0v,例如可以是0.1v、0.2v、0.4v、0.6v、0.8v、1.0v等,时程为0.1-20ms,例如可以是0.1ms、2ms、4ms、6ms、8ms、10ms、12ms、14ms、16ms、18ms、20ms等。
在对钳制的细胞膜进行短促的机械性破坏(break-in)后,由于碳纤电极突然接触到细胞內液中一定浓度的谷氨酸或其他胞内液成分,而导致记录的基线瞬间明显抬升,而随着胞内液被电极内电解液不断稀释,抬升的基线逐渐恢复到原基线水平,此时形成了全细胞(whole-cell)记录模式,而突触终末内的囊泡,会被施加碳纤电极吸附,并迅速撞击到碳纤电极上,当囊泡膜破裂,释放出其内包含的神经递质,即可与碳纤电极发生电化学反应,该信号被实时检测并记录下来。
在本发明所述检测的过程中,脑片始终浸泡在二元气饱和的bath溶液中,以保证其生理活性。
相对于现有技术,本发明具有以下有益效果:
(1)本发明所述检测装置及检测方法不仅可以应用于培养细胞,还可以应用于脑片乃至在体细胞,即凡是能进行全细胞膜片钳记录的细胞,均可使用本发明所述装置及检测方法对细胞原位纳米级囊泡内含物的精准定量检测;
(2)本发明所述检测装置及检测方法突破了对电极尖端粗细的限制,在制备碳纤电极时可以利用不同种类的酶涂层加以修饰,检测对象不再受限于只能直接跟裸碳反应的化学物质,进一步拓展到谷氨酸、乙酰胆碱、gaba等其他电化学活性较弱的物质;
(3)由于检测过程电化学信号时时记录,除击破单个囊泡检测的信号外,细胞内基底液中相应物质浓度也可进行同步检测,在细胞生理状态发生变化时,细胞基质中某些成分(如葡萄糖、谷氨酸等)的浓度可能发生变化,如若修饰碳纤电极酶涂层,可将研究细胞内囊泡内含物的检测,进一步拓展为细胞基质成分在不同生理状态下的动态变化的检测。
附图说明
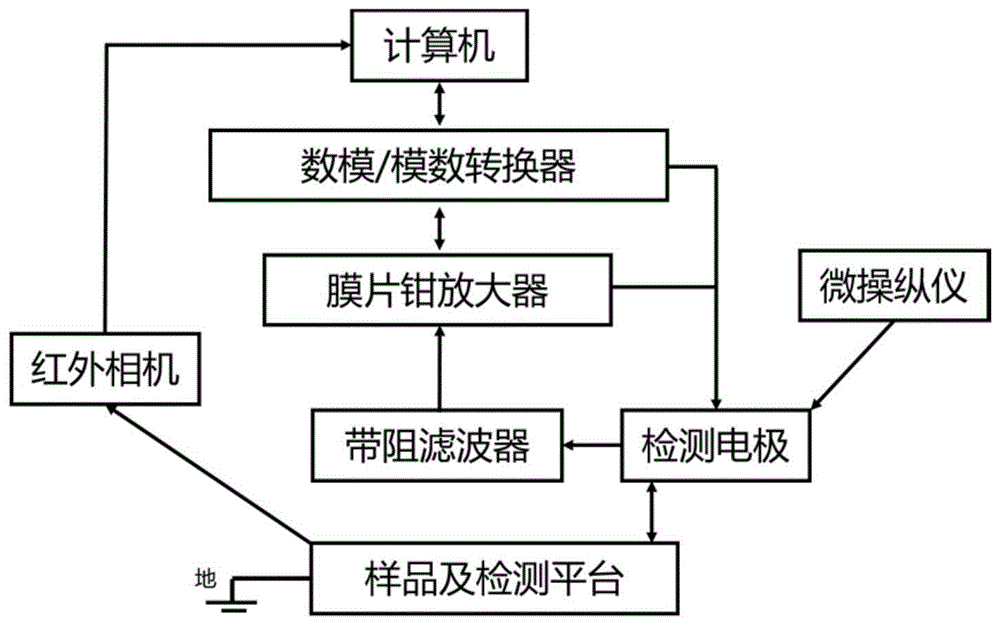
图1为本发明所述细胞原位单个囊泡内含物的检测装置示意图。
图2为本发明所述细胞原位单个囊泡内含物的检测过程的示意图。
图3为低倍镜下观察到的含mntb区域的脑片目标区域及目标细胞。
图4为高倍镜下观察到的含mntb区域的脑片目标区域及目标细胞。
图5为实施例1通过ir/dic显微镜所拍摄的calyxofheld突触以及对突触内囊泡进行电化学检测所用的玻璃电极及碳纤电极图。
图6为实施例1中所记录的电化学信号及单个事件示例图。
图7为实施例1中细胞膜破裂瞬间细胞基质内游离谷氨酸引起的基线抬升及恢复过程图。
图8实施例2中被酶涂层修饰后的电化学电极对谷氨酸敏感性的测试图;
图9为实施例2提供的安培电流差和谷氨酸浓度的线性关系图。
图10实施例2中被酶涂层修饰后的电化学电极对抗坏血酸、尿酸、多巴胺等干扰物的响应测试图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
图1为本发明所述细胞原位单个囊泡内含物的检测装置示意图;其中,计算机与膜片钳放大器的数模/模数转换器连接,负责输出命令与输入信号的记录;用于观察和检测的样品放置在显微镜系统的检测平台上,其形态学特征可以通过显微镜系统的红外相机传入计算机进行观察;检测电极包含玻璃电极(内置碳纤电极),在微操纵仪的控制下,可以到达用于检测的目标区域及目标细胞;检测电极记录到电化学信号通过带阻滤波器后,传回到膜片钳放大器,并通过数模/模数转换器,在计算机中读取。
图2为本发明所述细胞原位单个囊泡内含物的检测过程的示意图。由图2所示,所述检测方法为:通过膜片钳放大器给碳纤电极施加钳制电压,借助玻璃微电极在calyxofheld突触终末的递质释放面上形成巨阻式封接,形成细胞贴附式记录模式后,再在对钳制的细胞膜进行短促的机械性破坏(break-in)后,形成了全细胞(whole-cell)记录模式。
实施例1
本实施例提供一种细胞原位单个囊泡内含物的检测方法,所述检测方法具体包括以下步骤:
(1)制备脑片:
(a)手术器具(包括手术剪、眼科剪单面手术刀、双面刀片、镊子、美工铲、强力胶水、滤纸等)准备好后,将出生后7-9天小鼠麻醉并断头,用手术剪、眼科剪和镊子等解剖小鼠头部,取出脑干,这个过程要每隔5s浸入冰的slicing溶液(所述slicing溶液包括:125mm氯化钠、25mm碳酸氢钠、3mm肌醇、2mm丙酮酸钠、2.5mm氯化钾、1.25mm磷酸二氢钠、25mm葡萄糖、0.1mm氯化钙和3mm氯化镁,所述slicing溶液的ph为7.4,并通有95%氧气和5%二氧化碳的二元气);
(b)将脑干组织粘到切片盘上,在冰的slicing溶液里,用切片机逐层切割脑片,在包含mntb区域收取2-3张200μm厚的脑片;
(c)将收取的含有目标区域的脑片立即转移至含有2mmca2+的bath溶液(所述bath溶液包括:2.5u/ml的木瓜蛋白酶、125mm氯化钠,25mm碳酸氢钠,3mm肌醇,2mm丙酮酸钠,2.5mm氯化钾,125mm磷酸二氢钠,25mm葡萄糖,2mm氯化钙,1mm氯化镁,ph为7.4,并通有95%氧气和5%二氧化碳的二元气)中,在25℃的室温条件下孵育6min。
(2)细胞贴附式钳制:
(a)将一张脑片迅速放到显微镜的载玻片上,并用铂金质地的u形金属板上缠绕的细尼龙线压住脑片;用显微镜观察脑片的目标区域,首先用低倍镜mntb区域,然后用高倍镜观察直到找到合适的calyxofheld突触,准备进行电化学检测;确定目标细胞后,将电化学检测用的碳纤电极及参比电极(氯化银-银丝参比电极)尖端没入存在于玻璃电极尖端的电解液中,形成微型电化学反应池;
所述电解液按质量百分含量计包括:125mm葡萄糖酸钾,20mm氯化钾,10mmhepes,10mm磷酸肌酸酐二钠(na2-creatine),4mmatp-mg,0.3mmgtp-na,0.5mmegta,溶剂为水;
其中,低倍镜下含mntb脑片的目标区域图如图3所示,可以看出靠近腹侧中线的、左右各一的密集细胞群;高倍镜下含mntb脑片的目标区域图如图4所示,可以看到呈花萼状的巨大的突触前结构,突触后神经元胞体略呈球形,直径在10-20μm。
(b)通过膜片钳放大器给碳纤电极施加+700mv的钳制电压,记录一段细胞外溶液中的基线;然后在持续的电化学电流记录过程中,借助玻璃微电极在calyxofheld突触终末的递质释放面上形成巨阻式封接,形成细胞贴附式(cell-attach)记录模式;
其中,图5为实施例1通过ir/dic显微镜所拍摄的calyxofheld突触以及对突触内囊泡进行电化学检测所用的玻璃电极及碳纤电极图。
此时,碳纤电极尖端离突触前膜上的囊泡释放活性带(activezone)足够近(2μm),记录到神经递质释放并与碳纤电极发生氧化还原反应的正向电化学信号,神经递质释放并与碳纤电极发生氧化还原反应的正向电化学信号,如图6所示。
(3)在对钳制的细胞膜进行短促的机械性破坏(break-in)后,形成了全细胞(whole-cell)记录模式;所述短促的打破细胞膜操作为利用负压(气压幅值1.0psi,时程0.5s)。
其中,图7为实施例1中细胞膜破裂瞬间细胞基质内游离谷氨酸引起的基线抬升及恢复过程图,如图7所示,由于碳纤电极突然接触到细胞內液中一定浓度的谷氨酸,而导致记录的基线瞬间明显抬升,而随着胞内液被电极内电解液不断稀释,抬升的基线逐渐恢复到原基线水平;
(4)数据记录:突触终末内的囊泡,会被施加了+700mv的碳纤电极吸附,并迅速撞击到碳纤电极上,当囊泡膜破裂,释放出其内包含的神经递质,即可与碳纤电极发生电化学反应,该信号被时时检测并记录下来;
其中,图6为实施例1中所记录的电化学信号及单个事件示例图,如图6所示,单个囊泡破裂释放内含递质所产生的信号呈单棘状,时程为ms级,信号采集阈值根据实验条件可设定为基线rms的3-5倍。
实施例2
敏感性和抗干扰性测试
本实施例提供一种细胞原位单个囊泡内含物的检测方法,所述碳纤电极利用传统酶基电极结构,含有敏感酶(谷氨酸氧化酶33u/ml)、交联剂1%戊二醛、稳定剂1%小牛血清白蛋白(浓度配比为2:1:1)的酶涂层加以修饰,并通过邻苯二胺作为干扰物隔绝膜,并在碳纤表面电镀铂纳米颗粒以提高对酶反应产生的报告分子的响应。针对不同的递质,通过更换酶的类型和组合,可以起到特异性检测的效果。所述的谷氨酸电化学电极对谷氨酸的线性检测范围为1-156μm(r2=0.998),与脑内谷氨酸浓度变化范围相匹配(如图8和图9所述)。
此外,所述的电化学电极对200μm的抗坏血酸、20μm的尿酸和1μm的多巴胺均无明显响应,而在给与干扰物前后仍对5μm谷氨酸具有显著的响应(如图10所示),证明其可以用于生物样品中的谷氨酸检测。
申请人声明,本发明通过上所述细胞原位单个囊泡内含物的检测装置及其检测方法,但本发明并不局限于上所述实施例,即不意味着本发明必须依赖上所述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!