基于CrIII/CrVI氧化还原电对的高功率氧化还原液流电池及其介导的再生的制作方法
本发明描述了新型氧化还原液流电池系统,其是用于电存储的电化学电池。
背景技术:
氧化还原液流电池(rfb)是二次(可充电)燃料电池和电池-燃料电池混合体(图1)。与传统的电池不同,rfb将系统的能量和功率分离,因而如同燃料电池具有随电活性物质储槽的尺寸而变化的全系统能量和随着电化学反应器的尺寸而变化的系统功率。这种特性使它们对于以低成本存储大量电力是理想的,因为额外的电活性材料通常比大型反应器便宜得多。由于这个原因,rfb目前正在被使用,并进一步开发为大规模电网级电力存储设备(j.powersources2006,160,716-732)。这对于间歇性可再生能源,其为了稳定它们向当前的电网的输出而在给定资源(风能,太阳能)变得暂时不可用时需要备用电源,变得尤其有价值。
已经开发了许多rfb化学,然而它们普遍使用经历1或2次e-还原(n=1或2)和/或具有低到中等溶解度(c最大)的氧化剂,极大地限制了(1)它们的体积能量密度和(2)它们的功率密度。这分别适用于vo2+、ce4+、fe3+(1e–)、br2(2e–)、和o2(4e–)、全钒、zn/ce4+、cr2+/fe3+、h2/br2、和h2/o2rfb中的氧化剂。虽然o2和br2具有较高的n,但它们的c最大值远小于其他物质的那些(0.001和0.2m相比>1m)。与rfb相关的较低能量和功率密度会导致相对于如铅-酸和锂离子电池等竞争技术的非常大的电池尺寸。这种电池的庞大规模造成了不必要的设施,运营和材料成本,以及对电池选址的限制。
因此,存在对于具有显著更高的能量和功率密度的氧化剂的需要。虽然多种其他氧化剂具有较高的n和c最大,如高锰酸盐(mno4-,n=5,c最大=7.3m),但是它们本身性质的多e-反应倾向于是不可逆的,而因此不适用于rfb。许多这样的反应遵循复杂的机制,并导致正极处的沉淀或中毒,随着时间迅速降低电流和功率输出。具有高n和c最大且无污染反应的可逆氧化剂体系在该领域是未知的。
氧化剂cr2o72-因其能量密度参数(n=6,c最大=7.1)与mno4-的那些相似,因此对于rfb的中使用是吸引力的。此外,cr2o72-的扩散系数显著高于vo2+或ce4+(0.96相比0.25和0.36×10-5cm2/s),导致更快的cr2o72-传输和相应更高的功率密度。这些令人印象深刻的高能量和功率密度特性使得研究人员从1841年到1859年开发出了一次(不可充电)zn/cr2o72-电池,然后成为电报的标准电源。
基于cr2o72–至cr3+的还原的rfb已经在例如fr7917793中提出,但是实际上这种系统对于实际使用效率太低。这些rfb通过在多个固态电极催化剂上氧化cr3+而再生cr2o72–,这些电极催化剂都在如此高的超电势下氧化cr3+使得它们导致o2共析出。这种催化剂包括pt-族金属,贫金属氧化物(例如,pbo2)和导电碳材料。cr3+氧化的高超电势导致电压显著损失为热量且电流显著损失为o2析出而非cr2o72–再生,导致系统具有低至负的充电效率。出于这个原因,使用这些固态催化剂氧化cr3+的使用唯一限于能量消耗的(而不是能量储存)工业用途,以在废铬电镀液中再生cr2o72–。事实上,以前提出的使用cr2o72–的rfb的效率如此低,以至于在rfb的现代综述中没有对其讨论,或仅在它们功能较差的背景之下讨论。尽管在过去的67年里的大量努力,但自从zn/cr2o72–一次电池首次发明以来的175年内还没有设计出有效再生cr2o72–的方法。将2cr3+能量高效地6e-氧化成cr2o72–的不可能性如此广泛地为人所接受,以至于现在液流电池研究人员已经设计出经历连续的1e-氧化的低溶解度cr复合物,导致能量密度和由cr2o72–的可用电压都显著减少。
本发明采用已知的高能量、高功率、不可逆还原(放电)的氧化剂cr2o72–,并使其在rfb中可逆地使用。在已知的电极催化剂上cr2o72–还原产物cr3+不可能容易地被氧化(即,充电)。因此,以前使用cr2o72–的电池仅用作一次(不可充电)电池。在本发明中,通过使用由正极(在充电期间)不均匀氧化并且将cr3+均匀地氧化回cr2o72–的电化学可逆的电子介体,使用ec催化机制完成充电循环而克服cr2o72–的不可逆反应。
电子介体已经描述于现有技术中,例如,在wo2013/131838中,其使用了1e-介体ce4+在催化床之间来回穿梭e-(参见
技术实现要素:
和第[0008],[0009]段)。然而,wo2013/131838中提出的解决方案特别需要除ce4+之外的催化剂以进行h2o的4e-氧化或其它化合物的氧化。
此外,本文中证明了cr2o72–可以稳定地还原(放电)延长的时间而没有任何不期望的副反应。相反,具有相似能量和功率密度的氧化剂mno4-的还原导致了mno2的快速沉淀,尤其导致了电极结垢。
发明内容
在第一方面,本发明提供了包含电化学电池的可充电氧化还原液流电池(rfb),电化学电池包括正半电池中的至少一个正电极和在负半电池中的负电极;两个半电池之间的离子传导膜,其中膜设计用于双酸性阳极电解液和阴极电解液,或设计用于酸性阴极电解液和碱性阳极电解液;至少两个用于阴极电解液和阳极电解液的储罐;一个或多个分别使储存的阴极电解液和阳极电解液循环通过阴极和阳极半电池的泵;以及至少一种阳极电解液和至少一种阴极电解液;
其中,
阳极电解液包含至少一种能够可逆的氧化的燃料,至少一种用于导电的电解质和至少一种溶剂;并且
阴极电解液包含criii/crvi氧化还原电对,至少一种用于导电的电解质,至少一种溶剂和至少一种电化学可逆的电子介体;并且进一步地
其中,
所述电子介体能够使用溶液中的ec催化机制将criii均匀地氧化成crvi。
另一方面,本发明还涉及如本文描述的氧化还原液流电池用于电网级能量存储、住房者能量存储、远程位置、间歇性可再生发电场所,优选风力和太阳能发电场的稳固或负载均衡、微型水电、地热能、潮汐能、能源套利、便携和/或个人电子产品、电动交通工具如船舶、潜艇、飞机、无人水下航行器(uuv)或无人机(uav)、军事电子设备、卫星和其他有人或无人航天器,或可以有利地使用可充电rfb的其他应用的储存电能的用途。
本发明的进一步的方面是用于存储电能的方法,包括:
a)使电解质循环通过如本文描述的氧化还原液流电池中的正半电池,
b)向所述氧化还原液流电池的正极提供电流电源,
c)使用由正极不均匀氧化的电化学可逆电子介体将criii均匀氧化成crvi而不同时氧化水。
附图说明
图1:包含(1)阳极电解液储罐;(2)阴极电解液储罐;(3)阳极电解液室;(4)阴极电解液室;(5)阳极;(6)阴极;(7)选择透过性离子传导膜;(8)阳极电解液泵;和(9)阴极电解液泵的氧化还原液流电池的示意图。
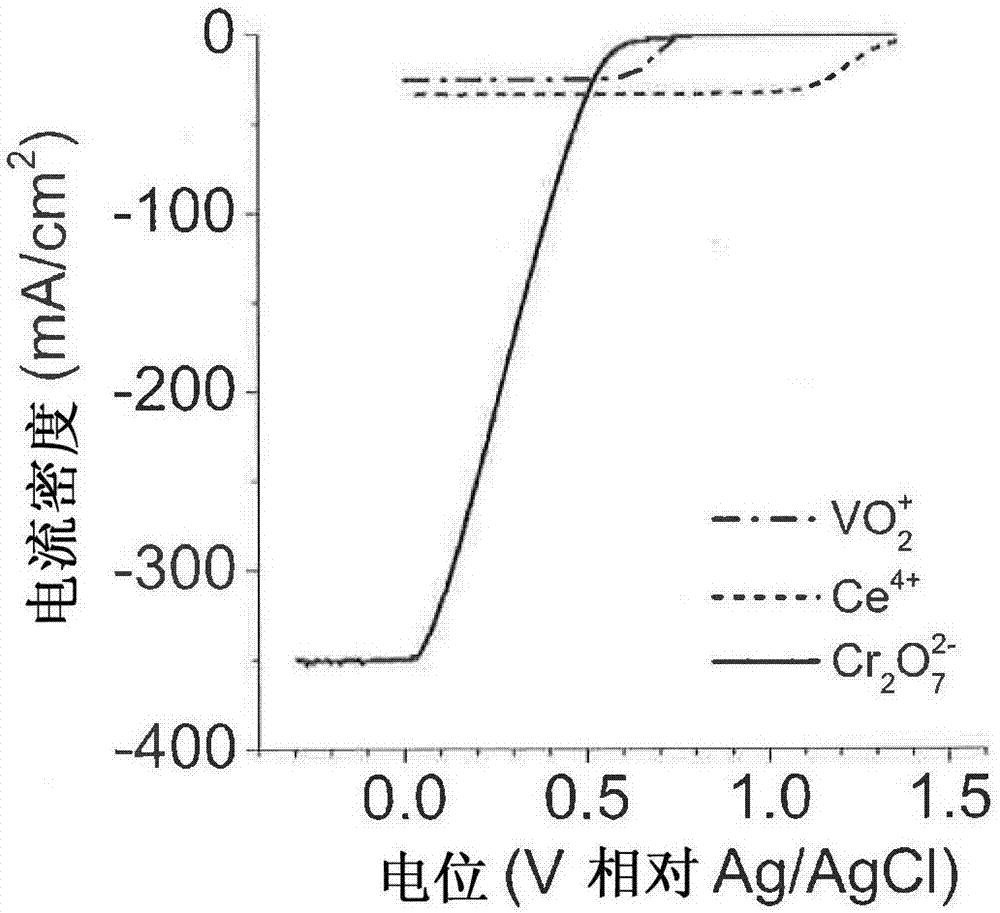
图2:在0.5mh2so4中的au上在1000rpm,50mv/s下的100mmvo2+(点虚线),ce4+(虚线)和cr2o72-(实线)的rde伏安法。
图3:cr2o72-(7.1m),ce4+(2.5m)和vo2+(3m)的饱和溶液的体积容量。
图4:各种cr2o72-催化剂的半波电位(e1/2)的表,取自0.5mh2so4中5mmcr2o72–在3000rpm,50mv/s下的rde伏安法。
图5:(1)5mmcr2o72-和5mmce4+的混合溶液(实线)以及(2)5mmce4+的单物质溶液(点虚线)二者在0.5mh2so4中的au上在50mv/s下的循环伏安法(cv)。
图6:(1)5mmcr2o72-和5mmce4+的混合溶液(实线);(2)5mmce4+(点虚线);(3)5mmcr2o72-(点线);(4)仅电解质(双点虚线);和(5)当将au的背景校正计算在内时5mmcr2o72-和5mmce4+的混合溶液的预期电流(虚线)的循环伏安法(cv),全部在0.5mh2so4中的au上在50mv/s下。
图7:2.5mmcr2o72–和2.5mmce4+的混合溶液的rde伏安法,其显示(1)初始电流(具有三角形的实线);(2)2.5c放电后的电流(虚线);和(3)在2.5c再充电之后的电流(具有圆的实现),全部在0.5mh2so4中的au上在250rpm,50mv/s下。
图8a:在(1)2.5mmce4+(虚线)和(2)2.5mmcr2o72–和2.5mmce4+(实线)的放电期间的计时库仑法,二者都在0.5mh2so4中的au上在4000rpm下。
图8b:2.5mmcr2o72–和2.5mmce4+在0.5mh2so4中的au上在4000rpm下的充电期间的计时库仑法。插图:(1)2.5mmce4+(虚线)以及(2)2.5mmcr2o72–和2.5mmce4+(实线)二者在0.5mh2so4中的au上在4000rpm下的充电期间的对照计时库仑法。
图9:5mmcr2o72–的rde伏安法,显示了0.5mh2so4中的au上在1000rpm,50mv/s下的阳极(实线)和阴极(虚线)扫描。
具体实施方式
以以下一般方式描述了“ec催化机制”(在bard和faulkner的“electrochemicalmethods:fundamentalsandapplications”,2001年第二版中也表示为eci):
其由其中使给定物质a转化为物质b的电化学步骤(以下称为e)组成。此后是物质b和物质c之间的后续化学催化步骤(以下称为c催化),其由b再生物质a并由c产生副产物d。a的再生代表了使得电极表面附近出现a浓度明显增加的催化过程,产生高于对a还原成b预期的电化学电流:
e:a+1e–→b
c催化:b+c→a+d
由于再生的a必须保留于待检测的电极表面,则在(1)a的消耗和再生之间的较短时间段内,和(2)横跨电极的降低的溶液流速下(其减少了传输时间和a离开电极表面的传输速率)检测到高电流。
通过能斯特方程定义参与简化的可逆还原(例如,
其中c氧化和c还原是给定的氧化还原物质(例如,ce4+和ce3+)的氧化和还原形式的相应浓度,n是参与给定氧化还原物质的氧化形式至还原形式的转化的e-数目,r是通用气体常数,t是温度,而f是法拉第常数。术语e0是氧化还原物质的标准电位,当c氧化=c还原时,其是观察到的电位(e)。在本发明的上下文中,能斯特方程表明给定的可逆氧化还原物质的电位取决于溶液中存在的氧化与还原形式的比率而从其e0变化。因此,99:1的ce4+/ce3+的比率会使ce4+的e正向移动0.120v,并且99.96:0.04的比率会使e正向移动0.200v。
在rde伏安法中使用“旋转圆盘电极”rde以实现穿过电极表面的层流。当使用平面rde时,如本文所呈现的结果,rde伏安法允许直接评估用于rfb的给定燃料或氧化剂的多个基本参数。由于rde伏安法评估基本参数,而不是给定的燃料电池或rfb的性能,在所有可能的系统中rde伏安法的结果是普遍可比较的。
rde伏安法中的电化学反应的“传质限制电流”il是在给定的rde旋转速率下的最大可获得电流。由于il是源自跨越rde的层流的稳态传输的函数,il与电位无关,并且在rde伏安图中表现为水平线。
在rde伏安法中的给定电化学反应的半波电位e1/2是达到1/2的il时的电位。在相当低的电流密度下必须进行适当精确的e1/2测量;在分析玻璃器皿中的高电流密度下,溶液电阻会以显著改变e1/2的对角线使rde伏安图变形。为了对高n氧化剂如cr2o72-获得低电流密度,必须使用低浓度(1至10mm)和低至中等的转速(50至3000rpm)。在本发明的上下文中,e1/2适用作给定电极的操作电位的一阶评价,并因此适用作rfb的操作电压。
术语“nhe”和“ag/agcl”是指用于测量电极的e的两种标准类型的参比电极,其中nhe是标准氢电极,而ag/agcl是银/氯化银电极,并且给定的eag/agcl=enhe-0.197v。除非另有说明,否则本节中的所有未参考的电位均表示为v相对于ag/agcl,而非v相对于nhe。
术语储罐是指其中可以储存一种或多种液体和/或气体的容器。液体和/或气体可以通过挡板或其他合适的分隔壁彼此分离。
“烷基”是指仅由碳原子和氢原子构成的不含不饱和度,具有1至10个碳原子的直链或支链烃链基团(例如(c1-10)烷基或c1-10烷基)。无论何时在本文中出现,数字范围如“1至10”是指在给定范围内的每个整数,例如,“1至10个碳原子”是指烷基基团可以由1个碳原子、2个碳原子、3个碳原子等组成,至多包括10个碳原子,尽管该定义也旨在涵盖没有具体指定数值范围的术语“烷基”的出现。典型的烷基包括但不限于,甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基、叔丁基、戊基、异戊基、新戊基、己基、庚基、辛基、壬基和癸基。烷基部分可以通过单键连接到分子的其余部分,如例如甲基(me)、乙基(et)、正丙基(pr)、1-甲基乙基(异丙基)、正丁基、正戊基、1,1-二甲基乙基(叔丁基)和3-甲基己基。除非在说明书中另外具体说明,否则烷基基团可选地被一个或多个独立地是以下基团的取代基取代:烷基、芳基、杂芳基、羟基、卤素、氰基、三氟甲基、三氟甲氧基、硝基、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-oc(o)n(ra)2、-c(o)n(ra)2、-n(ra)c(o)ora、-n(ra)c(o)ra、-n(ra)c(o)n(ra)2、n(ra)c(nra)n(ra)2、-n(ra)s(o)tra(其中t为1或2)、-s(o)tora(其中t为1或2)、-s(o)tn(ra)2(其中t为1或2)或po3(ra)2,其中每个ra独立地是氢、烷基、氟代烷基、芳基或杂芳基。
术语“烷氧基”是指基团-o-烷基,包括通过氧连接至母体结构的1至8个碳原子的直链、支链、环状构型及它们的组合(例如,如上面对于烷基的概述)。实例包括但不限于,甲氧基、乙氧基、丙氧基、异丙氧基、环丙氧基和环己氧基。“低级烷氧基”是指含有一至六个碳的烷氧基。
术语“取代的烷氧基”是指其中烷基成分被取代的烷氧基(即,-o-(取代的烷基))。除非在本说明书中另有说明,否则烷氧基基团的烷基部分可选被一个或多个独立地是以下基团的取代基取代:烷基、杂烷基、烯基、炔基、环烷基、杂环烷基、芳基、芳烷基、杂芳基、杂芳烷基、羟基、卤素基、氰基、三氟甲基、三氟甲氧基、硝基、三甲基硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-oc(o)n(ra)2、-c(o)n(ra)2、-n(ra)c(o)ora、-n(ra)c(o)ra、-n(ra)c(o)n(ra)2、n(ra)c(nra)n(ra)2、-n(ra)s(o)tra(其中t为1或2)、-s(o)tora(其中t为1或2)、-s(o)tn(ra)2其中t为1或2)或po3(ra)2,其中每个ra独立地是氢、氟基、烷基、氟代烷基、芳基或杂芳基。
术语“烷氧基羰基”是指通过羰基碳连接的式(烷氧基)(c=o)-的基团,其中烷氧基基团具有指定数目的碳原子。因此,(c1-6)烷氧基羰基基团是通过其氧连接到羰基连接基上的具有1至6个碳原子的烷氧基基团。“低级烷氧基羰基”是指其中烷氧基基团是低级烷氧基基团的烷氧基羰基基团。
术语“羧基”是指-(c=o)oh基团。
术语“芳烃基”或“芳基”或“ar”是指具有至少一个具有碳环的的共轭π电子体系的具有六至十个环原子的芳族基团(例如,c6-c10芳烃基的或c6-c10芳基)(例如,苯基,芴基和萘基)。由取代的苯衍生物形成并且在环原子上具有自由化合价的二价基团被称为取代的亚苯基基团。通过从具有自由化合价的碳原子上除去一个氢原子而由名称以“-基”结尾的单价多环烃基团衍生的二价基团通过在相应的单价基团的名称中加入“-亚基”而命名,例如,具有两个连接点的萘基基团被称为亚萘基基团。无论在本文中何时出现,数字范围如“6至10”是指给定范围内的每个整数;例如,“6至10个环原子”是指芳基基团可以由6个环原子、7个环原子等组成,最多至包括10个环原子。该术语包括单环或稠环多环(即,共享相邻环原子对的环)基团。除非在本说明书中另有说明,否则芳基部分可选地被一个或多个独立地是以下基团的取代基取代:氟基、烷基、杂烷基、芳基、杂芳基、羟基、卤素基、氰基、三氟甲基、三氟甲氧基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-oc(o)n(ra)2、-c(o)n(ra)2、-n(ra)c(o)ora、-n(ra)c(o)ra、-n(ra)c(o)n(ra)2、n(ra)c(nra)n(ra)2、-n(ra)s(o)tra(其中t为1或2)、-s(o)tora(其中t为1或2)、-s(o)tn(ra)2(其中t为1或2)或po3(ra)2,其中每个ra独立地是氟基、氢、烷基、氟代烷基、芳基或杂芳基。
术语“氟代烷基”是指被一个或多个如上所定义的氟代基团取代的如上所定义的烷基基团,例如三氟甲基、二氟甲基、2,2,2-三氟乙基、1-氟甲基-2-氟乙基等。氟代烷基基团的烷基部分可以如上文关于烷基所定义的可选地取代。
术语“氟代烷氧基”是指被一个或多个如上所定义的氟代基团取代的如上定义的烷氧基,例如三氟甲氧基、二氟甲氧基、2,2,2-三氟乙氧基、1-氟甲基-2-氟乙氧基等。氟代烷氧基基团的烷基部分可以如上文对烷基所定义的可选地取代。
术语“氟代芳基”是指被如上所定义的一个或多个氟代基团取代的如上所定义的芳基或杂芳基基团,例如五氟苯、三氟苯、二氟苯、三氟-1,10-菲咯啉、五氟-2,2'-联吡啶等。
术语“杂烷基”包括可选地取代的烷基基团并具有一个或多个选自不同于碳的原子,例如氧、氮、硫、磷或它们的组合的骨架链原子。可以给出的数值范围,例如c1-c4杂烷基,是指总链长度,在该实例中为4个原子长。杂烷基基团可以被一个或多个独立地是以下基团的取代基取代:烷基、杂烷基、芳基、杂芳基、羟基、卤代基、氰基、硝基、氧基、硫基、三甲基硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-oc(o)n(ra)2、-c(o)n(ra)2、-n(ra)c(o)ora、-n(ra)c(o)ra、-n(ra)c(o)n(ra)2、n(ra)c(nra)n(ra)2、-n(ra)s(o)tra(其中t为1或2)、-s(o)tora(其中t为1或2)、-s(o)tn(ra)2(其中t为1或2)或po3(ra)2,其中每个ra独立地是氟基、氢、烷基、氟代烷基、芳基或杂芳基。
“杂芳基”或“杂芳烃基”或“hetar”是指包含一个或多个选自氮、氧和硫的环杂原子并可以是单环,双环,三环或四环体系的5元至18元的芳族基团(例如,c5-c13杂芳基)。无论在本文中何时出现,数字范围如“5至18”是指在给定范围内的每个整数,例如,“5至18个环原子”是指杂芳基可以由5个环原子、6个环原子等组成,最多至并包括18个环原子。通过从具有自由化合价的原子上除去一个氢原子而由名称以“-基”结尾的单价杂环烃基基团衍生的二价基团通过在相应的单价基团的名称中加入“-亚基”命名,例如,具有两个连接点的吡啶基为亚吡啶基。含n的“杂芳烃基”或“杂芳基”部分是指环的至少一个骨架原子是氮原子的芳族基团。多环杂芳基基团可以是稠合或非稠合的。杂芳基基团中的杂原子可选地氧化。如果存在,一个或多个氮原子可选地季铵化。杂芳基可以通过环的任何原子连接到分子的其余部分。除非在本说明书中另有特别说明,杂芳基部分可选地被一个或多个独立地是以下基团的取代基取代:烷基、杂烷基、芳基、杂芳基、羟基、卤代基、氰基、硝基、氧基、硫基、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-oc(o)n(ra)2、-c(o)n(ra)2、-n(ra)c(o)ora、-n(ra)c(o)ra、-n(ra)c(o)n(ra)2、n(ra)c(nra)n(ra)2、-n(ra)s(o)tra(其中t为1或2)、-s(o)tora(其中t为1或2)、-s(o)tn(ra)2(其中t为1或2)或po3(ra)2,其中每个ra独立地是氟基、氢、烷基、氟代烷基、芳基或杂芳基。
cr2o72–的优越能量密度参数使其成为用于高能量、高功率rfb的理想氧化剂。对于等摩尔溶液,cr2o72–的电流密度分别比vo2+或ce4+的电流密度大14倍和10倍(参见图2),而当比较饱和溶液时cr2o72–具有比vo2+或ce4+大14倍和17倍的的体积容量(参见图3)。虽然na2cr2o7,cr2o72-的钠盐比这两种氧化剂中的任何一种具有更高的溶解度(分别是7.1对比3.0和2.5m),但大部分体积容量的改进归因于cr2o72–的6e-还原,这在本发明人研究的(玻璃碳、au、ag、pt、pd、ni,图4)和现有技术如de914264或fr7917793(pt族金属(也参见ahmedetal.,“electrochemicalchromicacidregenerationprocesswithfuel-cellelectrodeassistance.parti:removalofcontaminants.”j.appl.electrochem.2001,31(12),1381–1387),贫金属氧化物,和其它碳材料)研究的所有正极催化剂上都是不可逆的:
cr2o72–+6e–+14h+→2cr3++7h2o
在水溶液中,cr2o72-以与铬酸盐cro42–的平衡存在,铬酸盐cro42-可以经受3e-还原反应并生成溶解度较低(5.4m)的钠盐na2cro4。尽管cro42–具有比cr2o72–更低的能量和功率密度,但强酸性溶液和更高的总[cr]大大有利于cr2o72–物质形成。因此,对于rfb理想的高氧化剂和电解质浓度的条件也有利于cr2o72–的优势:
cro42–+3e–+8h+→cr3++4h2o
虽然cr2o72–代表通向在能量和功率密度上具有数量级的改进的rfb的路径,但其成功实施的关键在于设计rfb充电期间从cr3+再生cr2o72–的方法。本发明提出通过在阴极经由非均相反应而经受电化学可逆氧化的电子介体(em)均匀将其实现。由此产生的一系列反应将遵循ec催化机制,其中em在其氧化期间持续再生,直到cr3+完全再充电成cr2o72–:
e:em→em++1e–
c催化:2cr3++6em++7h2o→cr2o72–+6em+14h+
使用6e-放电和1e-再充电应该导致cr2o72-的不对称充电性能。然而,预期的再充电电流仍将明显高于1e-em本身,因为ec催化机制将以较低的阴极电解液流速迅速补充电极表面的em。
因此,本发明的一个方面是包含电化学电池的可充电氧化还原液流电池,电化学电池包括在正半电池中的至少一个正电极和在负半电池中的负电极,在两个半电池之间的离子传导膜,其中膜设计用于双酸性阳极电解液和阴极电解液,或设计用于酸性阴极溶液和碱性阳极溶液;一个或多个用于阴极电解液和阳极电解液的储罐,一个或多个用于使储存的阴极电解液和阳极电解液分别循环通过阴极和阳极半电池的泵,和至少一种阳极电解液和至少一种阴极电解液。阳极电解液包含至少一种能够可逆氧化的燃料,至少一种用于导电的电解质和至少一种溶剂。阴极电解液包含criii/crvi氧化还原电对,至少一种用于导电性的电解质,至少一种溶剂和至少一种电化学可逆的电子介体。电子介体能够使用溶液中的ec催化机制将criii均匀地氧化成crvi。
在一个实施方式中,如本文描述的氧化还原液流电池的电子介体具有+0.980至+1.800v的标准电极电位(e0)。优选地,电子介体的标准电极电位(e0)为+1.100至+1.400v,或+1.200至+1.350v。
在一些实施方式中,如本文描述的氧化还原液流电池的电子介体选自由以下组成的组:
ce4+/ce3+;
ru(bipy)33+/ru(bipy)32+,其中bipy是2,2'-联吡啶和/或由一个或多个选自氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氟代芳基、氰基、烷氧基、羧基、-oc(=o)r0、-so32-、-so2x或-c(=o)-x的取代基取代的2,2'-联吡啶,其中x是氢、c1-c6烷基、-or1、氟代烷基或-nr2r3,其中r0、r1、r2和r3各自独立地是氢、c1-c6烷基、c5-c7环烷基、全氟烷基、苯基、取代的苯基,其中所述苯基取代基是c1-c6烷基或c1-c6烷氧基、氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基或氰基,其中可选的取代的2,2'-联吡啶具有比e0=+1.24v相对nhe更高的正还原电位,优选地,2,2'-联吡啶被一个或多个氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氟代芳基、氰基、烷氧基、羧基取代基取代,更优选地,2,2'-联吡啶被一个或多个氟基、氟代烷基、氟代烷氧基和/或氟代芳基取代基取代,最优选地2,2'-联吡啶被8个氟代基取代基取代;
ru(phen)33+/ru(phen)32+,其中phen是1,10-菲咯啉和/或由一个或多个选自由氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氟代芳基、氰基、烷氧基、羧基、-oc(=o)r0、-so32-、-so2x或-c(=o)-x组成的组的取代基取代的1,10-菲咯啉,其中x是氢、c1-c6烷基、-or1、氟代烷基或-nr2r3,其中r0、r1、r2和r3各自独立地是氢、c1-c6烷基、c5-c7环烷基、全氟烷基、苯基、取代苯基,其中所述苯基取代基是c1-c6烷基或c1-c6烷氧基、氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基或氰基,其中可选取代的1,10-菲咯啉具有比e0=+1.20v相对nhe更高的正还原电位;优选地,1,10-菲咯啉被一个或多个氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氟代芳基、氰基、烷氧基、羧基取代基取代,更优选地1,10-菲咯啉被一个或多个氟基、氟代烷基、氟代烷氧基和/或氟代芳基取代基取代,最优选地1,10-菲咯啉被8个氟取代基取代;
fe(phen)33+/fe(phen)32+,其中phen是1,10-菲咯啉和/或用一个或多个选自由氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氟代芳基、氰基、烷氧基、羧基、氨基甲酰基、-oc(=o)r0、-so32-、-so2x或-c(=o)-x组成的组的取代基取代的1,10-菲咯啉,其中x是氢、c1-c6烷基、-or1、氟代烷基或-nr2r3,其中r0、r1、r2和r3各自独立地是氢、c1-c6烷基、c5-c7环烷基、全氟烷基、苯基、取代苯基,其中苯基取代基是c1-c6烷基或c1-c6烷氧基、氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基或氰基,其中可选取代的1,10-菲咯啉具有比e0=+1.150v相对nhe更高的正还原电位;优选地1,10-菲咯啉被一个或多个氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氟代芳基、氰基、烷氧基、羧基取代基取代,更优选地1,10-菲咯啉被一个或多个氟基、氟代烷基、氟代烷氧基和/或氟代芳基取代基取代,最优选地1,10-菲咯啉被8个氟取代基取代;
fe(bipy)33+/fe(bipy)32+,其中bipy是2,2'-联吡啶和/或由一个或多个选自由氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氟代芳基、氰基、烷氧基、羧基、-oc(=o)r0、-so32-、-so2x或-c(=o)-x组成的组的取代基取代的2,2'-联吡啶,其中x是氢、c1-c6烷基、-or1、氟代烷基或-nr2r3,其中r0、r1、r2和r3各自独立地是氢、c1-c6烷基、c5-c7环烷基、全氟烷基、苯基、取代苯基,其中苯基取代基是c1-c6烷基或c1-c6烷氧基、氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基或氰基,其中可选地取代的2,2'-联吡啶具有比e0=+1.03v相对nhe更高的正还原电位,优选地2,2'-联吡啶被一个或多个氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氟代芳基、氰基、烷氧基、羧基取代基取代,更优选地2,2'-联吡啶被一个或多个氟基、氟代烷基、氟代烷氧基和/或氟代芳基取代基取代,最优选地2,2'-联吡啶被8个氟取代基取代;
fe(pr3)53+/fe(pr3)52+,其中r选自由氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氟代芳基、氰基、烷氧基、羧基、-oc(=o)r0、-so32–、-so2x或-c(=o)-x组成的组,其中x是氢、c1-c6烷基、-or1、氟代烷基或-nr2r3,其中r0、r1、r2和r3各自独立地是氢、c1-c6烷基、c5-c7环烷基、氟代烷基、苯基、取代苯基,其中所述苯基取代基是c1-c6烷基或c1-c6烷氧基、氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氰基,优选r是五氟苯;
fe(co)x(pr)5-x3+/fe(co)x(pr)5-x2+,其中r选自由氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氟代芳基、氰基、烷氧基、羧基、-oc(=o)r0、-so32–、-so2x或-c(=o)-x组成的组,其中x是氢、c1-c6烷基、-or1、氟代烷基或-nr2r3,其中r0、r1、r2和r3各自独立地是氢、c1-c6烷基、c5-c7环烷基、氟代烷基、苯基、取代苯基,其中所述苯基取代基是c1-c6烷基或c1-c6烷氧基、氟基、氯基、溴基、羟基、硝基、氟代烷基、氟代烷氧基、氰基,优选r是五氟苯;
fe(co)x3+/fe(co)x2+,其中x为1至4;
cr(η6-c6rxh6-x)2,其中r是磺酸盐(-so3–)而x为0至6;
cr(co)4(p(oc6rxh5-x)3)2,其中r是磺酸盐(-so3–)而x=0至5;cr(co)4(p(och2r)3)2,其中r是磺酸盐(-so3–)或羟基(-oh)及它们的混合物。
在某些实施方式中,如本文描述的氧化还原液流电池的阴极电解液是包含以下的液体:至少一种电化学可逆的电子介体,用于导电性和ph控制的电解质(包括pka为2或更小的强酸,优选hno3、h2so4、h2o4、h3po4或它们的混合物),或者仅为用于导电性的电解质,优选mclo4、mno3、m2so4、mf、mcl、mbr或mi,其中m=li、na或k,四正丁基铵x,其中x=f、cl、br、i或六氟磷酸盐;以及选自由水或非水溶剂组成的组的溶剂,如乙腈、二甲基亚砜、二甲基甲酰胺、甲醇、乙醇、1-丙醇、异丙醇、乙醚、二甘醇二甲醚、四氢呋喃、甘油及它们的混合物。
在一个实施方式中,如本文描述的氧化还原液流电池的阳极电解液是包含以下的液体:能够可逆氧化的燃料的溶液;用于导电性和ph控制的电解质,包括pka为2或更低的强酸,优选hno3、h2so4、hclo4、h3po4或它们的混合物,或仅用于导电性的电解质,优选mclo4、mno3、m2so4、mf、mcl、mbr或mi,其中m=li、na或k,四正丁基铵x,其中x=f、cl、br、i或六氟磷酸盐;以及选自由水或非水性溶剂组成的组的溶剂,如乙腈、二甲基亚砜、二甲基甲酰胺、甲醇、乙醇、1-丙醇、异丙醇、醚、二甘醇二甲醚、四氢呋喃、甘油及它们的混合物。
在另一个实施方式中,如描述本文的氧化还原液流电池的可逆燃料是包含以下的液体:选自由(1)znii/zn;(2)feiii/feii/fe;(3)cuii/cui/cu;(4)h+/h2;(5)viii/vii;(6)criii/crii/cr;(7)criii/crii;(8)aliii/al;(9)zriv/zr;(10)coii/co;(11)niii/ni;(12)cdii/cd;(13)iniii/inii/ini/in;(14)gaiii/gai/ga;(15)snii/sn;(16)sniv/snii;(17)sbiii/sb;(18)pbii/pb;(19)lii/li;(20)nai/na;和/或(21)蒽醌2,6-二磺酸盐的氧化和还原的共轭物以及它们的混合物组成的组的氧化还原电对。优选地,可逆燃料选自由znii/zn、criii/crii、feii/fe、viii/vii和niii/ni组成的组,最优选znii/zn0。
在一个实施方式中,如本文描述的氧化还原液流电池的正极包含至少一种阴极催化剂。阴极催化剂选自由玻璃碳、石墨、碳黑、木炭、这些碳多形体的氧化处理(通过等离子体、电化学、或酸蚀刻)的的变体、au、pd、ag、pt、ni、ir、ru、rh,包含至少50%%的au、pd、ag、pt、ni、ir、ru、rh的au、pd、ag、pt、ni、ir、ru、rh的合金及它们的混合物组成的组。更优选地阴极催化剂选自由玻璃碳、石墨、碳黑、木炭、这些碳多形体的氧化处理的变体,或au组成的组。最优选阴极催化剂是au。
在一些实施方式中,如本文描述的氧化还原液流电池包含至少两种分隔开的阴极催化剂。催化剂优选是电分隔的。第一种阴极催化剂可以适用于cr2o72–还原(放电),而第二种催化剂可以适用于介体的高电位氧化(充电)。还原(放电)催化剂可以物理地插入阴极电解液并从阴极电解液中移出,优选地还原(放电)催化剂由自动致动器插入和除去。高电位氧化(充电)催化剂同样可替代地或另外地物理地插入阴极电解液中并从阴极电解液中除去,优选地高电位氧化(充电)催化剂由自动致动器插入和除去。
在一个具体的实施方式中,本文描述的氧化还原液流电池的阴极在还原(放电)期间周期性地脉冲至低电位以除去可能积聚于阴极处的任何沉淀或杂质。
在进一步的方面中,提供了用于存储电能的方法,其包括:
a)使电解质循环通过本文描述的氧化还原液流电池中的正半电池的流动通道,
b)向氧化还原液流电池的正电极提供电流电源,
c)使用由阴极不均匀氧化的电化学可逆的电子介体将cr3+均匀氧化成cr2o72-,而不同时氧化水。
在此方面的优选实施方式中,电解质和电子介体选自上文更详细描述的那些。
在另一方面中,本发明涉及如本文描述的氧化还原液流电池用于电网级能量存储、住房者能量存储、远程位置、间歇性可再生发电场所,优选风力和太阳能发电场的稳固或负载均衡、微型水电、地热能、潮汐能、能源套利、便携和/或个人电子产品、电动交通工具如船舶、潜艇、飞机、无人水下航行器(uuv)或无人机(uav)、军事电子设备、卫星和其他有人或无人航天器、或可以有利地使用可充电rfb的其他应用储存电能的用途。
本领域技术人员将意识到,在不脱离本发明的精神和范围的情况下,可以采用许多修改和变化。现在通过参考以下非限制性实施例进一步举例说明本发明。
实施例
为了证明cr2o72-的介导再生的概念验证,将ce4+/ce3+氧化还原电对用于em,并进行了三次验证以提供本发明的成功操作的证据。
实施例1:
经由循环伏安法(cv)在相对于ag/agcl+0.2至+1.5v的电位窗口中验证涉及cr3+与ce4+的反应产生ce3+的ec催化机制。
图5显示了两种情况:平坦/光滑的au电极上的(1)5mmce4+和5mmcr2o72-以及(2)5mmce4+的在含水0.5mh2so4中的溶液。在图5中,溶液(1)和(2)在+1.44v下的阳极(正向)扫描中显示出ce3+氧化的峰,其中氧化电流在+1.35v以上开始,并在+1.35v下的阴极(负向)扫描中显示出ce4+的还原的峰,其中净还原电流从+1.40v开始。在cv中,没有ce3+存在于本体溶液中,而所有检测到的ce3+都源自ce4+还原。一般而言,生成的ce3+将扩散到本体溶液中,但是过程较慢并在阳极扫描中检测的电极表面附近的耗尽区中存在一些ce3+。ce3+产生而同时cv在正极扫描中低于+1.40v,而在负极扫描中低于+1.35v。
由于溶液(1)和(2)在由ce4+产生ce3+的电位范围内花费相同的时间量,则cr3+和ce4+之间缺乏相互作用的无效假设是溶液(1)和(2)产生了阳极扫描中检测的相同量的ce3+。然而,溶液(1)在+1.44v下的ce3+氧化的峰值电流几乎翻倍。这是由于ce4+被cr3+还原,其后者由在阳极和阴极扫描中都低于+0.9v之下的cr2o72-还原产生。
为了排除上述结果中认为现象的可能性,使用一系列对照数据评价了来自在ce3+氧化(>+1.35v)附近的cr物质的电流的贡献。在图6中,对于(1)5mmce4+和5mmcr2o72-;(2)5mmce4+;(3)5mmcr2o72-;和(4)不存在ce4+或cr2o72-的au,全部在0.5mh2so4中显示了cv的负极扫描。au(4)的阳极扫描显示了电位>+1.2v处的大致线性的电流区域。由于所有的阳极扫描具有相同的au背景电流,则将au的线性电流区域用作近似基线。阳极扫描(5)表示阳极扫描(2)和(3)的总和,其中从(4)中减去一条基线。因此,为了更好地与(1)的比较,结果扫描(5)只有一条基线,而不是(2)和(3)两条基线的总和。(5)中的阳极扫描只占(1)相对(2)中所见的ce3+氧化峰的增加的一半。(1)中的额外电流显然归因于ec催化过程。
实施例2:
cr2o72-和ce4+溶液的放电/充电循环证实完全恢复了原始cr2o72-还原电流。图7显示了在0.5mh2so4中在250rpm下2.5mmcr2o72-和2.5mmce4+的rde伏安法,其中cr2o72-还原发生于<+0.9v的电位下。对于三种情况显示了rde伏安图:(1)放电之前;(2)cr2o72-以4000rpm的(非全部)2.5c放电之后;和(3)cr3+以4000rpm的2.5c充电之后。(1)和(3)中的质量传输限制电流相符,这表明原始cr2o72-浓度的完全恢复。
实施例3:
据观察,演示3中的cr3+充电经由预期的不对称ec催化过程发生。图8a表明2.5c放电(负电流和充电)发生迅速,只需要11分钟,而图8b的充电需要12小时30分钟。如对于ec催化反应所预期的,经由ce4+的cr3+的ec催化充电仍然比仅由ce3+充电ce4+进行更快。这通过在0.5mh2so4中以4000rpm放电2.5mmce4+的溶液11分钟(图8a)和在演示3(图8b,插图)中使用相同电位和rmp的ce3+充电至ce4+而证明。ce3+氧化的电流是溶液中也存在cr3+时的2.5倍。
这三个演示清楚地支持了cr2o72–的介导再生的功能。本发明的其他方面涉及进一步定义cr2o72–frb的最佳操作和特性。
在上面的演示中,emce4+用于证明cr2o72–充电的ec催化方法。本发明的各个实施方式可以利用具有与cr3+/cr2o72–氧化还原电对类似的标准电化学电位(e0)的各种em,具体地,在给定的电催化剂材料开始大量h2o氧化之前比cr3+/cr2o72–(e0=+1.23v相对nhe,+1.03v相对ag/agcl)负至多达0.250v的e0和比cr3+/cr2o72–正的任何电位。对于au和基于碳的电极,这包括特别是具有+0.98至+1.80v相对nhe和+0.78to+1.60v相对ag/agcl的e0的em。通常,应该选择具有比cr3+/cr2o72–正的e0的介体,以有效地将cr3+氧化成cr2o72–。然而,如由能斯特方程描述的,由于在较高的氧化比还原的介体的比率下给定的介体的e将向其e0正向偏移,可以使用具有比cr3+/cr2o72–负的e0的电极介体。在cr2o72–rfb的充电期间,预期99%至99.995%的em将以氧化形式存在,导致em的e0正向迁移0.120至0.250v。因此,具有比cr3+/cr2o72–的e0低高达0.250v的e0的em仍可以有效地将cr3+氧化成cr2o72–。
虽然这看起来em还应该具有比o2/h2o氧化还原电对(e0=+1.23v相对nhe)低的e0才能避免氧化水溶液,但绝大多数em却不能够在o2/h2o的e0下氧化h2o。对于固态电极材料这也是如此。这是因为h2o氧化成o2是需要特定催化剂有效进行的复杂反应。由于这个原因,au和大多数基于碳的电极材料直到+1.800v相对nhe或更高的电位都不能进行明显的h2o氧化,这允许很多可能的em可以将cr3+氧化成cr2o72–的宽电位范围。
虽然现有技术如grenet电池使用用于cr2o72-的基于碳的阴极,但据证实cr2o72–在au阴极上在远高于e1/2(较高的电压)下发生还原(图4),而因此对cr2o72–rfb提出au阴极。事实上,au也优于ag,pt,pd和ni的性能。
阻碍cr2o72–还原的阻断物质(表面氧化物,“毒物”,或沉淀)似乎在au阴极上在高电位下发展。这可以通过图9中rde伏安图中阳极和阴极扫描之间的高滞后证明,其中在阳极扫描中观察到cr2o72–还原的高e1/2(较高的电压)。也就是说,如果au阴极临时经历高于阴极扫描开始时发生的cr2o72–还原发生时的电位,则cr2o72–还原的e1/2就低于如果正极临时经历低于cr2o72–还原开始时的电位。这表明低于cr2o72–还原开始时的电位会去除阻断物质并允许更高的e1/2(较高的电压)。为了确保在更高的电压下更有效地放电,建议简单地使电极电位阶跃到低电位(特别是0≤e≤+0.6v相对ag/agcl)而去除阻断物质。这种基于电位阶跃的清洁技术以前由作者为bh4-(finkelsteinetal.,“self-poisoningduringbh4–oxidationatptandau,andinsitupoisonremovalproceduresforbh4–fuelcells.j.phys.chem.c2013,117,1571–1581)和nh3而开发。这些基于脉冲的技术通过模拟在rde伏安法期间发生的导致上述阳极和阴极扫描之间的滞后的电极电位变化来运作。
au倾向于在cr3+氧化所需的高电位下腐蚀/溶解。因此,本发明还提出双阴极材料的可选使用:用于cr2o72-还原的au和在用于cr3+氧化的高电位下稳定的第二材料(pt、pd、ni、碳等)。在本发明的一些实施方式中,au阴极材料在cr3+氧化期间物理地从阴极电解液中移除,以避免其经受潜在的破坏性高电势。
本发明的各种公开内容可以利用许多可逆的负极半电池化学而补充的cr2o72–正极化学。也就是说,本发明描述了一种可以与许多不同的负极化学配对而形成完整电化学电池的正极半电池化学。已经确立的是zn2+/zn负极与cr2o72-相容。其它已经证明和实验的负极化学也易于与cr2o72–工作良好,包括fe3+/fe2+、fe2+/fe、cu2+/cu+、cu+/cu、h+/h2、v3+/v2+、cr2+/cr、al3+/al、zr4+/zr、co2+/co、ni2+/ni、cd2+/cd、in3+/in2+、in2+/in+、in+/in、in3+/in、in2+/in、ga3+/ga+、ga+/ga、ga3+/ga、sn2+/sn、sn4+/sn2+、sb3+/sb、pb2+/pb、li+/li、na+/na和蒽醌2,6-二磺酸盐/二羟基蒽醌2,6-二磺酸盐氧化还原电对。
- 还没有人留言评论。精彩留言会获得点赞!