用于可再充电锂离子蓄电池的镍基阴极材料的制作方法
本发明涉及具有特定组合物的高ni过量“nmc”阴极材料。我们所说的“nmc”是指锂镍锰钴氧化物。高ni过量nmc粉末可以优选地用作可再充电锂离子蓄电池中的阴极活性材料。含有本发明阴极材料的蓄电池显示出优异的性能,诸如在高可逆容量、高温储存期间改善的热稳定性以及在高充电电压下循环时的良好长期循环稳定性。
锂离子蓄电池技术目前是电迁移率和固定式电站最有前途的储能手段。licoo2(掺杂或未掺杂-下文称为“lco”),其以前最常用作阴极材料,具有良好的性能,但价格昂贵。此外,由于钴资源逐渐枯竭,锂镍钴铝氧化物或锂镍锰钴氧化物(下文分别称为“nca”和“nmc”-注意两者均可掺杂)已经成为取代lco的潜在候选者。这些材料具有高可逆容量、相对高的体积能量密度、良好的倍率性能、长期的循环稳定性和低成本。
nmc阴极材料可以(近似地)理解为licoo2、lini0.5mn0.5o2和linio2的固态溶液,对应于通式li1+a[niz(ni0.5mn0.5)ycox]1-ao2,其中“z”代表所谓的ni过量,如下文所定义,因为ni在lini0.5mn0.5o2中是100%二价(ni2+),并且ni在linio2中是100%三价(ni3+)。在4.3v时,licoo2和lini0.5mn0.5o2的标称容量约为160mah/g,而linio2的标称容量为220mah/g。典型的nmc基材料被表示为lim'o2,其中m'=nix'mny'coz,并且可以被称为具有m'=ni1/3mn1/3co1/3的“111”材料、具有m'=ni0.4mn0.4co0.2的“442”、具有m'=ni0.5mn0.3co0.2的“532”或具有m'=ni0.6mn0.2co0.2的“622”。m'可以掺杂掺杂剂“a”诸如al、ca、ti、mg、w、zr、b和si,从而导致式li1-a((niz(ni0.5mn0.5)ycox)1-kak)1+ao2。
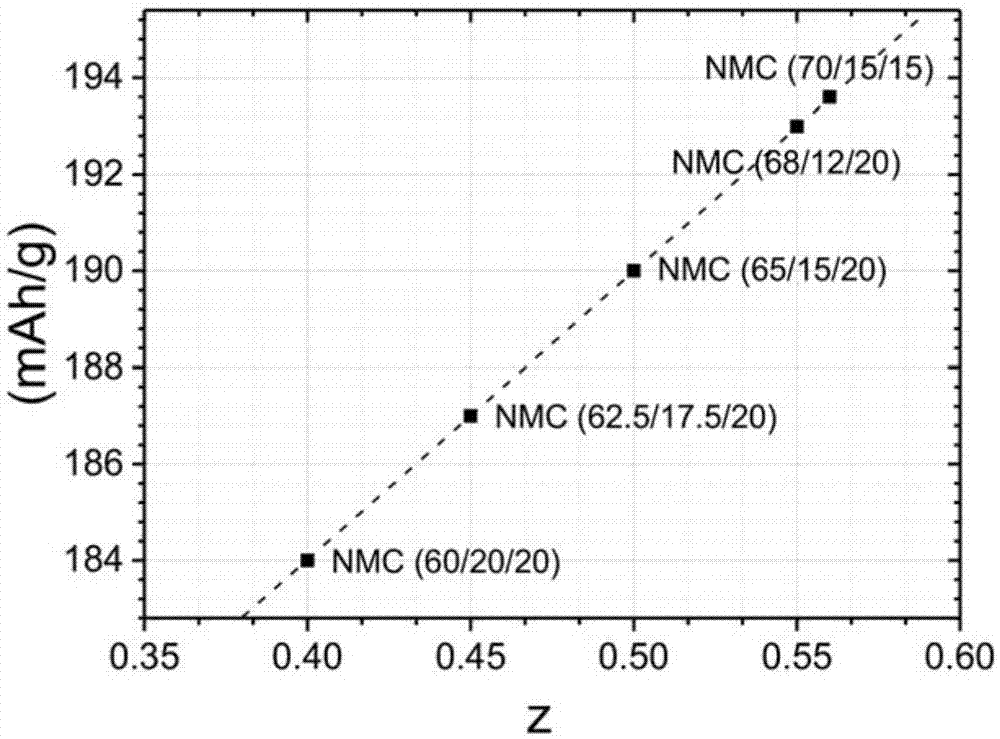
(未掺杂)nmc阴极材料的可逆容量可以从这些容量大致估算。例如,nmc622被理解为0.2licoo2+0.4lini0.5mn0.5o2+0.4linio2。预期容量等于0.2×160+0.4×160+0.4×220=184mah/g。容量随着“ni过量”而增加。例如,nmc622中的ni过量为0.4。如果我们假设锂的化学计量为li/(ni+mn+co)=1.0,则“ni过量”是3价ni的部分。图1示出了作为ni过量的函数的预期容量。这里,x轴是ni过量(“z”)并且y轴是计算的可逆容量。
此外,ni和mn的价格远低于co。因此,使用ni和mn代替co,大大降低了每单位交付能量的阴极成本。根据2014年5月27日在oreba1.0会议上宣布的“就每千瓦时的价格而言,2020年阴极材料在大规模应用的成本竞争方面有望成为lfp最佳表现者”,lco的每个阴极容量的金属价格为35美元/千瓦时,而nmc111则为22美元/千瓦时。随着nmc中ni含量的增加,每阴极容量的金属价格也随之上涨,这是因为ni价格高于mn价格,但其并未达到lco的成本。因此,与lco相比,具有更高能量密度和更低工艺成本的ni过量nmc在当今的蓄电池市场中是更优选的。
nmc的大规模制造要求易于制备和生产高质量的阴极材料。由于阴极材料中的ni过量增加-这从容量角度来看是期望的-生产变得更加困难。例如-超高ni过量阴极材料,如nca-lini0.8co0.15al0.05o2不能在空气中制备或使用li2co3作为锂源。如果li2co3被用作锂前体,则碳酸盐需要分解并且将co2释放到气相中。然而,co2超高ni过量阴极材料的平衡分压非常小。因而,co2的气相运输限制了反应动力学,并且co3分解发生非常缓慢-即使在纯氧中也是如此。而且,超高ni过量阴极具有低热力学稳定性。当在正常空气中加热时,充分反应并且充分锂化的超高ni过量阴极甚至会分解。co2的空气分压足够高,以至于co2从晶体结构中提取锂并形成li2co3。因此co2在生产超高ni过量阴极期间需要游离气体,典型地是氧气。这导致生产成本更高。此外,由于使用li2co3不可能像锂源一样,需要应用锂前体如li2o、lioh·h2o或lioh来代替廉价的li2co3,而这进一步增加了生产成本。另外,过渡金属前体-例如混合的过渡金属氢氧化物-不需含碳酸盐。
最后,当使用氢氧化锂(lioh·h2o或lioh)时,氢氧化锂的低熔点是一个值得关注的点。而li2co3倾向于在熔融之前反应,氢氧化锂倾向于在反应之前熔化。这会在批量生产工艺期间产生许多不良影响,如产品的不均匀性、用熔融lioh浸渍陶瓷匣钵等。另外,在制造高ni过量nmc期间,ni离子倾向于迁移到li位点,这严重限制了实际容量,因此难以具有适当的化学计量。这个问题也影响嵌入机制的可逆性,导致容量衰减。可以总结出,超高ni过量阴极材料如nca的容量增加会导致显著的生产成本。
另一个超高ni过量阴极的问题是可溶性碱的含量。在例如wo2012-107313中明确讨论了“可溶性碱”的概念:可溶性碱是指表面杂质如li2co3和lioh。由于ni过量阴极材料中li的低热力学稳定性,所以剩余的碳酸盐分解地非常缓慢或者存在于空气中的co2容易被吸附并在阴极表面形成li2co3。此外,在水或湿气存在的情况下,li容易从块体中提取,从而导致形成lioh。因而,超高ni过量阴极如nca的表面上容易出现不期望的“可溶性碱”。
在超高ni过量情况下,碳酸盐杂质有多种可能的来源。具体而言,可溶性碱可以源自用作生产中过渡金属源的混合的过渡金属氢氧化物。混合的过渡金属氢氧化物通常通过过渡金属硫酸盐和工业级碱诸如氢氧化钠(naoh)的共沉淀获得。因而,氢氧化物可以含有co32-杂质。在用锂源烧结期间,残留的co32-与锂反应并产生li2co3。正如lim'o2微晶在烧结期间生长,li2co3碱将积聚在这些微晶的表面上。因而,在高ni过量nmc如nmc622中在高温下烧结后,碳酸盐化合物保留在最终产品的表面上。这种碱可以溶解在水中,因此可溶性碱含量可以通过称为ph滴定的技术来测量,如us7,648,693中所讨论的。
可溶性碱,尤其是残留的li2co3是主要问题,因为它们是锂离子蓄电池循环稳定性差的原因。并且,还不清楚在大规模制备期间超高ni过量是否可持续,因为用作前体的材料对空气敏感。因此,在co2游离氧化气体(典型地为o2)中进行超高ni过量阴极材料的制备,以在升高的温度下降低可溶性碱含量。lioh·h2o也被用作锂源来代替li2co3以降低可溶性碱含量。使用lioh·h2o制备高ni过量nmc的典型工艺例如应用于us2015/0010824中。具有低li2co3杂质的lioh·h2o作为锂源与目标组合物的混合的过渡金属氢氧化物共混,并在空气气氛下在高温下烧结。在此工艺中,高ni过量nmc最终产品(如nmc622)的碱含量大大降低。
nmc实现高能量密度和ni过量有两大趋势。一种趋势是将ni过量增加最多至超高值,以便在正常变化电压下实现高容量。第二个趋势是增加充电电压,以便在ni过量较少的情况下实现高容量。例如,nca具有超高约0.8的ni过量,因为所有的ni都是3价。在nc91(lini0.9co0.1o2)中,ni过量甚至是0.9。这些阴极材料即使在相对低的充电电压下也具有超高容量。例如-在用锂作为反电极进行纽扣电池测试时,nc91在4.3v下的容量高达220mah/g。如前所述,以合理的成本在大规模生产工艺中生产此类阴极材料是困难的。此外,我们观察到安全性差的问题。
充电蓄电池的安全问题是一个普遍的问题。该安全性与一个称为热失控的工艺有关。由于放热反应,蓄电池升温并且蓄电池内部的反应倍率增加,从而导致蓄电池由于热失控而爆炸。热失控主要由电解质燃烧引起。如果蓄电池充满电并且阴极处于脱锂状态,则所得li1-xm'o2中的“x”值很高。这些高度脱锂的阴极在与电解质接触时非常不安全。脱锂阴极是一种氧化剂,可与起还原剂作用的电解质反应。该反应剧烈放热,并导致热失控。在极限情况下,蓄电池会爆炸。以一种简单的方式,其可以解释为使用可从脱锂阴极获得的氧来燃烧电解质。一旦达到蓄电池中的特定温度,则阴极就会分解并递送燃烧电解质的氧气。反应后-由于ni在二价状态下稳定并且存在较大ni过量-所以大部分过渡金属为2价。在原理上-每摩尔阴极可递送1摩尔氧气以燃烧电解质:nio2+电解质→nio+燃烧产物(h2o,co2)。
实现高能量密度的另一趋势是为ni过量设定更多的中间值,但是应用高的充电电压。ni过量的典型值在约0.4到约0.6的范围内。这个区域将被我们称为“高ni过量”。高ni过量nmc在4.2v或4.3v下的可逆容量小于“超高”ni过量化合物(ni过量>0.6)。为了达到相同的充电状态(即在脱锂阴极中保留li),如超高ni过量阴极(fx.nca),具有高ni过量阴极的蓄电池(fx.nmc622)需要充电到更高的电压。例如,对于nca可以在4.2v下获得类似充电状态,并且使用nmc622可以在4.35v下获得类似充电状态。因而,为了改善“高ni过量”nmc的容量,应用更高的充电电压。
即使在高充电电压下,所得到的脱锂高ni过量阴极在低电压下比上述脱锂超高ni过量阴极更安全。尽管ni基阴极在氧气燃烧反应期间倾向于形成nio,但ni-m'倾向于在脱锂期间工艺形成更稳定的m'3o4化合物。这些化合物具有较高的最终氧气化学计量,因而可用较少的氧气来燃烧电解质。没有ni过量的阴极的示意性实施例是limn0.5ni0.5o2→mn0.5ni0.5o2+电解质→0.5nimno3+燃烧产物(h2o,co2)。在这种情况下,由于在燃烧反应后只有50%的过渡金属是二价的,所以0.5的氧气可用于燃烧电解质。这与上述讨论的超高ni过量阴极的情况不同,其中几乎有1摩尔可用。
原则上,第2趋势可能会延伸到更少的ni过量阴极。只有很少的ni过量阴极材料可以被充电至更高的电压。例如,nmc532可以充电至约4.45v或者nmc442可以充电至约4.55v以实现相似的容量。在这种情况下-由于ni含量较低,预计脱锂阴极的安全性会进一步改善,并且生产工艺也会简化。然而,这种方法是不可行的,因为目前的电解质在这些超高的充电电压下不能很好地工作,因而观察到较差的循环稳定性。
本发明涉及第2趋势,从而将较高的充电电压应用到不具有超高(>0.6)但仅具有高ni过量(0.4至0.6)的阴极材料。随着ni含量和充电电压的增加,难以获得良好的安全性和廉价的制备工艺。因而从现有技术中已知,高ni过量材料在li离子蓄电池中的成功制备和应用方面存在许多问题。因此,为了使高ni过量材料可接受,必须提供具有最优化的nmc组合物和增强蓄电池性能的此类阴极材料,其中实现了高可逆容量同时实现了良好的循环稳定性和安全性。
技术实现要素:
从第一方面来看,本发明可以提供用于锂离子蓄电池的正电极材料,该正电极材料包含具有通式li1+a((niz(ni0.5mn0.5)ycox)1-kak)1-ao2的锂过渡金属基氧化物粉末,其中a是掺杂剂,并且-0.025≤a≤0.025、0.18≤x≤0.22、0.42≤z≤0.52、1.075<z/y<1.625、x+y+z=1并且k≤0.01。可以组合的不同实施方案可提供以下特征:
-锂过渡金属基氧化物粉末具有≤1000ppm的碳含量;
-锂过渡金属基氧化物粉末具有≤400ppm的碳含量;
-锂过渡金属基氧化物粉末具有介于0.05重量%和1.0重量%之间的硫含量;
-锂过渡金属基氧化物粉末具有介于0.1重量%和0.3重量%之间的硫含量;
-所述粉末还包含介于0.15重量%和5重量%之间的linaso4次生相;并且这里可能是粉末由包含锂过渡金属基氧化物的芯部和包含所述linaso4次生相的涂层组成。也可以是该次生相还包含最多至1重量%的al2o3、lialo2、lif、li3po4、mgo和li2tio3中的一种或多种;
-掺杂剂a是al、ca、w、b、si、ti、mg和zr中的一种或多种。
-粉末由包含锂过渡金属基氧化物的芯部和包含锂和过渡金属的表面层组成,表面层由外界面和内界面界定,内界面与芯部接触,其中a是至少一种掺杂剂且包含al,其中芯部具有0.3mol%至3mol%的al含量,并且其中表面层具有从在内界面处的芯部的al含量增加至在外界面处的至少10摩尔%的al含量,al含量由xps确定。在该实施方案中,表面层可以由以下项组成:芯部ni、co和mn的过渡金属的紧密混合物;以及al2o3,和来自由lif、cao、tio2、mgo、wo3、zro2、cr2o3和v2o5组成的组中的一种或多种化合物。
本发明公开了高ni过量nmc材料,其在窄范围内具有最优化的组合物,从而导致蓄电池性能(诸如高容量、长期循环稳定性和热稳定性)增强。这些阴极材料可以通过竞争性工艺生产。
附图说明
图1.根据ni过量的函数计算nmc材料的可逆容量
图2.三元ni-mn-co组合物三角形中的具体组合物范围
图3.nmc化合物在纽扣电池测试方法1中初始放电容量的等值线图
图4.nmc化合物在纽扣电池测试方法1中容量衰减的等值线图
图5a.nmc化合物在纽扣电池测试方法2中的斜率结果
图5b.图5a的分解图
图6.nmc化合物在纽扣电池测试方法2中斜率结果的等值线图
图7.nmc化合物在纽扣电池测试方法3中恢复容量的等值线图
图8.nmc化合物的dsc光谱
图9.全电池循环寿命测试结果,其中x轴是循环次数,并且y轴是相对放电容量。
图10.在全电池循环寿命与纽扣电池测试方法1的容量衰减之间的相关性。
具体实施方式
本发明集中于用作可再充电锂蓄电池中阴极材料的锂过渡金属氧化物。阴极材料具有nmc组合物,其为lim'o2,其中m'为选自ni、mn和co中的一种或多种过渡金属;但m'也可以掺杂其他元素。本发明的阴极材料具有允许实现最优性能的特定范围的组合物。
尤其是,实现高可逆容量,同时实现良好的循环稳定性和安全性。如果co含量在0.18至0.22范围内并且ni和mn在小范围内变化,则获得了改善的性能。该ni-mn范围可以由彼此相关的2个关系表示:ni-mn和ni/mn。如“ionics,20,1361-1366(2014)”中所述,用1+2*z/y表示的ni/mn摩尔比也会影响性能,诸如容量和循环稳定性。随着ni/mn比率的增加,总放电容量增加,但当该比率变得太高时,电极材料的稳定性下降。另一方面,当mn含量相对于ni含量增加时,则容量降低。随着ni含量增加,ni过量“z”(=ni减去mn)以及ni与mn的化学计量比随之增加。如果ni过量在0.42至0.52范围内并且ni与mn的化学计量比在3.15至4.25范围内,则获得改善的性能。图2示出了三元ni-mn-co组成三角形中的这种特定组合物范围。在具有ni-mn-co角的五角形内的优选的化学计量区域是(1)0.615/0.195/0.189、(2)0.622/0.198/0.180、(3)0.664/0.156/0.18、(4)0.631/0.149/0.22、(5)0.60/0.18/0.22。
典型地,本发明公开的阴极材料通过使用混合的过渡金属前体如混合的金属氢氧化物m'(oh)2、羟基氧化物m'ooh或中间体m”oa(oh)2-a(其中m=ni、mn和co;并且0<a<1)的多重烧结方法来制造。在以下描述中,术语“m'-氢氧化物”涵盖这些不同的前体组合物。m'-氢氧化物典型地通过沉淀工艺来制备。将含金属酸溶液的一种或多种进料馈送入搅拌反应器中。同时,将碱的一种或多种进料添加到该反应器中。而且,将添加剂诸如氨或草酸盐馈送入到该反应器中以更好地控制颗粒生长。通常使用的金属酸是过渡金属硫酸盐溶液,并且典型的碱是naoh。因而,沉淀反应“m'so4+2naoh→m'(oh)2+na2so4”发生。许多沉淀装置的设计是可能的。连续搅拌槽式反应器(cstr)的工艺提供了一个连续的工艺,既提供进料溶液又连续收集溢流。
另选地,该设计可以是分批工艺,其中在反应器被充满后停止沉淀。它也可以是批量和增稠工艺的组合,其中更多的沉淀物在反应器中积累,因为液体(沉降或过滤后)被移除,但大部分固体在该工艺期间保留在反应器中。这样,进入反应器的m'so4和naoh的进料可以持续更长时间。
在沉淀反应条件如搅拌器的rpm、槽的ph值、流率和流率比、停留时间和温度等期间保持良好的控制,以获得高质量的混合的过渡金属氢氧化物产品。在沉淀后将获得混合的过渡金属氢氧化物过滤、洗涤并干燥。因而,获得了混合的过渡金属氢氧化物。混合的过渡前体将成为下面烧结工艺的前体。
由于可以通过沉淀法制备混合的过渡金属前体,所以沉淀的m'-氢氧化物中的目标过渡金属组合物m'具有0.18至0.22摩尔的co含量,并且其含有的ni过量(=ni-mn)为0.42至0.52。而且,ni与mn的比率介于3.15至4.25之间。因而过渡金属组合物可以写为niz(ni0.5mn0.5)ycox,其中0.42≤z≤0.52、0.18≤x≤0.22和3.15<(2*z/y)+1<4.25。
本发明的阴极材料可以通过有成本效率的烧结工艺来制备。烧结在含氧气体中进行。与具有超高ni过量阴极材料的阴极材料相反,该阴极材料需要在无co2的气氛如纯o2中制备,本发明的阴极材料可以在空气中烧结,这允许制备工艺的成本降低。典型地,通过多重烧结方法制备阴极材料。如果应用双重烧结,则第1次烧结工艺递送具有小于1的li/m'化学计量比的产物。并且第2次烧结工艺递送具有接近一的li/m'化学计量比的完全锂化产物。此类工艺在wo2017-042654中公开。
在第1次烧结步骤中,混合的过渡金属前体与锂源共混。典型地lioh·h2o或li2co3被用作锂源。li2co3的使用是可能的,并且允许减少制备成本,除了如果镍过量太高则不能使用li2co3。将共混物在含氧气体中(例如,在空气流中)烧结,以获得缺锂的中间材料。典型的烧结温度高于650℃但小于950℃。中间材料具有小于一的li/m'化学计量比,典型地在0.7至0.95的范围内。
在第2次烧结工艺中,将来自第1次烧结步骤的缺锂中间体与lioh·h2o混合,以便获得最终的li/m'目标组合物。目标比率接近化学计量li/m'=1.00的值。该共混物在含氧气体中(例如,在空气或氧气流中)烧结以获得最终的阴极材料。典型的烧结温度高于800℃但小于880℃。典型地在烧结之后进行后处理步骤(研磨、过筛等)。代替应用2步骤的烧结工艺,阴极材料也可以通过其他合适的工艺制备。传统的单步烧结是一种可能的替代选择。如果应用单一烧结,则典型的li源是lioh·h2o。
所得到的阴极材料具有良好的晶体结构并其具有低可溶性碱含量。特别是,可溶性碳酸盐的碱含量低。碳含量(作为可溶性碳酸盐存在)的典型值在150ppm至约1000ppm的范围内,但优选地不超过400ppm。如果碳含量太高,则获得的容量较少并且循环稳定性会恶化。此外鼓胀属性恶化。当充电的袋式电池暴露于热时,鼓胀是一种不希望的属性,其中由于蓄电池内的气体放出而导致蓄电池体积增加。最后,阴极可能含有硫。可以存在至少0.05质量%,优选地至少0.1质量%的硫。硫的存在改善了循环稳定性并增加了可逆容量。我们的结果表明,硫对于优化多晶阴极材料中的晶界是重要的。如果硫含量低得多,则晶界非常紧密并且可逆容量恶化。硫的含量不应超过1质量%,否则可逆容量损失。
在第2次烧结工艺后,所获得材料可以作为可充电锂离子蓄电池的阴极材料。具有这种特定组合物的阴极的性能可以通过表面处理进一步增强,由此允许增加充电电压而不会使性能恶化,因而允许实现更高的能量密度。表面处理使表面稳定,以防止在循环或储存期间中在蓄电池中发生不希望的反应,并且在延长的循环期间中防止颗粒开裂也可能是有效的,因为这会触发新的表面增强的不期望的副反应。充放电期间阴极中li含量的变化引起产生应变的体积变化。表面涂层可有助于减少表面上的应变,并延缓裂纹成核。该机制在“journaloftheelectrochemicalsociety(《电化学学会志》),164,a6116-a6122(2017)”中有详细描述。在典型的表面处理方法中,表面的所有表面或部分都被合适的化学品覆盖。目前,al和zr基的化合物很受欢迎,然而许多化学品可用于表面处理,其中一些被列在“naturecommunications(《自然通讯》),7,13779(2016)”中。化学品的应用通过湿法或干法处理完成。通常,用于表面处理的化学品的量低,在1质量%以下的范围中。在本发明中,已经使用了将al和/或lif或linaso4应用到表面的表面涂层方法。这些方法已经在us6,753,111、wo2016-116862和ep3111494a1中描述。其他表面处理方法是已知的,其应用了含mg、b、p等的化学品。
如果ni过量大于0.52,则表面处理对改善性能的效率较低。如果ni过量小于0.42,则表面处理改善了性能,但是容量变得不足。表面处理和合适的ni过量的组合是协同作用的。通常,在将化学品应用到表面上之后进行热处理。典型的热处理温度是
(a)100℃-250℃:如果该工艺是涉及熔化或干燥的传统涂层工艺;
(b)300℃-450℃:如果表面反应是期望的,但块体不应该反应,并且
(c)600℃-800℃:如果涉及某些固态扩散或块体反应。
本发明的实施例可以应用于(1)在(c)温度范围内的al基涂层然后进行热处理;或(2)使用(b)温度范围的al和lif基涂层或al和linaso4基涂层。
本发明观察到,只有窄的组成的范围允许获得高容量并且同时具有良好的循环稳定性和安全性。如果该组合物偏离该最优区域,则观察到循环稳定性的恶化。在该最优区域内,通过应用相对高的充电电压可以获得足够的高容量。这个窄的最优化的区域内的阴极材料尤其适用于大的蓄电池或应用超过4.15v充电电压的蓄电池。它典型在4.3v或甚至在4.35v和高温下显示出良好的性能。并且,与超高ni过量nmc(诸如nmc811或nc91)相比,具有最优化的组合物的阴极材料显示出更加较好的安全属性和循环稳定性。
如果该组合物偏离上文给出的值,则性能会变得更差。如果ni过量较低,则在固定的电压下的容量也会减少,并且需要应用较高的充电电压才能达到目标容量。由于该电压太高,所以观察到了差的循环稳定性。如果co含量较高,则阴极的成本增加并且在固定的电压下的容量降低。如果co含量较低,则观察到了循环期间的结构不稳定性。与参考相比,结构不稳定性表现为自身循环稳定性较差。令人惊讶的是,对于钴含量较低的中等高ni过量阴极,观察到了此类不稳定性(对于超高ni过量阴极更为典型)。作者的结论是,正确的co浓度控制对于实现良好性能的阴极材料至关重要。如果ni过量较高,则制备困难增加。并且,由固定的电压获得的容量低于预期,并且当在更高的电压下充电以获得目标容量时,获得了较低的性能。尤其是,与目标组合物相比,其安全性恶化,并且循环稳定性降低。
阴极材料的锂对金属的比率接近一:li1+am'1-ao2,其中“a”接近于零。如果锂浓度较高,则可溶性碱含量增加并且容量恶化。如果锂浓度较低,则容量恶化。作者的结论是,控制锂与过渡金属的化学计量比在约0.95至1.05范围内对于获得良好的性能至关重要。
结论如下:如果该组合物与最优组合物不同,则整体性能恶化。尤其是:
-如果co大于0.22,则容量恶化
-如果co小于0.18,则循环稳定性恶化
-如果ni过量小于0.42,则容量不足
-如果ni过量大于0.52,则循环稳定性和安全属性恶化
-如果ni/mn(=(z+(0.5*y))/0.5*y)的比率大于4.25,则循环稳定性恶化,
-如果ni/mn的比率小于3.15,则容量恶化,
-如果li/m'的化学计量比大大超过1.05,则容量恶化并且可溶性碱的含量变得太高,并且
-如果li/m'的化学计量比远小于0.95,则容量和循环稳定性恶化。
分析方法的描述
a)纽扣电池测试
a)纽扣电池制备
为了制备正电极,将含有电化学活性材料、导体(superp,timcal)、粘合剂(kf#9305,kureha)的浆料-以按重量计90:5:5的配方-在溶剂(nmp,mitsubishi)中由高速均化器制备。使用具有230μm间隙的刮刀涂覆器将均匀化浆液涂布在铝箔的一面上。将浆料涂布箔在120℃下的烘箱中干燥,然后使用压延工具进行压制。然后再次在真空烘箱中干燥,以完全移除电极膜中的剩余溶剂。纽扣电池在充满氩气的手套箱中组装。隔膜(celgard2320)位于正电极和用作负电极的锂箔之间。1mlipf6在ec/dmc(1:2)中用作电解质并落在隔膜与电极之间。然后,将纽扣电池完全密封以防止电解质泄漏。
b)测试方法1
方法1是传统的“恒定截止电压”测试。本发明中的传统纽扣电池测试遵循表1中所示的程序。使用toscat-3100计算机控制的恒电流循环站(来自toyo)将每个电池在25℃下循环。纽扣电池测试程序使用160ma/g的1c电流定义并且包括如下两部分:
第i部分是在4.3v/li至3.0v/li金属窗口范围内在0.1c、0.2c、0.5c、1c、2c和3c下的倍率性能评估。除了在恒定电流模式(cc)下测量初始充电容量(cq1)和放电容量(dq1)的第1次循环以外,所有后续循环在充电期间的特征为具有恒定的恒定电流-恒定电压,终止电流标准为0.05c。在每次充电与放电之间允许第一次循环30分钟和所有后续循环10分钟的休息时间。
第ii部分是在1c下的循环寿命评估。充电截止电压设定为4.5v/li金属。在循环7和34在0.1c下测量4.5v/li金属的放电容量,并且在循环8和35在1c下测量该放电容量。
第iii部分是一个加速循环寿命实验,使用1c倍率进行充电,并且使用1c倍率进行介于4.5v/li和3.0v/li金属之间的放电。容量衰减计算如下:
表1.纽扣电池测试方法1程序
c)测试方法2
如果不同阴极材料的特定容量不同,则对它们的循环稳定性进行比较并不容易。如果一个样本具有低容量并且循环性好,而另一个样本具有高容量并且循环性差,则要进行“公平”的比较并不容易。因此,“测试方法2”使用恒定电荷容量协议。测试方法2比较了在相同容量下的循环稳定性。选择200mah/g的固定的充电容量。一般来讲,在循环期间观察到了“衰减”,这是因为可逆容量的损失。因而,为了保持充电容量固定在200mah/g,充电电压连续增加。监测充电终止电压是量化在固定的充电电压条件下的循环期间衰减率的敏感工具。电压越快,循环稳定性越差。定义了4.7v的最大电压。在较高的电压下测试几乎没有意义,因为电解质的稳定性在高电压下显著恶化。因此,如果充电电压超过4.7v,则该测试切换到恒定电压(v=4.7v)测试类型。将容量作为循环次数的函数绘图时,可容易检测从常数q到常数v的切换循环。这是表征循环稳定性的一个很好参考:切换发生越晚,循环稳定性越好。
最后,在“正常”(恒定v)测试期间,全部容量并不总是在第一循环完成。有时容量会在前几个循环期间增加。这种效应被称为“负极衰减”或“激活”。为了使这种效应最小化-在应用200mah/g的固定的充电容量之前,在低电压下进行10次循环。选择“软”测试条件的低电压是因为它允许避免由于在激活期间的结构损坏而引起的容量损失。因而,预期在使用200mah/g的固定的充电容量的下述“苛刻”循环期间发生容量衰减。表2示出了详细的测试协议。纽扣电池测试程序使用220ma/g的1c电流定义并且包括如下两部分:
第i部分(激活)是在4.1v/li至3.0v/li金属窗口范围内,在0.5c下从第1次循环到第10次循环的循环寿命评估。循环在充电期间的特征为具有恒定的电流恒定电压,终止电流标准为0.05c。在每次充电与放电之间允许所有循环20分钟的休息时间。
第ii部分(恒定q循环)是在固定的充电容量(q)下循环寿命的评估。对于在这部分中的第1次循环,充电和放电容量在4.3v/li至3.0v/li金属窗口范围内在0.2c下测量。在接下来的9次循环期间,将进行测试以实现固定的充电容量。充电时间限于获得200mah/g充电容量的时刻。为了获得固定的容量,充电终止电压增加。并且当充电电压超过4.7v时,则该测试切换到恒定电压(v=4.7v)测试类型。该程序重复四次。最后,在0.2c下进一步测量一次循环。
循环稳定性通过如下计算斜率(s)来测量:
其中n是在达到4.7v的循环次数(在循环14之后),或者当在循环51未达到4.7v的电压时n是37。斜率s越低,则观察到的循环材料越稳定。
表2.纽扣电池测试方法2程序
*q=200mah/g
d)测试方法3
“测试方法3”是储存属性的测试。在该测试中,在高温储存之前和之后测量容量。如上所述制备纽扣电池。在4.3v/li至3.0v/li的金属窗口范围内在0.1c下测量容量。表3总结了应用测试程序的细节。
表3.储存前的储存属性测试程序
*x=190mah/g
将在第1次循环下的放电容量dq1'用作基准值来评价储存属性。第2次循环充电以准备储存。将纽扣电池充电至190mah/g后,将该纽扣电池拆解。因为电极是“湿的”,所以通过用dmc洗涤移除过量的电解质,并将电极密封在铝袋包中。这些袋包在80℃储存2周。在储存后,将新的纽扣电池与这些电极和新鲜电解质组装在一起。在插入蓄电池循环机后,应用事后循环时间表并测量剩余容量。表4总结了应用事后测试程序的细节。这里,保留容量(dq2”)=选择第2次循环的放电容量来评估储存属性。这种属性由储存期前后的放电容量的变化确定。恢复容量(r.q)的计算如下:
表4.储存后的储存属性测试程序
b)碳分析
用horibaemia-320v碳/硫分析仪测量阴极材料的碳含量。将1克阴极材料置于高频感应加热炉中的陶瓷坩埚中。将1.5克钨和0.3克锡作为促进剂添加到坩埚中。这些材料在可编程的温度下加热。然后通过四个红外探测器分析燃烧期间产生的气体。co2含量和co含量的分析确定了碳浓度。
c)差示扫描量热法(dsc)分析
如上所述制备纽扣电池电极。将含有约3.3mg活性材料的小电极冲压并装入纽扣电池中。使用c/24倍率将电池充电至4.3v,随后恒压浸泡至少1小时。在拆解纽扣电池之后,用碳酸二甲酯(dmc)反复清洗电极以移除剩余的电解质。在dmc蒸发之后,将电极浸入不锈钢罐中,并且添加约1.3mg电解质,随后将电池气密封闭(压接)。该电解质与上述用于制备纽扣电池的电解质相同。dsc测量使用ta仪器dscq10装置进行。dsc扫描使用5℃/min的加热率从50℃传导至350℃。ta也提供dsc电池和压接设备。放热热容量是通过对介于100℃和320℃之间基线上的峰面积进行积分来估算的。
d)全电池测试
如下制备650mah袋式电池:将阴极材料、super-p(商购获得自timcal的super-ptmli)、作为正电极导电剂的石墨(商购获得自timcal的ks-6)和作为正电极粘合剂的聚偏二氟乙烯(商购获得自kureha的pvdf1710)添加到作为分散介质的n-甲基-2-吡咯烷酮(nmp)中,以使正电极活性材料粉末、正电极导电剂superp和石墨以及正电极粘合剂的质量比设定为92/3/1/4。之后,捏合该混合物以制备正电极混合物浆料。将所得到的正电极混合物浆料应用在由15μm厚的铝箔构成的正电极集流器的两面。应用区域的宽度为43毫米且长度为450毫米。典型的阴极活性材料装载重量为13.9mg/cm2。然后将电极干燥并使用100kgf(981n)的压力压延。典型的电极密度是3.2g/cm3。另外,将作为正电极集流片的铝板电弧焊接到该正电极的端部。
使用商购获得的负电极。简而言之,在铜箔的两面应用质量比为96/2/2的石墨、羧甲基纤维素钠(cmc)和苯乙烯丁二烯橡胶(sbr)的混合物。将用作负电极集流片的镍板电弧焊接到该负电极的端部。用于电池平衡的典型阴极和阳极放电容量比是0.75。非水电解质是通过将六氟磷酸锂(lipf6)盐以1.0mol/l的浓度溶解在体积比为1:2的碳酸亚乙酯(ec)和碳酸二乙酯(dec))的混合的溶剂中而获得的。
为了获得螺旋卷绕电极组件,将正电极片、负电极片和由厚度为20μm的微孔聚合物膜(商购获得自celgard的
将非水电解质溶液在室温下浸渍8小时。将该蓄电池以其理论容量的15%进行预充电,并在室温下老化一天。然后将该蓄电池脱气并密封铝袋。该制备蓄电池的使用如下:在cc模式(恒定电流)下,使用0.2c的电流(其中1c=650ma)将蓄电池充电最多至4.2v,然后是cv模式(恒定电压)直到截止电流达到c/20,然后以0.5c倍率在cc模式下放电降至截止电压2.7v。
已制备的全电池蓄电池在45℃的以下条件下进行多次充放电,以确定其充放电循环性能:
-在1c倍率下,以cc模式进行充电最多至4.2v,然后是cv模式直至达到c/20,
-然后将电池放置休息10分钟,
-在cc模式下以1c倍率完成放电降至2.7v,
-然后将电池放置休息10分钟,
-充电-放电循环继续进行直至蓄电池达到约80%的保留容量。每100次循环,在cc模式下以0.2c倍率完成一次放电降至2.7v。
当循环中的放电容量达到初始放电容量的80%时,获得80%恢复容量(r.q.的80%处的循环次数)的循环次数以计数循环次数。如果放电容量在1000次循环内未达到初始放电容量的80%,则假定放电容量继续线性下降,使用最后50次循环外推r.q.的80%处的循环次数。
制造实施例
以下描述给出了通过双重烧结工艺制造高ni过量nmc粉末程序的实施例,双重烧结工艺是锂源(通常为li2co3或lioh·h2o)和混合的过渡金属源(通常是混合的过渡金属氢氧化物m'(oh)2或羟基氧化物m'ooh(其中m'=ni、mn和co),但不限于这些氢氧化物,如前所述)之间的固态反应。双重烧结工艺其中包括两个烧结步骤:
1)第1次共混:为了获得缺锂烧结前体,将锂和混合的过渡金属源在亨舍尔
2)第1次烧结:将第1次共混步骤的共混物在加热炉中在含氧气氛下在700℃至950℃下烧结5至30小时。在第1次烧结之后,将烧结后的滤饼压碎、分级并过筛,以备第2次共混步骤。从该步骤获得的产物是缺锂烧结前体,这意味着lim'o2中的li/m'化学计量比小于1。
3)第2次共混:将缺锂烧结前体与lioh·h2o共混,以便纠正li的化学计量。共混在亨舍尔
4)第2次烧结:将第2次共混的共混物在加热炉中在含氧气氛下在800℃至950℃的温度范围内烧结5至30小时。
5)后处理:在第2次烧结之后,将烧结后的滤饼压碎、分级并过筛,以获得非团聚nmc粉末。
实施例1
根据上述“制造实施例”制备样品实施例1.1。混合的镍-锰-钴氢氧化物(m'(oh)2)用作前体,其中m'(oh)2是通过在混合的镍-锰-钴硫酸盐、氢氧化钠和氨的大规模连续搅拌槽式反应器(cstr)中通过共沉淀工艺制备的。在第1次共混步骤中,5.5kg的m'(oh)2混合物,其中m'=ni0.625mn0.175co0.20(ni过量=0.45),并且制备了具有0.85的li/m'比率的lioh·h2o。将第1共混物在箱式加热炉中在氧气氛下在800℃下烧结10小时。将所得到的缺锂烧结前体与lioh·h2o共混,以便制备50g的第2共混物,其中li/m'为1.01。将第2共混物在箱式加热炉中在干燥的空气气氛下在840℃下烧结10小时。以上制备的实施例1.1具有式li1.005m'0.995o2(li/m'=1.01)。
实施例1.2,具有式li0.975m'1.025o2(li/m'=0.95),根据与实施例1.1中相同的方法制备,不同之处在于:第1次和第2次烧结温度分别为720℃和845℃。
实施例1.3,具有式li1.015m'0.985o2(li/m'=1.03),根据与实施例1.1中相同的方法制备,不同之处在于:第2次烧结温度为835℃。
实施例1.4,具有式li1.024m'0.976o2(li/m'=1.05),根据与实施例1.1中相同的方法制备,不同之处在于:第2次烧结温度为835℃。
为了评估该实施例作为锂离子蓄电池的正电极,通过上述“纽扣电池的制备”来制备纽扣电池。本实施例的传统纽扣电池测试是通过上述“测试方法1”进行的。初始放电容量(dq1)在4.3v/li至3.0v/li金属窗口范围内在0.1c下测量。在1c下测量的容量衰减(1c/1cqfad.)用于4.5v/li至3.0v/li金属的充电和放电。为了研究在固定的充电状态下实施例的循环稳定性,通过上述“测试方法2”并且使用200mah/g的固定的充电容量评估纽扣电池。使用充电终止电压作为循环次数的函数来计算斜率(s)直到切换点为止,其中斜率意味着循环稳定性。通过上述“测试方法3”估算实施例在80℃下2周的储存属性。通过观察在(dq1')之前和储存之后(dq2”)的容量变化来评估表明储存属性的恢复容量(r.q)。
通过上述“碳分析”测量样品的碳含量。通过检测样品在50℃至350℃下的燃烧期间产生的气体(co2和co)来确定碳浓度。通过上述“dsc分析”来研究该实施例的热稳定性。放热热容量是通过对dsc结果介于100℃和320℃之间基线上的峰面积进行积分来估算的。
表5中示出了实施例1.1至实施例1.4的初始放电容量、容量衰减、斜率、恢复容量、碳含量和放热热容量。
比较例1
样品比较例1,具有式li1.034m'0.966o2(li/m'=1.07),根据与实施例1.1中相同的方法制备,不同之处在于:第1次和第2次烧结温度分别为720℃和830℃。
比较例2
根据与实施例1.1相同的方法获得具有组合物为li1.005m'0.995o2(li/m'=1.01)的样品比较例2,不同之处在于,m'(oh)2中的m'为ni0.65mn0.10co0.25(ni过量=0.55),并且第2次烧结温度为800℃。
比较例3
根据与实施例1.1相同的方法制备具有组合物为li1.005m'0.995o2(li/m'=1.01)的比较例3,不同之处在于,m'(oh)2中的m'为ni0.65mn0.175co0.175(ni过量=0.48)并且第2次烧结温度为825℃。
比较例4
根据与实施例1.1相同的方法获得具有组合物为li1.005m'0.995o2(li/m'=1.01)的比较例4,不同之处在于,m'(oh)2中的m'为ni0.6mn0.2co0.2(ni过量=0.4)并且第2次烧结温度为860℃。
比较例5
根据与实施例1.1相同的方法获得具有组合物为lim'o2(li/m'=1.00)的比较例5,不同之处在于,用作前体的m'(oh)2中的m'为ni0.68mn0.12co0.2(ni过量=0.56)并且第2次烧结温度为820℃。
比较例6
根据与实施例1.1相同的方法获得具有式为li0.995m'1.005o2(li/m'=0.99)的比较例6,不同之处在于,m'(oh)2中的m'为ni0.7mn0.15co0.15(ni过量=0.55)并且第2次烧结温度为830℃。
根据与实施例1中相同的方法测量比较例比较例1至比较例6的初始放电容量和容量衰减。该实施例的斜率也是如此,其意味着循环稳定性,在80℃下2周的储存属性和碳含量。初始放电容量、容量衰减、斜率、恢复容量和碳含量如表5所示。
实施例2
根据上述“制造实施例”制备作为工业规模产品的实施例2.1。混合的镍-锰-钴氢氧化物(m'(oh)2)用作前体,其中m'(oh)2是通过在混合的镍-锰-钴硫酸盐、氢氧化钠和氨的大规模连续搅拌槽式反应器(cstr)中通过共沉淀工艺制备的。在第1次共混步骤中,5.5kg的m'(oh)2混合物,其中m'=ni0.625mn0.175co0.20(ni过量=0.45),并且制备了具有0.8的li/m'比率的li2co3。将第1共混物在箱式加热炉中在干燥的空气气氛下在885℃下烧结10小时。将所得到的缺锂烧结前体与lioh·h2o共混,以便制备4.5kg的第2共混物,其中li/m'为1.045。将第2共混物在箱式加热炉中在干燥的空气气氛下在840℃下烧结10小时。以上制备的实施例2.1具有式li1.022m'0.978o2(li/m'=1.045)。
实施例2.2是铝包覆的锂过渡金属氧化物,按以下程序制备。将1.3kg的实施例2.1与0.26g的氧化铝共混。将该共混物在箱式加热炉中在750℃下加热7小时。使用270目(astm)的筛将加热的铝涂覆的锂过渡金属氧化物过筛。
实施例2.3是作为次生相含有linaso4的铝包覆锂过渡金属氧化物,将通过以下程序制备。将4.0kg的实施例2.1与8.0g的氧化铝共混,以制备第1共混物。通过高rpm共混器将第1共混物与na2s2o8溶液(48gna2s2o8粉末在140ml水中)共混以制备第2共混物。将第2共混物在375℃下加热6小时。使用270目(astm)的筛将作为次生相含有linaso4的加热的铝涂覆的锂过渡金属氧化物过筛。
根据与实施例1中相同的方法测量实施例2.1、实施例2.2和实施例2.3的初始容量和容量衰减,并示于表5中。按照上述全电池测试方法进行实施例2.1、实施例2.2和实施例2.3的全电池测试,产生表5中给出的恢复容量的80%处的多次循环。
比较例7
根据上述“制造实施例”制备作为工业规模产品的比较例7.1。混合的镍-锰-钴氢氧化物(m'(oh)2)用作前体,其中m'(oh)2是通过在混合的镍-锰-钴硫酸盐、氢氧化钠和氨的大规模连续搅拌槽式反应器(cstr)中通过共沉淀工艺制备的。在第1次共混步骤中,5.5kg的m'(oh)2混合物,其中m'=ni0.6mn0.2co0.2(ni过量=0.40),并且制备了具有0.85的li/m'比率的li2co3。将第1共混物在箱式加热炉中在干燥的空气气氛下在900℃下烧结10小时。将所得到的缺锂烧结前体与lioh·h2o共混,以便制备3.0kg的第2共混物,具有1.055的li/m'比率。将第2共混物在箱式加热炉中在干燥的空气气氛下在855℃下烧结10小时。以上制备的比较例7.1具有式li1.027m'0.973o2(li/m'=1.055)。
比较例7.2是铝包覆的锂过渡金属氧化物,按以下程序制备。将1.3kg的实施例7.1与0.26g的氧化铝共混。将该共混物在箱式加热炉中在750℃下加热5小时。使用270目(astm)的筛将加热的铝涂覆的锂过渡金属氧化物过筛。
比较例8
根据上述“制造实施例”制备作为工业规模产品的比较例8。混合的镍-锰-钴氢氧化物(m'(oh)2)用作前体,其中m'(oh)2是通过在混合的镍-锰-钴硫酸盐、氢氧化钠和氨的大规模连续搅拌槽式反应器(cstr)中通过共沉淀工艺制备的。在第1次共混步骤中,5.5kg的m'(oh)2混合物,其中m'=ni0.70mn0.15co0.15(ni过量=0.55),并且制备了具有0.85的li/m'比率的lioh·h2o。将第1共混物在rhk(辊道窑)中在氧气氛下在800℃下烧结10小时。将所得的缺锂烧结前体与lioh·h2o共混,以便制备3.0kg的第2共混物,具有0.99的li/m'比率。将第2共混物在箱式加热炉中在氧气氛下在830℃下烧结10小时。以上制备的比较例8具有式li0.995m'1.005o2(li/m'=0.99)。
根据与实施例1中相同的方法测量比较例7.1、比较例7.2和比较例8的初始容量和容量衰减,并示于表5中。按照上述全电池测试方法进行比较例7.1、比较例7.2和比较例8的全电池测试,产生表5和图9中给出的恢复容量的80%处的多次循环。
如表5所示,将实施例1.1与具有更高和更低co含量的实施例进行比较。首先,如果co含量较高,诸如比较例2,则由于mn含量较低,所以循环稳定性降低。相反,如果co含量较低,诸如比较例3,则循环期间的结构稳定性恶化。尽管比较例3具有0.48的高ni过量,但它具有较低的放电容量和较差的循环稳定性以保持固定的充电容量。
接下来,将实施例1.1与具有低和高ni过量的实施例进行比较。如果ni过量较低,诸如比较例4,则在固定的电压下的容量较低。此外,为了达到高充电容量(200mah/g)应用了更高的充电电压,从而导致差的循环稳定性。相反,如果ni过量较高,诸如比较例5和比较例6,则它们具有较高的放电容量。相应地,为了获得高充电容量,应用较低的充电电压。然而,与实施例1.1相比,安全性仍然恶化,循环稳定性仍然较低。另外,较高ni过量的nmc化合物(比较例5)表现出差的热稳定性。
而且,将实施例1.1与具有更高和更低摩尔比的ni/mn实施例进行比较。如表5所示,如果诸如比较例2的ni/mn的比率过高,则放电容量高,但循环稳定性恶化。相反,如果ni/mn的比率太低,诸如比较例4,则即使在高电压下放电容量也低。相应地,ni/mn为3.15至4.25的nmc化合物诸如实施例1.1示出了更高的容量和更好的循环稳定性。
图3示出了通过“测试方法1”测量的实施例的放电容量。dq1的值由使用商业软件origin9.1-等值线图在不同区域的阴影表明。在该图中,x轴表示ni过量(z)并且y轴表示nmc化合物中的co/m'(mol/mol%)。随着ni过量增加,容量也增加。具有放电容量高于约180mah/g的nmc化合物对应于具有高容量的组合物。我们观察到在co/m'=20mol/mol%时的最优容量,以较少的ni过量实现更高的容量。
接下来,图4示出了通过“测试方法1”测量的实施例的容量衰减率。1c/1cqfad.的值以每100次循环中的%计,由使用商业软件origin9.1-等值线图在不同区域的阴影表明。在该图中,x轴表示ni过量(z)并且y轴表示该样品中co/m'的含量(mol/mol%)。具有容量衰减低于约20mol/mol%的样品具有改善循环寿命的组合物。我们观察到一定的co组合物的最优值。随着ni过量增加,在约20mol/mol%的co/m'处观察到了更好的循环稳定性。
再者,图5a、图5b(图5a左上角的分解图)和图6示出了通过“测试方法2”测量的实施例的斜率。在图5a和图5b中,x轴给出的循环数、并且左右y轴分别是放电容量和实际截止充电电压。在这些图中,根据“测试方法2”中的公式计算斜率值(mv/循环)。例如,实施例1.1在循环14时具有4.6317v,并且其循环次数(n)为23直到达到4.7v。实施例1.1的循环稳定性通过如下计算的斜率(s)测量:
而且,比较例3在循环14时具有4.6045v,并且其循环次数为19直到达到4.7v。比较例3的斜率计算如下:
在图6中,斜率值(mv/循环)由使用商业软件origin9.1-等值线图在不同区域中用阴影表明。在该图中,x轴表示ni过量(z)并且y轴表示该样品中co/m'的含量(mol/mol%)。如图所示,具有低于约16mv斜率的样品具有增强的循环稳定性的组合物。我们观察到随着ni过量减少,斜率变差,如果ni过量低于0.42并且钴低于0.18或高于0.22,则斜率过大。
另外,图7示出了通过“测试方法3”测量的实施例的恢复容量。r.q.值的%由使用商业软件原点9.1-等值线图在不同区域的阴影表明。在该图中,x轴表示ni过量(z)并且y轴表示co/m'的含量(mol/mol%)。恢复容量高于约70%的样品具有在高温下具有良好储存属性的组合物。
从图3至图7可以得出结论,最优化的组合物中的最佳的一种是具有co/m'含量为20mol/mol%和z=0.45的样品,因为上述所有标准都满足这种组合物。
图8示出了实施例1.1、比较例4和比较例5的dsc光谱。在该图中,x轴表示温度(℃)并且y轴表示热流(w/g)。从约180℃开始并在约250℃至264℃达到最大值的主要放热峰由脱锂阴极的结构变化引起,伴随着氧气释放和随后电解质通过氧气燃烧。特别是,随着nmc中ni含量的增加,主峰温度不断降低,演进放热热量不断增加,其表明安全性降低。具有高ni过量(0.56)的比较例5具有比其他实施例更低的放热峰温度和更高的放热反应焓。这些实施例示出,随着ni过量增加,带电阴极材料的热稳定性显着恶化。因此,容量增加不仅会降低循环稳定性,而且会降低安全性。相应地,从这些实施例中,实施例1.1具有增强的电池性能和高热稳定性的最优化的组合物。
为了进一步确定实施例1的样品的电化学属性,通过“测试方法1”和“碳分析”研究具有各种li/m'比率的nmc样品。如表5中所述,如果li/m'的比率太高,诸如比较例1,则在混合的过渡金属源与锂源之间的反应未完成并导致未反应且熔融的锂源。因此,剩余的锂致使最终nmc产品中存在大量的碳,以及低的放电容量结果。
另一方面,如果li/m'的比率太低,即低于0.95,则晶体结构内的锂化学计量小于预期。xrd衍射数据(此处未显示)允许得出的结论是,由于低li/m',更多的过渡金属位于锂位,从而阻断li的扩散路径。这导致较低的可逆容量以及较差的循环寿命。因此,实施例1中li/m'为0.95至1.05的样品具有特定的组合物,其具有增强的电化学性能,诸如高容量、良好的循环稳定性和高热稳定性。
使用与工业生产相容的工艺以规模制备实施例2.1、比较例7.1、比较例7.2和比较例8。通过测试方法1和全电池测试(参见图9)进行钮扣电池测试的结果表明,在工业产品中,关于约0.45的ni过量在最优化的nmc组合物中是最佳的结论仍然有效。图9和表5还表明实施例2.2和实施例2.3具有优异的电化学属性,这表明可以通过表面改性技术诸如铝涂层进一步改善电化学性能。
图10示出了在全电池循环寿命与来自纽扣电池测试方法1的容量衰减(1c/1cqfad.)之间的相关性。x轴是来自纽扣电池测试方法1以%/100循环计的容量衰减(1c/1cqfad.)并且y轴是初始全电池放电容量的80%处的循环次数。这表明纽扣电池测试方法1的结果可以代表实际蓄电池的电化学属性。
- 还没有人留言评论。精彩留言会获得点赞!