一种利用污水中大肠杆菌产海藻糖发电的酶生物燃料电池的制作方法
本发明属于酶燃料电池的制备技术领域,具体涉及一种酶的活性高、稳定性好的高效的藻糖水解酶和葡萄糖氧化酶共同修饰阳极的酶生物燃料电池的制备方法,及采用这种双酶固定阳极的酶燃料电池利用不同来源污水产生的海藻糖产电的方法。
背景技术:
酶生物燃料电池是采用氧化还原酶作为催化剂催化燃料氧化的生物燃料电池,在阳极产生氢离子和自由电子,阴极利用氢离子和自由电子将过氧化物还原为水,从而完成电子的流动,将化学能转化为电能。相较于传统的化学电池,生物燃料电池虽然由于酶脆弱的自然活性,它只能部分的氧化燃料并且电池的寿命比较短,却具有以下方面的优势:(1)酶生物燃料电池在理论上具有很高的能量转化效率;(2)原料来源广泛;(3)操作条件温和,使用酶作为催化剂,能在常温、常压、中性的条件下有效运作;(4)生物相容性好;(5)在缺乏电力基础设施的局部地区,酶生物燃料电池具有广泛应用的潜力。在能源危机和环境污染的严峻现实下,开发像生物燃料电池一样的绿色环保的新能源已经迫在眉睫。
在污水处理领域,大肠杆菌常作为水污染程度的一种指示性菌种。大肠菌群的值可表明水样被粪便污染的程度,间接表明有肠道病菌(伤寒、痢疾、霍乱等)存在的可能性。在生物制药企业、造纸企业和禽类、畜类屠宰加工、肉制品加工、水产养殖等来源的废水以及城市生活污水中,富集了大量废弃的大肠杆菌,严重污染环境和人类健康。而在这些大肠杆菌体内,存在一种由葡萄糖分子以α,α-1,1-糖苷键相连而成的非还原性二糖——海藻糖(trehalose),其含量最高可达菌体干重的10-20%。研究证明大肠杆菌在受到高温、干燥、强酸、强碱、高渗透压、高浓度有机溶剂等环境压力条件时能诱发海藻糖的高表达,从而保护细胞膜和胞内蛋白质在各种相应环境压力条件下免于失活或变性,被誉为“生命之糖”。由于海藻糖可被一系列连续的酶水解形成氢离子和电子,因此,开发污水中大肠杆菌来源的海藻糖成为新的生物燃料电池的燃料来源对于环境保护和新能源开发具有一箭双雕的重要意义。
然而,目前酶生物燃料电池普遍存在因为酶的负载量低或者酶活性不高导致输出功率过低以及酶稳定性低的问题。而进一步水解海藻糖为葡萄糖的海藻糖水解酶,也因其属于周质酶,含量偏低提纯困难,制备出来的海藻糖水解酶活性偏低,从而限制了其在酶生物燃料电池的应用。利用全细胞催化水解海藻糖可以免去细胞破碎工序,提高酶的稳定性和利用率。但是,由于微生物细胞膜的通透性屏障,使反应底物和产物难以自由出入细胞,生物催化的效率明显低于纯酶催化反应体系。
技术实现要素:
本发明所要解决的技术问题是克服现有阳极载酶的方式的缺陷,提供一种利用污水中大肠杆菌产海藻糖发电的酶生物燃料电池,提高利用全细胞催化水解海藻糖的效率,以生物表面活性剂来处理工程大肠杆菌细胞,增加细胞的通透性,从而避免渗透休克提取酶的方法对酶造成的损失,提高酶的活性和载酶量。同时将透性化的工程大肠杆菌以及gox一起固定在阳极上进行多种酶的催化,进一步提高了底物的水解效率,从而增强了燃料电池的性能。本发明的酶生物燃料电池扩大了酶生物燃料电池可以使用燃料的范围,提高了输出电流或电压,具有单酶电极难以达到的性能。
为实现上述技术目的,本发明采用如下技术方案:
一种利用污水中大肠杆菌产海藻糖发电的酶生物燃料电池,所述酶生物燃料电池阳极表面固定含有海藻糖水解酶trea的生物工程大肠杆菌以及葡萄糖氧化酶gox,所述生物工程大肠杆菌经全细胞透性化处理;阴极表面固定胆红素氧化酶bod。
所述含有海藻糖水解酶trea的生物工程大肠杆菌即将海藻糖水解酶trea基因通过载体连接导入e.colibl21感受态细胞获取。
所述生物工程大肠杆菌的全细胞透性化处理方法步骤如下:
(1)取生物工程大肠杆菌接种到加氨苄的lb液体培养基中,测定od600为0.6-0.8时加入iptg诱导产酶,获得发酵液,离心分离获得湿菌体;
(2)向湿菌体中加入与发酵液等体积的0.1-0.4g/l的糖脂、脂肽或脂肪酸类生物表面活性剂溶液反应,20-25℃,100-200rpm下反应30-60min,获取经透性化处理的细胞;
(3)将经透性化处理的细胞离心,用磷酸盐缓冲液洗涤2次后,用1/2体积磷酸盐缓冲液重悬,获得经全细胞透性化处理的生物工程大肠杆菌发酵液。
其中,加氨苄的lb液体培养基配方为:蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l,氨苄抗生素0.1g/l。生物表面活性剂溶液是利用0.04mol/l的磷酸缓冲盐溶液配制而成,且磷酸缓冲盐体系中磷酸根浓度为0.01-0.04mol/l。
本发明的方法,所述阳极制备方式为:将清洗后的阳极材料浸泡在经全细胞透性化处理的生物工程大肠杆菌发酵液中,于35~40℃静置2~16h,取出后用超纯水冲洗,再放入5~25g/l的葡萄糖氧化酶的超纯水溶液中于35~40℃静置16h,取出后用超纯水冲洗,得到酶阳极。
所述阴极的制备方式为:将清洗后的阴极材料放入5g/l胆红素氧化酶的超纯水溶液中于35~40℃静置16h,取出后用超纯水冲洗,得到酶阴极。
所述阳极和阴极的材料为碳毡。
与现有技术相比,本发明的制备方法及所得到的产物具有如下优点及有益效果:
(1)本发明采用海藻糖水解酶与葡萄糖氧化酶双固定在阳极的方式,扩大了燃料的范围,拥有单酶阳极无法达到的性能;
(2)本发明利用透性化技术对含有海藻糖水解酶的工程大肠杆菌做了透性化处理,固定在燃料电池阳极进行全细胞催化,大大提高了海藻糖水解酶的载酶量以及活性,从而提高了输出电压;
(3)本发明所述的酶生物燃料电池阳极,制备方法简单且成本较低,反应在室温中性环境下进行,制备的酶电极催化性能好,具有良好的应用前景。
附图说明
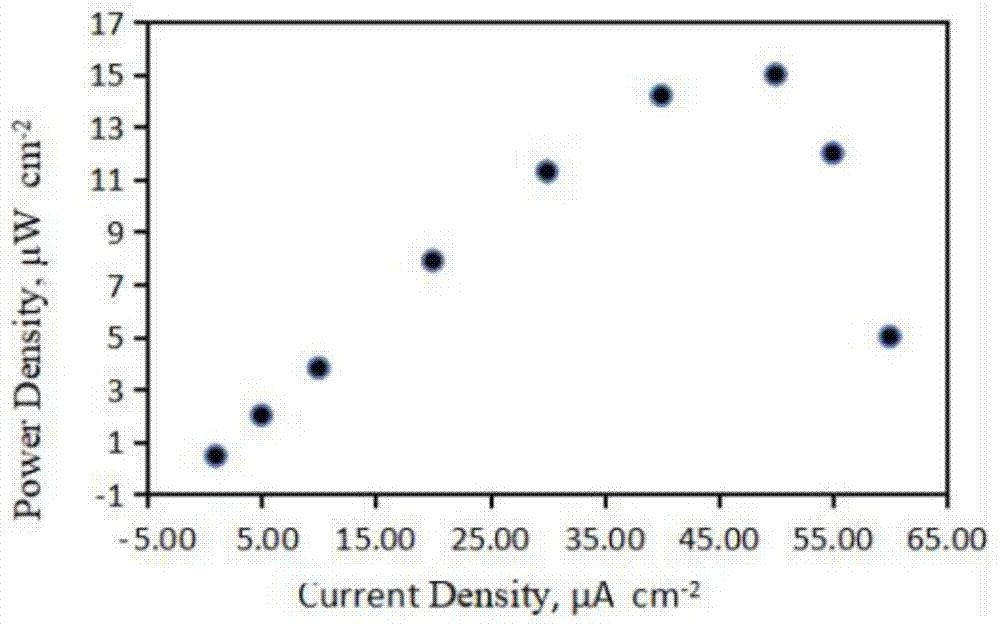
图1是实施例4的燃料电池的功率密度图;
图2是实施例4的燃料电池的电流变化图;
图3是实施例5的燃料电池的功率密度图。
具体实施方式
以下通过结合实施例对本发明的上述内容做进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下实施例。凡基于本发明上述内容所实现的技术均属于本发明的范围。由于碳毡固定酶的技术相同,故只对不同来源的阳极燃料构成的酶生物燃料电池做具体实施陈述。
实施例1
本实施例说明本发明生物工程大肠杆菌的制备方法。
从escherichiacolistr.k-12substr.mg1655的基因组中提取并扩增海藻糖水解酶trea的基因,将trea基因与载体pet22b(+)进行ndei和xhoi双酶切,然后对酶切片段进行胶回收,t4dna连接酶16na连接过夜,得到重组质粒pet22b(+)–trea,将质粒转化到e.colibl21感受态细胞,氨苄平板筛选出单菌落,进行菌落pcr及后续验证。将成功构建的工程菌使用甘油低温保存法保存,即为所述生物工程大肠杆菌。
实施例2
本实施说明本发明生物工程大肠杆菌的全细胞透性化处理方法。
(1)取实施例1保存的菌种,按体积比1.5%的接种量将菌种接种到加氨苄的lb液体培养基中,测定od600为0.6-0.8时加入iptg,保持iptg终浓度为0.5-1.5mmol/l,诱导产酶7–9h,培养条件为37℃,200rpm,获得发酵液;离心分离获得湿菌体,离心条件为4℃,6000rpm,离心时间为10min;
加氨苄的lb液体培养基配方为:蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l,氨苄抗生素0.1g/l。
(2)向步骤(1)中获取的湿菌体中加入与步骤(1)中的发酵液等体积的0.1-0.4g/l的糖脂、脂肽或脂肪酸类生物表面活性剂溶液,于20-25℃,100-200rpm下反应30-60min,获得经透性化处理的细胞;其中,生物表面活性剂溶液是利用0.04mol/l的磷酸缓冲盐溶液配制而成,且磷酸缓冲盐体系中磷酸根浓度为0.01-0.04mol/l。
(3)将步骤(2)获取的细胞在6000rpm下离心10min,用磷酸盐缓冲液洗涤2次后,用1/2体积磷酸盐缓冲液重悬,获得用于制备阳极的生物工程大肠杆菌的发酵液。
实施例3
本实施例说明本发明所述生物燃料电池中酶阴极和酶阳极的制备方法。
将两块碳毡裁剪成几何面积为8cm2的长方形。将碳毡分别使用丙酮、乙醇和超纯水水超声清洗碳毡10min并晾干以清除表面的油脂、灰尘或者其他杂物。
将其中一块碳毡浸泡在实施例2获取的生物工程大肠杆菌发酵液中于35~40℃静置2~16h,取出后用超纯水冲洗,自然晾干,备用;
将清洗后的阳极碳毡浸泡在工程大肠杆菌发酵液中于35~40℃静置2~16h,取出后用超纯水冲洗,再放入5~25g/l的葡萄糖氧化酶的超纯水溶液中于35~40℃静置16h,取出后用超纯水冲洗,于4℃下保存,即得到酶阳极;
将另一块碳毡放入5g/l胆红素氧化酶的超纯水溶液中于35~40℃静置16h,取出后用超纯水冲洗,于4℃下保存,即得到酶阴极。
实施例4
本实施例以海藻糖溶液为阳极燃料对以实施例3制备的酶阴极、酶阳极作为电极的酶生物燃料电池进行生物燃料性能测定,酶生物燃料电池为双室燃料电池,阴极室和阳极室通过阳离子交换膜隔开。
(1)配制50mmol/l的海藻糖溶液作为阳极燃料,溶剂为0.1m的ph为7.4的磷酸缓冲液,氮气吹扫;
(2)将海藻糖溶液倒入阳极室,30%的过氧化氢倒入阴极室,中间用阳离子交换膜隔开;
(3)将银导线分别接在酶阳极与酶阴极的一端,分别放入阳极室和阴极室,连接通路,得到的燃料电池功率密度图如图1所示,所测得的最大输出功率为16.2μw/cm2,开路电位约为450mv;
(4)对双酶固定阳极的酶生物燃料电池的连续操作稳定性与长期储存稳定性进行了测试。首先在连续操作稳定性测试中,由图2所示,记录了所组装电池在连续60h的运行过程中输出电流的变化情况,在60h后,该电池的输出电流密度依然可以保持在初始最大输出值的72%。表明该双酶生物燃料电池有效的提高了所组装生物燃料电池的稳定性。
实施例5
本实施例利用含有废弃工程大肠杆菌str.k-12substr.mg1655的污水为阳极燃料来源,对以实施例3制备的酶阴极、酶阳极作为电极的电池进行生物燃料性能测定。
(1)将污水低温离心,离心温度为4℃,以5000rpm的转速离心10分钟,弃上清液得到富集后的大肠杆菌湿菌体。加入等体积的lb培养基,倒入锥形瓶在37℃,200rpm培养一小时以后,将培养温度改为16℃,继续发酵5h后获得发酵液;离心分离获得湿菌体,离心条件为4℃,6000rpm,离心时间为10min;取12g湿菌体加入30ml0.1m的ph为7.4的磷酸缓冲液,混匀以后进行超声波破碎,同样的离心条件离心5分钟取上层清液加入上述磷酸缓冲液定容至50ml并进行氮气吹扫,所得溶液即为阳极燃料;
(2)将阳极燃料倒入阳极室,30%的过氧化氢倒入阴极室,中间用阳离子交换膜隔开;
(3)将银导线分别接在酶阳极与酶阴极的一端,分别放入阳极室和阴极室,连接通路,得到的燃料电池功率密度图如图3所示,所测得的最大输出功率为55.6μw/cm2。
- 还没有人留言评论。精彩留言会获得点赞!