一种枳的组织培养再生苗的培养方法与流程
本发明属于植物繁殖技术领域,具体地说,涉及一种枳的组织培养再生苗的培养方法。
背景技术:
枳(Poncirus trifoliata(L.)Raf)是芸香科柑橘亚科枳属(Poncirus Raf.)的一种植物,为小乔木;树冠伞形或圆头形,枝有刺,花单朵或成对腋生,果近圆球形或梨形,为温带树种,喜光,稍耐荫,喜温暖湿润气候,耐寒力较强,耐热;对土壤不要求不严,多以此作柑橘类砧木,同时具有较高的药用价值和观赏价值,中国各地均有栽培。
枳虽然在中国各地均有栽培,但随着柑橘类的果树栽培面积越来越广,枳作为一种抗逆性较强,生长旺的砧木,需求量也越来越大,同时,对枳砧木的要求也越来越高。若沿用传统的分株繁殖方法,繁殖系数低,增殖速度慢,远远不能满足人们的需要;若用种子播种,存在变异变化大,难以保存亲本的优良性状等缺点;同时自然环境复杂,传统繁殖方法培育的砧木存在细菌、真菌及病毒的侵害,还会对嫁接的柑橘接穗造成一定的影响。因此,通过组织培养建立无毒再生苗的培育体系成为当前的一种趋势。
技术实现要素:
有鉴于此,本发明针对枳的繁殖系数低、增殖速度慢及易受到细菌、真菌、病毒侵害的问题,提供了一种枳的组织培养再生苗的培养方法,建立枳的高效再生体系,可实现优质种苗的工厂化规模化生产及实验室脱毒再生苗的培养体系。
为了解决上述技术问题,本发明公开了一种枳的组织培养再生苗的培养方法,选取枳的茎段作为组培用的外植体;对茎段进行愈伤组织诱导;成功诱导后通过切割愈伤组织进行进一步继代培养、增大并逐渐分化形成不定芽;再通过光下诱导不定芽再分化形成茎和叶;最后,经生根培养形成不定根后进行驯化移栽,然后正常培养。
进一步地,包括以下步骤:
步骤1、外植体的选择及处理:选取枳的茎段为起始材料,消毒后作为组培用的外植体;
步骤2、愈伤组织的诱导培养:将经过消毒的外植体接种于愈伤组织诱导培养基MS+6-BA1.0-2.0mg/L+IBA0.1-0.2mg/L+GA30.25-0.5mg/L上进行暗培养,茎段切口处逐渐形成愈伤组织。
步骤3、愈伤组织的增殖培养:
形成的愈伤组织经切割后转接到愈伤组织增殖培养基MS+6-BA0.5-1.0mg/L+IBA0.1-0.2mg/L+GA30.25-0.5mg/L上进行暗培养,愈伤组织较为迅速的生长膨大;
步骤4、愈伤组织的分化及再分化培养:
将增殖后的愈伤组织转移到光下培养,通过光诱导,迅速分化形成不定芽,而后缓慢分化为茎和叶;
步骤5、生根成苗及驯化移栽:
将再分化形成的茎和叶转移到生根培养基1/2MS+IBA0.25-0.5mg/L上进行培养,20~30天后,长出1-2条肉质不定根,生根成苗成为新的植株,炼苗、缓苗后正常培养。
进一步地,愈伤组织的诱导及增殖的培养条件均为:培养温度23-27℃,避光进行暗培养;愈伤组织分化及再分化培养、再生苗的生根培养条件均为23-27℃,光照时间为10~12h/d,光照强度为2500-3000lux。
进一步地,愈伤组织诱导培养基、愈伤组织增殖及分化培养基及再生苗的生根培养基均为MS培养基,蔗糖用量为20~40g/L,凝固剂为琼脂粉、用量为6~7g/L,培养基pH为5.7-5.9。
进一步地,炼苗、缓苗具体为:先在组培室打开瓶盖炼苗3天,然后将其移至温室或荫棚,再炼苗3天;然后将组培苗从培养瓶中取出,洗净其表面的琼脂,移栽到培养基质中进行缓苗,然后正常培养。
进一步地,培养基质为蛭石与珍珠盐。
进一步地,培养基质含水量25%以内,空气相对湿度60~80%,遮光50%。
与现有技术相比,本发明可以获得包括以下技术效果:
1)本发明通过选取枳的茎段作为组培用的外植体;对茎段进行愈伤组织诱导培养形成愈伤组织;愈伤组织可通过特定培养基进行有效增殖,并逐渐分化形成不定芽;不定芽可继续分化形成茎和叶;再通过生根培养形成不定根后进行驯化移栽,然后正常培养,解决了枳的繁殖系数低、增殖速度慢及易受细菌、真菌和病毒侵害的问题,建立了枳的高效再生体系;
2)通过茎段组织培养进行枳的愈伤组织诱导,不受地区、季节、气候限制,可实现优质再生苗的工厂化规模化生产及实验室脱毒再生苗的培养体系,而且遗传性状相对稳定一致;
3)为完善枳的遗传转化体系,建立分子育种的平台,从分子水平对其进行遗传改良,深入研究开发利用奠定了基础。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
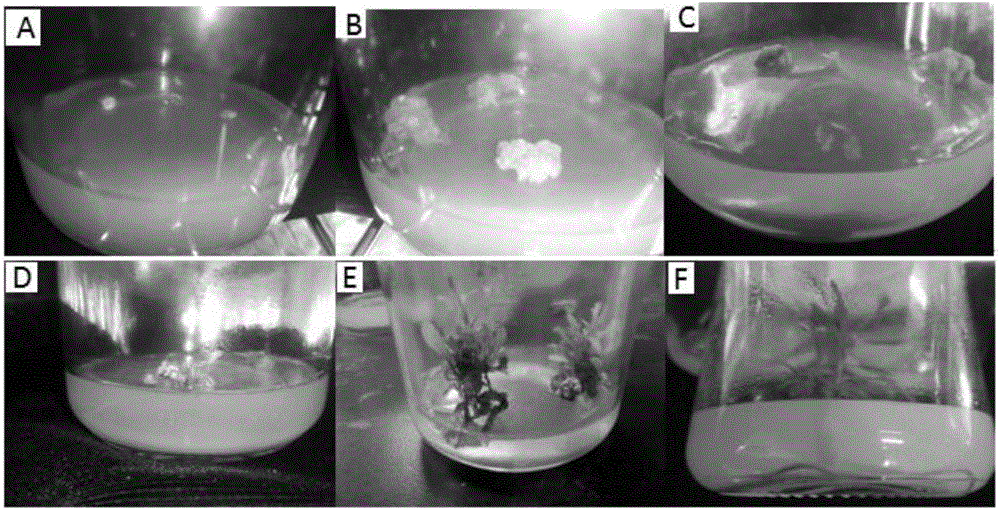
图1是本发明枳的组织培养再生苗过程对比图;图中,A为枳茎段诱导的愈伤组织,B为愈伤组织的增殖培养,C为愈伤组织进行分化形成不定芽,D为愈伤组织开始再分化形成茎和叶,E为枳经愈伤组织形成的未生根的再生苗,F为生根培养后的完整的枳再生苗;
图2是本发明愈伤组织切割增殖效率。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
本发明公开了一种枳的组织培养再生苗的培养方法,具体包括以下步骤:
步骤1、外植体的选择及处理:
选取枳的茎段为起始材料,消毒后作为组培用的外植体;
具体地,所述消毒具体为:材料去叶后用多菌灵1000倍液处理30min-50min,清水洗净后流水冲洗2小时后备用;在超净工作台上剪成小段后转移到无菌烧杯中;用体积分数为75%的乙醇灭菌30s,期间不断晃动烧杯,然后用无菌水(ddH2O)清洗2-3次,再用质量分数为0.1%的HgCl2浸泡8-10min,无菌水清洗2-3次。
步骤2、愈伤组织的诱导培养:
在超净工作台上,将经过表面消毒的外植体转移至无菌接种盘中,用无菌滤纸吸干外植体表面水分,用消过毒的镊子将材料横向接种于培养基中,并轻压,保证材料嵌入培养基中;愈伤组织诱导的培养基为MS+6-BA1.0-2.0mg/L+IBA0.1-0.2mg/L+GA30.25-0.5mg/L,接种后20-30d形成明显的愈伤组织;诱导出的愈伤组织切割后如图1(A)所示;
培养条件:培养温度25±2℃,暗培养。
愈伤组织(callus)原指植物体的局部受到创伤刺激后,在伤口表面新生的组织。是由植物创口的细胞脱分化形成的薄壁细胞,在一定条件下可进一步诱导器官再生或胚状体而形成植株。
步骤3、愈伤组织的增殖培养:
将步骤2形成的愈伤组织经切割后转接到愈伤组织增殖培养基MS+6-BA0.5-1.0mg/L+IBA0.1-0.2mg/L+GA30.25-0.5mg/L上进行暗培养,愈伤组织较为迅速的生长膨大,如图1(B)所示。
切除茎段两侧切口处的愈伤组织,接到继代培养基上;愈伤组织在上述愈伤组织增殖培养基中各组分浓度范围内均能正常生长。
培养条件:培养温度25±2℃,暗培养。
步骤4、愈伤组织的分化及再分化:
将增殖后的愈伤组织转移到光下培养,通过光诱导,迅速分化形成不定芽,如图1(C)所示;而后缓慢分化为茎和叶,如图1(D)所示。
培养条件均为:培养温度25±2℃,光照时间为10~12h/d,光照强度为2500-3000lux。
步骤5、生根成苗及驯化移栽
将再分化形成的茎和叶转移到生根培养基1/2MS+IBA0.25-0.5mg/L上进行培养,如图1(E)所示;20~30天后,长出1-2条肉质不定根,生根成苗成为新的植株,如图1(F)所示;炼苗、缓苗后正常培养。
其中,愈伤组织诱导培养、愈伤组织增殖及分化培养及再生苗的生根培养,所用的基本培养基均为MS培养基,蔗糖用量为20~40g/L,凝固剂为琼脂粉、用量为6~7g/L,培养基pH为5.8±0.1;其中,所添加的植物激素为6-BA:苄氨基嘌呤、IBA:吲哚丁酸、GA3:赤霉素。
进一步地,所述炼苗、缓苗具体为:先在组培室打开瓶盖炼苗3天,然后将其移至温室或荫棚,再炼苗3天;然后将组培苗从培养瓶中取出,洗净其表面的琼脂,移栽到培养基质中进行缓苗,然后正常培养。
优选的,所述培养基质为蛭石与珍珠盐;所述培养基质含水量25%以内,空气相对湿度60~80%,遮光50%。
本发明利用枳的茎段在一定浓度的植物生长调节剂诱导下产生愈伤组织,愈伤组织又能进行增殖培养;又因增殖培养后的愈伤组织能经过光诱导和生根培养形成完整的再生苗;期间,能通过切割愈伤组织使之能以几何倍数进行增殖生长,还可通过有无光诱导来调控是否进行分化与再分化,从而可实现优质种苗的规模化生产,而且遗传性状相对稳定一致。
其中,IBA是植物主根生长促进剂,常用于木本和草本植物的浸根移栽,硬枝杆插,能加速根的生长,提高植物生根的百分率,也可用于植物种子的浸种和拌种,可提高发芽率和成活率。6-BA的主要作用是促进芽的形成,也可以诱导愈伤组织发生。GA3为植物生长调节剂,主要用于促进作物的生长发育,提早成熟,提高产量和打破种子、块茎、鳞茎等器官的休眠,促进发芽等。在前期愈伤组织的诱导和培养中,6-BA能有效的促进愈伤组织的发生及增殖,而赤霉素能促进愈伤组织的增殖生长。IBA可提高植物的发芽率和成活率,同时在生根培养中,能十分有效的加速根的形成与生长。
其中,6-BA的取值范围为1.0-2.0mg/L、IBA的取值范围为0.1-0.2mg/L、GA3的取值范围为0.25-0.5mg/L;光照时长为10-12h/d,光照强度为2500-3000lux。6-BA在1.0mg/L的条件下能成功诱导愈伤组织,但诱导率不高,在2.0mg/L的时候诱导率最高,如再继续添加,反而会抑制愈伤组织的发生;IBA同理,在0.1mg/L的时候能有效促进愈伤组织生长分化及生根,0.2mg/L的时候为最适浓度,但如果超过0.2mg/L,则会出现抑制效果。GA3的浓度0.25mg/L时,对芽的分化及再分化有促进作用,但不明显,当达到0.5mg/L的时候,效果最佳,但如果继续增加浓度,则会大幅度抑制芽的分化及再分化。光照时长和光照强度为协同作用,当光照时长为10h/d时,光照强度为2500lux时,愈伤组织能进行正常的分化和再分化,但增殖系数不高,且在生根培养条件下,叶片会出现不同程度的营养不良,表现为黄化,但不影响生根及炼苗移栽的成活率。光照时长为12h/d时,光照强度为3000lux为最佳条件。如果继续增加其光照时长或光照强度,在愈伤组织分化和再分化中则会出现愈伤组织快速老化的现象,表现为愈伤组织表面变成淡黄色至深黄色,愈伤组织表现为疏散,且与正常愈伤组织比较为干燥,同时,老化的愈伤组织不能有效的进行分化和再分化,即使分化成不定芽,也会在再分化过程中停止再分化,变黄后衰亡。
实施例1
一种枳的组织培养再生苗的培养方法,具体包括以下步骤:
步骤1、外植体的选择及处理:
选取枳的茎段为起始材料,消毒后作为组培用的外植体;消毒具体为:材料去叶后用多菌灵1000倍液处理30min,清水洗净后流水冲洗2小时后备用;在超净工作台上剪成小段后转移到无菌烧杯中;用75%乙醇灭菌30s,期间不断晃动烧杯,然后用无菌水(ddH2O)清洗2-3次,再用0.1%HgCl2浸泡8-10min,无菌水清洗2-3次。
步骤2、愈伤组织的诱导培养:
在超净工作台上,将经过表面消毒的外植体转移至无菌接种盘中,用无菌滤纸吸干外植体表面水分,用消过毒的镊子将材料横向接种于培养基中,并轻压,保证材料嵌入愈伤组织诱导培养基中;接种后20-30d形成明显的愈伤组织;诱导出的愈伤组织切割后如图1(A)所示;
枳茎段愈伤组织诱导:采用愈伤组织诱导培养基,愈伤组织诱导培养基以MS为基础培养基(含大量元素),琼脂为6g/L,蔗糖为30g/L,培养基pH为5.8;培养温度25℃,暗培养;其中,愈伤组织诱导培养基的植物生长调节剂浓度如表1所示:
表1愈伤组织诱导培养基的植物生长调节剂浓度
愈伤组织诱导成功率为100%,茎段两侧切口均能长出愈伤组织。
步骤3、愈伤组织的增殖培养:
将步骤2形成的愈伤组织经切割后转接到愈伤组织增殖培养基上进行暗培养,愈伤组织较为迅速的生长膨大,如图1(B)所示。
枳茎段愈伤组织增殖培养条件:采用愈伤组织增殖培养基,愈伤组织增殖培养基以MS为基础培养基(含大量元素),琼脂为6g/L,蔗糖为30g/L,培养基pH为5.8;培养温度25℃,暗培养;愈伤组织增殖培养基的植物生长调节剂浓度如表2所示:
表2愈伤组织增殖培养基的植物生长调节剂浓度
步骤4、愈伤组织的分化及再分化:
将增殖后的愈伤组织转移到光下培养,通过光诱导,迅速分化形成不定芽,如图1(C)所示;而后缓慢分化为茎和叶,如图1(D)所示。
培养条件均为:培养温度25℃,光照时间为12h/d,光照强度为3000lux。在上述浓度下,光下培养,再分化率为80%;已分化出不定芽。未分化的主要原因为愈伤组织的老化。
步骤5、生根成苗及驯化移栽
将再分化形成的茎和叶转移到生根培养基上进行培养,如图1(E)所示;20~30天后,长出1-2条肉质不定根,生根成苗成为新的植株,如图1(F)所示;炼苗、缓苗后正常培养。
生根培养条件:采用生根培养基,生根培养基以MS为基础培养基(含大量元素),琼脂为6g/L,蔗糖为30g/L,培养基pH为5.8;培养温度25℃,光照时间为12h/d,光照强度为3000lux。生根培养基的植物生长调节剂浓度如表3所示:
表3生根培养基的植物生长调节剂浓度
炼苗、缓苗具体为:先在组培室打开瓶盖炼苗3天,然后将其移至温室或荫棚,再炼苗3天;然后将组培苗从培养瓶中取出,洗净其表面的琼脂,移栽到培养基质中进行缓苗,然后正常培养。培养基质为蛭石与珍珠盐;所述培养基质含水量25%以内,空气相对湿度60~80%,遮光50%。
实施例2
一种枳的组织培养再生苗的培养方法,具体包括以下步骤:
步骤1、外植体的选择及处理:
选取枳的茎段为起始材料,消毒后作为组培用的外植体;消毒具体为:材料去叶后用多菌灵1000倍液处理30min,清水洗净后流水冲洗2小时后备用;在超净工作台上剪成小段后转移到无菌烧杯中;用75%乙醇灭菌30s,期间不断晃动烧杯,然后用无菌水(ddH2O)清洗2-3次,再用0.1%HgCl2浸泡8-10min,无菌水清洗2-3次。
步骤2、愈伤组织的诱导培养:
在超净工作台上,将经过表面消毒的外植体转移至无菌接种盘中,用无菌滤纸吸干外植体表面水分,用消过毒的镊子将材料横向接种于培养基中,并轻压,保证材料嵌入愈伤组织诱导培养基中;接种后20-30d形成明显的愈伤组织;诱导出的愈伤组织切割后如图1(A)所示;
枳茎段愈伤组织诱导:采用愈伤组织诱导培养基,愈伤组织诱导培养基以MS为基础培养基(含大量元素),琼脂为6g/L,蔗糖为30g/L,培养基pH为5.8;培养温度23℃,暗培养;其中,愈伤组织诱导培养基的植物生长调节剂浓度如表4所示:
表4愈伤组织诱导培养基的植物生长调节剂浓度
愈伤组织诱导成功率为80%,部分切口未成功诱导愈伤组织。
步骤3、愈伤组织的增殖培养:
将步骤2形成的愈伤组织经切割后转接到愈伤组织增殖培养基上进行暗培养,愈伤组织较为迅速的生长膨大,如图1(B)所示。
枳茎段愈伤组织增殖培养条件:采用愈伤组织增殖培养基,愈伤组织增殖培养基以MS为基础培养基(含大量元素),琼脂为6g/L,蔗糖为30g/L,培养基pH为5.8;培养温度25℃,暗培养;愈伤组织增殖培养基的植物生长调节剂浓度如表5所示:
表5愈伤组织增殖培养基的植物生长调节剂浓度
步骤4、愈伤组织的分化及再分化:
将增殖后的愈伤组织转移到光下培养,通过光诱导,迅速分化形成不定芽,如图1(C)所示;而后缓慢分化为茎和叶,如图1(D)所示。
培养条件均为:培养温度23℃,光照时间为10h/d,光照强度为2500lux。在上述浓度下,光下培养,再分化率为64%;已分化出不定芽。未分化的主要原因为愈伤组织的老化,且老化的愈伤组织明显增多。
步骤5、生根成苗及驯化移栽
将再分化形成的茎和叶转移到生根培养基上进行培养,如图1(E)所示;20~30天后,长出1-2条肉质不定根,生根成苗成为新的植株,如图1(F)所示;炼苗、缓苗后正常培养。
生根培养条件:采用生根培养基,生根培养基以MS为基础培养基(含大量元素),琼脂为6g/L,蔗糖为30g/L,培养基pH为5.8;培养温度25℃,光照时间为10h/d,光照强度为2500lux。生根培养基的植物生长调节剂浓度如表6所示:
表6生根培养基的植物生长调节剂浓度
炼苗、缓苗具体为:先在组培室打开瓶盖炼苗3天,然后将其移至温室或荫棚,再炼苗3天;然后将组培苗从培养瓶中取出,洗净其表面的琼脂,移栽到培养基质中进行缓苗,然后正常培养。培养基质为蛭石与珍珠盐;所述培养基质含水量25%以内,空气相对湿度60~80%,遮光50%。
实施例3
一种枳的组织培养再生苗的培养方法,具体包括以下步骤:
步骤1、外植体的选择及处理:
选取枳的茎段为起始材料,消毒后作为组培用的外植体;消毒具体为:材料去叶后用多菌灵1000倍液处理30min,清水洗净后流水冲洗2小时后备用;在超净工作台上剪成小段后转移到无菌烧杯中;用75%乙醇灭菌30s,期间不断晃动烧杯,然后用无菌水(ddH2O)清洗2-3次,再用0.1%HgCl2浸泡8-10min,无菌水清洗2-3次。
步骤2、愈伤组织的诱导培养:
在超净工作台上,将经过表面消毒的外植体转移至无菌接种盘中,用无菌滤纸吸干外植体表面水分,用消过毒的镊子将材料横向接种于培养基中,并轻压,保证材料嵌入愈伤组织诱导培养基中;接种后20-30d形成明显的愈伤组织;诱导出的愈伤组织切割后如图1(A)所示;
枳茎段愈伤组织诱导:采用愈伤组织诱导培养基,愈伤组织诱导培养基以MS为基础培养基(含大量元素),琼脂为6g/L,蔗糖为30g/L,培养基pH为5.8;培养温度27℃,暗培养;其中,愈伤组织诱导培养基的植物生长调节剂浓度如表7所示:
表7愈伤组织诱导培养基的植物生长调节剂浓度
愈伤组织诱导成功率为100%,茎段两侧切口均能长出愈伤组织。
步骤3、愈伤组织的增殖培养:
将步骤2形成的愈伤组织经切割后转接到愈伤组织增殖培养基上进行暗培养,愈伤组织较为迅速的生长膨大,如图1(B)所示。
枳茎段愈伤组织增殖培养条件:采用愈伤组织增殖培养基,愈伤组织增殖培养基以MS为基础培养基(含大量元素),琼脂为6g/L,蔗糖为30g/L,培养基pH为5.8;培养温度27℃,暗培养;愈伤组织增殖培养基的植物生长调节剂浓度如表7所示:
表7愈伤组织增殖培养基的植物生长调节剂浓度
步骤4、愈伤组织切割及再培养:
将步骤3增殖出的愈伤组织进行切割,每块愈伤组织切割至10个小块,然后继续放在愈伤组织增殖培养基中进行培养,培养2-3周即可用于再次切割,也可培养4-5周,用于分化及再分化;以上操作均在无菌操作台进行。
步骤5、愈伤组织的分化及再分化:
将增殖后的愈伤组织转移到光下培养,通过光诱导,迅速分化形成不定芽,如图1(C)所示;而后缓慢分化为茎和叶,如图1(D)所示。
培养条件均为:培养温度25℃,光照时间为12h/d,光照强度为3000lux。在上述浓度下,光下培养,再分化率为80%;已分化出不定芽。未分化的主要原因为愈伤组织的老化。
步骤6、生根成苗及驯化移栽
将再分化形成的茎和叶转移到生根培养基上进行培养,如图1(E)所示;20~30天后,长出1-2条肉质不定根,生根成苗成为新的植株,如图1(F)所示;炼苗、缓苗后正常培养。
生根培养条件:采用生根培养基,生根培养基以MS为基础培养基(含大量元素),琼脂为6g/L,蔗糖为30g/L,培养基pH为5.8;培养温度27℃,光照时间为12h/d,光照强度为3000lux。生根培养基的植物生长调节剂浓度如表9所示:
表9生根培养基的植物生长调节剂浓度
炼苗、缓苗具体为:先在组培室打开瓶盖炼苗3天,然后将其移至温室或荫棚,再炼苗3天;然后将组培苗从培养瓶中取出,洗净其表面的琼脂,移栽到培养基质中进行缓苗,然后正常培养。培养基质为蛭石与珍珠盐;所述培养基质含水量25%以内,空气相对湿度60~80%,遮光50%。采用本发明的方法愈伤组织切割增殖效率如图2所示,增殖培养后的愈伤组织,可经过切割,继续进行增殖培养,愈伤组织的个数将成几何倍数增长(以增值后的愈伤组织切割成10个较小的愈伤组织为例);切割后培养(培养至可切割大小为2-3周,培养至可诱导分化为4-5周)的愈伤组织经过可按本发明后续的技术措施进行分化及再分化、生根培养、炼苗移栽。采用本发明的繁殖方法对枳进行繁殖,在步骤2中对增殖后的愈伤组织进行切割再培养可使其增殖系数呈现几何基数式增长,远远高于传统的分株繁殖方式,采用上述通过枳的组织培养再生苗的方法,繁殖系数高,增殖速度快,且不受地区、季节、气候限制,可实现优质再生苗的工厂化规模化生产及实验室脱毒再生苗的培养体系。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!