一种发酵制备麸皮水溶性膳食纤维的方法与流程
本发明属于食品加工制造技术领域,涉及小麦麸皮固态发酵,具体涉及水溶性膳食纤维的提取和分级,尤其是一种发酵制备麸皮水溶性膳食纤维的方法。
背景技术:
我国拥有丰富的膳食纤维资源,但天然膳食纤维资源中SDF比例非常低,只占3%~4%,远不能满足市场需求。
膳食纤维具有预防便秘、降血糖、降血脂等生理功能并且在食品中应用广泛。
小麦年产量我国居世界第一位,作为面粉制造业的主要副产品,麦麸含有多种营养成分,是一种有益健康的膳食纤维资源,但我国麦麸多用于饲料行业,附加值低,若能提高麦麸中水溶性膳食纤维含量,可以提高行业产能。
目前,提取水溶性膳食纤维的方法主要有化学法、酶法、酶法与化学法结合,但因其成本高、环境污染问题、工艺复杂等缺点逐渐被弱化。水提醇沉法因操作步骤简单,设备成本相对较低,适合大规模生产。
通过检索,尚未发现与本发明申请相关的专利公开文献。
技术实现要素:
本发明的目的在于克服现有技术的不足之处,提供一种发酵制备麸皮水溶性膳食纤维的方法,该方法选用米根霉发酵小麦麸皮制备水溶性膳食纤维,该方法简单实用,且产物得率高、纯度高。
本发明解决其技术问题是采取以下技术方案实现的:
一种发酵制备水溶性膳食纤维的方法,所述方法采用米根霉作为单一菌种进行固态发酵。
而且,所述发酵条件为:取小麦麸皮,加入蒸馏水,调节含水量至总质量的50~60%,搅拌分散均匀,封口,121℃高压灭菌20min,冷却至室温后,按接种量8~10%接入均匀分散的种子菌球培养液,霉菌培养箱内28~32℃培养4~5天。
而且,所述方法制备得到的水溶性膳食纤维为均一组分。
而且,具体步骤如下:
(a)菌种活化;
土豆斜面培养基PDA:向烧杯中加入100mL蒸馏水,加热至沸腾,依次加入马铃薯浸出粉0.6%,无水葡萄糖2.0%,琼脂1.5~2.0%,搅拌至全部溶解,趁热分装,每支试管加塞后包扎,在121℃高压条件下灭菌20min,冷却至50~60℃,摆斜面,制成斜面试管培养基;
其中,上述百分数为在100ml蒸馏水中的比例,按照100ml蒸馏水100g换算;
在超净工作台中,将保存于4℃的米根霉接种于上述斜面试管培养基上,25℃培养箱中培养3~4天,待其长出成熟孢子后,得已活化斜面,置于冰箱中4℃保存;
(b)种子培养;
液体培养基:在250mL锥形瓶中加入葡萄糖10g/L,蛋白胨1g/L,蒸馏水50mL,吐温–80100μL,微量元素50μL,营养盐溶液5mL,1mol/L柠檬酸缓冲液2.5mL,121℃条件下灭菌20min,得种子液体培养基,冷却备用;
其中,所述微量元素为ZnSO4·7H2O 1.4g/L、MgSO4·H2O 1.6g/L、Fe2(SO4)3·7H2O 5.0g/L;所述营养盐溶液为MgSO4·7H2O 3.0g/L、KH2PO42.0g/L、(NH4)2SO41.4g/L、尿素3.0g/L;
种子液体培养:用无菌水冲洗已活化斜面,制备孢子悬液,稀释至孢子浓度为106~108个/mL后,加入玻璃珠分散均匀;在250mL锥形瓶中装入50mL种子液体培养基,将孢子接种于液体培养基内,接种量为10%,28~30℃温控摇床中培养72h,摇床转速140r/min,得种子培养液;
(c)固态发酵;
发酵培养基:取小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀,封口后121℃灭菌20min,冷却至室温待用;
固体发酵培养:向每个发酵用容器中加入接种量为8~10%的种子培养液,置于霉菌培养箱内,在28~30℃下培养4~5天;
(d)对步骤(c)中得到的麸皮进行淀粉酶、糖化酶处理;
按300U/g麸皮加入耐高温α–淀粉酶,95℃恒温搅拌30min;冷却物料至60℃,按230U/g麸皮加入糖化酶,60℃恒温搅拌30min;95℃加热15min灭酶处理,用碘液检测是否还有淀粉残留以达到完全去除淀粉目的;
(e)浸提;
浸提液为蒸馏水,固液比1:8,提取温度90℃,提取时间1h,重复提取三次,得粗多糖溶液;
(f)酶解;
取粗多糖溶液,添加13.12U/g麸皮的碱性蛋白酶,调节pH为7.0,55℃水浴加热,酶解时间1.2h,95℃高温加热15min灭酶处理,离心,取上清液,得酶解后的粗多糖溶液;
(g)TCA法脱蛋白;
取酶解后的粗多糖溶液继续脱蛋白,加入等体积的TCA溶液,使TCA最终浓度达到1.5%,混合均匀后静置30min,离心,取上清液;
(h)乙醇梯度沉淀;
精密称取250mg SDF,配制成50mL悬浮液,分批多次加入95%乙醇,每次加入5mL,最终使乙醇体积浓度达到90%以上,边加边搅,每次所得醇沉液4℃下静置2h,5000r/min离心10min,收集沉淀,蒸馏水透析并冷冻干燥后得到各级多糖,称重并采用苯酚-硫酸法测定总糖含量,以总糖含量计算收率;
将(h)步骤中沉淀产物离心、冻干即为麸皮水溶性膳食纤维。
而且,所述步骤(h)中乙醇梯度沉淀时,当最终乙醇沉淀体积浓度分别为35%、65%、80%时较其它体积浓度的水溶性膳食纤维产率高。
本发明取得的优点和积极效果是:
本发明方法选用米根霉发酵小麦麸皮制备水溶性膳食纤维,该方法简单实用,且产物得率高、纯度高,对麦麸中水溶性膳食纤维的提取工艺进行了优化,为进一步对水溶性膳食纤维进行结构鉴定和理化分析奠定基础。
附图说明
图1为本发明中乙醇梯度沉淀获得的各级组分分子量分布检测结果图;
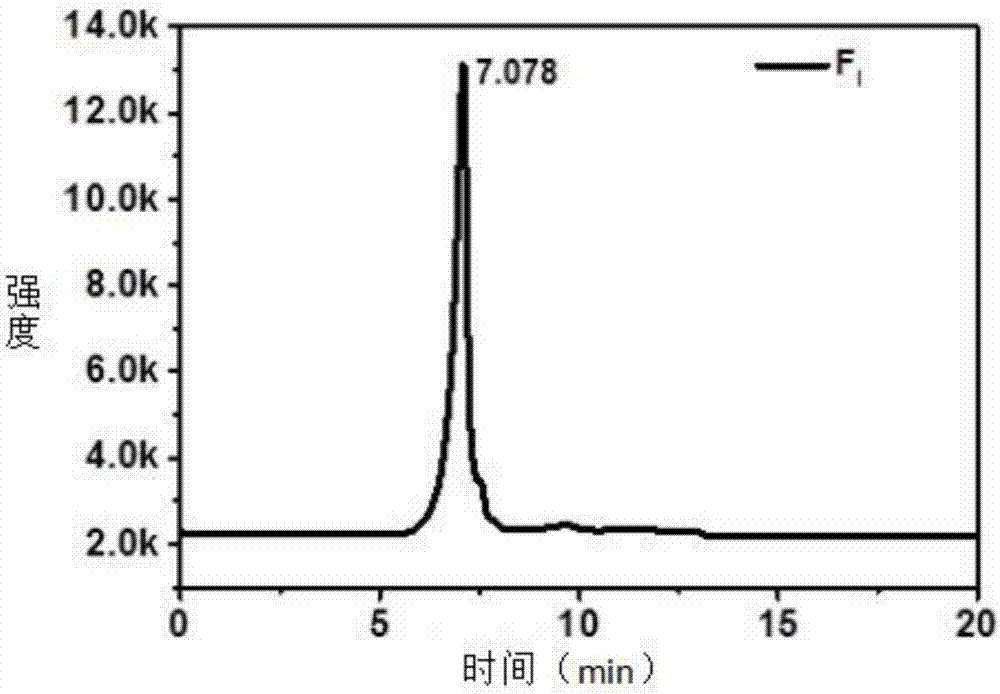
图2为本发明中乙醇梯度沉淀获得的FI组分液相鉴定结果图;其中,发酵后的膳食纤维组分在乙醇浓度为35%;
图3为本发明中乙醇梯度沉淀获得的FII组分液相鉴定结果图;其中,发酵后的膳食纤维组分在乙醇浓度为35~65%;
图4为本发明中乙醇梯度沉淀获得的FIII组分液相鉴定结果图;其中,发酵后的膳食纤维组分在乙醇浓度为65~80%。
具体实施方式
下面结合实施例,对本发明进一步说明;下述实施例是说明性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
本发明中所使用的原料,如无特殊说明,均为常规的市售产品;本发明中所使用的方法,如无特殊说明,均为本领域的常规方法。
一种发酵制备水溶性膳食纤维的方法,所述方法采用米根霉作为单一菌种进行固态发酵。
具体地,所述发酵条件为:取小麦麸皮,加入蒸馏水,调节含水量至总质量的50~60%,搅拌分散均匀,封口,121℃高压灭菌20min,冷却至室温后,按接种量8~10%接入均匀分散的种子菌球培养液,霉菌培养箱内28~32℃培养4~5天。
具体地,所述方法制备得到的水溶性膳食纤维为均一组分。
具体地,具体步骤如下:
(a)菌种活化;
土豆斜面培养基PDA:向烧杯中加入100mL蒸馏水,加热至沸腾,依次加入马铃薯浸出粉0.6%,无水葡萄糖2.0%,琼脂1.5~2.0%,搅拌至全部溶解,趁热分装,每支试管加塞后包扎,在121℃高压条件下灭菌20min,冷却至50~60℃,摆斜面,制成斜面试管培养基;
其中,上述百分数为在100ml蒸馏水中的比例,按照100ml蒸馏水100g换算;
在超净工作台中,将保存于4℃的米根霉接种于上述斜面试管培养基上,25℃培养箱中培养3~4天,待其长出成熟孢子后,得已活化斜面,置于冰箱中4℃保存;
(b)种子培养;
液体培养基:在250mL锥形瓶中加入葡萄糖10g/L,蛋白胨1g/L,蒸馏水50mL,吐温–80100μL,微量元素50μL,营养盐溶液5mL,1mol/L柠檬酸缓冲液2.5mL,121℃条件下灭菌20min,得种子液体培养基,冷却备用;
其中,所述微量元素为ZnSO4·7H2O 1.4g/L、MgSO4·H2O 1.6g/L、Fe2(SO4)3·7H2O 5.0g/L;所述营养盐溶液为MgSO4·7H2O 3.0g/L、KH2PO42.0g/L、(NH4)2SO41.4g/L、尿素3.0g/L;
种子液体培养:用无菌水冲洗已活化斜面,制备孢子悬液,稀释至孢子浓度为106~108个/mL后,加入玻璃珠分散均匀;在250mL锥形瓶中装入50mL种子液体培养基,将孢子接种于液体培养基内,接种量为10%,28~30℃温控摇床中培养72h,摇床转速140r/min,得种子培养液;
(c)固态发酵;
发酵培养基:取小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀,封口后121℃灭菌20min,冷却至室温待用;
固体发酵培养:向每个发酵用容器中加入接种量为8~10%的种子培养液,置于霉菌培养箱内,在28~30℃下培养4~5天;
(d)对步骤(c)中得到的麸皮进行淀粉酶、糖化酶处理;
按300U/g麸皮加入耐高温α–淀粉酶,95℃恒温搅拌30min;冷却物料至60℃,按230U/g麸皮加入糖化酶,60℃恒温搅拌30min;95℃加热15min灭酶处理,用碘液检测是否还有淀粉残留以达到完全去除淀粉目的;
(e)浸提;
浸提液为蒸馏水,固液比1:8,提取温度90℃,提取时间1h,重复提取三次,得粗多糖溶液;
(f)酶解;
取粗多糖溶液,添加13.12U/g麸皮的碱性蛋白酶,调节pH为7.0,55℃水浴加热,酶解时间1.2h,95℃高温加热15min灭酶处理,离心,取上清液,得酶解后的粗多糖溶液;
(g)TCA法脱蛋白;
取酶解后的粗多糖溶液继续脱蛋白,加入等体积的TCA溶液,使TCA最终浓度达到1.5%,混合均匀后静置30min,离心,取上清液;
(h)乙醇梯度沉淀;
精密称取250mg SDF,配制成50mL悬浮液,分批多次加入95%乙醇,每次加入5mL,最终使乙醇体积浓度达到90%以上,边加边搅,每次所得醇沉液4℃下静置2h,5000r/min离心10min,收集沉淀,蒸馏水透析并冷冻干燥后得到各级多糖,称重并采用苯酚-硫酸法测定总糖含量,以总糖含量计算收率;
将(h)步骤中沉淀产物离心、冻干即为麸皮水溶性膳食纤维。
具体地,所述步骤(h)中乙醇梯度沉淀时,当最终乙醇沉淀体积浓度分别为35%、65%、80%时较其它体积浓度的水溶性膳食纤维产率高。
采用如下实施例1至实施例10的不同发酵条件制备麸皮水溶性膳食纤维,其余制备步骤同上述发酵制备水溶性膳食纤维的方法的具体步骤。
实施例1:
发酵条件为:取未灭菌小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀。向每个发酵用容器中加入10%的种子培养液,置于霉菌培养箱内在28~30℃下培养4~5天。
实施例2:
发酵条件为:取紫外灭菌20min小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀。向每个发酵用容器中加入10%的种子培养液,置于霉菌培养箱内在28~30℃下培养4~5天。
实施例3:
发酵条件为:取80℃常压灭菌20min小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀。向每个发酵用容器中加入10%的种子培养液,置于霉菌培养箱内在28~30℃下培养4~5天。
实施例4:
发酵条件为:取100℃常压灭菌20min小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀。向每个发酵用容器中加入10%的种子培养液,置于霉菌培养箱内在28~30℃下培养4~5天。
实施例5:
发酵条件为:取121℃高压灭菌20min小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀。向每个发酵用容器中加入10%的种子培养液,置于霉菌培养箱内在28~30℃下培养4~5天。
实施例6:
发酵条件为:取小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀,封口后121℃灭菌20min,冷却至室温待用。向每个发酵用容器中加入10%的絮状种子培养液,置于霉菌培养箱内在28~30℃下培养4~5天。
实施例7:
发酵条件为:取小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀,封口后121℃灭菌20min,冷却至室温待用。向每个发酵用容器中加入10%的致密团块状种子培养液,置于霉菌培养箱内在28~30℃下培养4~5天。
实施例8:
发酵条件为:取小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀,封口后121℃灭菌20min,冷却至室温待用。向每个发酵用容器中加入10%的团块状种子培养液,置于霉菌培养箱内在28~30℃下培养4~5天。
实施例9:
发酵条件为:取小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀,封口后121℃灭菌20min,冷却至室温待用。向每个发酵用容器中加入10%的均一菌球种子培养液,置于霉菌培养箱内在28~30℃下培养4~5天。
实施例10:
发酵条件为:取小麦麸皮20.0g,用蒸馏水将含水量调节至50%~60%,搅拌分散均匀,封口后121℃灭菌20min,冷却至室温待用。向每个发酵用容器中加入10%的叠加菌球种子培养液,置于霉菌培养箱内在28~30℃下培养4~5天。
本发明的相关检测:
麦麸膳食纤维多糖含量测定:按照AACC方法测定总膳食纤维(TDF)、不溶性膳食纤维(IDF)和可溶性膳食纤维(SDF)含量。
表1实施例1~5底物不同灭菌方式对固态发酵麦麸中膳食纤维多糖增加量的影响
注:ΔSDF,ΔIDF和ΔSDF/TDF分别代表同批次处理样品发酵前后可溶性、不溶性及可溶性多糖/总多糖的变化,同列不同字母表示处理间在0.05水平上差异显著
菌体形态观察:培养结束后,取样进行菌体形态学观察。
细胞干重测定:用干重法测定菌体量。将种子液进行抽滤,75℃烘干至恒重。准确称量,差重法计算菌体干重。
表2实施例6~10种子液中不同菌体形态对发酵麦麸中可溶性膳食纤维多糖含量的影响
注:ΔSDF代表批次处理样品发酵前后可溶性的变化,同列不同字母表示处理间在0.05水平上差异显著
从表1和表2中结果表明,121℃高压灭菌20min小麦麸皮,接种均一菌球种子培养液其固态发酵后水溶性膳食纤维增加效果最为显著。
水溶性成分理化组成分析:采用考马斯亮蓝法测定蛋白质含量、采用苯酚-硫酸法测定总糖含量、采用3,5-二硝基水杨酸DNS比色法测定还原糖含量。
测定结果保留三位有效数字;精密度:在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
表3固态发酵前后可溶性膳食纤维多糖理化组分分析
注:同列不同字母表示处理间在0.05水平上差异显著。
由表3可见,水洗麦麸各组分含量较对照组均有降低,发酵麦麸总糖含量、还原糖含量较对照组均有上升、蛋白质含量较对照组有所下降,但高于水洗麦麸。这说明米根霉发酵对水溶性多糖的理化组分产生了影响,还原糖含量的增加可能是由于发酵过程中米根霉分解利用淀粉产生的;发酵后蛋白含量明显减少,但相对于水洗麸皮仍稍有增加,这是因为米根霉在发酵过程中合成了蛋白质,同时分泌孢外蛋白酶分解麦麸中的蛋白质,且合成的蛋白质少于分解的蛋白质。从结果中可以看出,通过米根霉固态发酵小麦麸皮可以提高小麦麸皮中总糖含量及还原糖含量,膳食纤维含量显著上升。
精密称取250mg SDF,配制成50mL悬浮液,分批多次加入95%乙醇,每次加入5mL,使乙醇体积浓度达到90%以上,边加边搅,每次所得醇沉液4℃下静置2h,5000r/min离心10min,收集沉淀,分别用75%乙醇、95%乙醇、丙酮、蒸馏水冲洗,蒸馏水透析并冷冻干燥后得到各级多糖,称重并采用苯酚-硫酸法测定总糖含量,以总糖含量计算收率。
表4乙醇梯度沉淀获得的各级组分分子量分布
由图1和表4中可以看出,随着乙醇浓度增加,Mn和Mw均有降低。取其中产率较高的组分鉴定其分子量和纯度,经35%、65%、80%浓度的乙醇梯度沉淀后,从发酵后的水溶性多糖提取物中获得三种分子量分布范围的麦麸多糖组分,包括:FI、FII、FIII,其数均分子质量分别为:1.58×106Da,1.86×105Da,0.90×104Da。
由图2、图3、图4可以看出,三组组分的液相色谱出峰相对单一,结合表4中FI、FII、FIII的分散指数(Mw/Mn)均较小,可以认为各组分分子量分布相对集中且可认为是均一组分。
上述实施例的作用在于说明本发明的实质性内容,但并不以此限定本发明的保护范围。本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和保护范围。
- 还没有人留言评论。精彩留言会获得点赞!